(完整版)初三化学-原子的构成习题精选及答案
初中化学 原子的结构 练习题(含答案)

初中化学原子的结构练习题(含答案)一、选择题1. 原子的结构是()A. 细胞B. 粒子C. 分子D. 质子答案:C2. 原子中组成原子核的粒子是()A. 电子B. 质子C. 中子D. 什么都不是答案:B3. 下列说法正确的是()A. 电子在原子核外绕行B. 质子和中子分别带正电和负电C. 原子核中的粒子数目不固定D. 原子核内质子质量大于中子答案:A4. 原子的结构是由()构成的。
A. 原子核和电子云B. 原子核和质子C. 原子核和中子D. 电子云和质子答案:A5. 原子核中所含的质子数决定了()。
A. 元素的化学性质B. 元素的物理性质C. 元素的放射性D. 元素的熔点答案:A6. 下列关于原子核的说法,正确的是()A. 原子核的直径是电子云的数千倍B. 原子核内质子和中子的质量几乎相等C. 原子核内质子和中子的数量相等D. 原子核是由正电质子组成的答案:B二、判断题1. 原子核由质子和电子组成。
答案:错2. 原子核的直径大约是原子的直径的万分之一。
答案:对3. 原子核的电子云中没含有电子。
答案:错4. 原子核中的质子数目决定了元素的原子序数。
答案:对5. 原子核内质子的质量大于中子。
答案:错三、填空题1. 原子核由________和________组成。
答案:质子,中子2. 原子核的直径约为________。
答案:10^-15米3. 原子核内质子与中子的数量差异称为________。
答案:中子过剩4. 原子的质子数称为________,用符号____表示。
答案:原子序数,Z5. 电子绕行的区域称为________。
答案:电子云四、简答题1. 请简要描述原子核的构成和性质。
答案:原子核是由质子和中子组成的,在原子中占据着非常小的体积空间,约占整个原子体积的10^-15倍。
原子核带有正电荷,质子和中子的质量几乎相等,质子的质量略大于中子。
此外,原子核还具有放射性。
2. 原子的质子数如何影响元素的性质?答案:元素的质子数,即原子核内质子的数量,决定了元素的原子序数。
九年级化学 - 原子的结构(练习+答案)

九年级化学- 原子的结构1.原子是由居于原子中心的原子核和__核外电子__构成的,原子核是由__质子__和__中子__构成的。
2.由于原子核内质子所带电荷与核外电子的电荷数量__相等__,电性__相反__,因此原子不显电性。
3.在原子中,核电荷数=核内__质子数__=核外__电子数__。
4.原子中的核外电子是分层排布的,可以用__原子结构示意图__表示。
5.相对原子质量是以__一种碳原子质量的1/12__作为标准,其他原子的__质量__与它相比较所得到的比。
6.原子结构示意图的含义:小圆圈和圈内的数字表示__原子核__和__核电荷数__,弧线表示__电子层__,弧线上的数字表示该电子层上的__电子数__。
7.稀有气体最外层有__8__个(除氦外)电子,形成相对稳定的结构;金属的原子最外层电子一般少于__4__个,在化学反应中易__失去__电子;非金属的原子最外层电子一般多于__4__个,在化学反应中易__得到__电子。
9.构成物质的的粒子除了原子、分子之外,还有__离子__,__带电__的原子叫做离子。
其中带正电的原子叫做__阳__离子,带负电的原子叫做__阴__离子。
9.原子的质量主要集中在__原子核__上,因此相对原子质量≈__质子数__+__中子数__。
小节练习题1.原子核中一定含有的粒子是(B)A.中子B.质子C.电子D.质子和中子2.锂电池可用作心脏起搏器的电源。
已知一种锂原子核内含有3个质子和4个中子,则该锂原子的核外电子数为(B)A.1 B.3C.4 D.73.下列粒子不显电性的是(D)A.质子B.电子C.原子核D.分子4. 氯化钠由什么粒子构成?四位同学分别给出以下答案,你认为正确的是(A)A.离子B.分子C.原子D.中子5. 下列关于原子结构的认识错误的是(C)A.原子内部有相对较大的空间B.原子由原子核和核外电子构成C.原子由质子和中子构成D.原子核带有正电荷6.下列有关离子的认识错误的是(D)A.原子失去电子,形成了阳离子B.原子得到电子,形成了阴离子C.离子也是构成物质的粒子D.原子失去电子后带负电荷7.下列结构示意图中,表示阴离子的是(D)8.下图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。
初三化学 原子的构成习题精选及标准答案

精品文档原子的构成习题精选含答案一、选择题1.原子和分子的区别是:( )A.分子在化学反应中分成原子,但在化学反应中原子不可再分B.分子一定比原子大C.分子能构成物质,而原子只能构成分子D.在化学反应中分子和原子都可以变成另一种分子和原子,区别在于它们发生的是不同的变化的碳原子的质量是千克,则一个氧原子的.已知一个质子数和中子数都是26( ) 质量是:16.16克 BA..千克 D C.千克3.在原子中,质子数等于:( )A.中子数B.核外电子总数C.相对原子质量D.中子数和电子数之和4.下列原子各1克,所含原子个数最多的是:( )A.氧原子B.铁原子C.氢原子D.氯原子5.一滴水能分成许许多多个水分子,分子又可分成原子,原子又由中子、质子、电子等构成,这些微粒中,一定能保持水的化学性质的是()。
A.水分子B.构成水分子的原子C.中子和质子D.电子6.原子和分子的根本区别是()A.是否能直接构成物质B.是否能保持物质的化学性质C.是否在化学反应中发生种类的变化D.是否能构成单质7.下列关于原子的说法错误的是()A.原子是化学变化中的最小微粒B.原子是最小的微粒C.原子核带正电荷,但原子不显电性D.分子能直接构成物质而原子不能精品文档.精品文档8.原子中决定相对原子质量大小的是()A.质子数和中子数B.质子数和电子数C.中子数和电子数D.核电荷数和电子数9.下列各种原子各1克,所含原子个数最多的是()A.氧原子B.铁原子C.氢原子D.氯原子10.下列各式中,表示两个氢原子的是(). 2H B.. C DA.11.碳的原子量是().千克D.1/12克 12A.克B.12C )12.在原子中(.质子数一定等于中子数A .质子数一定等于电子数B C.质子数、中子数、电子数三者都相等 D.原子核所带电量跟核外电子的电量相等 13.下列关于原子的叙述正确的是() A.物质都是由原子直接构成的B.原子是由质子和电子构成的 D.原子是由原子核和核外电子构成的C.原子是由质子和中子构成的二、填空题,,电子数是______质子数是1.硫原子的相对原子质量(原子量)为32,16,则中子数是______ ______。
九年级化学原子的构成习题精选

九年级化学原子的构成习题精选习题精选(一)1.化学变化中的最小粒子是( )。
A.分子B.原子C.质子D.电子2.原子的质量主要集中在( )。
A.质子B.中子C.电子D.原子核3.据报道,上海某医院正在研究用放射性碘治疗肿瘤。
这种碘原子的核电荷数为53,相对原子质量为125。
下列关于这种原子的说法中,错误的是( )。
A.中子数为72B.质子数为72C.电子数为53D.质子数和中子数之和为1254.下列关于原子核的叙述中,正确的是( )。
①通常由中子和电子构成②通常由质子和中子构成③带负电荷④不显电性⑤不能再分⑥体积大约相当于原子⑦质量大约相当于原子A.①⑤B.②⑦C.③④D.②⑥⑦5.用其质量的1/12作为相对原子质量的标准的碳原子相对原子的质量是( )。
A.12gB.12C.1/12gD.1/126.下列叙述中,正确的是( )。
A.相对原子质量就是原子质量的简称B.相对原子质量可用千克或克作单位C.相对原子质量是一个没有单位的比值D.原子质量约等于原子核内质子质量和中子质量之和7.下列粒子中带正电荷的是。
(填序号)①电子②质子③中子④原子核⑤原子⑥分子8.我国著名化学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕、铈、铒、锗、锌、镝等元素的相对原子质量新值,其中他测定核电荷数为63的铕元素的相对原子质量新值为152,则该元素的原子中质子数为,中子数为,核外电子数为。
9.北约轰炸南联盟时,广泛使用了美制贫铀弹,造成了严重的生态灾难。
已知贫铀弹中含有铀236(236为相对原子质量),它具有放射性,其质子数为92,则这种铀原子里中子数与核外电子数之差为。
10.已知一个碳12原子的质量为1.993×10-26kg,一个氧原子的质量为2.657×10-26kg,求氧原子的相对原子质量。
参考答案:1.B 2.D 3.B 4.B 5.B 6.D 7.②④ 8.63 89 63 9.5210.26-262.65710kgAr(O)161.99310kg(1/12)-⨯=≈⨯⨯习题精选(二)1.下列叙述中错误的是()。
中考化学重点知识二轮专题练习8 原子的构成(含答案)

一.选择题1.不显电性的一组粒子是()A.原子、中子、电子B.原子核、原子、分子C.中子、电子、原子D.中子、分子、原子2.知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、c对应的是()A.原子核、核外电子B.原子、核外电子C.原子、原子核D.核外电子、原子3.关于原子的说法错误的是()A.原子是化学变化中的最小微粒B.原子是构成物质的一种粒子C.在化学变化中原子可分,分子不可分D.分子里,质子数和电子数不等4.下列关于原子、分子的说法错误的是()A.分子可以构成物质,而原子只能构成分子B.在化学变化中,分子可以分成原子,而原子不能再分C.在原子中,质子数等于核外电子数D.分子是保持物质化学性质的最小粒子5.一种氟原子的原子核内有9个质子和10个中子,该原子的核电荷数为()A.7B.9C.10D.196.已知某原子的实际质量为M g,又知C12原子的质量为N g,则该原子的相对原子质量为A. B. C. D.7.铈(Ce)是一种常见的稀土元素,已知一种铈原子的原子核内有58个质子和82个中子,该原子的核外电子数为A.24B.58C.82D.1408.钛和钛合金被认为是21世纪的重要金属材料,它们具有熔点高、密度小、抗腐蚀性能好等优良性能,因此被广泛用于火箭、航天飞机、船舶和化工等.已知钛原子的质子数为22,中子数为26,则钛原子的核外电子数为()A.48B.26C.4D.229.“国际热核聚变实验反应堆”计划是研究人类新的未来能源,其聚变原理是两个氘原子核(核内含一个质子和一个中子)聚合成一个较重的氦原子核,从而释放出巨大的能量。
而且海水中氘的储量大,足够人类使用几百亿年。
请问聚合后氦原子核中的质子数是()A.1B.2C.3D.410.某粒子的结构示意图如图所示,对该粒子的说法错误的是A.核电荷数为12B.核外有3个电子层C.带12个单位正电荷D.在化学反应中,易失去最外层上的2个电子二、非选择题11.在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子填在相应的横线上。
九年级化学第四单元第一节原子的构成练习试题及答案

九年级化学第四单元第一节原子的组成练习试题及答案一、选择题1.据报导,科学家发现了一种新元素,它的原子核内有161 此中子,质量数272。
该元素的质子数为()。
(全国高考题)(A)111(B)161(C)272(D)4332.依据元素的核电荷数,不可以确立的是()。
(A)原子核内质子数(B)原子核内中子数(C)原子最外层电子数(D)原子核外电子数3.氢原子的电子云图中的小黑点表示的意义是()。
(A)一个黑点表示一个电子(B)黑点的多少表示电子个数的多少(C)表示电子运动的轨迹(D)电子在核外空间出现时机的多少5.元素的化学性质主要决定于原子的()。
(A)质子数(B)中子数(C)核外电子数(D)最外层电子数6.周期表中16 号元素和 4 号元素的原子对比较,前者的以下数据是后者的 4 倍的是(A)电子数(B)最外层电子数(C)电子层数(D)次外层电子数7.据报导,某些建筑资料会产生放射性氡,进而对人体产生损害。
该原子的中子数和质子数之差是()。
(上海市高考题)(A)136(B)50(C)86(D)2228.以下表达中,正确的选项是()。
(A)两种微粒,若核外电子排布完整同样,则其化学性质必定同样(B)凡单原子形成的离子,必定拥有罕有气体元素原子的核外电子排布(C)两原子,假如核外电子排布同样,则必定属于同种元素(D)不存在两种质子数和电子数均同样的阳离子和阴离子9.以下说法中错误的选项是()。
(A)质量数同样的原子,其化学性质必定同样(B)质子数同样的微粒,其核外电子排布也同样(C)金属性越开朗,其原子在反响中越易失掉电子(D)非金属性越开朗,其阴离子越难失掉电子二、填空题1. A 元素原子M 电子层上有 6 个电子。
元素的原子最外电子层只有 1 个电子。
( 1) B 元素的原子构造表示图为。
( 2)A、B 两元素形成的化合物的名称是灼烧时,火焰呈色。
B 元素与 A 元素的原子核外电子层数同样,,化学式是,该化合物在无色火焰上B2.有 V、 W、 X、 Y、 Z 五种元素,它们的核电荷数挨次增大,且都小于20。
初三化学原子的构成试题答案及解析

初三化学原子的构成试题答案及解析1.根据下列结构示意图判断,属于原子且容易失去电子的是【答案】C【解析】原子中,质子数=核外电子数;最外层电子数大于4的,容易得到电子;小于4的容易失去电子。
选C。
【考点】原子的构成;原子的性质。
点评:若原子只有一个电子层,则该层有2个电子就是稳定结构,虽然电子数小于4个,但也不容易失去或得到电子。
2.元素钬(Ho)能有效地治疗肝癌,已知它的相对原子质量为166,核电荷数为67,则这原子核内的中子数和核外电子数分别为A.166和67B.99和65C.166和99D.99和67【答案】D【解析】原子中,质子数=核电荷数=核外电子数=原子序数;相对原子质量=质子数+中子数。
元素钬(Ho)的相对原子质量为166,核电荷数为67,则这原子核内的中子数和核外电子数分别为99和67。
选D。
【考点】原子的构成。
点评:原子中,质子数=核电荷数=核外电子数=原子序数;相对原子质量=质子数+中子数。
3.(4分)某原子的结构示意图如图所示,已知该粒子在化学反应中易得到2个电子形成稳定结构,X = ,Y = 。
【答案】X=16 Y=6【解析】该粒子在化学反应中易得到2个电子形成稳定结构,即得2个电子形成8电子稳定结构,则原子的最外层应有6个电子;核外电子总数=2+8+6=16,原子中质子数X等于核外电子数16.4.元素Z的核电荷数为a,它的阳离子Z m+与元素Y的阴离子Y n-的电子层结构相同,则元素Y的核电荷数是_________。
【答案】a-m-n【解析】本题考查的是原子的有关数量计算,解题时根据阳离子核外电子数=质子数—所带电荷数,阴离子核外电子数=质子数+所带电荷数来解答。
离子是由原子失去或得到电子而形成的,且离子所带的电荷数等于原子形成离子时失去或得到的电子的数目,又Z m+的核外电子数为a—m,若设Y的核电荷数为b,则Y n-核外电子数为b+n,又Z m+与Y n-电子层结构相同,则a-m=b+n,因此b=a-m-n。
《原子的构成》配套练习 2022年九年级化学附答案
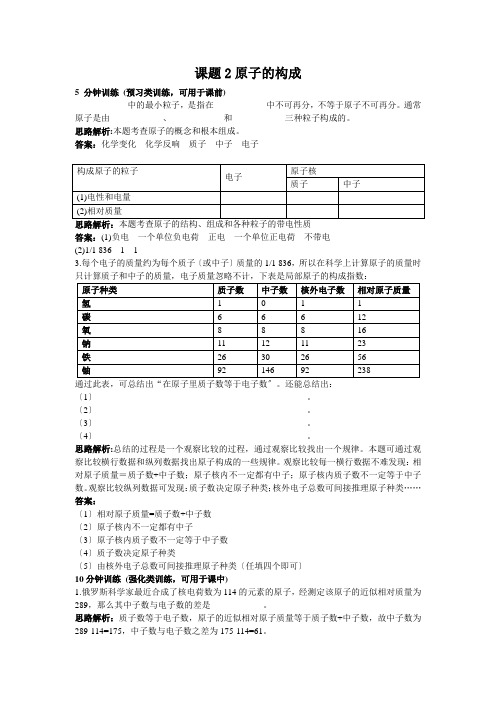
课题2原子的构成5 分钟训练(预习类训练,可用于课前)____________中的最小粒子,是指在____________中不可再分,不等于原子不可再分。
通常原子是由____________、____________和____________三种粒子构成的。
思路解析:本题考查原子的概念和根本组成。
答案:化学变化化学反响质子中子电子思路解析:本题考查原子的结构、组成和各种粒子的带电性质答案:(1)负电一个单位负电荷正电一个单位正电荷不带电(2)1/1 8361 13.每个电子的质量约为每个质子〔或中子〕质量的1/1 836,所以在科学上计算原子的质量时只计算质子和中子的质量,电子质量忽略不计,下表是局部原子的构成指数:通过此表,可总结出“在原子里质子数等于电子数〞。
还能总结出:〔1〕________________________________________________。
〔2〕________________________________________________。
〔3〕________________________________________________。
〔4〕________________________________________________。
思路解析:总结的过程是一个观察比较的过程,通过观察比较找出一个规律。
本题可通过观察比较横行数据和纵列数据找出原子构成的一些规律。
观察比较每一横行数据不难发现:相对原子质量=质子数+中子数;原子核内不一定都有中子;原子核内质子数不一定等于中子数。
观察比较纵列数据可发现:质子数决定原子种类;核外电子总数可间接推理原子种类……答案:〔1〕相对原子质量=质子数+中子数〔2〕原子核内不一定都有中子〔3〕原子核内质子数不一定等于中子数〔4〕质子数决定原子种类〔5〕由核外电子总数可间接推理原子种类〔任填四个即可〕10分钟训练(强化类训练,可用于课中)1.俄罗斯科学家最近合成了核电荷数为114的元素的原子,经测定该原子的近似相对质量为289,那么其中子数与电子数的差是____________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原子的构成习题精选含答案
一、选择题
1.原子和分子的区别是:( )
A.分子在化学反应中分成原子,但在化学反应中原子不可再分
B.分子一定比原子大
C.分子能构成物质,而原子只能构成分子
D.在化学反应中分子和原子都可以变成另一种分子和原子,区别在于它们发生的是不同的变化
2.已知一个质子数和中子数都是6 的碳原子的质量是千克,则一个氧原子的质量是:( )
A.16 克B.16
C.千克D.千克
3.在原子中,质子数等于:( )
A.中子数B.核外电子总数C.相对原子质量D.中子数和电子数之和
4.下列原子各1 克,所含原子个数最多的是:( )
A.氧原子 B.铁原子 C.氢原子 D.氯原子
5.一滴水能分成许许多多个水分子,分子又可分成原子,原子又由中子、质子、电子等构成,这些微粒中,一定能保持水的化学性质的是()。
A.水分子B.构成水分子的原子
C.中子和质子 D.电子
6.原子和分子的根本区别是()
A.是否能直接构成物质B.是否能保持物质的化学性质
C.是否在化学反应中发生种类的变化D.是否能构成单质
7.下列关于原子的说法错误的是()
A.原子是化学变化中的最小微粒B.原子是最小的微粒
C.原子核带正电荷,但原子不显电性D.分子能直接构成物质而原子不能
8.原子中决定相对原子质量大小的是()
A.质子数和中子数 B.质子数和电子数
C.中子数和电子数 D.核电荷数和电子数
9.下列各种原子各1 克,所含原子个数最多的是()
A.氧原子 B.铁原子 C.氢原子 D.氯原子
10.下列各式中,表示两个氢原子的是()
A.2H B.C.D.
11.碳的原子量是()
A.12 克B.12C.千克
D.1/12 克12.在原子中()
A.质子数一定等于中子数
B.质子数一定等于电子数
C.质子数、中子数、电子数三者都相等
D.原子核所带电量跟核外电子的电量相等
13.下列关于原子的叙述正确的是()
A.物质都是由原子直接构成的 B.原子是由质子和电子构成的
C.原子是由质子和中子构成的 D.原子是由原子核和核外电子构成的
二、填空题
1.硫原子的相对原子质量(原子量)为32,质子数是16,则中子数是,电子数是
,核电荷数是。
2.说明下列符号表示的意义:N 表示;表示;2N 表示;表示
;中“2”的意义。
3.英国科学家于19 世纪提出了近代原子学说;意大利的科学家提出了分子的概念,指出了分子和原子的区别和联系。
英国科学家发现了电子,并认为一切原子中都含有电子。
4.铁是由构成;碳由构成;水由构成;二氧化碳分子由构成;
3 个氧分子由构成;氩气由构成。
5.判断:任何一种原子都含有质子、中子和电子()
三、简答题
1.用原子和分子的观点解释氧化汞受热分解生成汞和氧气。
2.一个铁原子质量是千克,一个碳12 原子质量是千克,问铁原子的相对原子质量是多少?
四、创新题
1.道尔顿的原子学说中,包括下述三个论点:①原子是不能再分的粒子。
②同种元素的原子的性质和质量都相同。
③原子是微观上的实心球体。
从现代的观点看,你认为道尔顿的三个论点中,不确切的有()
A.①B.①③C.②③D.①②③
2.美国铱星公司原计划发射 77 颗卫星以实现卫星通讯,发射卫星的数目与铱元素的原子
核外电子数目恰好相等。
下列关于铱元素的各种说法中正确的是()
(A)铱原子的质子数为 70 (B)铱原子的相对原子质量为 77
(C)铱原子的核电荷数为 77(D)铱原子是金属原子
3.已知每个电子的质量约为每个质子(中子)质量的倍。
通过下表的内容,可总结出“在原子里质子数等于电子数”。
还总结出:
(1)(2)
(3)(4)
原子种类质子数中子数核外电子数相对原子质量
氢 1 0 1 1
碳 6 6 6 12
氧8 8 8 16
铁26 30 26 56
钠11 12 11 23
答案:
一、1.A;2.C;3.B;4.C5.A
6.答案:C 点拨:由于原子和分子都可以直接构成物质,当然也都可以构成单质,如金属单质铁、非金属单质氧气,所以都可以保持物质的化学性质,主要区别在于化学变化中能否再分。
7.答案:B D 点拨:A 为原子的定义正确。
B 还可再分为原子核和核外电子,只是化学变
化中的最小的微粒。
原子中,原子核带的正电荷和核外电子带的负电荷相等但电性相反故C 正确。
D 原子也能直接构成物质,如:金属汞等。
8.答案:A 点拨:原子由原子核和核外电子构成,原子核又由质子和中子构成。
而 1 个电子的质量仅为 1 个质子或中子质量的 1/1836,跟质子、中子相比电子质量可忽略不计,所以A 正确。
9.答案:C 点拨:每种原子的个数都由该元素的质量除以其原子的实际质量求得。
那么在等
质量的前提下,谁的原子质量小,即相对原子质量小,谁所含的原子个数就多。
10.答案:A 点拨:B 表示1 个氢分子;C 表示2 个氢分子;D 表示2 个氢离子。
11.答案:B 点拨:碳的原子量为。
原子量的单位为“1”,所以
A 不正确。
12.答案:B D 点拨:质子数不一定等于中子数。
如氢原子有 1 个质子而无中子,所以
A、C 不正确。
在原子中核电荷数=质子数=电子数。
原子不显电性就是由于质子数=电子数。
所以
B、D 正确。
13.答案:D 点拨:物质不都是由原子直接构成,也由分子直接构成,A 不正确。
原子包括
原子核和核外电子两部分,而原子核中有质子和中子组成,也可以说原子由质子、中子、
核外电子组成,故 B、C 不对。
二、1.答案:16,16,16 点拨:由于原子质量主要由核内质子数和中子数决定。
且质子和
中子的相对质量近似为 1,所以原子的相对原子质量≈质子数+中子数;又因为核电荷数
=质子数=电子数,由两个等式即可求解。
2.答案:氮元素和一个氮原子;l 个氮分子;2 个氮原子;2 个氮分子;一个分子中含有 2 个H 原子
3.答案:道尔顿,阿佛加德罗,汤姆生点拨:考查对基础知识的掌握。
4.答案:铁原子,碳原子,水分子,氧原子和碳原子,6 个氧原子,氩原子点拨:由原子直接构成的有金属,固态非金属单质、稀有气体。
除以上三种外物质是由分子构成,而分子由原子构成,当分子前出现个数时,原子也要讲个数。
5.答案:×点拨:不一定含中子加氢有 1 个质子,无中子,1 个核外电子。
三、1.答案;氧化汞是由氧化汞分子构成的,受热后,氧化汞分子分解为汞原子和氧原子,每两个氧原子结合成氧气分子,许多氧气分子聚集成氧气,而许多汞原子聚集成金属汞。
点拨:本题主要考查化学变化的实质,即化学变化中,分子破坏,变成原子,而原子再重
新组成新的分子或直接构成新的物质。
从而进一步明确有的物质是由分子构成,有的物质是由原子构成的。
2.答案:铁原子的相对原子质量点拨:本题可根据相对原子质
量的定义进行计算:相对原子质量
四、1.答案:D 点拨:三个观点都不确切。
原子在化学变化中不能再分,用其他方法还可以分成质子、中子、电子;原子并非是实心,原子核外有很大的空间。
2.答案:C D 点拨:质子数=核外电子数。
此题巧妙的将给予信息和原子知识相结合。
3.答案:(1)个别种类原子核里没有中子。
如氢。
(2)相对原子质量等于质子数与中子数之和。
(3)原子核内质子数与中子数不一定相等。
(4)不同的原子质子数不同。
点拨:本题主要考查学生运用原子的知识,善于发现规律的能力,答案不固定。
