无机化学第四章_化学键与分子结构补充习题
第4章学生自测题Microsoft Word 文档 (2)

《无机化学》自测题第四章 化学键与分子结构1. 是非题(判断下列各项叙述是否正确,对的请在括号中填“√”,错的填“×”)金属和非金属原子化合物必形成离子键化合物。
( )离子键化合物中, 离子总是形成8电子结构。
因为只有8电子结构是稳定的。
( )Li+和H-这两个阳、阴离子不论相距多少距离,总是相互吸引的。
( )当2个原子形成共价键时,可以是σ加π键,也可以都是σ键。
( )C 和O 的电负性差值很大,为此CO 中键的极性很大。
( )破坏NH 3中三个键需要的能量(1170 kJ •mol -1)大于破坏N 2的键(941 kJ •mol -1),但常温下N 2却比NH 3稳定得多,这是因为分子的反应性主要与破坏第一个键所需的能量有关。
( )-+-22222O ,O ,O ,O 的键级分别为1,2,和,因此它们的稳定性次序为 。
( ) 下列化合物中正离子的极化能力大小顺序为ZnCl 2 > FeCl 2 > CuCl 2 > KCl ( )相同原子的双键的键能等于其单键键能的2倍。
( )SnF 4,XeF 4,CCl 4,SnCl 4分子的几何构型均为正四面体。
( )NaCl 和NaH 都是离子晶体,但后者远不如前者稳定。
( )由于Si 原子和Cl 原子的电负性不同,所以SiCl 4分子具有极性。
( )与共价键相似,范德华力具有饱和性和方向性。
( )在S-Cl ,Si-Cl ,Al-Cl ,P-Cl 四种化学键中,键的极性最大的是Si-Cl 键。
( ) 根据原子基态电子构型,可以判断若有多少个未成对电子就能形成多少个共价键。
( ) 直线形分子X-Y-Z 是非极性的。
( )SF 4,N 2O ,XeF 2,IF 3价层均有5对价电子对,但这些分子的空间构型却不相同,这些分子的空间构型分别是变形四面体、直线形、直线形、T 形。
( )原子在基态时没有成对电子,就不能形成共价键。
无机化学第6版试题第四章

答案为"B",解释:该物质具有弱碱性,能与酸反 应生成盐和水。
选择题3
答案为"C",解释:该物质具有还原性,能与强氧 化剂反应。
简答题解析
简答题1
答案为"A",解释:该物质具有强氧化性,能与多种还原性物质反 应。
简答题2
答案为"B",解释:该物质具有弱碱性,能与酸反应生成盐和水。
简答题3
答案为"C",解释:该物质具有还原性,能与强氧化剂反应。
难点突破
酸碱反应与氧化还原反应的关联
01
理解酸碱反应和氧化还原反应之间的联系,掌握它们在化学反
应中的作用和相互影响。
配位化合物的应用
02
了解配位化合物在化学、生物学和医学等领域的应用,掌握配
位化合物的合成和性质。
无机化学中的空间效应
03
理解无机化学中的空间效应,掌握其在化学反应中的作用和影
响。
03 试题解析
章节重要性
在无机化学中的地位
第四章是金属元素及其化合物性质的 基础,是理解和掌握无机化学知识体 系的关键章节之一。
对后续其化合物的性质在工业生产、 环境保护、药物合成等领域具有广泛 的应用价值。
为学习其他相关课程,如分析化学、 物理化学等打下基础。
02 知识点梳理
答案:A、C
解释:化学平衡常数K越大,表示该反应进行得越完全,因此选项A正确。对于放热反应来说,温度升高,K值减小;对于吸 热反应来说,温度升高,K值增大。因此选项B错误。温度升高,正、逆反应速率都增大,因此选项C正确。提高反应物浓度 ,化学平衡向正反应方向移动,但K值不变,因此选项D错误。
05 总结与展望
04、无机化学万题库(是非题)

无机化学万题库是非题(一)物质的状态1.()1 mol 物质的量就是1 mol 物质的质量。
2.()溶液的蒸气压与溶液的体积有关,体积越大,蒸气压也越大。
3.()温度较低、压力较高的实际气体性质接近于理想气体。
4.()范德华方程是在理想气体状态方程的基础上修正的,所以修正后范德华方程中的压力指理想气体的压力,体积是理想气体的体积。
5.()对于任何纯物质而言,熔点总比凝固点高一些。
6.()水的三相点就是水的冰点。
7.()通常指的沸点是蒸气压等于外界压力时液体的温度。
8.()三相点是固体、液体和气体可以平衡共存时的温度和压力。
9.()临界温度越高的物质,越容易液化。
10.()高于临界温度时,无论如何加压,气体都不能液化。
11.()任何纯净物质都具有一个三相点。
12.()混合气体中,某组分气体的分压力与其物质的量的大小成正比。
13.()气体扩散定律指出:同温同压下气体的扩散速度与其密度成反比。
14.()单独降温可以使气体液化;单独加压则不一定能使气体液化。
15.()使气体液化所需要的最低压强,称为临界压强。
16.()气体的最几速率、平均速率和均方根速率中以最几速率数值最大。
17.()气体的最几速率、平均速率和均方根速率中以平均速率数值最大。
18.()气体的最几速率、平均速率和均方根速率中以均方根速率数值最大。
19.()气体的最几速率、平均速率和均方根速率中以最几速率分子数最多。
20.()气体的最几速率、平均速率和均方根速率中以平均速率分子数最多。
21.()气体的最几速率、平均速率和均方根速率中以均方根速率分子数最多。
22.()液体的蒸发速度与液面面积有关,液面面积越大,蒸发速度也越大。
23.()凝聚和蒸发的过程是分别独立进行的,两者之间没有直接的定量关系。
24.()液体的饱和蒸气压仅与液体的本质和温度有关,与液体的量和液面上方空间的体积大小无关。
25.()若液体的蒸气压为p,实验证明lg p与绝对温度T成直线关系。
无机化学化学键与分子结构选择题

(三)化学键与分子结构1.下列分子中,两个相邻共价键的夹角最小的是A、BF3 B、H2S C、NH3D、H2O2.下列分子中,两个相邻共价键的夹角最小的是A、BF3 B、CCl4C、NH3D、H2O3.下列分子和离子中,中心原子成键轨道不是sp2杂化的是A、NO 3-B、HCHOC、BF3D、NH34.NCl3分子中,N原子与三个氯原子成键所采用的轨道是A、两个sp轨道,一个p轨道成键B、三个sp3轨道成键C、P X、P y 、P z 轨道成键D、三个sp2轨道成键5.水分子中氧原子的杂化轨道是A、sp B、sp2C、sp3D、dsp26.下列化合物中,极性最大的是A、CS2B、H2S C、SO3D、SnCl47.下列分子中,偶极矩不等于零的是A、BeCl2B、BF3C、NF3 D、CO28.下列液态物质中只需克服色散力就能使之沸腾的是A、H2O B、CO C、HF D、Xe9.极化能力最强的离子应具有的特性是A、离子电荷高、离子半径大B、离子电荷高、离子半径小C、离子电荷低、离子半径小D、离子电荷低、离子半径大10.下列各组离子中,离子的极化力最强的是A、K+、Li+B、Ca2+、Mg2+C、Fe3+、Ti4+D、Sc3+、Y3+11.比较下列各组物质的熔点,正确的是A、NaCl > NaF B、CCl4> CBr4C、H2S > H2Te D、FeCl3 < FeCl212.下列各分子中,偶极矩不为零的分子为A、BeCl2B、BF3C、NF3D、CH413.下列各组离子化合物的晶格能变化顺序中,正确的是A、MgO> CaO> Al2O3B、LiF> NaCl >KIC、RbBr< CsI <KClD、BaS> BaO> BaCl214.下列物质熔点变化顺序中,不正确的是A、NaF> NaCl > NaBr > NaIB、NaCl< MgCl2< AlCl3<SiCl4C、LiF> NaCl >KBr > CsID、Al2O3>MgO> CaO> BaO15.下列原子轨道的n相同,且各有一个自旋方式相反的不成对电子,则沿X 轴方向可形成π 键的是A、P X-P XB、P X-P yC、P y-P ZD、P z-P z16.下列分子或离子中,键角最大的是A、XeF2B、NCl3C、CO32-D、PCl4+17.下列分子或离子中,具有反磁性的是A、O2B、O2-C、O2+D、O22-18.按分子轨道理论,下列稳定性排列正确的是A、O2 > O2+> O22-B、O2+> O2 > O22-C、O22-> O2 > O2+D、O2+> O22-> O219.下列各组原子轨道中不能叠加成键的是A、P X-P X B、P X-P Y C、S-P X D、S-P Z20.下列分子或离子中,中心原子的价层电子对几何构型为四面体,而分子(离子)的空间构型为V 字形的是A、NH4+B、SO2C、ICl-2D、OF221.几何形状是平面三角形的分子或离子是A、SO3B、SO-23C、CH-3D、PH322.几何形状是平面三角形的分子或离子是A、SO32-B、SnCl3-C、CH3-D、NO3-23.下列分子中偶极矩大于零的是A、SF4B、PF5C、SnF4 D、BF324.下列分子中偶极矩大于零的是A、BF3B、PF3C、SiF4 D、PF525.下列分子中属于非极性分子的是A、PH3B、AsH3C、BCl3 D、CHCl326.下列分子中属于非极性分子的是A、SF4B、PCl5C、PCl3 D、IF527.根据VSEPR理论,BrF3分子的几何构型为A、平面三角形B、三角锥形C、三角双锥形D、T字形28.下列各组物质中,沸点高低次序不正确的是A、HF>NH3B、S2(g)>O2C、NH3>PH3D、SiH4>PH329.下列体系中,溶质和溶剂分子间,三种分子间力和氢键都存在的是A、I2和CCl4溶液B、I2酒精溶液C、酒精的水溶液D、CH3Cl的CCl4溶液30.下列晶体中,熔化时只需克服色散力的是A、K B、H2O C、SiC D、SiF431.下列物质的熔点由高到低的顺序正确的是a、CuCl2b、SiO2c、NH3 d、PH3A、a > b > c > dB、b > a > c > dC、b > a > d > cD、a > b > d > c32.下列分子中,离域π 键类型为П33的是A、O3 B、SO3C、NO2 D、HNO333.根据分子轨道中电子排布,下列分子、离子稳定性顺序正确的是A、O2 >O+2>O-2> O-22B、O-22>O-2>O+2> O2 C、O+2>O-2> O-22> O2D、O+2>O2>O-2> O-2234.若中心原子采用s p3 d2杂化轨道成键的分子,其空间构型可能是A、八面体B、平面正方形C、四方锥形D、以上三种均有可能35.下列氟化物分子中,分子偶极矩不为零的是A、PF5 B、BF3C、IF5D、XeF436.下列化合物中具有氢键的是A、CH3F B、CH3OH C、CH3OCH3 D、C6H637.下列晶格能大小顺序中正确的是A、CaO>KCl> MgO>NaClB、NaCl> KCl> RbCl>SrOC、M g O>RbCl> SrO>BaOD、Mg O>NaCl> KCl> RbCl38.在下列各种含氢化合物中,有氢键的是A、CHF3 B、C2H6 C、C6H6 D、HCOOH E、CH439.HF具有反常的高沸点是由于A、范德华力B、极性共价键C、氢键D、离子键40.在石墨晶体中,层与层之间的结合力是A、金属键B、共价键C、范德华力D、大π键41.关于晶格能,下列说法中正确的是A、晶格能是指气态阳离子与气态阴离子生成1 mol离子晶体所释放的能量B、晶格能是由单质化合成1 mol 离子化合物时所释放的能量C、晶格能是指气态阳离子与气态阴离子生成离子晶体所释放的能量D、晶格能就是组成离子晶体时,离子键的键能42.下列物质中,既有离子键又有共价键的是A、KCl B、CO C、Na2SO4D、NH4+43.下列说法中,正确的是A、离子键和共价键相比,其作用范围更大B、所有高熔点物质都是离子型的C、离子型固体的饱和水溶液都是导电性极其良好D、阴离子总是比阳离子大44.下列原子轨道中各有一个自旋方向相反的不成对电子,则沿x 轴方向可形成 键的是A、2 s-4 d z2B、2 p x-2 p xC、2 p y-2 p yD、3 d xy-3 d xy45.下列说法中,正确的是A、相同原子间的双键键能是单键键能的两倍B、原子形成共价键的数目等于基态原子的未成对电子数C、分子轨道是由同一原子中能量相近、对称性匹配的原子轨道组合而成D、p y 和d xy 的线性组合形成π成键轨道和π反键轨道46.下列关于O22-和O2-的性质的说法中,不正确的是A、两种离子都比O2分子稳定性小B、O22-的键长比O2-键长短C、O22-是反磁性的,而O2-是顺磁性的D、O22-的键能比O2-的键能小47.下列分子和离子中,中心原子杂化轨道类型为s p3 d杂化,且分子(离子) 空间构型呈直线型的是A、ICl2-B、SbF4-C、CO2D、SO248.若中心原子采用sp3d杂化轨道成键的分子,其空间构型可能是A、三角双锥形B、变形四面体C、直线形D、以上三种均有可能49.AB2型的分子或离子,其中心原子可能采取的杂化轨道类型是A、s p B、s p2C、s p3 D、除A、B、C 外,还有s p3d50.下列物质熔点沸点变化顺序中,正确的一组是A、He >Ne >Ar B、HF >HCl >HBr C、CH4 < SiH4 < GeH4D、W >Cs >Ba51.下列物质熔点高低顺序正确的是A、He > Kr B、Na < Rb C、HF < HCl D、MgO > CaO52.下列化学键中,极性最弱的是A、H-F B、H-O C、O-F D、C-F53.下列叙述中正确的是A、F2的键能低于Cl2B、F的电负性低于Cl C、F2的键能大于Cl2D、F的第一电离能低于Cl54.OF2分子的中心原子采取的杂化轨道是A、s p2B、s p3C、s p D、d s p255.CH4分子中,C-H键是属于A、离子键B、p-p键C、s -s p3σ键D、配位共价键56.CO2分子中,碳原子轨道采取的杂化方式是A、s p B、s p2 C、s p3等性杂化D、s p3不等性杂化57.下列分子中属于极性分子的是A、SiCl4( g ) B、SnCl2( g ) C、CO2 D、BF358.下列各组判断中,正确的是A、CH4,CO2是非极性分子B、CHCl3,BCl3,H2S,HCl是极性分子C、CH4,H2S,CO2是非极性分子D、CHCl3,BCl3,HCl是极性分子59.下列各组判断中,不正确的是A、CH4,CO2,BCl3是非极性分子B、CHCl3,HCl,H2S是极性分子C、CH4,CO2,BCl3,H2S,是非极性分子D、CHCl3,HCl是极性分子60.为确定分子式为XY2的共价化合物是直线型还是弯曲型的,最好是测定它的A、与另一个化合物的反应性能B、偶极矩C、键能D、离子性百分数61.在单质碘的四氯化碳溶液中,溶质和溶剂分子之间存在着A、取向力B、诱导力C、色散力D、诱导力和色散力62.下列物质中属于以分子间作用力结合的晶体是A、KBr(s) B、CO2(s) C、CuAl2(s) D、SiC(s)63.下列物质在液态时只需要克服色散力就能使之沸腾的是A、O2B、CO C、HF D、H2O64.下列能形成分子间氢键的物质是A、NH3B、C2H4C、HI D、H2S65.下列氢键中最强的是A、S-H……O B、N-H……N C、F-H……F D、C-H……N66.HCl,HBr,HI三种物质的沸点依次升高的主要原因是A、范德华力减小B、取向力增大C、诱导力增大D、色散力增大67.下列化合物中,不存在氢键的是A、HNO3B、H2S C、H3BO3 D、H3PO368.下列化合物中,存在分子内氢键的是A、H2O B、NH3C、CH3F D、HNO369.SO2分子间存在着A、色散力B、色散力、诱导力C、色散力、取向力D、色散力、诱导力、取向力70.干冰升华时吸收的能量用于克服A、键能B、取向力C、诱导力D、色散力71.晶体溶于水时,其溶解热与下列两种能量的相对值有关的是A、离解能和电离能B、离解能和水合能C、水合能和晶格能D、晶格能和电离能72.电价键占优势的液态化合物的特征是A、凝固点低,导电性弱B、凝固点高,导电性强C、凝固点低,导电性强D、凝固点高,导电性弱73.下列说法中不正确的是A、σ键比π键的键能大B、形成σ键比形成π键电子云重叠多C、在相同原子间形成双键比形成单键的键长要短D、双键和叁键都是重键74.下列分子中C与O之间键长最短的是A、CO B、CO2C、CH3OH D、CH3COOH75.下列分子或离子中,呈反磁性的是A、B2B、O2C、CO D、NO76.下列分子和离子中,中心原子杂化轨道类型为s p3 d杂化,且分子(离子) 空间构型呈直线型的是A、ICl-2B、SbF-4C、IF3D、ICl-477.按分子轨道理论,O-2的键级是A、1 B、2 C、121D、22178.按分子轨道理论,下列稳定性大小顺序正确的是A、N-22>N-2>N2B、N2 >N-2> N-22C、N-2>N-22> N2D、N-2>N2 > N-2279.下列分子或离子中,磁性最强的是A、O2B、O2-C、O2+D、O22-80.在下列物质中,氧原子间化学键最稳定的是A、O22-B、O2-C、O2D、O2+81.下列分子中,中心原子以s p 3 d 2杂化的是A、IF5B、PCl5C、SF4D、XeF282.根据分子轨道理论,下列分子或离子中键级最高的是A、O22+B、O2+C、O2D、O2-83.用分子轨道理论来判断下列说法,不正确的是A、N2+的键能比N2分子的小B、CO+的键级是2.5C、N2-和O2+是等电子体系D、第二周期同核双原子分子中,只有Be2分子不能稳定存在84.按分子轨道理论,下列分子或离子中键级等于2的是A、O2-B、CN-C、Be2D、C285.下列说法中正确的是A、BCl3分子中B-Cl键是非极性的B、BCl3分子和B-Cl键都是极性的C、BCl3分子是极性分子,而B-Cl键是非极性键D、BCl3分子是非极性分子,而B-Cl键是极性键86.ClO3F分子的几何构型属于A、直线形B、平面正方形C、四面体形D、平面三角形87.下列物质中,属于极性分子的是A、PCl5(g) B、BCl3C、NCl3 D、XeF288.用VSEPR判断下列离子或分子几何构型为三角锥形的是A、SO3B、SO32-C、NO3-D、CH3+89.下列各组分子中,均有极性的一组是A、PF3,PF5B、SF4,SF6C、PF3,SF4D、PF5,SF690.下列物质中,含极性键的非极性分子是A、H2O B、HCl C、SO3D、NO291.下列各对物质中,分子间作用力最弱的是A、NH3和PH3B、He和Ne C、N2和O2D、H2O和CO292.下列分子中,分子间作用力最强的是A、CCl4B、CHCl3C、CH2Cl2 D、CH3Cl93.下列说法中正确的是A、色散力仅存在于非极性分子之间B、极性分子之间的作用力称为取向力C、诱导力仅存在于极性分子与非极性分子之间D、分子量小的物质,其熔点、沸点也会高于分子量大的物质94.在NaCl晶体中,Na+(或Cl-)离子的最大配位数是A、2 B、4 C、6 D、895.下列物质熔点变化顺序中,正确的一组是A、MgO>BaO> BN> ZnCl2>CdCl2B、BN>MgO>BaO>CdCl2>ZnCl2C、BN>MgO>BaO> ZnCl2>CdCl2D、BN> BaO>MgO> ZnCl2> CdCl296.ICl-2离子中,其中心原子I的杂化态为A、s p3B、s p2C、d s p3D、s p3 d97.CO-23的几何构型是A、平面三角形B、三角锥形C、T字形D、直线形98.下列分子中,偶极矩为零的是A、CO2B、SO2C、H2O D、NH399.下列化合物中,既存在离子键和共价键,又存在配位键的是A、NH4F B、NaOH C、H2S D、BaCl2100.下列氯化物的热稳定次序正确的是A、NaCl>MgCl2>AlCl3>SiCl4B、NaCl<MgCl2<AlCl3<SiCl4C、NaCl<MgCl2>AlCl3>SiCl4D、NaCl>MgCl2<AlCl3>SiCl4101.石英和金刚石的相似之处在于A、都具有四面体结构B、都是以共价键结合的原子晶体C、都具有非极性共价键D、其硬度和熔点相近102.如果正离子的电子层结构类型相同,在下述情况中极化能力较大的是A、离子的电荷多,半径大B、离子的电荷多,半径小C、离子的电荷少,半径大D、离子的电荷少,半径小103.下列离子中,极化率最大的是A、Na+B、I-C、Rb+D、Cl-104.下列离子中,属于(9~17)电子构型的是A、Li+B、F-C、Fe3+D、Pb2+105.下列离子中,变形性最大的是A、CO-23B、SO-24C、ClO-4D、MnO-4106.下列分子中,偶极矩不为零的是A、CO2B、BF3C、CHCl3 D、PCl5107.下列说法正确的是A、非极性分子内的化学键总是非极性的B、色散力仅存在于非极性分子之间C、取向力仅存在于极性分子之间D、有氢原子的物质分子间就有氢键108.按离子的电子构型分类,Li+属于A、9~17电子型B、2电子型C、8电子型D、18电子型C、B2 109.下列分子或离子中键级等于零的是A、O2B、O+2D、Ne2110.根据VSEPR理论,可判断下列分子中具有直线形结构的是A、CS2B、NO2 C、OF2D、SO2111.下列分子中,偶极矩不为零的是A、CCl4B、PCl5C、PCl3 D、SF6112.下列各组物质中,熔点最高的一组是A、NaI和SiI4B、NaI和SiF4 C、NaF和SiF4D、NaF和SiI4113.下列说法不正确的是A、离子晶体中,离子的电荷数越多,核间距离越大,晶格能越大B、离子晶体在熔融时能导电C、离子晶体的水溶液能导电D、离子晶体中,晶格能越大,通常熔点越高,硬度越大114.关于杂化轨道的下列说法,正确的是A、CH4分子中的s p3杂化轨道是由H原子的1个n s轨道和C原子的3个p轨道混合起来而形成的B、s p3杂化轨道是由同一原子中的1个n s轨道和3个n p轨道混合起来重新组合成的4个新的原子轨道C、凡是中心原子采取s p3杂化轨道成键的分子,其几何构型都是正四面体D、凡AB3型共价化合物,其中心原子A均采用s p3杂化轨道成键115.常态下:F2、Cl2是气态,Br2是液态,I2是固态,这是由于A、聚集状态不同B、电负性不同C、价电子构型不同D、色散力不同116.下列分子中极性最小的是A、H2O B、NH3C、H2S D、CO2117.下列化合物中,熔点最高的是A、CaO B、SrO C、BaO D、MgO118.下列关于共价键说法错误的是A、两个原子间键长越短,键越牢固B、两个原子半径之和约等于所形成的共价键键长C、两个原子间键长越长,键越牢固D、键的强度与键长无关119.下列关于杂化轨道说法错误的有A、所有原子轨道都参与杂化B、同一原子中能量相近的原子轨道参与杂化C、杂化轨道能量集中,有利于牢固成键D、杂化轨道中一定有一个电子120.s轨道和p轨道杂化的类型有A、s p,s p2B、s p,s p2,s p3C、s p,s p3 D、s p,s p2,s p3,s p3不等性121.下列晶体中具有σ键、大π键和分子间力的有A、MgO B、BN C、CO2(s) D、石墨122.下列关于晶体点缺陷说法错误的是A、点缺陷主要是由于升高温度和掺入杂质引起的B、置换固溶体可看做是一种点缺陷C、点缺陷仅限于晶体中的某一点上D、点缺陷可发生在晶体中的某些位置123.根据分子轨道理论解释He 2分子不存在,是因为其电子排布式为A、(σs1)2 (σ*s1)2B、(σs1)2 (σ2 s)2C、(σs1)2 (σ*s1)1 (σ2 s)1 D、(σs1)2(σ2p)2124.下列分子构型中以s p3杂化轨道成键的是A、直线形B、平面三角形C、八面体形D、四面体形125.非整数比化合物的化学式为A、AmBn+δB、AnBm C、AmBn (1+D、A1Bm (1+126.下列分子或离子中键角最小的是A、NH3B、PCl4+C、BF3D、H2O E、ICl2-127.下列叙述中错误的是A、相同原子间双键的键能等于单键键能的两倍B、对双原子分子来说,键能等于键离解能C、对多原子分子来说,原子化能等于各键键能总和D、键级、键能和键离解能都可作为衡量化学键牢固程度的物理量,其数值愈大,表示键愈强128.下列叙述中正确的是A、旋转操作后ψ 数值恢复但符号相反,这种原子轨道属于u对称B、H2O分子的C2旋转轴是通过O原子核并垂直于分子平面的轴C、HF的最高占有轨道是1π反键轨道D、HF分子中对成键有贡献的是进入3σ的电子129.IF5的空间构型是A、三角双锥形B、平面三角形C、四方锥形D、变形四面体130.下列键能大小顺序中正确的是A、O2+<O2<O2-B、NO<NO+C、N2>O2> O2+D、CO<NO<O2131.H2S分子的空间构型、中心原子的杂化方式分别为A、直线形、s p杂化B、V形、s p2杂化C、直线形、s p3 d杂化D、V 形、s p3杂化132.下列叙述中错误的是A、单原子分子的偶极矩等于零B、键矩愈大,分子的偶极矩也愈大C、有对称中心的分子,其偶极矩等于零D、分子的偶极矩是键矩的矢量和133.下列各组物质沸点高低顺序中正确的是A、HI>HBr>HCl>HFB、H2Te>H2Se>H2S>H2OC、NH3>AsH3>PH3D、CH4>GeH4>SiH4134.在金属晶体的面心立方密堆积结构中,金属原子的配位数为A、4 B、6 C、8 D、12135.下列离子中,极化力最大的是A、Cu+B、Rb+C、Ba2+D、Sr 2+136.下列离子半径大小次序中错误的是 A 、Mg 2+<Ca 2+ B 、Fe 2+>Fe 3+ C 、Cs +>Ba 2+ D 、F ->O 2-137.下列分子中至少有两个长度的键的是 A 、CS 2 B 、BF 3 C 、SF 4D 、XeF 4138.下列分子中,其空间构型不是“V”字形的是 A 、NO 2 B 、O 3 C 、SO 2 D 、BeCl 2139.下列分子中,其空间构型不是“V”字形的是 A 、NO 2 B 、O 3 C 、SO 2 D 、XeF 2140.由键级大小推断下列键长大小次序正确的是A 、N 2>N +2和NO>NO +B 、N 2>N +2和NO<NO +C 、N 2<N +2和NO<NO +D 、N 2<N +2和NO>NO +141.按照分子轨道理论,O 2的最高占有轨道是 A 、1πu B 、1πg C 、3σ u D 、3σ g142.下列式子中,X 是以s p 杂化轨道成键的是A 、 A -X -AB 、A =X =AC 、 A =••X -XD 、A -••••X -A 143.下列分子中,具有直线形结构的是 A 、OF 2 B 、NO 2 C 、SO 2D 、CS 2144.下列分子中,具有直线形结构的是 A 、OF 2 B 、NO 2 C 、SO 2D 、XeF 2145.已知H -H 、Cl -Cl 和H -Cl 的键能分别为436、243和431 kJ·mol -1,则下列反应H 2 ( g )+ Cl 2 ( g ) =2 HCl ( g )的焓变kJ·mol -1)为A 、-183B 、183C 、-248D 、248146.在25℃和标态下,已知NH 3的生成焓Δ f H m Θ =-46.2 kJ·mol -1,H -H 和N≡N 的键能分别为436和946 kJ·mol -1,则N -H 键的键能(kJ·mol -1)为A 、1173B 、-1173C 、391D 、-391147.已知C -H 的键能为416 kJ·mol -1,CH 3Cl(g)的原子化热为1574 kJ·mol -1,C -Cl 的键能(kJ·mol -1)为A 、326B 、-326C 、357D 、-357148.下列离子的电子结构中,未成对电子数等于零的是 A 、Cu 2+ B 、Mn 2+C 、Pb 2+D 、Fe 2+149.下列离子的电子结构中,未成对电子数等于零的是 A 、Cu 2+ B 、Mn 2+C 、Cd 2+D 、Fe 2+150.根据VSEPR 理论,可判断XeO 3和ClF 3的分子空间构型是A 、平面三角形和三角锥形B 、三角锥形和T 字形C 、T 字形和平面三角形D 、三角锥形和平面三角形151.原子轨道之所以要发生杂化是因为A 、进行电子重排B 、增加配对的电子数C 、增加成键能力D 、保持共价键的方向性152.在Br -CH =CH -Br 分子中,C -Br 键的轨道重叠方式是 A 、s p -p B 、s p 2-s C 、s p 2-p D 、s p 3-p153.在下列物种中,不具有孤电子对的是A、NCl3B、H2S C、OH -D、NH+4154.HNO3的沸点(86℃)比H2O的沸点(100℃)低得多的原因是A、HNO3的分子量比H2O的分子量大得多B、HNO3形成分子间氢键,H2O形成分子内氢键C、HNO3形成分子内氢键,H2O形成分子间氢键D、HNO3分子中有Π4大3π键,而H2O分子中没有155.PH3分子中P原子采取的杂化类型是A、s p B、s p2C、s p3 D、不等性s p3156.分子间的范德华力是随下列哪一个量值增加而增加?A、分子量B、温度C、电子数D、电离能157.CH3OCH3和HF分子之间存在的作用力有A、取向力、诱导力、色散力、氢键B、取向力、诱导力、色散力C、诱导力、色散力D、色散力158.下列各组物质中,两种分子间存在氢键的一组是A、CH3OH和HF B、HCl 和HBr C、C6H6和H2O D、H2S和H2O159.下列单键键能最大的是A、O-H B、F-H C、F-F D、N-H160.下列说法中正确的是A、非极性分子中没有极性键B、键长不是固定不变的C、四个原子组成的分子一定是四面体D、三个原子组成的分子一定是直线形161.下列分子中键有极性,分子也有极性的是A、PH3 B、SiF4C、BF3 D、CO2162.下列杂化轨道中可能存在的是A、n=1 的sp B、n=2 的sp3d C、n=2 的sp3D、n=3 的sd163.在H-C-H 分子中,四个原子处于同一平面上,C原子采用的杂化轨道是‖OA、spB、sp2C、sp3D、sp3d164.在乙烯(CH2=CH2)分子中,六个原子处于同一平面上,一条π键垂直于该平面,则C原子采用的杂化轨道是A、spB、sp2C、sp3D、sp3d165.乙醇和醋酸易溶于水而碘和二硫化碳难溶于水的根本原因是A、分子量不同B、有无氢键C、分子的极性不同D、分子间力不同166.在N2、O2和F2分子中,键的强度次序为N2 >O2 > F2。
无机化学分子结构练习题

课外练习题6(分子结构) 2010,2一、填空题1.O2+的分子轨道电子排布式为,N2+的分子轨道电子排布式为,它们的键级为:O2+,N2+,它们在磁场中均呈现。
2.NH3、PH3、AsH3、SbH3四种氢化物的沸点高低顺序为,NH3分子间除存在三种力外,还有。
3.Be2的分子轨道排布式,CO(它是N2分子的等电子体,分子轨道能级与N2相同)的分子轨道排布式为,CO+的分子轨道排布式为,它们的键级分别为,稳定性大小顺序为,呈顺磁性的是。
4.He、Ne、Ar、Kr、Xe均为原子分子,在它们的分子之间只存在力,它们的沸点高低顺序为。
5.NO+、NO的稳定性大小顺序为,呈顺磁性的是,呈反磁性的是。
6.CO32-、NF3、POCl3、PCl5、BF3中,中心原子的杂化方式依次为,其中杂化轨道中有孤对电子的物种有,有d轨道参与杂化的物种有。
7.根据价层电子对互斥理论可推知ICl4-共有对价层电子对,离子的空间构型为,中心原子采用的杂化方式为。
8.HI分子之间的作用力有,其主要作用力是。
9.F2、Cl2、Br2、I2的沸点高低顺序为,它们都是性分子,偶极矩为,分子之间只有。
10.SiF4中硅原子的杂化方式为,分子间键角为,SiF62-中硅原子的杂化方式为,离子中键角为。
11.由原子轨道线性组合成分子轨道必须遵守的三个原则是。
12.COCl2(∠ClCCl =120º,∠OCCl =120º)中心原子的杂化轨道的类型是;PCl3(∠ClPCl =101º)中心原子的杂化轨道类型是。
13.B2分子的分子轨道排布式为,分子的键级是。
14.OF2分子的中心原子是采用杂化轨道成键的,该分子的空间构型为。
15二、选择题1.下列叙述中错误的是。
(A) 相同原子间双键的键能等于单键键能的二倍。
(B) 对双原子分子来说,键能等于离解能。
(C) 对多原子分子来说,原子化能等于各键离解能总和。
(D) 键级、键能和键离解能都可以作为衡量化学键牢固的物理量,其数值越大,表示键越强。
无机与分析化学第4章习题答案
第四章配位化合物习题参考解答1.试举例说明复盐与配合物,配位剂与螯合剂的区别。
解复盐(如KCl ·MgCl 2·6H 2O)在晶体或在溶液中均无配离子,在溶液中各种离子均以自由离子存在;配合物K 2[HgI 4]在晶体与溶液中均存在[HgI 4]2-配离子,在溶液中主要以[HgI 4]2-存在,独立的自由Hg 2+很少。
配位剂有单基配位剂与多基配位剂:单基配位剂只有一个配位 原子,如NH 3(配位原子是N);多基配位剂(如乙二胺H 2N -CH 2- CH 2-NH 2)含有两个或两个以上配位原子,这种多基配位体能和中 心原子M 形成环状结构的化合物,故称螯合剂。
2.哪些元素的原子或离子可以作为配合物的形成体?哪些分 子和离子常作为配位体?它们形成配合物时需具备什么条件? 解配合物的中心原子一般为带正电的阳离子,也有电中性的 原子甚至还有极少数的阴离子,以过渡金属离子最为常见,少数高 氧化态的非金属元素原子也能作中心离子,如Si(Ⅳ)、P(Ⅴ)等。
配位体可以是阴离子,如X-、OH -、SCN -、CN -、C 2O 4-等;也可以是中性分子,如H 2O 、CO 、乙二胺、醚等。
它们形成配合物时需具备的条件是中心离子(或原子)的价层上 有空轨道,配体有可提供孤对电子的配位原子。
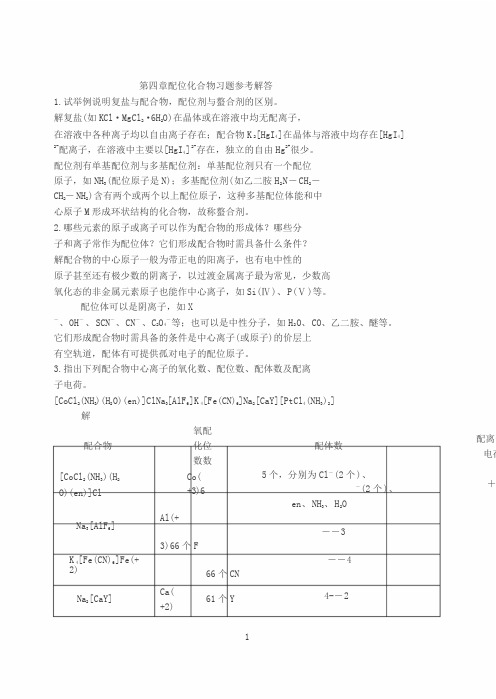
3.指出下列配合物中心离子的氧化数、配位数、配体数及配离 子电荷。
[CoCl 2(NH 3)(H 2O)(en)]ClNa 3[AlF 6]K 4[Fe(CN)6]Na 2[CaY][PtCl 4(NH 3)2]解配合物 [CoCl 2(NH 3)(H 2 O)(en)]Cl 氧配 化位 数数 Co( +3)6配体数5个,分别为Cl -(2个)、-(2个)、en 、NH 3、H 2O配离子电荷+Na 3[AlF 6]A l(+--33)66个FK 4[Fe(CN)6]Fe(+2) --466个CNNa 2[CaY]C a( +2)61个Y4--2 1[PtCl4(NH3)2] P t(+4)66个,4个Cl -,2个NH304.命名下列配合物,指出中心离子的氧化数和配位数。
高等教育出版社 无机化学 第四章 课后习题答案

第四章1. 试用离子键理论说明由金属钾和单质氯反应,形成氯化钾的过程?如何理解离子键没有方向性和饱和性? 答原子所得,二者因静电引力而吸引,之间得作用力成为离子键。
离子键没有方向性可以这样理解:阴离子与阳离子并非只有再某一方向才具有吸引力,而是在任何方向都有力的作用,只不过当距离远时其作用力小一点而已。
2. 用下列数据求氢原子的电子亲和能:K(s) → K(g) △H 1=83 kJ ·mol 1- K(g) → K +(g) △H 2=419 kJ ·mol 1-21H 2(g) → H(g) △H 3=218kJ ·mol 1- K +(g) + H -(g) → KH(s) △H 4= -742kJ ·mol 1- K(s) + 21H 2(g) → KH(s) △H 5= -59kJ ·mol 1- 解3. ClF 的解离能为246kJ ·mol -1 ,ClF 的生成热为—56 kJ ·mol -1 Cl 2的解离能为238kJ ·mol -1,试计算F 2(g )解离能。
解4.试根据晶体的构型与半径比的关系,判断下列AB型离子化合物的晶体构型:BeO,NaBr,CaS,RbI,BeS,CsBr,AgCl。
答5.试从电负性数据,计算下列化合物中单键的离子性百分数各为多少?并判断哪些是离子型化合物?哪些是共价型化合物?NaF,AgBr,RbF,HI,CuI,HBr,CrCl。
答6.如何理解共价键具有方向性和饱和性?答7.BF3是平面三角形的几何构型,但NF3却是三角的几何构型,试用杂化轨道理论加以说明。
答8.指出下列化合物合理的结构是哪一种?不合理结构的错误在哪里?(a)(b)(c)答N2O存在9.在下列各组中,哪一种化合物的键角大?说明其原因。
(a)CH4和NH3(b)OF2和Cl2O(c)NH3和NF3(d)PH3和NH3答10.试用价层电子互斥理论判断下列分子或离子的空间构型。
新教材高中化学第四章物质结构元素周期律第三节化学键第2课时共价键课后训练新人教版

第2课时共价键课后·训练提升合格考过关检验1.下列叙述正确的是( )。
A.O2分子间存在着非极性共价键B.SO2和H2O反应的产物是离子化合物C.CO2分子内存在着极性共价键D.稀盐酸中含有H+和Cl,故HCl是离子化合物答案:C解析:O2分子内存在着非极性共价键,O2分子间只有范德华力,A项不正确。
SO2和H2O反应的产物H2SO3是共价化合物,B项不正确。
CO2分子内有碳氧双键,故存在极性共价键,C项正确。
HCl中只有共价键,没有离子键,故HCl为共价化合物,D项不正确。
2.H2O2中不存在的化学键类型是( )。
A.极性键B.非极性键C.离子键D.共价键答案:C解析:形成离子键时,成键微粒中要么含有金属离子,要么含有N,故H2O2中不存在离子键。
H2O2的电子式为H,氧原子之间形成的是非极性键,氢原子与氧原子之间形成的是极性键。
3.下列关于电子式的表述正确的是( )。
A.HClO的电子式为B.SCl2的电子式为C.用电子式表示HCl的形成过程为H×+·H+]D.已知SCN每个原子都达到8电子结构,则其电子式为C︙︙]答案:D解析:A项,HClO的电子式为。
B项,S原子的最外层有6个电子,Cl原子的最外层有7个电子,它们之间形成2个共价键从而达到8电子稳定结构,故其电子式为。
C项,HCl 为共价化合物,其电子式为。
4.下列物质中,既含有极性键又含有非极性键的是( )。
A.N2H4B.CO2C.Na2O2D.NH4Cl答案:A5.下列变化过程中,无化学键断裂或形成的是( )。
A.石墨转化为金刚石B.KCl晶体溶于水C.蔗糖熔化D.H2SO4溶于水答案:C解析:石墨转化为金刚石是化学变化,一定有化学键的断裂和形成;KCl是离子化合物,晶体溶于水时离子键被破坏;蔗糖熔化时破坏的是分子间作用力;H2SO4是共价化合物,且是电解质,溶于水时破坏共价键,故选C。
6.下列化合物中,含有非极性键的离子化合物是( )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机化学第四章_化学键与分子结构补充习题(总10页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--第四章化学键与分子结构补充习题【选择题】1.下列卤化物中,离子键成分大小顺序正确的是()。
A.CsF>RbCl>KBr>NaI B.CsF>RbBr>KCl>NaF C.RbBr>CsI>NaF>KCl D.KCl>NaF>CsI>RbBr 2.下列物质中沸点高低顺序正确的是()。
A.H2Te>H2Se>H2S>H2O B.H2Se>H2S>H2O>H2Te;C.H2O>H2S>H2Se>H2Te D.H2O>H2Te>H2Se>H2S3.既能衡量元素金属性强弱,又能衡量其非金属性强弱的物理量是()。
A.电负性 B.电离能 C.电子亲和能 D.偶极矩4.Pb2+、Bi3+离子均属何种电子构型()。
A.18 B.18 + 2 C.8 D.9~175.下列离子型化合物熔点最低的是()。
A.NaF B.BaO C.SrO D.MgO 6.下列各化学键中极性最大的是()。
A.B-Cl B.Ba-Cl C.Be-Cl D.Br-Cl7.下列分子中属于非极性分子的是()。
A.CHCl3 B.PCI3C.CO2D.HCl8.下列分子中,空间构型不是直线的是()。
A.CO B.H2O C.CO2D.HgCI29.下列说法中错误的是()。
A.杂化轨道有利于形成σ键B.杂化轨道均参加成键C.采取杂化轨道成键,更能满足轨道最大重迭原理D.采取杂化轨道成键,能提高原子成键能力10.BF4-离子中,B原子采用的杂化轨道是()。
A.sp B.sp2 C.sp 3 D.不等性sp311.下列分子中,构型是平面三角形的分子是()。
A.CO2 B.PCl3C.BCl3D.NH312.下列分子中键角最大的是()。
A.PCl3 B.NH3C.SiCl4D.CO213.下列关于杂化轨道理论的说法中正确的是()。
A.杂化轨道理论是在分子轨道理论基础上发展起来的B.成键过程中,中心原子能量相近的各原子轨道组合起来,形成一个新的原子轨道C.形成杂化轨道的数目等于参加杂化的各原子轨道数目之和D.未杂化的原子轨道与杂化轨道的能量是相同的14.OF2分子中O原子的杂化方式是()。
A.sp2 B.sp C.sp3 D.sp3不等性15.一般金属有银白色光泽,其原因是金属()。
A.一般是整体 B.存在自由电子 C.密度大 D.价电子少16.共价键若按其成键原子轨道的对称性可区分为()。
A.正常共价键和配位键两类B.σ键和π键两类C.价键理论的共价键和分子轨道理论的共价键D.正常共价键、配位键和金属键三类17.现代价键理论无法解释其存在的物质是()。
A.CO2 B.H2+ C.H2O D.CO18.下列判断正确的是( )。
A.Mg是绝缘体 B.Ge是导体 C.Li是半导体 D.Si 是半导体19.下列判断正确的是()。
A.AsH3、MgO都是共价化合物B.AsH3、HCl都是共价化合物C.CaF2、AsH3都是离子型化合物D.CaF2、SO2都是共价化合物20.下列判断错误的是()。
A.NaF是离子键 B.CsCl是离子键 C.CuI是离子键 D.HI 是共价键21.极性共价化合物的实例是()。
A.CCl4 B.BCl3 C.HCl D.NaCl22.下列物质间只存在诱导力和色散力的是()。
A.食盐与苯 B.苯与CCl4 C.KCl与MgO D.CS2和CCl423.下列物质的分子间力最大的是()。
A.O2 B.Br2C.N2D.H224.下列物质之间没有氢键存在,但同时存在着三种范德华力的是()。
A.SO2和CHCl3B.乙醇和氨水 C.CCl4和GeCl4D.HgCl2和BCl325.氨比甲烷易溶于水,其原因是()。
A.相对分子量的差别 B.密度的差别 C.分子极性的差别 D.熔点的差别26.下列说法中正确的是()。
A.所有含氢化合物中都存在氢键 B.色散力存在于所有分子间C.气体分子间只存在色散力 D.固体分子间都存在取向力27.下列物质按熔点降低顺序排列正确的是()。
A.CaO>MgO>SiBr4>SiCl4B.MgO>CaO>SiBr4>SiCl4C.SiBr4>MgO>CaO>SiCl4D.CaO>MgO>SiCl4>SiBr428.氟化氢的反常熔、沸点归因于()。
A.氢键 B.共价键 C.离子键D.配位键29.下列分子中偶极矩不为零的是()。
A.HgBr2 B.BF3C.CCl4D.NF330.下列物质中的化学键属于离子键的是()。
A.CaO B.PCl3 C.MgCl2D.HCl31.下列气态卤化氢分子偶极矩变小的顺序是()。
A.HCl、HBr、HI、HF B.HF、HCI、HBr、HIC.HI、HBr、HCl、HF D.HBr、HCl、HF、HI 32.共价键最可能存在于()。
A.非金属原子之间 B.金属原子之间C.非金属原子和金属原子之间 D.电负性差很大的元素的原子之间33.下列四种卤化物中离子特征百分数变大的顺序为()。
A.CsI、RbBr、KCI、NaF B.NaF、KCl、RbBr、CsIC.RbBr、CsI、NaF、KCl D.KCl、NaF、CsI、RbBr 34.下列关于范德华力的论述,错误的是()。
A.非极性分子之间没有取向力B.诱导力在三种范德化力中通常是最小的C.分子的极性越大,取向力越大D.极性分子之间没有色散力35.下列物质呈固态时,属于分子晶体的是()。
A.Si B.NaF C.CCl4D.Fe36.下列晶体中以离子键为主的是()。
A.CO2晶体 B.I2晶体 C.SiO2晶体D.CaO晶体37.下列物质中无一定熔点的是()。
A.食盐 B.铜 C.冰D.石腊38.下列离子中,半径最大的是()。
A.Cl- B.K+ C.S2-D.Ca2+39.下列物质中熔点最高的是()。
A.SiC B.SiCl4 C.AlCl3D.MgF240.石墨晶体中,层与层之间的结合力是()。
A.金属键 B.共价键 C.范德华力D.离子键41.在NaCl晶体中,每个Cl-离子周围最靠近的Na+离子数目是( )。
A.2 B.4 C.6 D.842.NaF、MgO、CaO晶格能大小的次序是()。
A.MgO>CaO>NaF B.CaO>MgO>NaFC.NaF>MgO>CaO D.NaF>CaO>MgO 43.通常用晶格能的大小来表示()的强弱。
A.氢键 B.离子键 C.共价键D.金属键44.下列各种晶体中,含有简单的独立分子的晶体是()。
A.原子晶体 B.离子晶体 C.分子晶体D.金属晶体45.下列分子中,即含有取向力、诱导力,又含有色散力的是()。
A.H2 B.HCl C.BF3D.CCl446.具有饱和性和方向性的是()。
A.氢键 B.离子键 C.分子间力D.金属键47.下列分子中不含有氢键的是()。
A.NH3 B.CH3OCH3C.H2O D.HCOOH48.下列晶体中熔化时要破坏共价键的是()。
A.SiF4 B.CO2C.AgD.SiO249.氨比甲烷易溶于水的原因是二者()的不同。
A.分子量 B.熔点 C.分子极性D.密度50.下列分子中只存在色散力的是()。
A.CO B.H2O C.HBrD.SiF451.H2O的沸点是100℃,H2S的沸点是-42℃,这种差别可以用()解释。
A.分子间力 B.共价键 C.离子键D.氢键52.下列分子中()的偶极矩不等于零。
A.CCl4 B.PCl3C.CO2D.BF353.下列化合物中氢键表现最强的是()。
A.NH3 B.H2S C.H2O D.HF54.下列分子中键有极性,分子也有极性的是()。
A.Cl2 B.NH3C.CO2D.BF355.下列晶体中熔点最高的是()。
[原子晶体>离子晶体>金属晶体>分子晶体]A.NaBr B.SiO2 C.CCl4D.MgO【填空题】4.MgO晶体比金属Mg的延展性;石墨晶体比金刚石晶体的导电性;SiO2晶体比SiF4晶体的硬度;I2晶体比NaI晶体在水中的溶解度。
5.已知B2轨道的能级顺序为σ1sσ*1sσ2sσ*2sπ2pyπ2pzσ2pxπ*2pyπ*2pzσ*2px,则B2的分子轨道分布式为,成键数目及名称为。
6.HF的沸点比HI高,主要是由于。
7.根据杂化轨道理论,BF3分子的空间构型为,偶极矩零;NF3分子的空间构型为,偶极矩零,BeCl2分子的空间构型为,偶极矩零。
8.极性分子之间存在着力、力和力;非极性分子之间存在着色散力;极性分子和非极性分子之间存在着力和力。
9.H2O分子的空间构型是形,键角既不是90º,也不是109º28′,而是,这是由于。
10.NH3的沸点比PH3的沸点高,其原因是。
11.氯化物中离子极化作用的增强使键型由向转化,化合物的晶型也相应地由向转化,使化合物的熔、沸点。
12.第16号元素S原子的外层电子构型为,它以杂化轨道和H原子结合成H2S分子,该分子的空间构型为,偶极矩零,S—H键是共价键。
13.分子间力包括、和,它们的强度都小于。
H2分子之间只存在力。
14.H2O分子之间存在力、力、力和,CCl4分子之间存在。
15.金刚石是晶体,KCl是晶体,干冰是晶体,其中熔点最低的是,因为其质点间的结合力是。
16.N原子外层电子构型为,它以杂化轨道和H原子结合成NH3分子,该分子的空间构型为,偶极矩零,N-H键是共价键。
17.在共价化合物中,键的极性大小可由差值的大小来衡量,分子的极性大小,可由的大小来衡量。
【判断题】1.偶极矩可衡量分子极性大小,晶格能可衡量离子晶体的稳定性。
()2.氢键是一种分子之间的作用力,所以没有饱和性和方向性。
()3.色散力不仅仅存在于非极性分子之间。
()4.同时含有H原子和F(或O、N)原子的化合物,其分子之间一定存在氢键。
()5.分子的极性取决于键的极性。
()6.色散力存在于任何分子之间。
()7.CaO的分子量比BaO的分子量要小,所以CaO的熔点比BaO的要低。
()8.凡是中心原子采用sp3杂化轨道成键的分子,其几何构型都是正四面体。
()9.CO2、BCl3、CH4分子中都有极性键,所以它们都是极性分子。
()10.凡是AB3型的共价化合物,其中心原子均采取sp2杂化轨道成键。
()11.CH4分子中的sp3杂化轨道是由C原子的3个p轨道和H原子的1s轨道杂化而成的。
