二组分液液平衡系统相图ppt课件
合集下载
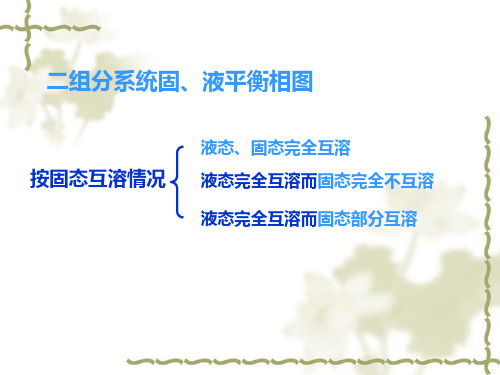
3.4 二组分系统固液平衡相图
t/℃
80
l(A+B)
•t
* B
液相线(凝固
60
点降低曲线)
• 40 t
* A
s(A)+l(A+B)
l (A+B)+sB
固相线
20 C
•E s(A)+s(B)
共晶线
D
(温度、三个相的
0.0 0.2 0.4 0.6 0.8 1.0 组成都不变)
邻硝基氯苯(A) xB
对硝基氯苯(B)
E点:液相能存在的
l+s s(A+B)
p/102kPa
t=60℃ l(A+B)
lg g(A+B)
d-香芹(A) wB
l-香芹(B)
图a 最高熔点液固相图
H2O(A)
yB
C2H5OH(B)
图b 最高恒沸点气液相图
2 液态完全互溶而固态完全不互溶
t/℃ 80
60
• 40 t
* A
20
C
•E
•t
* B
t/℃
•t
* A
p=101 325Pa
出的t-xB图,列表回答系统在5C,30C,50C时的
相数、相的聚集态及成分、各相的物质的量、系统所 在相区的条件自由度数。
解:
系统 相数
温度
t / C
5
2
相的聚集态 及成分
s (A), s (B)
30 2 s (B), l (A+B)
50 1
l (A+B)
各相的物量
ns(A) = 2 mol ns(B) = 8 mol
t
* B
l (A+B)
二组分液态部分互溶和完全不互溶系统液-气平衡相图精品PPT课件

液相组成 w[(NH4)2SO4] 0
0.167 0.286 0.375 0.384 0.411 0.422 0.438 0.458 0.479 0.498 0.518
固相
冰 冰
冰 冰
冰+(NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4
3.固态部分互溶的二组分凝聚系统相图
(1) 系统有一低共熔点
在相图上有三个单相区: AEB线以上,熔化物(L) AJF以左, 固溶体(1) BCG以右,固溶体 (2) 有三个两相区: AEJ区, L +(1) BEC区, L + (2) FJECG区,(1)+ (2)
AE,BE是液相组成线;AJ,BC是固溶体组成线;JEC线 为三相共存线,即(1)、(2)和组成为E的熔液三相共存,E点 为(1)、(2)的低共熔点。
8杠杆规则及其应用bbbb??????????mmmm???得bbbb??????mm????aobb??b?b??m?m?得杠杆规则bbbb?????mm?????设m为质量为质量分数1
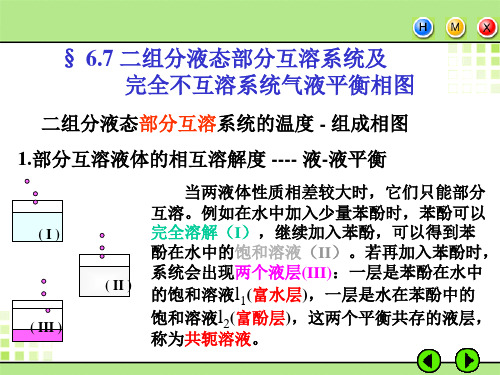
§6.4 二组分液态部分互溶和完全不互 溶系统液-气平衡相图
1. 液体的相互溶解度
彼此互相饱和的两溶液,称为共轭溶液 6.7p.2影二响组不分大液,态通部常分是互T溶-x图系—统—的溶气解一度液曲平线衡相图
MN:三相平衡线
§6.5 绘制二组分凝聚系统相图的方法
1.热分析法(适用于熔点高的二元合金相图绘制)
原理:当系统缓而均匀地冷却时,若系统内无相 的变化,则温度将随时间而均匀地改变,即在T-t 曲线上呈一条直线,若系统内有相变化,则因放 出相变热,使系统温度变化不均匀,在T-t 图上 有转折或水平线段,由此判断系统是否有相变化。
4.3 二组分气-液平衡体系

五、完全不互溶双液体系--水蒸气蒸馏
如果两种液体在性质上差别很大,它们间 的相互溶解度很小,这样的体系可看作完全 不互溶的双液系。在这种体系中任一液体的 蒸气压与同温度单独存在时完全一样,并与 两种液体存在的量无关。溶液的总蒸气压等 于两纯组分饱和蒸气压之和。
即:
p p p
* A
* B
不管其相对数量如何,体系的总蒸气压P 大于任一纯组分的蒸气压,因此体系的沸点 必然低于任一液体的沸点。
(三)理想液态混合物的 p-x -y图
若将P=P*A+(P*B-P*A)xB 代入PyB=P*BxB 可得
Px yB * PA ( P P ) xB
* B B * * B A
(xA= 1-xB)
(yA =1-yB)
据此可以分别求得气相和液相的组成。 气相线总是在液相线的下面(见图)
这是 p-x 图的一种,把液相组成 x 和气相组成 y 画在 同一张图上即得 p-x-y 图
(一)产生正负偏差不大的体系
pB p B xA 如图所示,是对拉乌 yB p p 尔定律发生正偏差的情
* B
况,虚线为理论值,实 线为实验值。真实的蒸 气压大于理论计算值。 当正负偏差较小时,溶液 的总蒸气压介于两个纯组 分蒸气压之间。
如:CCl4-环己烷,CCl4-苯
一般偏差体系: p T一定
,
PB= P*BxB)
pA p xA yA p p
A B
pB p xB yB p p
y A p .x A y B p .xB
y A p .x A 若纯液体 B比纯液体A易挥发, y B p .xB 亦即p *> p *,则:
B A
第6章 二组分液态部分互溶系统及完全不互溶系统气液平衡相图
不变,但三相的数量却在改变,状态 L1 和 L2的两个液相量按
线段长度 GL2与 L1G的比例蒸发 t g
p=101.325kPa
成状态 G 的气相。
Q
d
因系统点 b 位于 G 点左侧 L1G线段上,在产生气相之前 L1 和 L2两液相的质量之比为线段 bL2和 L1b长度之比:
m( L1) bL2 m( L2 ) bL1
或 Δm(α) [wB (γ ) wB (α)] Δm( β ) [wB ( β ) wB (γ )]
及 Δm(α) Δm( β) Δm(γ) 0
Δm(α) wB ( β ) wB (γ ) Δm(γ ) wB ( β ) wB (α)
Δm( β ) wB (α) wB (γ ) Δm(γ ) wB ( β ) wB (α)
又为另一液层的饱和蒸汽压。即气相与两个液
L2
相均平衡,而这两个液相相互平衡。
根据这三相组成的关系,可将部分互溶系统气-液平衡的温 度 - 组成图分为两类:
3.部分互溶系统的温度 - 组成图
(1)气相组成介于两液相组成之间的系统
t
P
92
L1 0M A
p=101.325kPa
Q
G L2
wB/%
N 100 B
当系统由a 升温到L2´时,两个
共轭液相的相点分别沿 L1 L1´ 和 L2 L2´ 变化,两液相的质量 也不断变化,富水层减少,富酚层逐渐增加。在 L2´富水层状 态为L1´ ,然后富水层消失,只剩一个富酚层。此为第一种类 型。
t
p=const. be
C
LL11’´
L2’´ l
第二种类型为系统点在ce 线 左侧,升温过程中相变化的分析 与上类似,只是升到 MC 线时是 富酚层消失,只剩下富水层。
6-2二组分系统理想液态混合物的气—液平衡相图

二组分系统液态互溶情况:
(a)完全互溶
(b)完全不互溶 (c)部分互溶
液态完全互溶系统 p-x、t-x图
理想系统 真实系统
一般正偏差 最大正偏差
一般负偏差 最大负偏差
液态部分互溶系统 t-x图
气相组成介于两液相之间 气相组成位于两液相同侧
液态完全不互溶系统 t-x图
完全互溶系统:理想液态混合物系统气-液平衡相图
1. 压力—组成图
A、B形成理想液态混合物:均符合拉乌尔定律
A组分分压: pA pA* xA pA* 1 xB
B组分分压: pB pB* xB
pA,pB,p和xB均成
气相总压: p pA pB
直线关系
pA* 1 xB pB* xB
pA* pB* pA* xB
液相线:气相总压 p 与液相组成 xB 之间的关系曲线
nL
解: (1) 先确定系统点的总组成
xM
nB nA nB
6 46
0.6
利用
nG (xM yB ) nL (xB xM ) 即 nG (0.6 0.2) nL (0.7 0.6) (1)
nG nL n总 =4+6=10mol (2)
解得
nG =2mol
nL =8mol
(2) 气相中: 甲苯 nB nG yB 2 0.2 0.4mol 苯 nA nG yA 2 0.8 1.6mol
(4)最大负偏差系统
p实际 p理想
且在某一组成范围内比 难挥发组分的饱和蒸气 压还小,实际蒸气总压 出现最小值
液相线
氯仿(A)—丙酮(B)系统
加上气相线:
一般正偏差系统
一般负偏差系统
最大正偏差系统
液相线 气相线
(a)完全互溶
(b)完全不互溶 (c)部分互溶
液态完全互溶系统 p-x、t-x图
理想系统 真实系统
一般正偏差 最大正偏差
一般负偏差 最大负偏差
液态部分互溶系统 t-x图
气相组成介于两液相之间 气相组成位于两液相同侧
液态完全不互溶系统 t-x图
完全互溶系统:理想液态混合物系统气-液平衡相图
1. 压力—组成图
A、B形成理想液态混合物:均符合拉乌尔定律
A组分分压: pA pA* xA pA* 1 xB
B组分分压: pB pB* xB
pA,pB,p和xB均成
气相总压: p pA pB
直线关系
pA* 1 xB pB* xB
pA* pB* pA* xB
液相线:气相总压 p 与液相组成 xB 之间的关系曲线
nL
解: (1) 先确定系统点的总组成
xM
nB nA nB
6 46
0.6
利用
nG (xM yB ) nL (xB xM ) 即 nG (0.6 0.2) nL (0.7 0.6) (1)
nG nL n总 =4+6=10mol (2)
解得
nG =2mol
nL =8mol
(2) 气相中: 甲苯 nB nG yB 2 0.2 0.4mol 苯 nA nG yA 2 0.8 1.6mol
(4)最大负偏差系统
p实际 p理想
且在某一组成范围内比 难挥发组分的饱和蒸气 压还小,实际蒸气总压 出现最小值
液相线
氯仿(A)—丙酮(B)系统
加上气相线:
一般正偏差系统
一般负偏差系统
最大正偏差系统
液相线 气相线
物理化学课件二组分相图相图解读

2
压力-组成图(p~ xB图)
设组分A和B形成理想液态混合物(见图). 气-液平衡时蒸气总压p与液相组成xB的关系: 在温度T下两相平衡时, 由拉乌尔定律
* * xB pA pA xA , pB pB
T一定
g p y A yB pA pB xA xB l
•理想液态混合物的 气 - 液平衡
A和B均满足 pB = p*B xB
t 一定 p
p
l (A+B) M
* B
nGxG + nLxL = (nG + nL) xM 得
L 总 nG n n B B B
L
G
nL xG xM MG 推导 nG xM xL LM
B 既是系统点又是相点
A
xL xM xG nL nM nG
xB
7
• 实际混合物中苯(B)和甲苯(A)双液系的性质接近理想 混合物, 在79.7 ℃下实测 压力-组成 数据如下:
液相组成 xB 0 0.1161 0.2271 0.3383 0.4532 0.5451 0.6344 0.7327 0.8243 0.9189 0.9565 1.000
8
相点
系统点
液相线
• 点, 线, 区的含义 及各状态下自由 度数; • 会读系统总组成 g p 与相组成 ; yA yB pA pB 气相线 xA xB 相点 l
T一定
结线 •理想液态混合物的 气 - 液平衡
蒸气压组成相图 A和B均满足 pB = p*B xB
9
2. 温度-组成图(T~ xB图)
在恒压下表示二组分系统气-液平衡时的温度和
组成的关系. 根据实验数据可以作出T~x图(包括气相线和液 相线). 例如:苯~甲苯的T~x图如下:
物理化学课件二组分相图相图

* A A
气相线(p~y图) 将气相线与液相线画在同一张图上得:
6
系统点
p
相点
t 一定
l (A+B) M
L
G
• 系统点: 表示系统总状态 p (总组成)的点(例如M点); 结线 • 相点:表示各个相的状态的 点( 只有一个相时,系统点 就是相点) (例如L、G点).
* B
* pA
g (A+B)
• 结线: 两个平衡相点的连 结线。 相点
0.18 l A+B)
气相线
g(A+B)
0.12
0.06 g (A+B) 0.2 0.4 xB 0.6 0.8 1.0 B
p
* A
0.0 A
•H2O(A) - C3H6O (B)系统的压力-组成图
20
具有最大正偏差系统的压力-组成图 液相线和气相线在最高点处相切
1. 0 60 50
t =35 ℃
l L G
* f AB < f AA * f AB < f BB
•若纯组分有缔合作用, 在形成混合物后发生离解, 因分子数 增多而产生正偏差.
•混合时常有吸热及体积增大现象. 关于负偏差: •若两组分分子间的吸引力大于各纯组分分子间吸引力, 形成 混合物后, 分子就较难逸出液面而产生负偏差. * * f AB > f AA f AB > f BB
•若形成混合物后分子发生缔合, 因分子数减少而产生负偏差.
•混合时常有放热及体积缩小现象.
19
②. 压力-组成图
一般正偏差和一般负偏 差系统的压力-组成图 与理想系统的主要 差别是液相线不是直 线. 如: 统. 水和丙酮系
3.2 二组分系统气液平衡相图

LG
定温连结线
80
t
* B
xl,B
l(A+B)
60
0.0
0.0 0.2 0.4 0.6 0.8 1.0
C6H5CH3(A)
xB
C6H6 (B)
图3-10 C6H5CH3(A) - C6H6 (B)系统的 沸点-组成图
15
0.0 t/℃
120
t
* A
100
80
60
yB 0.2 0.4 0.6 0.8 1.0
p/102kPa
(2) 蒸气压‐组成曲线有极值
0.0 0.2 1. 0
t=60℃ 0.8
0.6
0.4
pA*
0.2
xB 0.4 0.6
l(A+B) lg
0.8 1.0 xB=0.92
蒸气压有极大值,
yB=xB,气相线与液相 线相切
左半支:yB > xB pB* 右半支:yB < xB
g(A+B)
0.0 0.0 0.2
若pB* > p > pA*, 则 yB > xB, yA < xA. 可知:
饱和蒸气压不同的两种液体形成理想液态混合物成气液平衡时, 两相的组成并不相同, 易挥发组分在气相中的相 对含量大于它在液相中的相对含量.
气-液平衡时蒸气总压p与气相组成yB的关系: 结合式 p = pA* + (pB* - pA* ) xB 和式 yB = pB*xB /p 可得
• 从相图分析恒温降压变化过程.
• 与纯物质在恒温下有一定的饱和蒸气压不同, 由于液相在 气化过程中组成不断变化(剩余难挥发性组分愈来愈多), 使得其平衡蒸气压不断下降, 因而存在相变压力区间. 5
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
p 影响不大,通常是T-x图——溶解度曲线
7
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
例如
在通常温度下将少量的酚加入水中时,开始酚是 完全溶解的。
如果继续往水里加酚,在浓度超过一定数值以后, 就不再溶解。
这时溶液中出现两个液层,这两个液层是部分互 溶的饱和溶液,即:
8
一、部分互溶液体的相互溶解度
• l2 的组成向 B 方向移动。
中国科学技术大学化
1
一、部分互溶液体的相互溶解度
如果升温,苯酚在水中的溶解度沿AC 线向上变化,水在苯酚中的溶解度沿 BC线向上变化,彼此的溶解度都增加。 如继续升温,则两层的组成逐渐接近, 最后汇集到C点,此时两层的浓度一样 而成单相溶液; 以C点以上,溶液成单相,自由度
• 连接 l1 和 l2 的线就是“结线”。
• 当体系的总组成(物系点)落在结线上时,体系两相共存。 • 且这两相的互比量(质量比)应遵守杠杆规则。
中国科学技术大学化
1
一、部分互溶液体的相互溶解度 •比如体系的总组成为 X 时,共轭溶液的组成分 别 为 X1 和 X2 , 而 这 两 个 相的互比量为:
中国科学技术大学化
1
2.若某温度时有一组成为 d 的溶液,其状态点在ACB曲 线的外面,故此时只有一 个液相存在。
• 如果将此溶液冷却,则当温度降 低到 50C时,体系的状态点正
好落在ACB曲线的 l1 上,此时体 系即将出现另一液相 l 2;
温度继续降低,共轭溶液的组成会随之变改:
• l1 的组成向 A 方向移动;
F K 1 2 11 2
表示在此温度以上,水与苯酚可以任意比例混溶而不分层,则C 点称为临界点,C点所对应的温度称为“最高临界溶解温度” 。
从上述图中可以看出:AC线相当于苯酚在水中的溶解度曲 线,BC线相当于水在苯酚的溶解度曲线
7.5%
71.2% 7.5%
71.2% 7.5%
71.2% 7.5%
10
一、部分互溶液体的相互溶解度
部分互溶液体的温度-组成图 • 根据相律,在温度和压力一定的情
况下,共轭溶液的组成是确定的。 因为这时自由度: f= C + 0 = 22 + 0 = 0 • 而在压力一定的条件下,共轭溶液 的组成将随温度的不同而改变,因 为这时,自由度:
71.2%<wB<100%
水的酚溶液
62.0%<wB<100% 50.0%<wB<100%
9
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
共轭溶液: T一定时,部分互溶的溶液浓度超过
一定范围,体系分层形成两个液相,当溶解达到 平衡时,这对彼此互相饱和的两个溶液。
◦ ① 酚在水中的饱和溶液; ◦ ② 水在酚中的饱和溶液。
中国科学技术大学化
1
如果继续往此体系中加酚,则两个 液相的组成仍然为 X1 和 X2,但这 两个液相的互比量变化。随着酚的
不断加入,l1 相会减少,l2 相的量
会增加。当总组成为 X 时 :
• 当体系的总组成为 X2 时,l1 相恰好消失。
• 如果继续加酚至组成为 b 时,则体系中只有一个水在酚 中的不饱和溶液相了。
【教学重点】 1. 部分互溶双液系统的相图
【教学难点】 1.水蒸气蒸馏原理
3
第四节 二组分气-液平衡系统相图
一、 拉乌尔定律及理想溶液 二、 气相组成与液相组成 三、 非理想溶液对理想溶液的偏差 四、 蒸馏与精馏原理
4
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度 当两种液体的性质差别较大时,可发生部分互 溶的现象,即在某温度范围内,两种液体的相互 溶解度都不大, 只有当一种液体的量很少,另一 种液体的量相对较多时,才能形成均匀的一相, 而在其它配比下,系统将分层而呈两个液相平衡 共存。此时将这两液相称为共轭溶液。
例如水(A)-苯酚(B): 在23.9℃及标准压力下,往水中逐渐加苯酚。
7.5%
0
7.5%
23.9 ℃ 0<wB<7.5%
酚的水溶液
50 ℃ 0<wB<11.5%
65 ℃ 0<wB<18.5%
71.2% 7.5%
71.2% 7.5%
71.2% 7.5%
7.5%<wB<71.2%
共轭溶液
11.5%<wB<62.0% 18.5%<wB<50.0%
5
Hale Waihona Puke 第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度 二、部分互溶液体的蒸馏 三、不互溶的液-液系统—水蒸气蒸馏
6
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
当两种液体性质上有明显的不同,体系的行 为比之理想溶液有很大的偏差时,会发生“部分互 溶”的现象,即一液体在另一液体中只有有限的溶 解度。
Wl1 l1X Wl2 l2X
或 :Wl 1 Xl2 Wl 2 Xl1
14
讨论
1. 在 50C 时,组成为 a 的溶液是酚在水中的不 饱和溶液。
• 如果在恒温度下往此溶液中加酚, 则体系的状态点(物系点) 将沿 a b 线向右移动;
当体系的总组成恰好落在ACB曲线上(即l1)时,体系中即 将出现组成为 X2 的另一液相 l2。
实用物理化学
1
目录图第表二章 相平衡
1 相律和相平衡的基本概念 2 单组分系统相平衡相图 3 二组分固-液平衡系统相图 4 气-液平衡系统相图 35 二组分液-液平衡系统相图 6 三组分平衡系统相图(自学)
2
第五节 二组分液-液平衡系统相图
【知识与能力目标】 1、理解部分互溶双液体系的相图 2、掌握水蒸气消耗系数及其物理意义
液相存在; • 自由度: f * = C +1 = 2 2 +1 = 1
(曲线ACB)
中国科学技术大学化
1
一、部分互溶液体的相互溶解度
在 50C 时,这两个相互 平衡的液相(即共轭溶液)
为l1 和 l2 ,其组成分别
为 X1 和 X2。
– X1 是酚在水中的饱和溶液组成;
– X2 是水在酚中的饱和溶液的组成。
f= C + 1 = 22 + 1 = 1 右图中即为水-酚体系在恒压下的温度-组成图。
11
一、部分互溶液体的相互溶解度
• 图中ACB曲线以外的区域是单 相区,只有一个液相,自由度: f = C +1 = 2 1 + 1 = 2
(黄色阴影面)
• 在ACB曲线以内的区域是两相区, • 在此区域内有两个相互平衡的
7
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
例如
在通常温度下将少量的酚加入水中时,开始酚是 完全溶解的。
如果继续往水里加酚,在浓度超过一定数值以后, 就不再溶解。
这时溶液中出现两个液层,这两个液层是部分互 溶的饱和溶液,即:
8
一、部分互溶液体的相互溶解度
• l2 的组成向 B 方向移动。
中国科学技术大学化
1
一、部分互溶液体的相互溶解度
如果升温,苯酚在水中的溶解度沿AC 线向上变化,水在苯酚中的溶解度沿 BC线向上变化,彼此的溶解度都增加。 如继续升温,则两层的组成逐渐接近, 最后汇集到C点,此时两层的浓度一样 而成单相溶液; 以C点以上,溶液成单相,自由度
• 连接 l1 和 l2 的线就是“结线”。
• 当体系的总组成(物系点)落在结线上时,体系两相共存。 • 且这两相的互比量(质量比)应遵守杠杆规则。
中国科学技术大学化
1
一、部分互溶液体的相互溶解度 •比如体系的总组成为 X 时,共轭溶液的组成分 别 为 X1 和 X2 , 而 这 两 个 相的互比量为:
中国科学技术大学化
1
2.若某温度时有一组成为 d 的溶液,其状态点在ACB曲 线的外面,故此时只有一 个液相存在。
• 如果将此溶液冷却,则当温度降 低到 50C时,体系的状态点正
好落在ACB曲线的 l1 上,此时体 系即将出现另一液相 l 2;
温度继续降低,共轭溶液的组成会随之变改:
• l1 的组成向 A 方向移动;
F K 1 2 11 2
表示在此温度以上,水与苯酚可以任意比例混溶而不分层,则C 点称为临界点,C点所对应的温度称为“最高临界溶解温度” 。
从上述图中可以看出:AC线相当于苯酚在水中的溶解度曲 线,BC线相当于水在苯酚的溶解度曲线
7.5%
71.2% 7.5%
71.2% 7.5%
71.2% 7.5%
10
一、部分互溶液体的相互溶解度
部分互溶液体的温度-组成图 • 根据相律,在温度和压力一定的情
况下,共轭溶液的组成是确定的。 因为这时自由度: f= C + 0 = 22 + 0 = 0 • 而在压力一定的条件下,共轭溶液 的组成将随温度的不同而改变,因 为这时,自由度:
71.2%<wB<100%
水的酚溶液
62.0%<wB<100% 50.0%<wB<100%
9
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
共轭溶液: T一定时,部分互溶的溶液浓度超过
一定范围,体系分层形成两个液相,当溶解达到 平衡时,这对彼此互相饱和的两个溶液。
◦ ① 酚在水中的饱和溶液; ◦ ② 水在酚中的饱和溶液。
中国科学技术大学化
1
如果继续往此体系中加酚,则两个 液相的组成仍然为 X1 和 X2,但这 两个液相的互比量变化。随着酚的
不断加入,l1 相会减少,l2 相的量
会增加。当总组成为 X 时 :
• 当体系的总组成为 X2 时,l1 相恰好消失。
• 如果继续加酚至组成为 b 时,则体系中只有一个水在酚 中的不饱和溶液相了。
【教学重点】 1. 部分互溶双液系统的相图
【教学难点】 1.水蒸气蒸馏原理
3
第四节 二组分气-液平衡系统相图
一、 拉乌尔定律及理想溶液 二、 气相组成与液相组成 三、 非理想溶液对理想溶液的偏差 四、 蒸馏与精馏原理
4
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度 当两种液体的性质差别较大时,可发生部分互 溶的现象,即在某温度范围内,两种液体的相互 溶解度都不大, 只有当一种液体的量很少,另一 种液体的量相对较多时,才能形成均匀的一相, 而在其它配比下,系统将分层而呈两个液相平衡 共存。此时将这两液相称为共轭溶液。
例如水(A)-苯酚(B): 在23.9℃及标准压力下,往水中逐渐加苯酚。
7.5%
0
7.5%
23.9 ℃ 0<wB<7.5%
酚的水溶液
50 ℃ 0<wB<11.5%
65 ℃ 0<wB<18.5%
71.2% 7.5%
71.2% 7.5%
71.2% 7.5%
7.5%<wB<71.2%
共轭溶液
11.5%<wB<62.0% 18.5%<wB<50.0%
5
Hale Waihona Puke 第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度 二、部分互溶液体的蒸馏 三、不互溶的液-液系统—水蒸气蒸馏
6
第五节 二组分液-液平衡系统相图
一、部分互溶液体的相互溶解度
当两种液体性质上有明显的不同,体系的行 为比之理想溶液有很大的偏差时,会发生“部分互 溶”的现象,即一液体在另一液体中只有有限的溶 解度。
Wl1 l1X Wl2 l2X
或 :Wl 1 Xl2 Wl 2 Xl1
14
讨论
1. 在 50C 时,组成为 a 的溶液是酚在水中的不 饱和溶液。
• 如果在恒温度下往此溶液中加酚, 则体系的状态点(物系点) 将沿 a b 线向右移动;
当体系的总组成恰好落在ACB曲线上(即l1)时,体系中即 将出现组成为 X2 的另一液相 l2。
实用物理化学
1
目录图第表二章 相平衡
1 相律和相平衡的基本概念 2 单组分系统相平衡相图 3 二组分固-液平衡系统相图 4 气-液平衡系统相图 35 二组分液-液平衡系统相图 6 三组分平衡系统相图(自学)
2
第五节 二组分液-液平衡系统相图
【知识与能力目标】 1、理解部分互溶双液体系的相图 2、掌握水蒸气消耗系数及其物理意义
液相存在; • 自由度: f * = C +1 = 2 2 +1 = 1
(曲线ACB)
中国科学技术大学化
1
一、部分互溶液体的相互溶解度
在 50C 时,这两个相互 平衡的液相(即共轭溶液)
为l1 和 l2 ,其组成分别
为 X1 和 X2。
– X1 是酚在水中的饱和溶液组成;
– X2 是水在酚中的饱和溶液的组成。
f= C + 1 = 22 + 1 = 1 右图中即为水-酚体系在恒压下的温度-组成图。
11
一、部分互溶液体的相互溶解度
• 图中ACB曲线以外的区域是单 相区,只有一个液相,自由度: f = C +1 = 2 1 + 1 = 2
(黄色阴影面)
• 在ACB曲线以内的区域是两相区, • 在此区域内有两个相互平衡的
