第三章 第四节 第1课时 难溶电解质的沉淀溶解平衡
人教版高中化学选择性必修第1册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡(第1课时)

温度一定,溶度积常数Ksp不变。
【思考】根据平衡常数的定义,尝试写出CaCO3和Mg(OH)2沉淀溶解平衡
的方程式和溶度积的表达式。
(25 ℃)
CaCO3(s)
Ca2+(aq) + CO32- (aq) Ksp = c(Ca2+)·c(CO32-) = 3.4×10-9
Mg(OH)2(s)
Mg2+(aq) + 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12
增大 Ksp只受温度影响
C. 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动
D. 常温下已知Ksp(BaSO4)=1.1×10-10,将0.01 mol/L的BaCl2溶 液与0.001 mol/L的Na2SO4溶液等体积混合,将析出沉淀
【练习4】
溴酸银(AgBrO3)溶解度随温度变化的曲线如图所示,已知溴酸银 的摩尔质量为236 g/mol,下列说法错误的是( )
A. 溴酸银的溶解是吸热过程 B. 温度升高时,溴酸银的溶解速率加快 C. 60 ℃时溴酸银的Ksp约等于6×10-4 D. 40 ℃时,将0.02 g溴酸银加入到10 g
水中,形成的分散系中存在沉淀溶解 平衡
谢谢观看
如何比较不同类型的难溶电解质的溶解能力?
三、溶度积常数Ksp的意义
【任务】比较25 ℃下MgCO3和Mg(OH)2的溶解度,已知Ksp(MgCO3)= 6.8×10-6 ,Ksp[Mg(OH)2]=5.6×10-12 。 思路:Ksp换算成饱和溶液浓度,再换算为溶解度。
四、溶度积常数Ksp的应用
我们知道,溶液中有沉淀生成是离子反应发生的条件之一。例如, 将BaCl2溶液与Na2SO4溶液混合,会生成白色的BaSO4沉淀,离子方程 式为:
【高中化学】高中化学(人教版)选修4同步教师用书:第3章 第4节 第1课时 沉淀溶解平衡与溶度积

第四节难溶电解质的溶解平衡第1课时沉淀溶解平衡与溶度积1.知道沉淀溶解平衡的概念及其影响因素。
2.明确溶度积和离子积的关系,并由此学会判断反应进行的方向。
(重点)沉淀溶解平衡[基础·初探]教材整理1.沉淀溶解平衡的概念在一定温度下,当沉淀溶解和生成速率相等时,即建立了动态平衡,叫做沉淀溶解平衡。
如AgCl溶于水有AgCl(s)溶解沉淀Ag+(aq)+Cl-(aq)。
2.沉淀溶解平衡的特征动态平衡,溶解速率和沉淀速率不等于0。
溶解速率和沉淀速率相等。
平衡状态时,溶液中的离子浓度保持不变。
当改变外界条件时,溶解平衡发生移动。
3.沉淀溶解平衡的移动固体物质的溶解是可逆过程:固体物质溶解沉淀溶液中的溶质(1)v溶解>v沉淀固体溶解(2)v溶解=v沉淀溶解平衡(3)v溶解<v沉淀析出晶体4.生成难溶电解质的离子反应的限度(1)25 ℃时,溶解性与溶解度的关系(2)反应完全的标志对于常量的化学反应来说,化学上通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时,沉淀就达完全。
[探究·升华][思考探究]物质的溶解度只有大小之分,没有在水中绝对不溶解的物质。
所谓难溶电解质是指溶解度小于0.01克的物质。
它可以是强电解质如BaSO4、AgCl等,也可以是弱电解质如Fe(OH)3、Mg(OH)2等。
但由于它们的溶解度都很小,溶解的极少部分,在水溶液中都可以认为是100%的电离,所以我们不区分其强弱,统称为难溶电解质。
问题思考:(1)在AgCl溶于水的起始阶段,v溶解和v沉淀怎样变化?当v溶解=v沉淀时,可逆过程达到一种什么样的状态?画出v-t图。
【提示】AgCl溶于水的起始阶段,v溶解开始大,后逐渐减小,v沉淀开始为0,后逐渐增大,直到v溶解=v沉淀,说明溶解达到平衡状态。
v-t图如下:(2)向AgCl饱和溶液中加水,AgCl的溶解度增大吗?溶解平衡移动吗?K sp 是否增大?升高温度K sp如何变化?【提示】向AgCl饱和溶液中加水,AgCl溶解平衡向正向移动,但是AgCl 的溶解度不增大,K sp不变。
《第三章 第四节 沉淀溶解平衡》教学设计教学反思

《沉淀溶解平衡》教学设计方案(第一课时)一、教学目标1. 理解沉淀溶解平衡的观点,掌握溶度积规则和溶度积常数的应用。
2. 能够运用溶度积规则诠释一些化学现象,解决实际问题。
3. 了解影响沉淀溶解平衡的因素,并能进行相关的计算。
二、教学重难点1. 教学重点:理解沉淀溶解平衡的观点,掌握溶度积规则的应用。
2. 教学难点:运用溶度积规则诠释化学现象,解决实际问题。
三、教学准备1. 准备相关实验器械和试剂,进行沉淀溶解平衡实验。
2. 准备PPT课件和相关视频材料。
3. 设计一些练习题和案例分析,供学生实践和讨论。
4. 引导学生自行预习相关知识,提供参考资料和文献。
四、教学过程:(一)引入通过生活实例或化学实验现象,如泡沫灭火器的工作原理,碳酸钠溶液与硫酸钙溶液的反应等引入沉淀溶解平衡的观点。
引导学生讨论反应速率、溶解平衡的平衡常数以及沉淀生成的条件等问题,引出本节课的主题。
(二)新课教学1. 沉淀溶解平衡的建立通过实验演示,观察沉淀溶解平衡的建立过程,引导学生分析影响沉淀溶解平衡的因素,如温度、浓度、溶度积等。
2. 沉淀溶解平衡的挪动通过实验演示,引导学生观察沉淀溶解平衡挪动的现象,讨论平衡挪动的原因和规律,加深对沉淀溶解平衡的理解。
3. 应用实例结合生活实例或化学实验,引导学生应用所学知识解决实际问题,如分析溶液中离子浓度之间的干系、设计实验方案等。
(三)小组讨论组织学生分组讨论,让学生互相交流、分享学习心得和经验,培养学生的合作认识和团队精神。
同时,教师也可针对学生的问题进行答疑解惑。
(四)教室小结教师总结本节课的主要内容,强调重点和难点,帮助学生梳理知识体系,加深学生对沉淀溶解平衡的理解和掌握。
(五)作业安置根据本节课的内容,安置适量的作业,包括习题、实验设计等,帮助学生稳固所学知识,提高学生的学习能力和实践能力。
教学设计方案(第二课时)一、教学目标1. 理解沉淀溶解平衡的观点,掌握溶度积规则和溶度积常数的计算方法。
2023-2024年人教版高中化学 导学案 人教版高中化学课件难溶电解质的溶解平衡
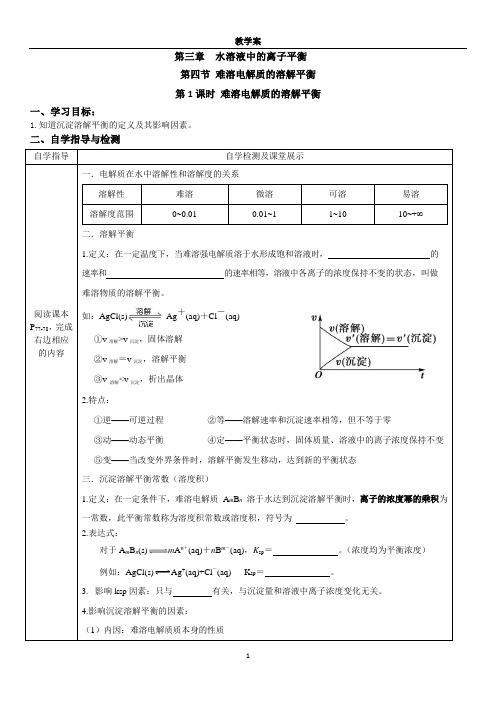
第三章水溶液中的离子平衡第四节难溶电解质的溶解平衡第1课时难溶电解质的溶解平衡一、学习目标:1.知道沉淀溶解平衡的定义及其影响因素。
二、自学指导与检测自学指导自学检测及课堂展示阅读课本P77-78,完成右边相应的内容一.电解质在水中溶解性和溶解度的关系溶解性难溶微溶可溶易溶溶解度范围0~0.01 0.01~1 1~10 10~+∞二.溶解平衡1.定义:在一定温度下,当难溶强电解质溶于水形成饱和溶液时,的速率和的速率相等,溶液中各离子的浓度保持不变的状态,叫做难溶物质的溶解平衡。
如:AgCl(s)Ag+(aq)+Cl-(aq)①v溶解>v沉淀,固体溶解②v溶解=v沉淀,溶解平衡③v溶解<v沉淀,析出晶体2.特点:①逆——可逆过程②等——溶解速率和沉淀速率相等,但不等于零③动——动态平衡④定——平衡状态时,固体质量、溶液中的离子浓度保持不变⑤变——当改变外界条件时,溶解平衡发生移动,达到新的平衡状态三.沉淀溶解平衡常数(溶度积)1.定义:在一定条件下,难溶电解质A m B n溶于水达到沉淀溶解平衡时,离子的浓度幂的乘积为一常数,此平衡常数称为溶度积常数或溶度积,符号为。
2.表达式:对于A m B n(s)m A n+(aq)+n B m-(aq),K sp=。
(浓度均为平衡浓度)例如:AgCl(s)Ag+(aq)+Cl-(aq) K sp=。
3.影响ksp因素:只与有关,与沉淀量和溶液中离子浓度变化无关。
4.影响沉淀溶解平衡的因素:(1)内因:难溶电解质质本身的性质(2)外因①温度:溶解平衡一般是的,温度升高平衡,K sp,但Ca(OH)2相反。
②浓度:加水稀释,沉淀溶解平衡向的方向移动(溶解的溶解质增多),但K SP ,溶解度S 不变③同离子效应:向平衡体系中加入与体系中相同的离子,平衡向的方向移动,但K SP,溶解度S 减小;如:AgCl 中加入KCl(S),则c(Ag+)减小、c(Cl—)增大,此时c(Ag+)≠c(Cl—)④向体系中加入能与体系中离子反应生成更难溶的电解质或气体的离子,则平衡向的方向移动。
课件沉淀溶解平衡

第四节 难溶电解质的溶解平衡 (1课时)
一、沉淀溶解平衡
1、溶解性和溶解度
20℃ 易溶 大于10 可溶 1~10 微溶 0.01~1 难溶 小于 0.01
溶解度/g
某温度下,100g溶剂(水) 能溶解溶质的质量
2、沉淀溶解平衡的建立
思考: 第一步:在装有难溶PbI2黄色固
①Ksp反应了电解质在水中的 溶解 能力。 对于 阴阳离子个数比相同 的难溶电解质, Ksp越小,在水溶液中的溶解能力 弱 越 。 ②温度越高,Ksp越 大 (适用溶解吸热)
(5)溶度积规则: (判断沉淀或溶解) Qc:为任意条件下离子浓度幂之积 Ksp:为饱和溶液中离子浓度的幂之积
Qc与Ksp的关系 Qc>Ksp Qc=Ksp Qc<Ksp
沉淀溶解平衡
溶度积
沉淀溶解平衡的应用
沉淀的溶解与生成
沉淀的转化
蛀牙的形成
牙齿表面覆盖的牙釉质是人体中最坚硬的部分, 起着保护牙齿的作用,其主要成分是羟基磷酸钙 [Ca5(PO4)3OH],它在唾液中存在下列平衡:
Ca5(PO4)3OH (s) Ksp=6.8×10-37mol9•L-9 5Ca2+(aq) +3PO43- (aq) +OH-(aq)
不变
不变
不变
通入H2S
不变
二、沉淀反应的应用
1、沉淀的生成:Qc >Ksp (1)、调节PH法 例:工业原料NH4Cl(FeCl3),加氨水调PH至78,得Fe(OH)3沉淀,过滤。
Fe3+ + 3NH3•H2O=Fe(OH)3↓+3NH4+
(2)加沉淀剂法
选择性必修1第三章第四节《沉淀溶解平衡》第一课时

问题1: 为什么饱和氯化钠溶液加入浓盐酸会有 晶体析出?
在NaCl饱和溶液中,存在溶解平衡
NaCl(s) N溶解a+(aq) + Cl-(aq)
结晶
达到溶解平衡时,就形成了该温度下的饱和溶液
加浓盐酸,会使c(Cl- )增加, 平衡逆向移动, 因而有NaCl晶体析出。
可溶的电解质在水中存在溶解平衡, 难溶的电解质在水中是否也存在溶解平衡呢?
可溶的电解质在水中存在溶解平衡, 难溶的电解质在水中是否也存在溶解平衡呢?
【思考】 什么是难溶电解质?
溶解度:一定温度下,100 g水中,某物质达到
饱和时所溶解的质量。
任何物质的溶解是有条件的,在一定的条 件下某物质的溶解量一般是有限的。
在20℃时溶解性与溶解度的关系如下:
难溶 易溶 难溶 微溶 难溶 易溶
溶解
AgCl(s) 沉淀 Ag+(aq) + Cl-(aq)
注意溶解平衡表达式的写法
溶解
AgCl(s) 沉淀 Ag+(aq) + Cl-(aq)
现学活用: 写出AgI、Ag2SO4、Mg(OH)2溶解
平衡的表达式
AgI(s) Ag+(aq) + I-(aq) Ag2SO4(s) 2Ag+(aq) + SO42-(aq) Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
①温度:升温,多数平衡向溶解方向移动。
②浓度:加水,平衡向溶解方向移动。
③外加试剂:
a、减小平衡体系中的相应离子浓度,平衡向溶解方向移动。
b、增大平衡体系中的相应离子浓度,平衡向沉淀方向移动。
二、沉淀溶解平衡常数—溶度积Ksp
1、溶度积(Ksp): 难溶电解质溶解平衡时,离子浓度幂的乘积。 ❖例:Mg(OH)2(s) Mg2+(aq) + 2OH-(aq)有:
《难溶电解质的沉淀溶解平衡》 讲义

《难溶电解质的沉淀溶解平衡》讲义一、什么是难溶电解质的沉淀溶解平衡在一定温度下,当难溶电解质溶于水形成饱和溶液时,溶解速率和沉淀速率相等的状态,就叫做沉淀溶解平衡。
比如说,把一定量的氯化银固体放入水中,氯化银会在水中溶解,同时溶解的银离子和氯离子又会结合生成氯化银沉淀。
开始时,溶解速率较大,沉淀速率较小。
随着时间的推移,溶解的氯化银逐渐增多,溶液中的银离子和氯离子浓度也逐渐增大,沉淀速率就会随之加快。
最终,溶解速率和沉淀速率相等,达到了一种动态平衡。
这就好像是一个拔河比赛,溶解和沉淀两边的力量相等,谁也无法战胜谁。
二、沉淀溶解平衡的特征1、动态平衡沉淀溶解平衡是一种动态平衡,溶解和沉淀这两个过程仍在不断进行,只是速率相等,看起来好像没有变化。
2、等速溶解速率和沉淀速率相等,这是平衡状态的重要标志。
3、定态平衡时,溶液中各离子的浓度保持不变,但不是绝对不变,而是在一定范围内波动。
4、同条件沉淀溶解平衡的建立与温度、浓度等条件有关。
在相同条件下,无论溶液中固体的量有多少,平衡状态下离子的浓度都是一定的。
三、沉淀溶解平衡的表达式以 AgCl 为例,其沉淀溶解平衡的表达式为:AgCl(s) ⇌ Ag+(aq) + Cl(aq)这里的“s”表示固体,“aq”表示在水溶液中。
四、影响沉淀溶解平衡的因素1、内因难溶电解质本身的性质是决定沉淀溶解平衡的主要内因。
不同的难溶电解质在相同条件下溶解度不同,溶解度越小,越难溶解。
2、外因(1)温度大多数难溶电解质的溶解过程是吸热的,升高温度,平衡向溶解的方向移动,溶解度增大;少数难溶电解质的溶解过程是放热的,升高温度,平衡向生成沉淀的方向移动,溶解度减小。
(2)浓度加水稀释,平衡向溶解的方向移动,但溶解度不变。
(3)同离子效应向平衡体系中加入相同的离子,平衡向生成沉淀的方向移动。
例如,在 AgCl 的饱和溶液中加入氯离子,会使平衡向左移动,生成更多的AgCl 沉淀。
(4)化学反应若加入能与体系中某些离子发生反应的物质,平衡会向溶解的方向移动。
高中化学新人教版选择性必修一3.4.1难溶电解质的沉淀溶解平衡 同步课件(64张)

必备知识·自主学习
一、难溶电解质的沉淀溶解平衡 1.25 ℃时,溶解性与溶解度的关系
2.沉淀溶解平衡 (1)含义:在一定温度下,当_沉__淀__和_溶__解__速率相等时所达到的平衡状态, 称为沉淀溶解平衡。 (2)图示
(3)表示方法:以 AgCl 为例,溶解平衡可Байду номын сангаас示为:
提示:c(Ag+)=Kcsp( (CAlgC-)l)
1.8×10-10 = 1.0×10-5
mol·L-1=1.8×10-5 mol·L-1,故
c(CrO24-
)=Kspc(2(AgA2gC+r)O4)
2.0×10-12 =(1.8×10-5)2
mol·L-1=6.17×10-3 mol·L-1。
Ca2++2OH-,
【解析】选 C。A 项,CaO+H2O===Ca(OH)2,由于保持恒温,Ca(OH)2 溶解度不变, c(OH-)不变,因此 pH 不变;B 项,加热时 Ca(OH)2 溶解度减小,平衡逆向移动, c(OH-)减小,pH 减小;C 项,CO32- +Ca2+===CaCO3↓,使平衡正向移动,Ca(OH)2 固体减少,但固体总质量增大;D 项,加入 NaOH 固体时,c(OH-)增大,平衡逆向 移动,因此 Ca(OH)2 固体增多。
(2)(情境思考)在化学分析中,以 AgNO3 标准溶液滴定溶液中的 Cl-时,采用 K2CrO4 为 指示剂,利用 Ag+与 CrO42- 反应生成砖红色沉淀指示滴定终点。当溶液中的 Cl-恰好 沉淀完全(浓度等于 1.0×10-5 mol·L-1)时,溶液中 c(Ag+)与 c(CrO24- )分别是多少 呢? (已知 25 ℃时 Ag2CrO4、AgCl 的 Ksp 分别为 2.0×10-12 和 1.8×10-10)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
归纳总结 难溶电解质沉淀溶解平衡与其电离平衡的区别
难溶电解质沉淀溶解平衡表示已溶溶质的离子与未溶溶质之间的平衡,是 可逆过程,表达式需要注明状态,如 Al(OH)3(s) Al3+(aq)+3OH-(aq)。 电离平衡是溶解的弱电解质分子与离子之间的转化达到的平衡状态,难溶 强电解质的电离,没有电离平衡,如 BaSO4===Ba2++SO24-;难溶弱电解 质的电离,存在电离平衡,如 Al(OH)3 Al3++3OH-。
2.将AgCl分别投入下列溶液中: ①40 mL 0.03 mol·L-1的HCl溶液 ②50 mL 0.03 mol·L-1的AgNO3溶液 ③30 mL 0.02 mol·L-1的CaCl2溶液 ④10 mL蒸馏水。AgCl的溶解度由大 到小的顺序是④>①__=__②__>③ 。
解析 AgCl(s)在溶液中存在如下沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq), ①中 c(Cl-)=0.03 mol·L-1,抑制了 AgCl(s)的溶解,使得 AgCl(s)的溶解度减小; ②中c(Ag+)=0.03 mol·L-1,也抑制了AgCl(s)的溶解,且抑制程度与①相同; ③中的c(Cl-)=0.04 mol·L-1,抑制溶解,且抑制程度大于①和②, AgCl(s)的溶解度更小。 所以AgCl的溶解度由大到小的顺序是④>①=②>③。
3.影响因素 溶度积Ksp值的大小只与 难溶电解质本身的性质和 温度有关。 4.应用 定量判断给定条件下有无沉淀生成。 Q:离子积对于 AmBn(s) mAn+(aq)+nBm-(aq)任意时刻 Q=cm(An+)·cn(Bm-)。
(1)Q>Ksp,溶液过饱和,有 沉淀 析出,直至溶液 饱和 ,达到新的平衡。 (2)Q=Ksp,溶液饱和,沉淀与溶解处于 平衡状态 。 (3)Q<Ksp,溶液未饱和,无沉淀 析出,若加入过量难溶电解质,难溶电解 质 溶解 直至溶液 饱和 。
二、溶度积常数
索
引
随堂演练 知识落实
课时对点练
一、难溶电解质的沉淀溶解平衡
1.25 ℃时,溶解性与溶解度的关系
溶解性
易溶
可溶
微溶
难溶
溶解度
>10 g
1~10 g 0.01~1 g <_0_.0_1__g_
2.难溶电解质的沉淀溶解平衡 (1)沉淀溶解平衡的建立
(以2)A沉g淀Cl沉溶淀解溶平解衡平方衡程为式例:A__g_C_l_(s_)_溶 沉__解 淀___A_g_+_(_a_q_)_+__C_l_-(_a_q_)_。 特别提醒 沉淀溶解平衡方程式各物质要标明聚集状态。 (3)沉淀、溶解之间这种动态 平衡也决定了Ag+与Cl-的反应不能完全进行 到底。一般情况下,当溶液中剩余离子的浓度小于1×10-5 mol·L-1 时, 化学上通常认为生成沉淀的反应进行 完全 了。
条件改变 加少量水
升温 加MgCl2(s)
加盐酸 加NaOH(s)
移动方向 _正__向__移__动_ _正__向__移_动__ 逆__向__移__动__ _正__向__移__动_ 逆__向__移__动__
c(Mg2+) 不__变__ 增__大__ 增__大__ 增__大__ _减__小_
c(OH-) 不__变__ 增__大__ _减__小_ _减__小_ 增__大__
(3)Ca(OH)2 溶解放热,所以升温 Ca(OH)2(s)
平衡逆向移动( √ )
Ca2+(aq)+2OH-(aq),溶解
(4)含等物质的量的AgNO3与NaCl的溶液混合后,恰好完全生成AgCl沉淀,
溶液中不存在Ag+和Cl-( × )
(5)当溶液中某离子浓度小于1×10-5 mol·L-1时,可视为该离子沉淀完全
3.难溶电解质沉淀溶解平衡的影响因素 (1)内因(决定因素):难溶电解质本身的性质。 (2)外因:温度、浓度等条件的影响符合勒夏特列原理。 (3)实例分析 已知沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),请分析当改变下 列条件时,对该沉淀溶解平衡的影响,填写下表(浓度变化均指平衡后和原 平衡比较):
特别提醒 大多数电解质溶解度随温度的升高而增大,但有许多例外, 如Ca(OH)2,温度越高,溶解度越小。
正误判断
(1)由于 BaSO4 难溶,所以将 BaSO4 加入水中,溶液中无 Ba2+和 SO24-( × )
(2)难溶电解质的沉淀溶解平衡是动态平衡,即溶解和沉淀仍然同时进行
着,只是v(溶解)=v(沉淀)( √ )
Ca2+(aq)
解析 恒温下加入CaO后,溶液仍为Ca(OH)2的饱和溶液,pH不变,A错误; 加热,Ca(OH)2的溶解度减小,溶液的pH降低,B错误; 加入Na2CO3溶液,沉淀溶解平衡向右移动,Ca(OH)2固体转化为CaCO3固 体,固体质量增加,C正确; 加入NaOH固体平衡向左移动,Ca(OH)2固体质量增加,D错误。
(√ )
应用体验
1.把 Ca(OH)2 放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) +2OH-(aq)。下列说法正确的是 A.恒温下向溶液中加入CaO,溶液的pH升高 B.给溶液加热,溶液的pH升高
√C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
第1课时 难溶电解质的沉淀溶解平衡
核心素养发展目标
1.变化观念与平衡思想:知道难溶电解质的沉淀溶解平衡及其影响 因素,能多角度、动态地分析难溶电解质的溶解平衡。
2.证据推理与模型认知:知道溶度积的意义,建立根据溶度积和离 子积的大小关系判断反应进行方向的思维模型。
一、难溶电解质的沉淀溶解平衡
内
容
返回
二、溶度积常数
1.概念 难溶电解质的沉淀溶解 平衡常数 称为 溶度积常数 ,简称溶度积,符号 为 Ksp ,Ksp的大小反映难溶电解质在水中的溶解能力。 2.表达式 AmBn(s) mAn+(aq)+nBm-(aq) Ksp= cm(An+)·cn(Bm-) 。 如:Fe(OH)3(s) Fe3+(aq)+3OH-(aq) Ksp=c(Fe3+)·c3(OH-)。
