化学反应工程课后习题
《化学反应工程》(第四版)课后习题答案详解

VR 1 V02 k 1 k 1 k1 k 2 1 2 2 2
V02 k1 k2 k1 / k2 1 2 1 1 V01 2k1 k2 2k1 / k2 1 4 1 3
1 V02 V01 3
加料速率减小到原来的1/3倍,可使转化 率达到0.5。
CA0 CB0 0.02mol/ L
2 rA kCACB 5.6CA
根据:t
x Af kCA0 (1 x Af )
3 3
当VR 1m 和2 时: (反应时间与反应体积无关) 0.95 t 169.64(min) 5.6 0.02(1 0.95)
习题3-3解答
3
(3)两个CSTR串联
VR C A0 x A1 C A0 ( x A2 x A1 ) 根据 V0 rA1 rA2
m 1 m2
C A0 x A1 C A0 ( x A2 x A1 ) kCA0 (1 x A1 )C A0 x A1 kCA0 (1 x A2 )C A0 x A2 1 ( x A2 x A1 ) ; (1 x A1 ) (1 x A2 ) x A2
x A2 0.98 x A1 0.85
VR1 1 1 V0 kCA0 (1 x A1 ) 0.01 2 (1 0.85)
VR1 333.33V0 333.33 0.002 0.67(m )
3
VR 2VR1 2 0.67 1.34(m )
(2)单个CSTR
VR C A0 x Af 根据 V0 rA
C A0 x Af VR V0 kCA0 (1 x Af )[C A0 C A0 (1 x Af )] 1 2500( s) 0.01 2 (1 0.98)
(完整版)化学反应工程习题

化学反应工程习题第一部分:均相反应器基本理论1、试分别写出N 2+3H 2=2NH 3中用N2、H 2、NH 3的浓度对时间的变化率来表示的该反应的速率;并写出这三种反应速率表达式之间的关系。
2、已知某化学计量式为S R B A 2121+=+的反应,其反应速率表达式为B AA C C r 5.02=,试求反应速率B r =?;若反应的化学计量式写成S R B A +=+22,则此时反应速率A r =?为什么?3、某气相反应在400 oK 时的反应速率方程式为221061.3AA P d dP -⨯=-τh kPa /,问反应速率常数的单位是什么?若将反应速率方程改写为21AA A kC d dn V r =⨯-=τh l mol ./,该反应速率常数k 的数值、单位如何?4、在973 oK 和294.3×103Pa 恒压下发生下列反应:C 4H 10→2C 2H 4+H 2 。
反应开始时,系统中含丁烷为116kg ,当反应完成50%时,丁烷分压以235.4×103Pa /s 的速率发生变化,试求下列项次的变化速率:(1)乙烯分压;(2)H 2的摩尔数;(3)丁烷的摩尔分率。
5、某溶液反应:A+B →C ,开始时A 与B 摩尔数相等,没有C ,1小时后A 的转化率为75%,当在下列三种情况下,2小时后反应物A 尚有百分之几未反应掉? (1)对A 为一级、B 为零级反应; (2)对A 、B 皆为一级反应; (3)对A 、B 皆为零级反应。
6、在一间歇反应器中进行下列液相反应: A + B = R A + R = S已知原料组成为C A0 = 2 kmol/m 3,C B0 = 4 kmol/m 3,C R0 = C S0 = 0。
反应混合物体积的变化忽略不计。
反应一段时间后测得C A = 0 .3 kmol/m 3,C R = 1.5 kmol/m 3。
计算这时B 和S 的浓度,并确定A 的转化率、生成R 的选择性和收率。
(完整版)化学反应工程课后习题答案.

积分之
2.10在催化剂上进行三甲基苯的氢解反应:
反应器进口原料气组成为66.67%H2,33.33%三甲基苯。在0.1Mpa及523K下等温反应,当反应器出口三甲基苯的转化率为80%时,其混合气体的氢含量为20%,试求:
(1)(1)此时反应器出口的气体组成。
(2)(2)若这两个反应的动力学方程分别为:
组分
摩尔分率yi0
摩尔数ni0(mol)
CH3OH
2/(2+4+1.3)=0.2740
27.40
空气
4/(2+4+1.3)=0.5479
54.79
水
1.3/(2+4+1.3)=0.1781
17.81
总计
1.000
100.0
设甲醇的转化率为XA,甲醛的收率为YP,根据(1.3)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数nA、nP和nc分别为:
组分
摩尔质量
摩尔分率yi
CO
28
15.49
H2
2
69.78
CO2
44
0.82
CH4
16
3.62
N2
28
10.29
总计
100
其中冷凝分离后气体平均分子量为
M’m=∑yiMi=9.554
又设放空气体流量为Akmol/h,粗甲醇的流量为Bkg/h。对整个系统的N2作衡算得:
5.38B/28×1000+0.1029A=2.92 (A)
20
30
40
50
60
70
试求当进口原料气体流量为50ml/min时CO的转化速率。
解:是一个流动反应器,其反应速率式可用(2.7)式来表示
化学反应工程课后习题答案

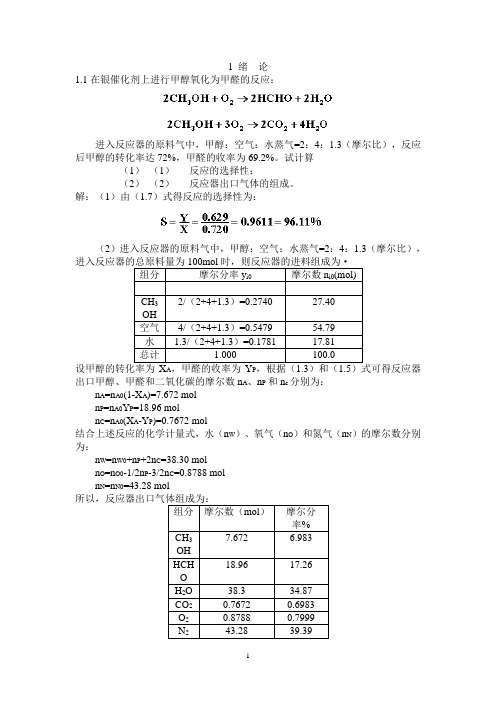
1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol设甲醇的转化率为X A,甲醛的收率为Y P,根据(1.3)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol所以,反应器出口气体组成为:1. 1.2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图原料气Bkg/h 粗甲醇Akmol/h100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 22.9210.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。
(完整版)反应工程课后答案完整版.
1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),组分摩尔分率y i0 摩尔数n i0(mol)CH32/(2+4+1.3)=0.2740 27.40OH空气4/(2+4+1.3)=0.5479 54.79水 1.3/(2+4+1.3)=0.1781 17.81总计 1.000 100.0A P出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol组分摩尔数(mol)摩尔分率%7.672 6.983CH3OH18.96 17.26HCHOH2O 38.3 34.87CO2 0.7672 0.6983O2 0.8788 0.7999N2 43.28 39.392 反应动力学基础2.4在等温下进行液相反应A+B→C+D,在该条件下的反应速率方程为:若将A和B的初始浓度均为3mol/l的原料混合进行反应,求反应4min时A的转化率。
解:由题中条件知是个等容反应过程,且A和B的初始浓度均相等,即为1.5mol/l,故可把反应速率式简化,得由(2.6)式可知代入速率方程式化简整理得积分得解得X A=82.76%。
2.6下面是两个反应的T-X图,图中AB是平衡曲线,NP是最佳温度曲线,AM是等温线,HB是等转化率线。
化学反应工程第二版课后习题

《化学反应工程》第二版习题0 第一章习题1 化学反应式与化学计量方程有何异同化学反应式中计量系数与化学计量方程中的计量系数有何关系2 何谓基元反应基元反应的动力学方程中活化能与反应级数的含义是什么何谓非基元反应非基元反应的动力学方程中活化能与反应级数含义是什么3 若将反应速率写成tcrddAA有什么条件 4 为什么均相液相反应过程的动力学方程实验测定采用间歇反应器5 现有如下基元反应过程请写出各组分生成速率与浓度之间关系。
1A2B??C AC?? D2A2B??C BC??D CD→E 32A2B??C AC??D 6 气相基元反应A2B→2P在30℃和常压下的反应速率常数kc2.65×104m6kmol-2s-1。
现以气相分压来表示速率方程即??rAkPpApB2求kP假定气体为理想气体7 有一反应在间歇反应器中进行经过8min后反应物转化掉80经过18min后转化掉90求表达此反应的动力学方程式。
8 反应Ag Bl→Cl气相反应物A被B的水溶液吸收吸收后A与B生成C。
反应动力学方程为??rAkcAcB。
由于反应物B在水中的浓度远大《化学反应工程》第二版习题1 于A在反应过程中可视为不变而反应物A溶解于水的速率极快以至于A在水中的浓度恒为其饱和溶解度。
试求此反应器中液相体积为5m3时C的生成量。
已知k1m3kmol-1hr-1cB03kmol·m-3cA饱和0.02 kmol·m-3水溶液流量为10m3hr-1。
9 反应O2HN2NO2H222在恒容下用等摩尔H2NO进行实验测得以下数据总压/MPa 0.0272 0.0326 0.0381 0.0435 0.0543 半衰期/s 265 186 135 104 67 求此反应的级数。
10 考虑反应3PA其动力学方程为VnktnVrAAAdd1试推导在恒容下以总压表示的动力学方程。
11 A和B在水溶液中进行反应在25℃下测得下列数据试确定该反应反应级数和反应速度常数。
《化学反应工程》教材课后习题答案 李绍芬 天津大学

其中 xi=yiMi/∑yiMi。进料的平均摩尔质量 Mm=∑yiMi=10.42kg/kmol。 经冷凝分离后的气体组成(亦即放空气体的组成)如下:
组分 摩尔质量 摩尔分率 yi CO H2 CO2 CH4 N2 总计 其中冷凝分离后气体平均分子量为 M’m=∑yiMi=9.554 又设放空气体流量为 Akmol/h, 粗甲醇的流量为 Bkg/h。 对整个系统的 N2 作衡算得: 5.38B/28×1000+0.1029A=2.92 对整个系统就所有物料作衡算得: 100×10.42=B+9.554A 联立(A) 、 (B)两个方程,解之得 A=26.91kmol/h 反应后产物中 CO 摩尔流量为 FCO=0.1549A+9.38B/(28×1000) 将求得的 A、B 值代入得 FCO=4.431 kmol/h 故 CO 的全程转化率为 B=785.2kg/h (B) (A) 28 2 44 16 28 15.49 69.78 0.82 3.62 10.29 100
dX A dX A C A0 dVR d (VR / Q0 )
用 XA~VR/Q0 作图,过 VR/Q0=0.20min 的点作切线,即得该条件下的 dXA/d(VR/Q0)值 α。 VR/Q0min 0.12 0.148 0.20 0.26 0.34 0.45 XA% 20.0 30.0 40.0 50.0 60.0 70.0
FCO,0 FCO 26.82 4.435 16.18% FCO,0 138.4
产物粗甲醇所溶解的 CO2、CO、H2、CH4 和 N2 总量 D 为
D
(9.82 9.38 1.76 2.14 5.38)B 0.02848Bkmol / h 1000
化学反应工程第二版课后答案

第一章习题1化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?答:化学反应式中计量系数恒为正值,化学计量方程中反应物的计量系数与化学反应式中数值相同,符号相反,对于产物二者相同。
2 何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么?答:如果反应物严格按照化学反应式一步直接转化生成产物,该反应是基元反应。
基元反应符合质量作用定律。
基元反应的活化能指1摩尔活化分子的平均能量比普通分子的平均能量的高出值。
基元反应的反应级数是该反应的反应分子数。
一切不符合质量作用定律的反应都是非基元反应。
非基元反应的活化能没有明确的物理意义,仅决定了反应速率对温度的敏感程度。
非基元反应的反应级数是经验数值,决定了反应速率对反应物浓度的敏感程度。
3若将反应速率写成tc rd d AA -=-,有什么条件? 答:化学反应的进行不引起物系体积的变化,即恒容。
4 为什么均相液相反应过程的动力学方程实验测定采用间歇反应器?答:在间歇反应器中可以直接得到反应时间和反应程度的关系,而这种关系仅是动力学方程的直接积分,与反应器大小和投料量无关。
5 现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。
(1)A+2B ↔C A+C ↔ D (2)A+2B ↔C B+C ↔D C+D →E(3)2A+2B ↔CA+C ↔D 解(1)D4C A 3D D 4C A 3C 22BA 1C C22B A 1B D 4C A 3C 22B A 1A 22c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=(2)E6D C 5D 4C B 3D E 6D C 5D 4C B 3C 22BA 1C D4C B 3C 22B A 1B C22B A 1A 22c k c c k c k c c k r c k c c k c k c c k c k c c k r c k c c k c k c c k r c k c c k r +--=+-+--=+-+-=+-=(3)D4C A 3D D 4C A 3C 22B2A 1C C22B 2A 1B D 4C A 3C 22B 2A 1A 2222c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=6 气相基元反应A+2B →2P 在30℃和常压下的反应速率常数k c =2.65×104m 6kmol -2s -1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1-5 2HCHO C2H2 C4H6O2 ,原料分离回收循环操作,
甲醛初始浓度10%(质量比),出反应器1.6%,丁炔二醇
初浓度0,出口浓度7.65%,求 xA, ,,
xA
nA0 nA nA0
10% 1.6% 10%
0.84
(nP nP0 ) / p (7.65% 0) / (1* MC4H6O2 ) 0.635
ln k2 Ea ( 1 1 ) k1 R T1 T 2
(1)T T 2 T1 8.4oC
T2
1
1 R
ln k 2
T 1 Ea k1
(2)T T 2 T1 12.7o C
若使反应速率提高一倍,活化能愈大,所需提高的温度愈小
2-6 反应温度上升10℃,反应速率加倍,Ea与T之间的关系? 当T1(K)=300、400、600、800和1000K时,求Ea
ln k2 E ( 1 1 ) k1 R T1 T 2
T(K)
300
ln 2 Ea ( 1 1 ) R T T 10
Ea 0.5763T (T 10)
400
600
800
1000
Ea(kJ/mol) 53.59 94.51 210.92 373.43 582.05
第3章 理想间歇反应器
3-1 间歇反应器,n=2,t1=5min时,转化率xA=50%;
3-4 间歇反应器,cA0=1mol/L,t=8min后,xA=0.8;
t=18min后,xA=0.9,求该反应的动力学关系?
cAn01kt
1 n 1
(1
x )1n A
1
t (1 x )1n 1
2
A2
t (1 x )1n 1
1
A1
18 8
(1 (1
0.9)1n 0.8)1n
1 1
n=2
x
c kt A
1 kt ln
1 x A
E
k k exp( a )
0
RT
等温时,k 一定
t 2
ln 1
1 x A2
ln
1
1 99.9%
10
t 1
ln 1
ln 1
1 x
1 50%
A1
3-3 n=1/2,10 min后xA=0.75, 30 min后转化率xA=?
CAn01kt
1 n 1
(1
x )n1 A
xA
dxA
0 kc2A0 (1 xA )( xA )
kcA0
1 (
1)
ln
( xA) (1 xA)
当 5时txA0.5 0.78h, txA0.9 2.78h , txA0.99 5.81h
(令 cB0 ) cA0
当C B0 /C A0 =β 越大,达到相同转化率所需的时间越短; 当C B0 /C A0 不变时,随x A 的增大,所需t 增大,且 x A 越高,t 增加越快
rA
反应转化量 反应时间 反应区
=kCAn
ktcAn01
1 n 1
(1
xA)1n
1
ln k2 Ea ( 1 1 ) k1 R T1 T 2 Ea 67.55 kJ / mol
k2 t1 k1 t2
2-5 C2H4二聚反应:(1) T=200℃,Ea=156.9 kJ/mol; C2H6二聚反应:(2) T=200℃,Ea=104.6 kJ/mol。为使反应 速率加倍,要提高多少温度?
A0
1 x
k 0.5 L / (mol min)
A
3-8 在间歇反应器中进行二级反应 A P ,反应速率为 (-rA )=0.01c2Amol / s
当 c A0 分别为1,5,10 mol/L时,求反应到 cA=0.01 mol/L时,
所需反应时间。并对计算结果进行讨论。
kt 1 1 cA cA0
In
CA0 (CT 0 CA ) CA (CT 0 CA0 )
(CA )opt
CT 0 2
CA0
CP0 2
=
0.65+0.05 = 2
0.35kmol/m3
293K
:0.7k1
2.4=In
0.65(0.7 0.35(0.7
0.35) 0.65)
k1,同理K
求k2
In k2 E ( 1 1 ) E 65.94kJ / mol k1 R T1 T2
t1 9900s
t5 9980s
t10 9990s
对于二级反应,若1/CA>>1/CA0
,
kt
1 cA
反应时间t与反应物初始浓度无关。
3-10
生物化工中胰蛋白原转化成胰蛋白酶时,
dcA dt
kcAcS
在间歇反应实验中测得不同温度下反应速率于某时刻 tMAX
达到最大值
CT 0kt
(CA0
CP0 )kt
1
1
t 30 1 (1 x )2
2 t 10
A2
1
1
1 (1 0.75)2
1
1
C
2 A0
kt
2
1
(1
x )2 Aຫໍສະໝຸດ xA2无解假设xA=1时,时间为t3
1
1
t 1 (1 x )2 1 (11)2
3 t
A3 1
1
1 1 (1 x )2 1 (1 0.75)2
A1
t 20 min 3
30 min后反应物A完全转化,xA=100%
(nA0 nA) / a (10% 1.6) / (2* M HCHO )
xA 0.534 循环操作 0.635
n m w* mtotal MM
第2章 化学反应动力学
2-4 间歇反应器:CA0和xA相同(T1=20℃时,反应时间t1=8d;
T2=120 ℃时,反应时间t2=10min),试估算 Ea
xA )(cB0
cA0xA)
kc
2 A0
(1
x
A
)(
cB0 cA0
xA)
kcA20 (1
xA )(
xA)
当
1时t cA0
xA
dx
0 kcA20 (1 xA )2
1 kcA0
xA (1 xA)
txA0.5 5.31h, txA0.9 47.7h,txA0.99 524.4h
当 1时t cA0
若要xA=75%,需增加多长时间?
x
c kt A
A0
1 x
A
c kt A0 1
x A1
c kt 1 x
A0 2
A1
x A2
1 x A2
t1 1 t2 3
t2 15min
t t2 t1 10min
3-2 n=1,等温,证明xA=99.9%时所需反应时间是xA=50%
时所需反应时间的10倍
3-12 在间歇釜式反应器中进行液相反应 A B P ,测得二级 反应速率常数:61.5102 L / (molgh) , cA0 0.307mol / L,计算当 cB0 / cA0 1和5时,转化率分别为0.5,0.9,0.99时所需的反 应时间,并对计算结果进行讨论。
rA
kcAcB
kcA0 (1
