(推荐)蛋白质的三维结构
合集下载
蛋白质的三维结构5课件.ppt

(二)-折叠片
(三)-转角和-凸起
-转角
-转角
-凸起
四 纤维状蛋白质
1α-角蛋白
1α-角蛋白
2 -角蛋白
2 -角蛋白
3 胶原蛋白:一种三股螺旋
3 胶原蛋白:一种三股螺旋
五 超二级结构
五 超二级结构
六 结构域
六 结构域
结构域分类
七 蛋白质的三级结构与球蛋白
疏水键、离子键、氢键和 Van der Waals力等。
主要的化学键
整条肽链中全部氨基酸残基的相对空间位置。即肽链中所有原子在三维空间的排布位置。
三级结构定义
球状蛋白
1 多肽链折叠成球形 2 大多包含几个二级结构 3 功能多样:酶调节蛋白
肌红蛋白
三维结构特征
纤维状蛋白质通常只含一种二级结构,而球蛋白通常含有多种二级结构. 球状蛋白质具有明显的折叠层次 一级结构 二级结构 超二级结构 结构域 三级结构或亚基 四级结构 球蛋白是紧密的球状或椭球状实体 疏水残基埋藏于球体内,亲水残基暴露于球体外 表面有一空穴(裂沟,凹槽或口袋),这个空穴能结合配体,蛋白质的活性部位 由二级结构向三级结构转变的主要动力是疏水作用.
-螺旋 ( -helix ) -折叠 ( -pleated sheet ) -转角 ( -turn ) 无规卷曲 ( random coil )
(一) -螺旋目 录1 偶极矩2 α-螺旋的右旋和左旋
3 影响α-螺旋结构的因素
脯氨酸 (亚氨基酸)
(二)-折叠片
(二)-折叠片
蛋白质的四级结构
1、对称性
血红蛋白质四级结构
多聚蛋白:病毒外壳
2、缔合蛋白的优越性
增强稳定性: 减少蛋白质的相对表面积 自身缔合稳定的需要 屏蔽亚基上的疏水残基以利于更加稳定 提高遗传经济和效率 编码同聚蛋白的小亚基比编码大一倍的蛋白质更经济 使催化集团靠近 亚基的催化基团聚集以形成活性中心 不同催化亚基聚合催化关联反应:A B C 发挥协同效应与别构效应 别构效应:别构部位与配体的结合可影响其他亚基,增 强或减弱对底物的结合 协同效应: 正协同效应,负协同效应
课件:蛋白质的三维结构

• 蛋白质的变性与复性
– 蛋白质的变性: 天然蛋白质受某些物理或化学 因素的影响,分子的空间构象破坏,导致其理 化性质、生物活性改变的现象。
– 蛋白质变性的实质是蛋白质分子中的次级键被 破坏,引起天然构像解体,但一级结构保持完 好。
• 蛋白质变性发生的改变
– 生物活性丧失 – 一些侧链基团暴露 – 理化性质改变,如溶解度下降,粘度增加等
• 寡聚蛋白中的每个独立三级结构单元称为 亚基。亚基本身都具有球状三级结构,一 般只包含一条多肽链,也有的由二条或二 条以上由二硫键连接的肽链组成
• 对称性是具有四级结构的蛋白质的重要性 质之一
• 寡聚蛋白使蛋白质的功能更加多样,并且
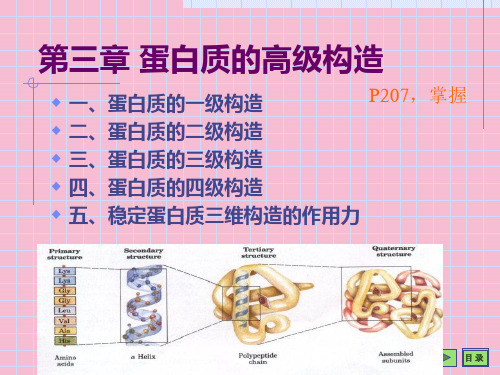
一级结构:多肽链中的氨基酸排列顺序 二级结构:多肽链主链折叠成的有规律性的结构
• 氢键:由带正电性的氢原子与电负性较强的 原子之间形成
• 疏水相互作用:非极性的疏水基团间为避开 水相而相互靠近,聚集于分子内部或非极性 区的趋势
• 范德华力:原子、分子间或基团间的短程作 用力。比离子键和氢键都弱的分子间非专一 性的相互作用
• 离子键:蛋白质中带有相反电荷的侧链间形 成的静电吸引力
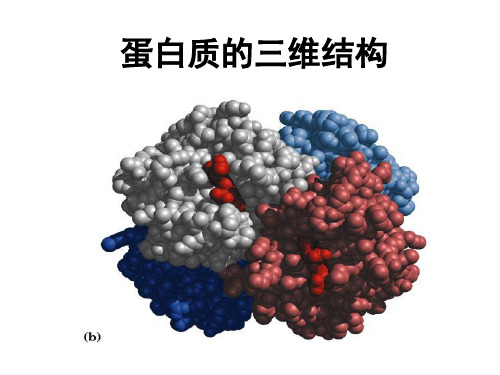
蛋白质的三维结构
• 蛋白质是氨基酸通过肽键连接的线形聚合 物
• 蛋白质的三维结构可划分为不同的结构层 次
– 一级结构:氨基酸序列 – 二级结构:主链结构 – 三级结构:三维形状 – 四级结构:亚基的组织
蛋白质的序列测定策略
8步骤 (片断重叠法) • 1. 多于1个亚基时,分开亚基 • 2. 断裂二硫键:氧化法(过甲酸)或还原法(-巯基乙
• 答:(a)苯异硫氰酸酯(b)苯异硫氰酸酯(c)脲;β巯基乙醇还原二硫键。(d)胰凝乳蛋白酶。(e)CNBr。 (f)胰蛋白酶
– 蛋白质的变性: 天然蛋白质受某些物理或化学 因素的影响,分子的空间构象破坏,导致其理 化性质、生物活性改变的现象。
– 蛋白质变性的实质是蛋白质分子中的次级键被 破坏,引起天然构像解体,但一级结构保持完 好。
• 蛋白质变性发生的改变
– 生物活性丧失 – 一些侧链基团暴露 – 理化性质改变,如溶解度下降,粘度增加等
• 寡聚蛋白中的每个独立三级结构单元称为 亚基。亚基本身都具有球状三级结构,一 般只包含一条多肽链,也有的由二条或二 条以上由二硫键连接的肽链组成
• 对称性是具有四级结构的蛋白质的重要性 质之一
• 寡聚蛋白使蛋白质的功能更加多样,并且
一级结构:多肽链中的氨基酸排列顺序 二级结构:多肽链主链折叠成的有规律性的结构
• 氢键:由带正电性的氢原子与电负性较强的 原子之间形成
• 疏水相互作用:非极性的疏水基团间为避开 水相而相互靠近,聚集于分子内部或非极性 区的趋势
• 范德华力:原子、分子间或基团间的短程作 用力。比离子键和氢键都弱的分子间非专一 性的相互作用
• 离子键:蛋白质中带有相反电荷的侧链间形 成的静电吸引力
蛋白质的三维结构
• 蛋白质是氨基酸通过肽键连接的线形聚合 物
• 蛋白质的三维结构可划分为不同的结构层 次
– 一级结构:氨基酸序列 – 二级结构:主链结构 – 三级结构:三维形状 – 四级结构:亚基的组织
蛋白质的序列测定策略
8步骤 (片断重叠法) • 1. 多于1个亚基时,分开亚基 • 2. 断裂二硫键:氧化法(过甲酸)或还原法(-巯基乙
• 答:(a)苯异硫氰酸酯(b)苯异硫氰酸酯(c)脲;β巯基乙醇还原二硫键。(d)胰凝乳蛋白酶。(e)CNBr。 (f)胰蛋白酶
-蛋白质的三维结构ppt课件
两个肽键衍生而来
目录
影响螺旋构成的要素〔P208,熟习〕
(1) R侧链对α-螺旋的影响
R侧链的大小和带电性决议了能否构成α-螺旋以及 构成的α-螺旋的稳定性。
① 多肽链上延续出现带同种电荷基团的氨基酸残基, (如Lys,或Asp,或Glu),那么由于静电排斥,不能 构成链内氢键,从而不能构成稳定的α-螺旋。如多聚 Lys、多聚Glu。而当这些残基分散存在时,不影响α螺旋稳定。
目录
β-凸起(了解)
β-凸起是一种小片的非反复性构 造,能单独存在,大多数经常作 为反平行β-折叠片中的一种不规 那么情况而存在。 β-凸起可以为是β-折叠股中额外 插入的一个残基,它使得在两个 正常氢键之间、在凸起折叠股上 是两个残基,而另一侧的正常股 上的一个残基。 β-凸起可引起多肽链方向的改动, 但改动的程度不如β-转角。
目录
〔1〕超二级构造〔掌握〕
在蛋白质分子中,由假
αα
设干相邻的二级构造单元组
合在一同,彼此相互作用,
构成有规那么的、在空间上
能识别的二级构造组合体。
几种类型的超二级构造:
ββ
αα;ββ;βαβ;
★超二级构造在构造层
次上高于二级构造,但没有
聚集成具有功能的构造域.
βαβ
目录
〔2〕构造域〔P222,掌握〕 多肽链在二级构造或超二级构造的根底 上构成三级构造的部分折叠区,它是相对 独立的严密球状实体,称为构造域。 *对于那些较小的蛋白质分子或亚基来说, 构造域和三级构造是一个意思,也就是说 这些蛋白质或亚基是单构造域的,如红氧 还蛋白、肌红蛋白等; *对于较大的球状蛋白质或亚基,其三级 构造往往由两个或多个构造域缔合而成也
我国1965年在世界上第一个用化学方法人工合成 的蛋白质就是这种牛胰岛素。
蛋白质的三维结构(1)
(一)-螺旋
LinusCarl Pauling1901-1994
1926年,留学Sommerfeld实验室(1年7个月) 1928年,发明杂化轨道, 创立量子化学 1930年,去Laurence Bragg实验室学X-ray衍射 1936年,与Mirsky一起发表蛋白质变性的理论---氢键 1937年,开始搭建蛋白质结构模型,发现α- Keratin 的
(2) -折 叠结 构
1、-折叠是由伸展的肽链间或同一肽链的不同肽段 间按层排列,通过链间的氢键交联而形成的。肽 链的主链呈锯齿状折叠,氢键与链的长轴接近垂 直
優點: 1.可以得到蛋白質在溶解狀態下的立體結構。 2.可避免蛋白質晶體取得的困難。 3.在溶液中測得核磁共振結構,比較符合蛋白 質在生理環境的狀態。 4.可觀察在不同溶液條件下蛋白質的立體結構 。 缺點: 只能對小的蛋白質作分析(以便於在溶液中快速 的旋轉,並在高濃度時保持溶解的狀態) 。
维持空间构象的作用力
二面角所决定的构象能否存在,主要取决 于两个相邻肽单位中,非键合原子之间的 接近有无阻碍。
-碳原子的二面角( 和 )
(二)可允许的或 值:拉氏构象图
蛋白质中非键合原子之间的最小接触距离(oA) •
C
C
3.20 (3.00)
N
O
H
N
2.9 (2.80)
2.7 (2.60)
O
2.8 (2.70)
二、稳定蛋白质三维结构的作用力
作用力
破坏因子
氢键: α-螺旋,β-折叠
尿素,盐酸胍
疏水作用: 形成球蛋白的核心
H2NC(:NH)NH2 HCl 去垢剂,有机溶剂
Van der Waals力:稳定紧密堆积的集团和原子
生物化学 蛋白质的三维结构(共44张PPT)

四、Protein的二级结构——无规那么卷曲
random coil
α-helix
β-turn β-sheet
无规卷曲泛指不能被归入明确的二级结构如螺旋和折叠的多肽区段, 但也不是完全没有规那么的,也像其他二级结构一样是明确而稳定的 结构。
五、纤维状蛋白——α角蛋白
α-螺旋 初原纤维
〔1〕α角蛋白 头发和羊毛的根本结构 是α-角蛋白,α-螺旋 是α-角蛋白的根本结构 单位;伸缩性能很好,加 热拉伸可转变成β构象, 因此湿热的头发可以拉 伸到原长度的2倍
空间位阻:Gly的R基太小,难以形成α-螺旋所需的两面角,所 以和Pro一样也是螺旋的最大破坏者;而Asn、Leu侧链很大 ,防碍α螺旋的形成;假设肽链中连续出现带庞大侧链的氨基 酸如Ile,也难以形成α-螺旋。
静电斥力: 假设一段肽链有多个Glu或Asp相邻,那么因 pH=7.0时都带负电荷,防碍α螺旋的形成;同样多个碱性 氨基酸残基在一段肽段内,正电荷相斥,也防碍α螺旋的形 成。
在组织层次上介于二级和三级结构之间,但没有聚集成具有功能的结构域。
其(E①疏F-h水a侧nd链-C埋折a2在+叠-分bin子中d内ing部,m,o亲tif-〕水碳侧链原在子分子总外表是处于折叠的角上,氨基酸的R基团处于折叠的棱角上并 有五与关、螺 纤棱旋维的状角写蛋垂法白,—直用—“α。n角S〞蛋相来白邻表示R: 基团之间的距离为0.7nm ② -折叠结构的氢键主要是由两条肽链间形成的,也可以在同一肽链的不同局部间形 成。几乎所有肽键都参与链内氢键的交联,氢键与链的长轴接近垂直。
➢二硫键绝大多数情况下二硫键是在多肽链的β-转角附近形成的。。假设二硫键的 形成并不规定多肽链的折叠,然而一旦蛋白质采取了它的三维结构那么二硫键的形成 将对此构象起稳定作用,蛋白质中所有的二硫键相继被复原将引起蛋白质的天然构象 改变和生物活性丧失。在许多情况下二硫键可选择性的被复原。
第三节蛋白质的三维结构

(2)β-折叠
β-pleated sheet
• β-折叠是由两条或多条几乎完全伸展 的肽链(或一条多肽链的若干肽段) 的肽链(或一条多肽链的若干肽段) 侧向集聚, 通过链间的氢键 氢键交联而形 侧向集聚, 通过链间的氢键交联而形 成的。肽链的主链呈锯齿状片层结构。 锯齿状片层结构 成的。肽链的主链呈锯齿状片层结构。 • β-折叠中几乎所有肽键都参与链内氢 键的交联,氢键与链的长轴接近垂直。 键的交联,氢键与链的长轴接近垂直。 • β-折叠的类型:平行式;反平行式 折叠的类型:平行式;
β-折迭包括平行式和反平行式两种类型
(3)β-转角 β-turn
• β- 转角是多肽链180°回折部分所形成的一种二级结构,其结构特征 转角是多肽链180°回折部分所形成的一种二级结构, 是多肽链180 为: • ⑴ 主链骨架本身以大约180°回折; 主链骨架本身以大约180 回折; 180° 回折部分通常由四个氨基酸残基构成; ⑵ 回折部分通常由四个氨基酸残基构成; ⑶构象依靠第一残基的-CO基与第四残基的-NH基之间形成氢键来维系。 构象依靠第一残基的-CO基与第四残基的-NH基之间形成氢键来维系。 基与第四残基的 基之间形成氢键来维系 • 这类结构主要存在于球状蛋白分子中。 这类结构主要存在于球状蛋白分子中。
不溶性(硬蛋白) 不溶性(硬蛋白) 纤维状蛋白质
角蛋白、胶原蛋白和弹性蛋白等 角蛋白、
可溶性
肌球蛋白和纤维蛋白原等
角蛋白
角蛋白广泛存在于动物的皮肤及皮肤的衍生物, 角蛋白广泛存在于动物的皮肤及皮肤的衍生物, 如毛发、 鳞和羽等。可分为α 如毛发、甲、角、鳞和羽等。可分为α-角蛋白和 角蛋白。 β-角蛋白。 角蛋白主要由 螺旋构象的多肽链组成。 主要由α α-角蛋白主要由α-螺旋构象的多肽链组成。一般 是由三条右手α 螺旋肽链形成一个原纤维( 是由三条右手α-螺旋肽链形成一个原纤维(向左 缠绕),原纤维的肽链之间有二硫键 ),原纤维的肽链之间有二硫键交联以维持 缠绕),原纤维的肽链之间有二硫键交联以维持 其稳定性 毛的纤维是由多个原纤维平行排列, 毛的纤维是由多个原纤维平行排列,并由氢键和 二硫键作为交联键将它们聚集成不溶性的蛋白质。 二硫键作为交联键将它们聚集成不溶性的蛋白质。 α-角蛋白的伸缩性能很好,当α-角蛋白被过度拉 角蛋白的伸缩性能很好, 伸缩性能很好 伸时,则氢键被破坏而不能复原。此时α 伸时,则氢键被破坏而不能复原。此时α-角蛋白 转变成β 折叠结构,称为β 角蛋白。 转变成β-折叠结构,称为β-角蛋白。
生物化学课件:4 蛋白质三维结构
2级结构
3级结构
4级结构
蛋白质的高级结构
蛋白质二级结构的基本类型
二级结构:靠氢键维系的部分蛋白质主链有规 律的折叠结构。(链内或链间形成的氢键)
主要有-螺旋、-折叠、-转角、无规卷曲。 其中-螺旋是蛋白质中最常见,含量最丰富的 二级结构
二级结构产生的原因
➢ Peptide bond不能转动 → 肽平面
0.54 nm 3.6 个残基
第n+3个肽键的H原子 第n个肽键的O原子
C原子 O原子 N原子 H原子
N-端
0.5 nm
(a)
理想α-螺旋的特性
①肽链上C=O氧与它后面 (C端)第四个残基上C的原子 N-H氢形成氢键,氢键O取原子 向与主轴基本平行。 N原子
H原子
②螺旋一圈占3.6个AA,螺 距0.54 nm,每个AA旋转 100o,沿轴上升0.15nm。
➢ 肽链中连续出现大侧链的氨基酸(如Ile),由于空 间位阻,也难以形成α-螺旋。
➢ 在多肽链中连续的出现带同种电荷的极性氨基酸, α-螺旋就不稳定,如多聚Lys、多聚Glu。
2. β-折叠(β- sheet)
-折叠是由两条或多 条伸展的多肽链平行 排列,由相邻肽链上 的酰胺H和羧基O间形 成的氢键所维持有规 则的结构。(也可以 在同一肽链的不同部 分之间形成)
蛋白质的三维结构
➢二级结构 ➢三级结构 ➢四级结构 ➢蛋白质变性与复性 ➢抗体
蛋白质的二级结构
➢肽平面 ➢二级结构的基本类型 ➢二级结构类型的代表性蛋白
肽平面
肽基 (peptide group) ➢ 构成肽链主链的基本单元,叫做肽基——
主链骨架重复单位,它包括两个α-碳原子 及其中间的一个肽键,Cα-CO-NH-Cα;
第5章蛋白质的三维结构(共105张PPT)
上图:L-Ala残基的拉氏构象图,横坐标为的取 值,纵坐标为 的取值。
32
多肽主链形成三维结构的空间限制
拉氏图不仅对蛋白质的构象研究起到了简化作用,对于 判断所得到的蛋白质结构模型的正误也有意义。 实际得到的许多蛋白质的三维结构证实了拉氏图是根本 正确的。
33
5.4 二级结构:多肽链折叠的规那么方式 Secondary structure :The common regular
• 反平行折叠片较稳定,重复单位为0.7 nm, 即每个氨基酸的长度为0.35nm;
α螺旋的偶极矩
α螺旋相当于在N—末端 积累了局部负电荷,在 C—末端积累了局部正电荷
43
Protein Secondary structure
α螺旋的手性
• 蛋白质中的α螺旋几乎
都是右手的 (除胶原蛋白外)。
44
影响α螺旋形成的因素
• 与它的氨基酸组成和序列有极大的关系:
– 侧链R-基团所带的电荷。如多聚赖氨酸, 不能形成;
多数情况下,这些基团分布在球状蛋白质分子的 外表,与水分子作用形成排列有序的水化层,稳 定蛋白质的构象。
16
5.2.5 二硫键 Disulfide bond
Covalent bond between side chains of two cysteine residues
17
Disulfide bond
Bond Energy (kJ/mol)
13-30 4-8 12-20 12-30 210 376.81
21
5.3 多肽主链折叠的空间限制
5.3.1 肽键和肽平面
多肽主链是由-NH-Cα-CO-相连重复排列 形成的。164
肽基〔peptide
32
多肽主链形成三维结构的空间限制
拉氏图不仅对蛋白质的构象研究起到了简化作用,对于 判断所得到的蛋白质结构模型的正误也有意义。 实际得到的许多蛋白质的三维结构证实了拉氏图是根本 正确的。
33
5.4 二级结构:多肽链折叠的规那么方式 Secondary structure :The common regular
• 反平行折叠片较稳定,重复单位为0.7 nm, 即每个氨基酸的长度为0.35nm;
α螺旋的偶极矩
α螺旋相当于在N—末端 积累了局部负电荷,在 C—末端积累了局部正电荷
43
Protein Secondary structure
α螺旋的手性
• 蛋白质中的α螺旋几乎
都是右手的 (除胶原蛋白外)。
44
影响α螺旋形成的因素
• 与它的氨基酸组成和序列有极大的关系:
– 侧链R-基团所带的电荷。如多聚赖氨酸, 不能形成;
多数情况下,这些基团分布在球状蛋白质分子的 外表,与水分子作用形成排列有序的水化层,稳 定蛋白质的构象。
16
5.2.5 二硫键 Disulfide bond
Covalent bond between side chains of two cysteine residues
17
Disulfide bond
Bond Energy (kJ/mol)
13-30 4-8 12-20 12-30 210 376.81
21
5.3 多肽主链折叠的空间限制
5.3.1 肽键和肽平面
多肽主链是由-NH-Cα-CO-相连重复排列 形成的。164
肽基〔peptide
蛋白质的三维结构
除了上面这种典型的α-螺旋外,还有一些 不典型的α-螺旋,所以规定了有关螺旋的写 法,用“nS”来表示,n为螺旋上升一圈氨基 酸的残基数。S为氢键封闭环内的原子数,典 型的α-螺旋用3.613表示,非典型的α-螺旋有 3.010, 4.416(π螺旋)等。
影响α-螺旋形成及稳定性的因素
一些侧链基团虽然不参与螺旋,但他们可影 响α-螺旋的稳定性。 1、在多肽链中连续的出现带同种电荷的极 性氨基酸,α-螺旋就不稳定。 2、在多肽链中只要出现pro,α-螺旋就被 中断,产生一个弯曲(bend)或结节 (kink)。 3、肽链中连续出现带庞大侧链的氨基酸如 Ile,由于空间位阻,也难以形成α-螺旋。
α-角蛋白的结构特征
β-角蛋白的结构特征
丝心蛋白(fibroin)是反平行β折叠片 以平行方式堆积的多层结构,富含Gly、 Ala、Ser,链间距离0.47nm 。
丝心蛋白质地柔软,抗张强度高但不能拉伸。
胶原蛋白(collagen)
组织中胶原蛋白含量(占蛋白质总量百分比)
组织 骨 跟腱 皮肤 角膜 软骨 韧带 主动脉 胶原蛋白 88.0 86.0 71.9 68.1 46-63 17.0 12-24
结构域(domain)
结构域是球状蛋白质的折叠单位,在 空间上彼此分隔,各自具有部分生物功能 的结构。通常含100~200个氨基酸残基。 一条长的多肽链首先折叠成几个相对独立 的结构域再缔合成三级结构。
结构域是1970年Edelman提出的,它是 指在较大的球状蛋白质分子中,多肽链往往 形成几个紧密的球状构象,彼此分开,以松 散的肽链相连,此球状构象就是结构域。 最常见的结构域约含100~200个氨基 酸残基,少至40个左右,多至400个以上。 结构域是球状蛋白质的折叠单位,多肽 链折叠的最后一步是结构域的缔合。 功能域是球状蛋白质分子中能独立存在的 功能单位,可由一个或多个结构域的组成。
03-蛋白质的三维结构
变性( 变性(denaturation) )
蛋白质分子由于物理或化学因素导致 的生物活性丧失, 溶解度降低, 的生物活性丧失 , 溶解度降低 , 物理化学 常数发生变化的过程 实质:分子中次级键破坏, 实质:分子中次级键破坏,共价键不变 特征: 特征:生物活性丧失
32
变性剂: 变性剂:使蛋白质分子变性的物质
12
三、二级结构
螺旋( helix) 1、α-螺旋(α-helix) 螺旋
肽链主链围绕中心轴盘绕成 螺旋状紧密卷曲的棒状结构 结构特征 1)ψ和φ约为 °和-47° 约为-57° ) ° 2)每圈螺旋约含 个氨基酸 )每圈螺旋约含3.6个氨基酸 残基, 螺距0.54nm,R基 残基, 螺距 , 基 在螺旋外侧
在β-折叠股中额外插入 折叠股中额外插入 一个残基,可引起肽链方向 一个残基, 稍有改变
4、无规卷曲(random coil) 、无规卷曲
受侧链相互作用影响较 大。常构成酶的活性部位和 蛋白质的功能部位
18
四、超二级结构
概念
若干相邻的二级结构单元彼此相互作 形成种类不多、 用,形成种类不多、有规则的二级结构组 合或二级结构串,在多种蛋白质中充当三 合或二级结构串, 级结构的构件
脂锚钩的作用: 脂锚钩的作用: 锚定蛋白 调节蛋白活性 在真核细胞中控 制信号传导途径
30
七、膜蛋白的结构
脂锚定结构有四种类型
1)酰胺-连接的豆 )酰胺蔻酰锚钩 2)硫酯-连接的脂 )硫酯肪酰锚钩 3)硫醚-连接的异 )硫醚戊二烯基锚钩 4)酰胺-连接的糖 )酰胺基脂酰肌醇锚钩
31
八、蛋白质的变性
34
九、氨基酸序列规定 蛋白质的三维结构
蛋白质的三维结构由氨基酸序列所规 二级结构决定于短程相互作用, 定,二级结构决定于短程相互作用,三级 结构决定于长程相互作用, 结构决定于长程相互作用,二硫桥对蛋白 质构象具有稳定作用
蛋白质分子由于物理或化学因素导致 的生物活性丧失, 溶解度降低, 的生物活性丧失 , 溶解度降低 , 物理化学 常数发生变化的过程 实质:分子中次级键破坏, 实质:分子中次级键破坏,共价键不变 特征: 特征:生物活性丧失
32
变性剂: 变性剂:使蛋白质分子变性的物质
12
三、二级结构
螺旋( helix) 1、α-螺旋(α-helix) 螺旋
肽链主链围绕中心轴盘绕成 螺旋状紧密卷曲的棒状结构 结构特征 1)ψ和φ约为 °和-47° 约为-57° ) ° 2)每圈螺旋约含 个氨基酸 )每圈螺旋约含3.6个氨基酸 残基, 螺距0.54nm,R基 残基, 螺距 , 基 在螺旋外侧
在β-折叠股中额外插入 折叠股中额外插入 一个残基,可引起肽链方向 一个残基, 稍有改变
4、无规卷曲(random coil) 、无规卷曲
受侧链相互作用影响较 大。常构成酶的活性部位和 蛋白质的功能部位
18
四、超二级结构
概念
若干相邻的二级结构单元彼此相互作 形成种类不多、 用,形成种类不多、有规则的二级结构组 合或二级结构串,在多种蛋白质中充当三 合或二级结构串, 级结构的构件
脂锚钩的作用: 脂锚钩的作用: 锚定蛋白 调节蛋白活性 在真核细胞中控 制信号传导途径
30
七、膜蛋白的结构
脂锚定结构有四种类型
1)酰胺-连接的豆 )酰胺蔻酰锚钩 2)硫酯-连接的脂 )硫酯肪酰锚钩 3)硫醚-连接的异 )硫醚戊二烯基锚钩 4)酰胺-连接的糖 )酰胺基脂酰肌醇锚钩
31
八、蛋白质的变性
34
九、氨基酸序列规定 蛋白质的三维结构
蛋白质的三维结构由氨基酸序列所规 二级结构决定于短程相互作用, 定,二级结构决定于短程相互作用,三级 结构决定于长程相互作用, 结构决定于长程相互作用,二硫桥对蛋白 质构象具有稳定作用
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
黄素氧还 蛋白中的 α-螺旋
胰腺胰 蛋白酶 抑制剂
柠檬酸合 酶中的α螺旋
钙调蛋白中 的α-螺旋
53
胶原蛋白的二级结 构是由三条肽链组成的 三股螺旋,这是一种右 手超螺旋结构。螺距为 8.6nm,每圈每股包含30 个残基。其中每一股螺 旋又是一种特殊的左手 螺旋,螺距为0.95nm, 每一螺圈含3.3个残基, 每一残基沿轴向的距离 为0.29nm。一级结构分 析表明,肽链的96%都 是按三联体的重复顺序: (g1y-x-y)n排列而成。 Gly数目占残基总数的三 分之一,x常为Pro,y常 为Hpro(羟脯氨酸)和 Hlys(羟赖氨酸)。
20
-折叠有两种 类型。一种为 平行式,即所 有肽链的N-端 都在同一边。 另一种为反平 行式,即相邻 两条肽链的方 向相反。反平 行式较稳定。
21
22
23
(三)β转角和β凸起
-转角由四个氨基酸残基组成,弯曲处的第一个氨基酸
残基的 -C=O 和第四个残基的 –N-H 之间形成氢键,形成一
个不很稳定的环状结构。
34
原胶原蛋白分子 在胶原纤维中都 是有规则地按四 分之一错位,首 尾相接,并行排 列组成纤维束。 这样通过1/4错 位排列便形成间 隔一定的(大约 70nm)电子密度 区域,而呈现横 纹区带。
35
36
37
胶原蛋白属于结构蛋白质,使骨、腱、软骨和皮肤具有机械强度。胶原 蛋白至少包括四种类型,称胶原蛋白I、Ⅱ、Ⅲ和Ⅳ。腱的胶原纤维具有很 高的抗张强度(tensile strength),约为20-30kg/mm2,相当于12号冷拉钢 丝的拉力。骨铬中的胶原纤维周围排列着羟基磷灰石(hydroxyapatite, Ca10(PO4)6(OH)2)结晶。脊椎动物的皮肤含有编织比较疏松,向各个方向伸 展的胶原纤维。血管亦含有胶原纤维。
(三)疏水作用(熵效应) (四)盐键 (五)二硫键
9
三、多肽主链折 叠的空间限制
(一)酰胺平面与 α-碳原子的二面角 (φ和ψ):
规定键两侧基 团为顺式排列时为0o, 从C沿键轴方向观察, 顺时针旋转的角度 为正值。
10
(二)可允许的φ和ψ:拉氏构象图
11
(二)可允许的 φ和ψ值:拉
氏构象图
由印度学者 Ramachandran制作
18
5 .其他类型的螺旋
4.416螺19旋
(二)β折叠片 -折叠是由两条或多条几乎完全伸展的肽链平行排列,
通过链间的氢键交联而形成的。肽链的主链呈锯齿桩折叠构 象。两个氨基酸之间的轴心距为0.35nm; -折叠结构可以 由两条肽链之间形成,也可以在同一肽链的不同部分之间形 成。几乎所有肽键都参与链内氢键的交联,氢键与链的长轴 接近垂直。
第5章 蛋白质的 三维结构
1
一、研究蛋白质构象的方法 (一)X射线衍射法
2
基本规律:X射线穿过原子平面层时,当光程差等于波长的倍 数,反射波可以互相叠加形成衍射斑点。如图5-2所示,光程 差等于2dsinθ,上述规律可总结为Bragg方程:
2dsinθ=nλ(n=±1, ±2, ±3…)
3
(二)研究溶液中蛋白质构象的光谱学方法
氨基酸残基酰胺基团的-CO基形成氢键。
蛋白质分子为右手-螺旋。
13
14
* *
3.613螺1旋5
2.α螺旋的偶 极矩和帽化
16
3.α螺旋 的手性
17
4.影响α螺旋形成的因素:R基太小使键角自由度过大,带同种电荷的R 基相互靠近,β碳原子上有分支均不利于形成α螺旋,含脯氨酸的肽段不 能形成α螺旋。
加会形成椭圆偏振光。
椭圆率θ=短轴/长轴
=tanθ
≈33cl∆ε(适合于小的θ, ∆ε=
εR− εL,c为摩尔浓度,l为光程,ε 为
摩尔吸光系数)
摩尔椭圆率[θ]λ=θ/cl×100=3300 ∆ε
6
4.核磁共振(NMR)
7
二、稳定蛋白质三维结构的作用力
8
(一)氢键 (二)范德华力
定向效应 诱导效应 分散效应
1.紫外差光谱
芳香族氨基酸在 极性环境下吸收峰向 短波长移动,称作篮 移,反之会红移。
2.荧光和荧光偏振
变性和非变性蛋 白质荧光峰和荧光偏 振的位置会有特定的 变化。
4
3.圆二色性
由尼科尔棱镜产生
由电光调制器产生
5
圆偏振光可右圆偏振
光因被测物的吸收而振幅不同,二者叠
基底膜蛋白聚糖
层黏连蛋白
38
巢蛋白
胶原蛋白的共价键
39
40
吡啶啉是由一个 原胶原的N末端 区和另一个相邻 的原胶原的C末 端区之间形成。
随着年龄的增长, 胶原蛋白之间的交 联键会增多。
41
(四) 弹性蛋白
1.弹性蛋白最重要的特性是富有弹性。 2.弹性蛋白不含羟赖氨酸,不被糖基化,不能 形成胶原蛋白那样的超螺旋。 3.弹性蛋白的一种交联方式是通过羟赖氨酸正 亮氨酸衍生物交联。 4.弹性蛋白的另一种交联方式是赖氨酸的侧链 氧化脱氨基生成醛基,三个醛基和一个未修饰的赖 氨酸的侧链形成锁链素和异锁链素,使多条弹性蛋 白链交联成肽链网。 5.弹性蛋白的肽链形成多种多样的无规卷曲, 有张力时,卷曲被拉伸,张力去除后又复原。
这类结构主要存在于球状蛋白分子中。
24
(四) 无规卷曲
无一定的规则,但对一定的球蛋白而言,特定的区域有特
定的卷曲方式.
25
五、纤维状蛋白质
26
(一) α-角蛋白
纤丝
27
卷曲的螺旋 初原纤维
原纤维
28
29
30
31
(二) 丝心蛋白和其他β-角蛋白:β折叠片蛋白质
32
33
(三) 胶原蛋白:
12
四、二级结构:多肽链折叠的规则方式
(一)α螺旋
1.α螺旋的结构
多肽链中的各个肽平面围绕同一轴旋转,形成
螺旋结构,螺旋一周,沿轴上升的距离即螺距为
0.54nm,含3.6个氨基酸残基;两个氨基酸之间的距
离为0.15nm;
肽链内形成氢键,氢键的取向几乎与轴平行,
每一个氨基酸残基的酰胺基团的-NH基与其后第四个
42
43
(五) 肌球蛋白和原肌球蛋白
44
45
木瓜蛋白酶
M
重酶解肌球蛋白
胰蛋白酶 轻酶解肌球蛋白
46
黄色是轻链结合部位,品红色是轻 链调节部位,其余为s1头部。
47
48
有些纤维状蛋白质是由球状蛋白质聚集而成的
49
六、超二级结 构和结构域
(一) 超二级结构
花边
50
51
52
(二) 结构域
