碱性磷酸酶km值测定
AKP Km值测定

【实验操作】
1 2 3 4 5 6 7 管号 底物液 0.05 0.15 0.25 0.30 0.40 0.60 0.80
(0.04M) 碳酸缓 液(pH=10)
8 0.00
0.90 0.90 0.90 0.90 0.90 0.95 0.85 0.75 0.70 0.60
0.90 0.90 0.40 0.20
VMAX
1/2VMAX
1/Vmax
1/[s]
[S] Km
-1/Km
底物浓度与反应速度关系曲线
双倒数曲线
【实验讨论】
比较两个值的大小,分析实验误差产生 的原因 比较两种Km测定方法各自的优缺点
0.90 1.00
蒸馏水
混匀后37℃水浴,预温5分钟左右
酶液
0.1 0.1
0.1
0.1
0.1
0.1 0.1
0.1
加入酶液后立即混匀(保持37℃水浴), 反应开始。
从加入酶液起计时至下一步 加入碱性 溶液停止反应,各管反应时间应准确一 致,为15分钟。
碱性溶液
1.0 1.0
1.0 1.0
1.0
1.0
Vmax•[S] + 1/ Vmax
本实验以碱性磷酸酶为例,用磷酸苯二钠为其 底物,生成酚和磷酸,酚在碱性溶液中与4一氨 基安替比林作用,经铁氰化钾氧化生成红色醌 的衍生物,根据红色的深浅可测出酶活力高低。 其反应式如下:
磷酸苯二钠+H2O AKP OH苯酚
苯酚+4-氨基安替比林 K3Fe(CN)6 醌衍生物 (红色)
碱性磷酸酶Km值 的测定
【实验目的】
1.了解酶的Km值测定原理和方法
2.掌握碱性磷酸酶(AKP)活性测
碱性磷酸酶km值的测定实验报告

碱性磷酸酶km值的测定实验报告篇一:碱性磷酸酶Km值得测定(1)碱性磷酸酶Km值得测定原理在适宜条件下,酶促反应的初速度随底物浓度【S】增大而增大,当底物浓度达一定时则反应趋于稳定,反应速度最大。
关系可用米氏方程表示Km是酶的特征性常数。
将米氏方程变形为双倒数方程对1/S作图可算出Km步骤,以1/V结果由y=+算出当y=0时x=,继而算出Km值=L讨论计算出来的Km值与查资料所得到的值有一定的差距。
1实验是粗测,本身存在实验误差,我们在操作过程中也造成误差,所以导致与实际值差距较大。
尿蛋白定性检测原理加热可以使蛋白质变性,溶液pH等于pI时溶解度最小。
步骤1.取大试管一支,加入5ml澄清尿液。
2.用试管夹持试管上端,酒精灯加热尿液斜面至沸。
3.滴加5%乙酸2~3滴于尿液表面,轻轻混匀局部,加热。
结果未加热部分是澄清,加热部分浑浊明显讨论正常尿液中不会出现浑浊,本实验尿液加入了蛋白质。
尿液中如果出现沉淀则说明出现了病症。
分子筛层析(凝胶过滤法)原理多孔凝胶对不同大小分子的排阻效应,使不同分子分离。
大分子先出,小分子后出。
步骤1.取5~8滴4mg/ml蓝色葡萄聚糖液和4滴2mg/ml重铬酸钾液混匀。
2.将层析柱出水口打开,缓放柱内液体至凝胶柱表面加入2混匀的待层析液。
3.从上口缓加蒸馏水,成2~3cm高水柱,出水口用小试管接水。
4.在上口加洗脱液洗脱。
每支小试管接1cm液体,并编号。
5.观察不同小试管的液体颜色的变化。
结果讨论分子筛层析能够大致的分离分子量不同的物质,但是分离的物质不纯有杂质,实验时间也相对较长,操作复杂。
篇二:碱性磷酸酶的Km测定篇三:酶工程实验报告五(纤维素酶米氏常数—Km的测定)本科学生实验报告学号 0姓名孙永升学院实验课程名称酶工程 < 实验 >教师及职称开课学期至学年填报时间年月日云南师范大学教务处编印13234km操作流程:A稀释:原酶液底物B预热 : 各预热10minC取液 :稀释到10000倍的纤维素酶液不同浓度的底物溶液D反应50 水浴中保温30minF 测定3mLDNS反应终止沸水浴5min 定容至25ml 测定OD540吸光值G 作双倒数图求Km实验注意事项本实验是一个定量测定方法,为获得准确的实验结果,应尽量减少实验操作中带来的误差。
碱性磷酸酶米氏常数的测定实验报告

碱性磷酸酶米氏常数的测定实验报告实验目的:1、学习和掌握米氏常数(Km)及最大反应速度(Vm)的测定原理。
2、测定牡蛎碱性磷酸酶水解对硝基苯磷酸钠盐时的Km和Vm值u。
实验原理:1、米氏方程:V=Vm[S]/Km+[S]其中[S]为底物浓度;v为初速度;Vm为最大反应速度;Km为米氏常数.Vm/2=Vm[S]/Km+[S]Km=[S]Km值等于酶促反应速度为最大反应速度一半时的底物浓度,单位是浓度单位。
米氏常数K是酶的一个基本特征常数。
2、动力学参数的测定:测定Km和Vm,可通过作图法求得。
最常用的Lineweaver-Burk双倒数作图法米氏方程转化为倒数形式,即:1/v=Km/Vm*1/[S]+1/Vm3、本实验测定碱性磷酸酶催化对硝基苯磷酸钠盐(pNPP)水解的Km和Vm反应式:产物对硝基苯酚pNP在405nm波长有吸收可通过分光光度法测定产物pNP的含量测定并制作产物pNP的标准曲线根据催化反应产生的产物OD值从标准曲线求出产物浓度,换算成反应速度v。
实验试剂与器材:试剂:0.5μmol/mL pNP 溶液、10 mmol/L pNPP溶液、20 mmol/L MgCl2,溶液、0.1 mol/L 碳酸钠-碳酸氢钠 pH 10.1缓冲液、0.1 mol/L NaOH、碱性磷酸酶。
器材:恒温水浴锅、722分光光度计实验操作流程:1.对硝基苯酚标准曲线的制作取15支试管编号,0号一支,1-7号各二支,按下表操作:以对硝基苯酚的绝对量(μmol数)为横坐标,OD405nnm值为纵坐标,绘制标准曲线。
求出PNP的摩尔消光系数(s)值。
2.反应速度测定15支试管,1-5做两组平行测定管,01-05作为空白对照分别以01-05调零点,测定对应样品管ODq0s。
3.数据处理各管在722分光光度计测定波长405nm的OD值(OD405nm)。
从对硝基苯酚标准曲线上查出OD405nm。
相当于产物对硝基苯酚的μmol数。
碱性磷酸酶km值测定实验报告

碱性磷酸酶km值测定实验报告碱性磷酸酶(Km)值测定实验报告引言:碱性磷酸酶是一种重要的酶,在生物体内起着多种功能。
它参与了细胞信号传导、骨骼形成和矿物质代谢等生理过程。
了解碱性磷酸酶的性质和特点对于研究其功能和应用具有重要意义。
本实验旨在测定碱性磷酸酶的Km值,以揭示其底物浓度与酶反应速率之间的关系。
材料与方法:1. 实验仪器:分光光度计、离心机、比色皿等。
2. 实验试剂:碱性磷酸酶提取液、磷酸盐缓冲液、对硝基酚磷酸盐、NaOH溶液等。
3. 实验操作:首先,将适量的碱性磷酸酶提取液加入磷酸盐缓冲液中制备酶溶液。
然后,分别取一系列浓度的对硝基酚磷酸盐溶液,并加入相同体积的酶溶液,混合均匀后放置于37℃恒温水浴中反应一定时间。
最后,利用分光光度计测定反应体系中产生的黄色产物的吸光度。
结果与讨论:通过测定不同浓度对硝基酚磷酸盐溶液的吸光度,我们得到了一系列实验数据。
将吸光度与对硝基酚磷酸盐浓度绘制成图表,我们可以得到一条标准曲线。
根据标准曲线,我们可以计算出不同底物浓度下的酶反应速率。
在实验过程中,我们发现酶的反应速率随着底物浓度的增加而增加,但随着底物浓度的进一步增加,酶反应速率逐渐趋于饱和。
这是因为酶与底物结合形成酶底物复合物,底物浓度的增加会增加酶底物复合物的形成速率。
然而,当底物浓度达到一定水平时,酶底物复合物的形成速率已经接近最大值,因此酶反应速率不再随底物浓度的增加而增加。
根据酶反应速率与底物浓度的关系,我们可以计算出碱性磷酸酶的Km值。
Km 值是指在半饱和状态下,底物浓度等于酶的反应速率的一半。
通过计算标准曲线上反应速率等于一半最大反应速率时的底物浓度,我们可以得到Km值。
Km值的大小反映了底物与酶之间的亲和力。
Km值越小,底物与酶之间的结合越紧密,亲和力越强。
反之,Km值越大,底物与酶之间的结合越松散,亲和力越弱。
通过测定Km值,我们可以了解碱性磷酸酶对底物的亲和力,进而推测其在生物体内的功能和作用。
碱性磷酸酶km值的测定

0. 1 0. 1 0. 1 0. 1 0. 1 0. 1 0. 1
加入酶液后立即混匀(保持37℃水浴) ,
混匀 , 室温放置10分钟左右, 以8号管为 空白 , 于5l0nm比色 , 记录各管的光密度
碱性溶液 1.0 1.0 1.0 1.0 1.0 1.0 1.0
1 2 30.05 0. 150.90 0.900.95 0.85
管号底物液 (0 .04M)碳酸缓液 (pH= 10)蒸馏水
混匀后37℃水浴 , 预温5分钟左右
【
】
反应开始。从加入酶液起计时至下一步 加入碱性 溶液停止反应 , 各管反应时间应准确一 致 , 为15分钟。
■ 比较两个值的大小,分析实验误差产生 的原因
底物浓度 mmol/L
1/ [S]
1/OD
【
】
4 5
1 2
8
6
3
3
5
7
1
1
/ OD510为纵轴作 图 , 观察曲线形状; 查Km值■
s]为横轴,
■ 以
1
1
1/ [s- 1/Km
底物浓度与反应速度关系曲线
双倒数曲线
1/2VMAX
VMAX
[S]
的原因■ 比较两种Km测定方法各自的优缺点
/ km , 据此可算出Km
1/ Vmax
距3;4-氨基安替比林 K3Fe(CN)6 (红色醌衍生物
:
:磷酸苯二钠+H2O
(红色
AKP
)
4 5 6 7 80.25 0.30 0.40 0.60 0.800.90 0.90 0.90 0.90 0.900.75 0.70 0.60 0.40 0.20
4-氨基安 替比林铁氰化钾
碱性磷酸酶km值测定 实验报告

碱性磷酸酶km值测定实验报告碱性磷酸酶(alkaline phosphatase)是一种重要的酶类物质,在生物体内发挥着关键的生物学功能。
为了更好地了解碱性磷酸酶的性质和功能,我们进行了碱性磷酸酶的KM值测定实验。
实验中,我们首先准备了一系列不同底物浓度的反应液,并添加了一定浓度的碱性磷酸酶。
然后,通过测定一定时间内底物浓度的变化,我们可以得到不同底物浓度下反应速率的数据。
在实验中,我们选择了两种常用的底物——对硝基苯磷酸钠(p-NPP)和酚酞磷酸钠(BTP)来进行测定。
p-NPP是一种无色底物,在碱性条件下可以被碱性磷酸酶催化水解生成对硝基苯酚,其产物可以通过测定吸光度来确定反应速率。
而BTP是一种红色底物,在碱性条件下可以被碱性磷酸酶催化水解生成酚酞,其产物可以通过测定吸光度来确定反应速率。
通过实验数据的处理和分析,我们得到了不同底物浓度下的反应速率和底物浓度的关系。
通过拟合实验数据,我们可以得到反应速率与底物浓度之间的动力学关系。
根据麦克斯韦-玛尔蒙方程,我们可以得到碱性磷酸酶的KM值。
KM值是一个重要的酶学参数,它反映了底物与酶结合的亲和力。
KM值越小,表示底物与酶结合的亲和力越强,底物浓度较低时就能够达到较高的反应速率。
而KM值越大,表示底物与酶结合的亲和力较弱,需要较高的底物浓度才能达到较高的反应速率。
通过实验测定,我们可以得到碱性磷酸酶的KM值,进而了解其底物结合特性。
这对于研究碱性磷酸酶的功能和调控机制具有重要意义。
同时,通过比较不同底物的KM值,我们还可以了解底物对于碱性磷酸酶的亲和力差异,进一步揭示酶底物特异性的原理。
除了测定KM值,我们还可以通过其他实验方法来研究碱性磷酸酶的功能和特性。
例如,可以通过测定酶的最适温度和最适pH值来了解酶的适应范围。
此外,还可以通过测定酶的抑制剂对酶活性的影响来研究酶的抑制机制。
这些实验方法的综合应用可以更全面地了解碱性磷酸酶的生物学功能。
综上所述,碱性磷酸酶KM值的测定是研究酶特性和功能的重要手段之一。
碱性磷酸酶km值测定实验报告

碱性磷酸酶km值测定实验报告碱性磷酸酶 Km 值测定实验报告一、实验目的1、掌握测定碱性磷酸酶(ALP)Km 值的原理和方法。
2、了解底物浓度对酶促反应速度的影响。
3、熟悉分光光度计的使用。
二、实验原理碱性磷酸酶是一种广泛分布于人体各脏器器官中的酶,在骨、肝、肠、胎盘等组织中含量较高。
它能催化磷酸酯的水解反应,产生无机磷酸和醇、酚等物质。
在酶促反应中,反应速度(v)与底物浓度S之间的关系可用米氏方程表示:v = VmaxS /(Km + S) ,其中 Vmax 为最大反应速度,Km 为米氏常数。
Km 值是酶的一个重要特征常数,它表示酶与底物的亲和力。
Km 值越小,酶与底物的亲和力越大;反之,Km 值越大,酶与底物的亲和力越小。
本实验通过测定不同底物浓度下的酶促反应速度,以反应速度 v 对底物浓度S作图,通过双倒数作图法(LineweaverBurk 作图法),即1/v 对 1/S作图,可求得碱性磷酸酶的 Km 值。
三、实验材料与仪器1、材料碱性磷酸酶提取液磷酸苯二钠溶液(不同浓度)01mol/L 氢氧化钠溶液004mol/L 碳酸钠溶液05mol/L 三氯乙酸溶液2、仪器分光光度计恒温水浴锅移液器试管、刻度吸管等四、实验步骤1、准备试剂配制不同浓度的磷酸苯二钠溶液:0005mol/L、001mol/L、002mol/L、003mol/L、004mol/L。
配制显色剂:将 01mol/L 氢氧化钠溶液和 004mol/L 碳酸钠溶液按4:1 的体积比混合。
2、反应体系设置取 7 支干净的试管,按下表加入试剂:|试管编号|1|2|3|4|5|6|7|||||||||||磷酸苯二钠溶液(mL)|000|020|040|060|080|100|_____||蒸馏水(mL)|100|080|060|040|020|000|_____||37℃预温5min 后,各加入05mL 碱性磷酸酶提取液,立即混匀,37℃水浴准确反应 15min||反应结束后,各加入 05mL 05mol/L 三氯乙酸溶液终止反应|3、显色与比色各管加入 45mL 显色剂,充分摇匀。
碱性磷酸酶米氏常数测定
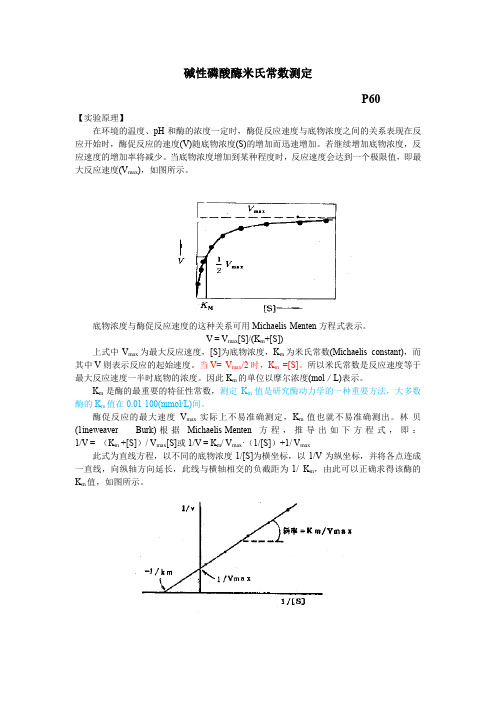
碱性磷酸酶米氏常数测定P60【实验原理】在环境的温度、pH和酶的浓度一定时,酶促反应速度与底物浓度之间的关系表现在反应开始时,酶促反应的速度(V)随底物浓度(S)的增加而迅速增加。
若继续增加底物浓度,反应速度的增加率将减少。
当底物浓度增加到某种程度时,反应速度会达到一个极限值,即最大反应速度(V max),如图所示。
底物浓度与酶促反应速度的这种关系可用Michaelis-Menten方程式表示。
V = V max[S]/(K m+[S])上式中V max为最大反应速度,[S]为底物浓度,K m为米氏常数(Michaelis constant),而其中V则表示反应的起始速度。
当V= V max/2时,K m=[S]。
所以米氏常数是反应速度等于最大反应速度一半时底物的浓度。
因此K m的单位以摩尔浓度(mol/L)表示。
K m是酶的最重要的特征性常数,测定K m值是研究酶动力学的一种重要方法,大多数酶的K m值在0.01-100(mmol/L)间。
酶促反应的最大速度V max实际上不易准确测定,K m值也就不易准确测出。
林-贝(1ineweaver - Burk)根据Michaelis-Menten方程,推导出如下方程式,即:1/V = (K m +[S])/ V max[S]或1/V = K m/ V max·(1/[S])+1/ V max此式为直线方程,以不同的底物浓度1/[S]为横坐标,以1/V为纵坐标,并将各点连成一直线,向纵轴方向延长,此线与横轴相交的负截距为-1/ K m,由此可以正确求得该酶的K m值,如图所示。
本实验以碱性磷酸酶为例,测定不同底物浓度的酶活性,再根据Lineweaver-Burk法作图,计算其K m值。
可以作为碱性磷酸酶底物的物质很多,底物反应的酶对于不同的底物有不同的K m值。
本实验以磷酸苯二钠为底物,由碱性磷酸酶催化水解,生成游离酚和磷酸盐。
酚在碱性条件下与4-氨基安替比林作用,经铁氰化钾氧化,生成红色的醌衍生物,颜色深浅和酚的含量成正比。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
即[Et]=[ES],反应达最大速度
Vmax=K3[ES]=K3[Et]
(5)
将(5)代入(4)得米氏方程式:V=─V─m─a─x[S] Km + [S]
医学课件ppt
7
❖ Km值的推导
当反应速度为最大反应速度一半时
V
Vmax Vmax/2
Vmax 2
= Vmax[S] Km + [S]
Km=[S]
=
K2+K3 K1
(2)
令:
K2+K3 = Km (米氏常数) K1
则(2)变为: ([Et]-[ES]) [S] =Km [ES]
医学课件ppt
6
整理得:
[ES]=[─Et─][─S]
(3)
Km + [S]
将(3)代入(1) 得
V=─KK─3m[─E+─t][[SS]]
(4)
当底物浓度很高,将酶的活性中心全部饱和时,
吸光度的倒数作纵坐标以底物浓度的倒数作横坐标,按
Lineweaver-Burk作图法求出Km值。
医学课件ppt
17
【试剂】
1.酚试剂 2.2.5mmol/L磷酸苯二钠基质液
称取磷酸苯二钠635mg,用蒸馏水溶解后定容至1000ml, 加氯仿数滴以防腐,置于冰箱中可保存1年之久。 3.碱性缓冲液(pH-10.0)
2
相关E学原理 (一)米-曼氏方程式
酶促反应模式——中间产物学说
E+S
k1 ES k3 E + P
k2
中间产物
医学课件ppt
3
※1913 年 Michaelis 和 Menten 提 出 反 应 速 度
与底物浓度关系的数学方程式,即米-曼氏 方程式( Michaelis equation)。
V ── = Vmax[S] Km + [S]
Km
[S]
∴Km值等于酶促反应速度为最大反应速度一半时
的底物浓度,单位是mol/L。
医学课件ppt
8
(二)Km与Vmax的意义
Km值
① Km等于酶促反应速度为最大反应速度一半时的底物 浓度。
② 意义:
a) Km是酶的特征性常数之一; b) Km可近似表示酶对底物的亲和力; c) 同一酶对于不同底物有不同的Km值。
➢ 关系式为:V = K3 [E]
0
[E]
当[S]>>[E]时,Vmax = k3 [E]
酶浓度对反应速度的影响
医学课件ppt
14
温度对反应速度的影响
双重影响
温度升高,酶促反应速度 升高;由于酶的本质是蛋白质, 温度升高,可引起酶的变性,从 而反应速度降低 。
酶 2.0
活 性 1.5
最适温度 (optimum temperature):
EXPERIMENT 3
酶促反应动力学 研究方法介绍
碱性磷酸酶km值测 定
医学课件ppt
1
实验目的
学习环境因素对酶促反应速度的影响; 学习米氏方程及Km值得测定; 测量碱性磷酸酶km值;
实验原理
E的反应速度受到环境因素的影响,这些因素包 括底物浓度、E浓度、PH、温度、激活剂、抑止剂等
医学课件ppt
医学课件ppt
16
碱性磷酸酶km值的测定
以不同浓度的磷酸苯二钠作为碱性磷酸酶的底物,在最适条件 下(pH=10.0,37℃),准确反应15min。在碱性条件下产物酚可 以与酚试剂作用生成蓝色化合物,该蓝色化合物在650nm波长 比色,色泽深浅与光密度成正比。反应式如下:
然后,以吸光度直接表示不同底物浓度时的酶反应速度,即以
0.6
0.4
0.2
-
-
碱性缓冲液
1.0
1.0
1.0
1.0
1.0
1.0
混匀后,37℃水浴5min
碱性磷酸酶
0.1
0.1
0.1
0.1
0.1
-
混匀后,37℃水浴15min(准确计时)
酚试剂
1.0
1.0
1.0
1.0
1.0
1.0
碱性磷酸酶
-
-
-
-
-
0.1
酶促反应速度最快时的 环境温度。 * 低温的应用
医学课件ppt
1.0
0.5
0 20 30 40 50 60
温度 ºC
温度对淀粉酶活性的影响
15
pH对反应速度的影响
酶
最适pH
活
(optimum pH): 性
酶催化活性最大时
的环境pH。
胃蛋白酶
淀粉酶
胆碱酯酶
0
2
4
6
8 10 pH
pH对某些酶活性的影响
医学课件ppt
9
Vmax
定义:Vm是酶完全被底物饱和时的反应速度,与酶浓 度成正比。
意义:Vmax=K3 [E] 如果酶的总浓度已知,可从Vmax计算 酶的
转换数(turnover number),即动力学常数K3。
医学课件ppt
10
酶的转换数
定义 — 当酶被底物充分饱和时,单位时间内 每个酶分子催化底物转变为产物的分 子数。
1/V
1/Vmax
1/[S]
医学课件ppt
12
Hanes作图法
在林-贝氏方程基础上,两边同乘[S]
[S]/V
[S]/V=Km/Vmax + [S]/Vmax
Km/Vm
-Km
[S]
医学课件ppt
13
酶浓度对反应速度的影响
V
➢ 当[S]>>[E],酶可被 底物饱和的情况下,反 应速度与酶浓度成正比。
意义 — 可用来比较每单位酶的催化能力。
医学课件ppt
11
(三)Km值与Vmax值的测定
双倒数作图法(double reciprocal plot)
Vmax[S] V = Km+[S]
两边同取倒数
1/V=
Km Vmax
1/[S] + 1/Vmax -1/Km
林-贝氏(Lineweaver-Burk)方程
称取无水Na2CO3 6.36g和NaHcO3 3.36g,先以适量蒸馏 水溶解,再定容至1000ml。 4.碱性磷酸酶液
称取碱性磷酸酶lmg,加水3~4ml,置于冰箱可保存5周左右。
医学课件ppt
18
操作
试剂(ml)
1
2
3
4
5
6
2.5mM磷酸苯二钠
0.2
0.4
0.6
0.8
1.0
1.0
蒸馏水
0.8
[S]:底物浓度
V: 不同[S]时的反应速度
Vmax:最大反应速度(maximum velocity) Km:米氏常数(Michaelis constant)
医学课件ppt
4
米-曼氏方程式推导基于两个假设:
(1) E与S形成ES复合物的反应是快速平衡反应,而ES分 解为E及P的反应为慢反应,反应速度取决于慢反应即 V=k3[ES]。
(2) S的总浓度远远大于E的总浓度,因此在反应的初始
阶段,S的浓度可认为不变即[S]=[St]。
医学课件ppt
5
推导过程
稳态:是指ES的生成速度与分解速度相等,即 [ES]恒定。
K1 ([Et]-[ES]) [S]=K2 [ES] + K3 [ES]
整理得:
([Et]-[ES])[S] [ES]
