初中化学 溶质的质量分数练习题(含答案)
初中化学中考溶质质量分数试题汇编及答案解析

初中化学中考溶质质量分数试题汇编及答案解析选择题14.(2017·河池)(2分)一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比()A.溶质的质量分数减小B.溶质质量不变C.溶液质量不变D.由饱和溶液变为不饱和溶液【分析】根据题意,一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),不考虑溶剂的蒸发,则所得溶液中溶质的质量减少、溶剂的质量不变,结合饱和溶液与不饱和溶液的特征、溶质的质量分数等,进行分析判断.【解答】解:A、一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出,溶质的质量减少,溶剂的质量不变,则溶质的质量分数减小,故选项说法正确.B、一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出,溶质的质量减少,故选项说法错误.C、一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出,溶质的质量减少,溶剂的质量不变,则溶液质量减少,故选项说法错误.D、一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出,剩余溶液不能继续溶解硝酸钾,仍为饱和溶液,故选项说法错误.故选:A.【点评】本题难度不大,掌握饱和溶液降温结晶后溶液组成的变化是正确解答本题的关键.4.(2017·宁夏)下列关于水的说法正确的是()A.将黄河水过滤可得到纯净水B.溶质质量分数为95%的酒精溶液中溶质是水C.地球表面约71%被水覆盖,所以水资源不可能短缺D.活性炭有净化水的作用,但不能将硬水转化为软水10.(2017•辽阳)实验室配制50g溶质质量分数为6%的氯化钠溶液,下列做法正确的是()A.用托盘天平称取5g氯化钠B.用50ml量筒量取所需水的体积C.溶解氯化钠时,使用的玻璃仪器有量筒、玻璃棒D.将配制好的溶液装入广口瓶中,塞好瓶塞并贴上标签【分析】A、根据氯化钠的质量为:50g×6%=3g进行分析;B、根据量筒使用的原则进行分析;C、根据溶解氯化钠时,使用的玻璃仪器有烧杯、玻璃棒,量筒中不能配制溶液进行分析;D、根据液体应该装在细口瓶内进行分析.【解答】解:A、需要氯化钠的质量为:50g×6%=3g,所以应该用托盘天平称取3g氯化钠,故A错误;B、量筒使用的就近原则,需要水的质量为50g﹣3g=47g,合47mL,所以用50ml 量筒量取所需水的体积,故B正确;C、溶解氯化钠时,使用的玻璃仪器有烧杯、玻璃棒,量筒中不能配制溶液,故C错误;D、液体应该装在细口瓶内,故D错误.故选:B.【点评】本题主要考查了配制一定质量分数溶液的实验操作,难度不大,需要在平时的学习中加强记忆即可完成.4.(2017•荆州)实验室配制100g 10%的NaCl溶液,不需要用到的仪器是()A.酒精灯B.托盘天平C.胶头滴管D.烧杯【分析】实验室配制100g10%的NaCl溶液操作步骤分别是:计算、称量、溶解,根据各操作所需要使用的仪器,判断所列仪器是否需要.【解答】解:A、配制100g10%的NaCl溶液的过程中,不需要进行加热,则不需要使用酒精灯,该组仪器不合适,故选项正确.B、配制100g10%的NaCl溶液的过程中,托盘天平用于称取固体氯化钠,故选项错误.C、配制100g10%的NaCl溶液的过程中,量筒与胶头滴管用于准确量取水,故选项错误.D、配制100g10%的NaCl溶液的过程中,烧杯用于完成溶解操作,故选项错误.故选:A.【点评】本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、溶解)、所需的仪器是正确解答本题的关键.7.(2017•日照)在实验室中,配制质量分数为10%的NaOH溶液,用于制作“叶脉书签”,下列说法正确的是()A.将NaOH固体直接放在托盘上称量B.NaOH有强烈的腐蚀性,实验时最好戴防护眼镜C.溶解时玻璃棒的作用是搅拌,增大NaOH的溶解度D.若在量取水时俯视凹液面的最低处,则配制溶液的质量分数小于10%【分析】A、根据氢氧化钠具有强腐蚀性,不能直接放在托盘天平的托盘上称量,应该放在小烧杯中快速称量解答;B、根据实验时的注意事项解答;C、根据溶解时玻璃棒的作用解答;D、根据俯视凹液面的最低处会导致量取的水偏少,导致溶质的质量分数偏大解答.【解答】解:A、由于氢氧化钠具有腐蚀性,且容易潮解,称量氢氧化钠固体时应该放在小烧杯中快速称量,不能直接放在托盘天平的托盘上称量,故错误;B、NaOH有强烈的腐蚀性,实验时最好戴防护眼镜,以免发生事故,故正确;C、溶解时玻璃棒的作用是搅拌,增大NaOH的溶解速率,溶解度不变,故错误;D、俯视量筒凹液面的最低处会导致实际量取的水偏少,其他操作正确,则会导致溶质的质量分数偏大,大于10%,故错误;答案:B【点评】本题考查配制一定物质的量浓度的溶液的方法,题目难度不大,注意掌握配制一定物质的量浓度的溶液的操作方法,注意称量氢氧化钠时应该放在小烧杯中快速称量,氢氧化钠溶解后放出热量,必须冷却之后才能转移到容量瓶中.3.(2017•南通)“一定溶质质量分数的NaOH溶液的配制”实验操作示意图如下,其中正确的是()【分析】A、根据固体药品的取用方法进行分析判断.B、根据氢氧化钠具有腐蚀性,进行分析判断.C、根据量筒读数时视线要与凹液面的最低处保持水平进行分析判断.D、根据溶解操作的方法进行分析判断.【解答】解:A、取用固体粉末状药品时,瓶塞要倒放,应用药匙取用,不能用手接触药品,图中瓶塞没有倒放,图中所示操作错误.B、氢氧化钠具有腐蚀性,应放在玻璃器皿中称量,图中所示操作错误.C、量取液体时,视线与液体的凹液面最低处保持水平,图中俯视读数,操作错误.D、溶解时,用玻璃棒进行搅拌,以加快溶解速率,图中所示操作正确.故选:D.【点评】本题难度不大,熟悉一定溶质质量分数的溶液的配制的实验步骤、常见化学实验基本操作的注意事项是解答此类试题的关键.4.(2017山东省聊城市,题号4,分值2)下列关于溶液说法正确的是A.将氯化钠和植物油放入水中,充分搅拌后都能形成溶液B.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解D.配制50g16%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤【答案】D【解析】此题主要考查溶液的有关知识。
课题3-溶质的质量分数计算题(含答案)

溶质的质量分数计算题一、固体物质未完全溶解型1、20℃时,将50g NaCl放入100g水中,充分搅拌后所得NaCl溶液的溶质质量分数是(20℃时NaCl的溶解度为36g)二、结晶水合物溶于水型2、将10g胆矾溶解在90g水中,则所得溶液中溶质的质量分数为三、所加物质与水反应型3、将31g Na2O溶于69g水中,所得溶液中溶质的质量分数是多少?四、多种溶质型4、在常温下向100g 5%的氯化钠溶液中加入5g氯化钾粉末,完全溶解后,氯化钠溶液的溶质质量分数是五、将浓溶液加水稀释型5、把40g 30%的NaOH溶液加水至100g,取出其中的10g,这10g溶液中溶质的质量分数是六、与化学反应有关型6、向400g溶质的质量分数为4.9%的稀硫酸中加入足量的锌粒,充分反应后,求所得溶液中溶质的质量7、8g三氧化硫加入到92g水中完全溶解,求所得溶液的溶质质量分数?8、20℃向71g20%的硫酸钠溶液中加入30.6g氯化钡和氯化钠的混合物,反应恰好完全,求1、反应后所得溶液的溶质质量分数;2、将反应后的混合物过滤,所得滤渣的质量为多少g?(已知,20℃时,食盐的溶解度为36g)Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl9、含有杂质的5.5gNa2CO3固体投入36.5g10%的盐酸溶液中,刚好完全反应,求反应后所得溶液中溶质的质量分数?(假设杂质不参与反应)七、与溶解度有关10、已知氯化铵在30℃时的溶解度为45.8克。
30℃时将68.7克氯化铵配制成400克的溶液,通过计算:(2)若不饱和,为了使其饱和,可用下面的方法:①蒸发溶剂法:需蒸发多少克水才能成为饱和溶液?②加溶质法:需再加入多少克氯化铵,溶液才能成为饱和溶液?11、将下列物质各10g分别投入90g水中,使之充分溶解。
请比较下列4种情况下所得溶液中溶质质量分数的大小顺序(注:Ca(OH)2的溶解度不超过0.2g)。
A.Na2OB.NaClC.CuSO4·5H2OD.CaO12、现有500g20℃的A物质溶液,若保持温度不变,蒸发掉20g水后,有5gA 析出,若再蒸发掉20g水后,又有7gA 析出,则在20℃时A物质的溶解度是13、20℃时,将一定质量的NH4NO3完全溶解于100g水中,将所得溶液分成两等份,其中一份蒸发18.75g 水,可使溶液饱和,另一份加入36g NH4NO3也达饱和,求⑴20℃时, NH4NO3的溶解度。
中考化学真题 考点12 溶质质量分数 专题分类精选试题(含解析)

考点12 溶质质量分数一、选择题22.(苏州,第22题)如果配制6%的氯化钠溶液的溶质质量分数偏小,其原因是A .称取的氯化钠固体质量偏大B .转移称量好的氯化钠同体时,有少量洒落在桌面上C .量取水的体积偏小D .转移配制好的溶液时,有少量液体溅出【答案】B【解析】称取的氯化钠固体质量偏大、量取水的体积偏小,都会导致溶质质量分数偏大;转移称量好的氯化钠同体时,有少量洒落在桌面上,会导致溶质质量分数偏小;转移配制好的溶液时,有少量液体溅出,溶质质量分数不变。
21.(苏州,第21题)下列有关“配制50g 溶质质量分数为6%的氯化钠溶液”的操作错误的是A .使用托盘天平前,要先取下支撑托盘的垫圈,再调节天平平衡B .称取氯化钠前,要在天平两端的托盘上分别放质量相同的纸片C .移动游码使其右侧对齐3g 的刻度线,然后将氯化钠加到天平的右盘上D .取用规格为50mL 的量筒量取17mL 水,快到所需刻度时改用胶头滴管定容【答案】C【解析】称量药品质量时要将药品放在右盘,砝码放在左盘,故C 错误。
11. (江苏连云港,11题)右图是甲、乙、丙三种固体物质的溶解度曲线。
下列叙述错误..的是 A .t 1℃时,三种物质的溶解度大小顺序为:丙>乙>甲B .t 2℃时,甲、丙两种物质的溶液中溶质的质量分数相等C .若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲D .若要将组成在N 点的甲溶液转变为M 点的甲溶液,可以采用恒温蒸发溶剂的方法 【答案】B【解析】根据t1℃时的垂线可知,丙此时的溶解度最大、乙次之、甲最小,A 正确;t2℃时,要想比较甲、丙的溶质质量分数大小,还需指出溶液是饱和的,否则无法比较,B 错误;根据甲、乙的溶解度随温度变化的趋势可知,甲的溶解度受温度变化影响较大而乙受温度变化影响相对较小,因此可采用降温结晶的方法提纯甲,C 正确;比较N 点和M 点可知,M 点为t3℃时的饱和溶液,N 为该温度下的不饱和溶液,即D 选项要求在温度不变的条件下,将甲的不饱和溶液变饱和,可采用恒温蒸发溶剂或添加溶质的方法,D 正确。
2023年中考化学重点知识二轮专题练习28 溶质的质量分数(含答案)

一. 选择题1.在25℃时,向不饱和氯化钾溶液加入少量氯化钾固体至溶液刚好饱和,在这一过程中,下列各量:①溶液中水的质量,②溶液中溶质的质量,③溶液中氯化钾的质量分数,④25℃时氯化钾的溶解度,⑤氯化钾溶液的质量。
其中不变的是()A.①和④;B.②和③C.③和④D.④和⑤2.下列有关溶液的说法中,正确的是A.溶液不一定都是混合物B.将100g KCl饱和溶液蒸干得到25g固体,则KCl在该温度下的溶解度为25gC.常温下将饱和Ca(OH)2溶液加热到50℃,会使溶液由饱和变为不饱和D.从25%的H2SO4溶液中取出10mL,则取出溶液的质量分数仍为25%3.把100mL10%的氯化钠溶液稀释50倍,稀释后溶液中的溶质质量()A.减少50倍B.增加50倍C.不变D.减少5倍4.某溶液溶质的质量分数为10%,下面说法正确的是()①在100份质量溶液中含有10份质量溶质②在110份质量溶液中含有10份质量溶质③在100份质量溶剂中含有10份质量溶质④在90份质量溶剂中溶有10份质量溶质.A.①②B.③④C.②③D.①④5.某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是()A.②中溶液是饱和溶液B.③中溶液一定是不饱和溶液C.②③中溶液的溶质质量分数不相同D.③中溶液的溶质质量大于②中溶液的溶质质量6.如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点,根据图中已给信息判断下列说法错误的是()A.P点的含义是t1℃时,a与c的溶解度相等B.t2℃时,a、b、c三种物质溶解度由小到大顺序为c b aC.将t2℃时a、b两种饱和溶液降温到t1℃时,析出晶体的质量a大于bD.将t1℃时,a、c两种物质饱和溶液的温度升高到t2℃时,所得两种溶液的质量分数a大于c7.甲、乙、丙三种固体物质的溶解度曲线如图所示.下列叙述错误的是A.t1℃时,将等质量的甲、乙分别配成饱和溶液,所得溶液质量:甲>乙B.将t1℃时甲、丙的饱和溶液升温到t2℃,两种溶液中溶质的质量分数相等C.将t2℃时甲的饱和溶液变为t3℃时甲的饱和溶液,可以采用蒸发水的方法D.将t3℃时三种物质的饱和溶液恒温蒸发等量水后,析出溶质的质量:甲>乙>丙8.如图为甲、乙两种固体物质的溶解度曲线。
2019年中考化学专题练习-溶质的质量分数及相关计算含答案

2019备战中考化学专题练习(全国通用)-溶质的质量分数及相关计算(含答案)一、单选题1.将50g 98%的浓硫酸溶于450g水中,所得溶液中溶质的质量分数为()A. 9.8%B. 10.2%C. 10.8%D. 19.6%2.t℃时,甲物质的饱和溶液的溶质质量分数为15%,乙物质的溶解度为15g,丙物质的10g饱和溶液蒸干后可得1.5g丙.当这三种物质的饱和溶液的质量相等时,含溶质的质量多少的顺序是()A. 丙>甲=乙B. 甲>乙>丙C. 乙>甲=丙D. 甲=丙>乙3.如图是A、B、C三种物质的溶解度曲线.下列说法错误的是()A. C的溶解度随温度的升高而减小B. t2℃时A、B、C的溶解度大小为A=B>CC. t2℃时,A、C的饱和溶液降温到t1℃时,A、C两溶液中溶质的质量分数相等D. t1℃时,A的饱和溶液中溶质质量分数为20%4.向100g溶液质量分数为10%的氯化钠溶液中加入10g硝酸钾,并完全溶解,该溶液中氯化钠的溶质质量分数会()A. 变大B. 变小C. 不变D. 无法确定5.要使20℃时饱和氢氧化钙溶液的溶质质量分数发生改变,可采取的措施有()①升高温度至30℃;②降低温度至10℃;③加入10g水;④加入1g氢氧化钙;⑤加入1g氧化钙;⑥蒸发掉10g的水,再恢复温度到20℃.A. ①③④B. ②⑤⑥C. ①③⑤D. ②④⑤6.向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤。
下列说法正确的是()①②③④⑤A. ②中A的质量分数最大B. ③⑤中A的质量分数相等C. ②④⑤的溶液为饱和溶液D. ①③④⑤中没有固体存在7.已知20℃时100g水中最多能溶解36g氯化钠。
20℃时向100g水中加50g氯化钠,充分溶解后,所得溶液中溶质的质量分数为()A. 36%B. 50%C. 33.3%D. 26.5%二、填空题8. 现有1000g溶质质量分数为10%的氯化钠溶液,其中所含溶质的质量是________g;若将此溶液稀释为4%的稀溶液,需加水________g。
初中化学溶质的质量分数练习题(含答案)
初中化学溶质的质量分数练习题(含答案)第九单元溶液(溶质的质量分数)同步练习1.溶液质量分数是表⽰的⼀种⽅法,其数学意义是之⽐。
现有溶质质量分数为20%的氯化钠溶液,其20%表⽰的含义就是每g氯化钠溶液中含有g。
2、将30g氯化钠溶于70g⽔中,制取氯化钠溶液,则氯化钠溶液中溶质的质量分数是。
3、100g 溶质质量分数为20%的硫酸溶液中含H2SO4g,⽔g;100毫升20%的硫酸溶液(密度 1.14g/mL)的质量是,其中含溶质H2SO4g,含溶剂⽔g。
4、现有80g 质量分数为10% 的硝酸钠溶液,试回答下列问题:(1)上述硝酸钠溶液中含溶质的质量为,溶剂的质量为。
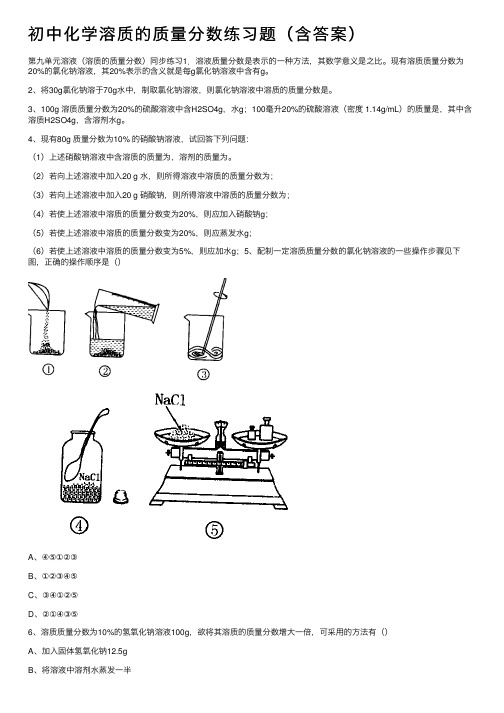
(2)若向上述溶液中加⼊20 g ⽔,则所得溶液中溶质的质量分数为;(3)若向上述溶液中加⼊20 g 硝酸钠,则所得溶液中溶质的质量分数为;(4)若使上述溶液中溶质的质量分数变为20%,则应加⼊硝酸钠g;(5)若使上述溶液中溶质的质量分数变为20%,则应蒸发⽔g;(6)若使上述溶液中溶质的质量分数变为5%,则应加⽔g;5、配制⼀定溶质质量分数的氯化钠溶液的⼀些操作步骤见下图,正确的操作顺序是()A、④⑤①②③B、①②③④⑤C、③④①②⑤D、②①④③⑤6、溶质质量分数为10%的氢氧化钠溶液100g,欲将其溶质的质量分数增⼤⼀倍,可采⽤的⽅法有()A、加⼊固体氢氧化钠12.5gB、将溶液中溶剂⽔蒸发⼀半C 、加⼊100g10%的氢氧化钠溶液D 、蒸发掉50g ⽔E 、加⼊50g40%的氢氧化钠溶液7、将m g 硝酸钾的不饱和溶液恒温蒸发⽔分⾄有晶体析出,在此变化过程中溶液⾥溶质质量分数 p % 与时间t 的关系正确的是()8、在45g20%的KCl 溶液中加⼊ 8g KCl 后再加⼊14g ⽔,所得溶液恰好为20℃的饱和溶液,则所得溶液中溶质的质量分数为。
9、下图是某同学配制⼀定质量的0.9%⽣理盐⽔的全过程:(1)请找出上图中的错误:①;②。
人教版九年级化学全一册第九单元课题3第1课时溶质的质量分数及其计算练习及答案

人教版九年级化学全一册课题3溶液的浓度第1课时溶质的质量分数及其计算1.在实验操作中如果不慎将少量浓硫酸沾到皮肤上,应立即用大量的水冲洗,然后涂上4%左右的碳酸氢钠溶液。
配制200 g质量分数为4%的碳酸氢钠溶液,需要碳酸氢钠的质量为()A.4 gB.8 gC.192 gD.200 g2.下列有关溶液的说法正确的是()A.将植物油与水混合,得到的是溶液B.配制溶液时,搅拌可以增大溶质的溶解度C.将10%的KNO3溶液倒出一半,剩余溶液中溶质的质量分数为20%D.将25 g KCl溶液蒸干得到5 g KCl固体,则原溶液中溶质的质量分数为20%3.用质量分数为98%(密度为1.84 g·mL-1)的浓硫酸配制500 mL 质量分数为20%的稀硫酸(密度为1.14 g·mL-1),稀释时需用水的体积约为()A.436.8 mLB.453.7 mLC.456.0 mLD.458.3 mL4.★如图为四种物质的溶解度曲线。
则下列说法错误的是()A.当温度为10 ℃时,物质溶解度关系为①>③>②>④B.若NH4H2PO4中混有少量NaCl杂质,可在较高温度配成饱和溶液,再降温结晶C.在10 ℃时把NH4H2PO4和Ce2(SO4)3的饱和溶液升温到30 ℃,有晶体析出的是Ce2(SO4)3D.22 ℃时,(NH4)2HPO4饱和溶液的质量分数约为70%5.20 ℃时,对100 g 5%的食盐溶液作了如下处理,求所得溶液中溶质的质量分数(假设每次所得溶液中无溶质析出或剩余)。
(1)蒸发10 g水后,溶质的质量分数为。
(2)加入10 g食盐后,溶质的质量分数为。
(3)增加10 g食盐和10 g水后,溶质的质量分数为。
(4)加入100 g 15%的食盐溶液后,溶质的质量分数为。
6.★在初中化学中,我们学习了溶液的有关知识。
右图是KNO3的溶解度曲线。
(1)从该溶解度曲线可以得到的信息是(写一条)。
甘肃省平凉市第七中学2020年九年级化学专题复习《溶质的质量分数》选择题专项练习(有答案)

《溶质的质量分数》选择题专项练习1.将100g 98%的浓硫酸注入900g水中,所得稀硫酸中溶质的质量分数为()A.9.8%B.10.0% C.10.9% D.11.1%2.农业生产上常用溶质质量分数为16%的氯化钠溶液来选种,对该溶液的认识正确的是( )A.溶液中含16 g氯化钠B.溶液质量为100 gC.每100 g溶液中含16 g氯化钠D.每100 g水中含16 g氯化钠3.下列氯化钠溶液,其溶质的质量分数不等于15%的是( )A.100 g水中溶解15 g氯化钠B.氯化钠与水按15∶85的质量比形成的溶液C.100 g 溶液中含15 g氯化钠D.30 g氯化钠溶解于170 g水中所形成的溶液4.如图表示一杯刚配制的饱和蔗糖溶液,要增加该溶液中溶质的质量分数,下列操作正确的是( )A.降温 B.升温C.加糖 D.搅拌5.某温度时,将20 g KNO溶解在100 g水中恰好饱和。
关于该饱和溶液的叙述3正确的是( )A.m(溶质)∶m(溶剂)=20∶120B.溶质的质量分数为20%C.升温后,溶质的质量分数增大D.降温后,溶质质量分数减小6. 20℃时,有质量分数为5%的食盐溶液A和质量分数为26.47%的食盐溶液B,下列有关A、B两种食盐溶液的判断正确的是()A.向m g溶液B中加入x g食盐,振荡后,溶液的质量不变,则食盐在20℃时的溶解度为36B.等质量的A、B中,溶剂质量:B>AC.m g溶液B中的溶质质量为100m/26.47 gD.向m g溶液A中加入x g食盐,振荡后,溶液的质量>m g7. 按下列方法配制的溶液,其溶质质量分数为5%的是()A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌B.称取5.0g生石灰,放入95mL水中,充分搅拌C.量取5.0mL浓盐酸,倒入95mL水中,充分搅拌D.称取5.0g二氧化锰,放入95mL水中,充分搅拌8.一种抗生素为粉末状固体,每瓶含0.5g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水()A. 1.5mLB. 2mLC. 3mLD. 4mL9. 每天补充适量的维生素C,有利于提高人体免疫力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第九单元溶液(溶质的质量分数)同步练习1.溶液质量分数是表示的一种方法,其数学意义是之比。
现有溶质质量分数为20%的氯化钠溶液,其20%表示的含义就是每g氯化钠溶液中含有g。
2、将30g氯化钠溶于70g水中,制取氯化钠溶液,则氯化钠溶液中溶质的质量分数是。
3、100g 溶质质量分数为20%的硫酸溶液中含H2SO4g,水g;100毫升20%的硫酸溶液(密度 1.14g/mL)的质量是,其中含溶质H2SO4g,含溶剂水g。
4、现有80g 质量分数为10% 的硝酸钠溶液,试回答下列问题:
(1)上述硝酸钠溶液中含溶质的质量为,溶剂的质量为。
(2)若向上述溶液中加入20 g 水,则所得溶液中溶质的质量分数为;
(3)若向上述溶液中加入20 g 硝酸钠,则所得溶液中溶质的质量分数为;
(4)若使上述溶液中溶质的质量分数变为20%,则应加入硝酸钠g;
(5)若使上述溶液中溶质的质量分数变为20%,则应蒸发水g;
(6)若使上述溶液中溶质的质量分数变为5%,则应加水g;5、配制一定溶质质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作顺序是()
A、④⑤①②③
B、①②③④⑤
C、③④①②⑤
D、②①④③⑤
6、溶质质量分数为10%的氢氧化钠溶液100g,欲将其溶质的质量分数增大一倍,可采用的方法有()
A、加入固体氢氧化钠12.5g
B、将溶液中溶剂水蒸发一半
C 、加入100g10%的氢氧化钠溶液
D 、蒸发掉50g 水
E 、加入50g40%的氢氧化钠溶液
7、将m g 硝酸钾的不饱和溶液恒温蒸发水分至有晶体析出,在此变化过程中溶液里溶质质量分数 p % 与时间t 的关系正确的是
( )
8、在45g20%的KCl 溶液中加入 8g KCl 后再加入14g 水,所得溶液恰好为20℃的饱和
溶
液
,
则
所
得
溶
液
中
溶
质
的
质
量
分
数
为 。
9、下图是某同学配制一定质量的0.9%生理盐水的全过程:
(1)请找出上图中的错误:
① ;② 。
(2)如果配制的生理盐水中NaCl 的质量分数小于0.9%,则可能造成误差的原因有(至少举出三点)
①
②
③
10、汽车、电机车一般要使用铅酸蓄电池。
某铅酸蓄电池用的酸溶液是溶质质量分数为28%的稀硫酸,现用 1 L 溶质质量分数为98%的浓硫酸(密度为1.84g/cm 3)配制该稀硫酸。
问:
⑴1 L 溶质质量分数为98%的浓硫酸的质量为 ,其中溶质的质量为 。
⑵将1 L 溶质质量分数为98%的浓硫酸配制成28%的稀硫酸,需要蒸馏水(密度为1g/cm 3) L ,配得稀硫酸的质量为 kg 。
11、根据氯化钠和硝酸钾的溶解度表,回答下列问题:
t
p%
A
t
p%
B
t 0
p%
C
t
p%
D
10℃20℃30℃40℃50℃60℃70℃NaCl35.8g36.0g36.3g36.6g37.0g37.3g37.8g
KNO320.9g31.6g45.8g63.9g85.5g110g138g
⑴通过分析上表数据,你有哪些发现?
⑵写出KNO3和NaCl具有相同溶解度时的温度范围(限表中相邻两个温度之间)
⑶在50℃时,100g水中加入90gKNO3,充分搅拌所得溶液质量为。
⑷在10℃时,NaCl饱和溶液溶质的质量分数KNO3饱和溶液溶质的质量分数。
(填“大于”、“等于”或“小于”)
12、现有24%的硝酸钾溶液、2%的硝酸钾溶液、硝酸钾固体和水。
请选用上述不同的物质配制10%的硝酸钾溶液,将用量的最简整数比填入下表中相应的位置。
24%硝酸钾溶液2%硝酸钾溶液硝酸钾固体水示例 4 7
方案1
方案2
方案3
【参考答案】
1、溶质质量与溶液质量之比,,100,溶质氯化钠20
2、30%
3、20,80,114g,22.8,91.2
4、⑴8g,72g ;⑵8%;⑶28%;⑷10;⑸40;⑹80
5、A
6、ADE
7、C
8、25.4%
9、⑴①广口瓶塞放反了(或瓶塞放反了);②砝码和药品放反了
⑵[提示:这是一道开放性试题,可以从不同的侧面回答]
计算错误如:①水算多了;②氯化钠算少了;
称量氯化钠操作错误如:③天平读数有误;④氯化钠和砝码放反了;⑤左盘放了纸片,右盘未放纸片;⑥天平未调零等;
用量筒量取水时错误如:⑦水量多了(或量取水读数时仰视);⑧氯化钠中混有杂质;⑨烧杯中有水等。
10、(1)1840g,1803.2g 4.6L 6.44kg
11、⑴①氯化钠的溶解度随温度的升高而增大,但变化不明显;
②硝酸钾的溶解度随温度的升高而增大,但变化非常显著。
⑵20℃~30℃。
⑶185.5g。
⑷大于。
12、
24%硝酸钾溶
2%硝酸钾溶液硝酸钾固体水
液
方案1 1 9
方案2 5 7
方案3 45 4
13、(1)计算:所需高锰酸钾的质量为400g×0.5%=2g,所需水的质量为400g-2g=398g,相当于398mL水。
(2)称量:用天平称取2g高锰酸钾,放入500mL大烧杯中,用量筒量取398mL水,倒入盛有2g高锰酸钾的烧杯中。
(3)溶解:用玻璃棒搅拌,使高锰酸钾完全溶解即可。
14、分三次漂洗好。
提示:用4500g水一次漂洗“拧干”的湿衣服上含有洗涤剂的质量为:。
分三次漂洗,第一次漂洗“拧干”的湿衣服上留有洗涤剂的质量为:
第二次漂洗“拧干”的湿衣服上留有洗涤剂的质量为:第三次漂洗“拧干”的湿衣服上留有洗涤剂的质量为:。
