化工原理讲稿(下册)-应化第十一章萃取讲(2)
化工原理萃取知识2

qmF qmS qmE1 qmR N qmM
M点是F、S的和点,也是E1、RN的和点 确定 E
1
依F,S确定M,依M和
A
RN ,确定
E
1
利用杠杆定律:
qmE 1 MRN E1 RN qmM
F E1
qmR N qmM qmE1
RN M
S
R’N B
qmE1 qmF qmS qmR N qmD
注意: E1和 RN 不是共轭相
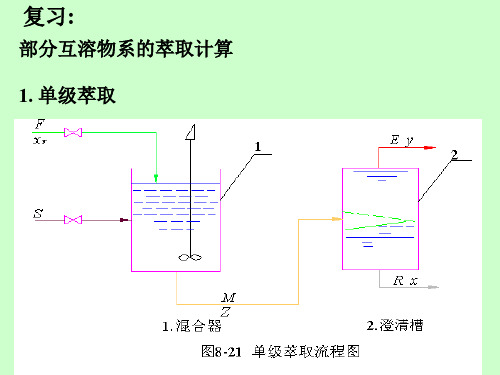
2.各级的物料衡算 第一级
qmF qmE 2 qmR1 qmE1 qmE1 qmF qmE 2 qmR1
第二级 第 N级
qmE 2 qmR1 qmE3 qmR2
……………………
qmE N qmR N 1 qmS qmR N
过S点作溶解度曲线的切线得点E,
求得R,得M点,于是得:
E
mS
MF MS
mF
对比:y’A与y’Amax
B S
可见: y’A<y’Amax
注意: 如果M点在两相区外相交,说明超出萃取
范围,不能进行萃取操作,由R1点确定的溶剂用量
为该操作条件下的最小溶剂用量m S,min
8.3.2 多级错流萃取 一、流程
D点移到无穷远时D=0,级联线互相平行。 ▴ qmS/qmF 再减小,F为E1和D的和点,D点落在三
角形相图左侧。净物流向右流动。
动画示意
如图, qmS/qmF
操作线斜率趋于联结线 到 ( qmS / qmF ) min 时,P 点
的斜率,当(qmS/qmF)
线重合,说明 E i
(夹紧点)所对应的两相联结线和级联
化工原理萃取实验讲义

实验九液-液萃取实验一、实验内容通过以水为萃取剂,萃取煤油中的苯甲酸,掌握传质单元高度的测定原理和方法。
二、实验目的⒈了解液-液萃取设备的一般结构和特点。
⒉熟悉液-液萃取操作的工艺流程,掌握液-液萃取装置的操作方法。
⒊学习和掌握液-液萃取塔传质单元数,传质单元高度及体积总传质系数的测定方法,分析外加能量对液-液萃取塔传质单元高度和通量的影响。
三、实验基本原理液液萃取(简称萃取)是以液体混合物分离为目的的常用化工单元操作,在石油炼制、化学工业和环境保护等部门有着广泛的应用,是除蒸馏以外最为常用的分离液体混合物用的单元操。
它是利用液体各组分在溶剂中溶解度的不同而进行液体混合物的分离,其基本过程如图9-1所示。
原料液中含有溶质A和溶剂B,为使A与B尽可能地分离,需选择一种溶剂,称为萃取剂S,要求它对A的溶解能力要大,而与原溶剂(稀释剂)B的相互溶解度愈小愈好。
萃取的第一步是使原料液与萃取剂在混合器中保持密切接触,溶质A将通过两液相间的界面由原料液向萃取剂中传递;在充分接触、传质之后,第二步是使两液相在分层器中因密度的差异而分为两层。
一层以萃取剂S为主,并溶有较多的溶质,称为萃取相;另一层以原溶剂B为主,还含有未被萃取完的部分溶质,称为萃余相。
若溶剂S和B为部分互溶,则萃取相中还含有B,萃余相中亦含有S。
当萃取相和萃余相达到相平衡时,则称上图中的设备为一个理论级。
萃取相和萃余相都是均相混合液,为了得到产品A,并回收溶剂S供循环使用,还需对它们作进一步的分离,通常是应用蒸馏;当溶质很难挥发时,也可采用蒸发。
由上可知,为了分离液体混合物,萃取的过程比蒸馏要复杂,但在遇到以下情况时,直接用蒸馏却不一定经济合理。
①当溶质A 的浓度很稀,特别是溶剂B 为易挥发组分时,以蒸馏法回收A 的单位热耗甚大。
这时可用萃取先将A 富集在萃取相,然后对萃取相进行蒸馏,因而使耗热量显著降低。
②当溶液是恒沸混合物或所需分离的组分沸点相近时,一般的蒸馏方法不适用。
化工原理(下)萃取

各组分的浓度本章均以质量%表示。
(也可用摩尔%) 三角形的三个顶点分别代表纯组 分A、B、S(100%); 三角形的三条边分别代表一个二 元物系,每边等分100份;
即:
xA+xB=1 或 xA+xS=1 或 xB+xS=1 三角形内任意一点代表一个三元混 合物 过M点做三条边的平行线
2、
结论:
1*
B、S物系一定,两相组成 一定,即:L、J点位置一定; B、S混合物的比例不同, 混溶点位置不同。 2* 若B、S完全不互溶, 则点L、J分别与三角形 的顶点B、S重合。
3*
溶解度曲线的“口”在哪条 边上,哪条边上的两组分 就为部分互溶 或完全不互溶。
如:制药工业中青霉素等的制备。 4、其他:稀有金属的提炼、环境
污染的治理等。
四、三元液—液萃取分类
(A与B是互溶的均相物系) 第Ⅰ类: A与B、S完全互溶, B、S为一对部分互溶组分: ( 此类物系的萃取相和萃余相 一般均为三组分溶液)
第Ⅱ类:
A、B完全互溶, B、S及A、S为两对部分互溶组分 以下主要讨论第Ⅰ类物系
关
第三节
萃取剂的选择 从以上分析可见,萃取剂的 性质和选择很重要。 对萃取剂要求: 既要分散好,又要分层快;与 B互溶度要小;回收要方便。这些 性质决定了该萃取剂能否工业化。
从以下几方面讨论: 一、选择性系数β:
(萃取剂选择性) 如前述,当kA>1、<1、=1 三种情况下均可萃取,但并没表 明S与B的互溶情况对萃取的影响, 我们希望萃取剂能尽可能多地溶 解A,尽可能少地溶解B,
二、三角形相图中的平衡关系: 1、溶解度曲线和连接线: (1)溶解度曲线:
化工原理第十一章液液萃取和固液萃取

E R
kA yA
xA
y
0 A
x
0 A
y
0 A
x
0 A
B
kB
yB xB
y
0 B
x
0 B
1
y
0 A
1
x
0 A
M
S
要求:1,
kA 越大越好,kB 越小越好。
原料液
萃取剂 S
S
A+B
xF
yA
萃取相 E
y0
萃取液 E A
A(大量),B(少量)
S+A+B 萃余相 R
x B+A+S A
S
x0
萃余液 R A B (大量),A(少量)
R R
B
第十一章 液液萃取和固液萃取
S
R,xR E,yE
R,xR E,yE
S
E M
S0
S
16/19
2.解析法
总: F S R E
溶质 A:FxA,F SyA,S RxA,R EyA,E
萃取剂 S:0 SyS,S RxS,R EyS,E
相平衡:k A
y A, E x A,R
kB
yB,E xB,R
幻灯片1目录
§11.1 概述 §11.2 液液相平衡关系及相图
浙江大学本科生课程 化工原理
第十一章 液液萃取和固液萃取
1/12
第十一章 液液萃取和固液萃取
§11.1 概述
1.什么是液液萃取?
利用液体混合物中各组分在外加溶剂中溶解度 的差异而分离该混合物的操作,称为~。外加 溶剂称为萃取剂。
浙江大学本科生课程 化工原理
FxF S 0 MxM
化工原理 第十一章-液液萃取

萃取的分类
(1)按组分数目分: 多元体系:原料液中有两个以上组分或溶剂为两种 不互溶的溶剂 三元体系:原料液中含有两个组分,溶剂为单溶剂
(2)按有无化学反应分:
物理萃取:萃取过程中,萃取剂与原料液中的有关 组分不发生化学反应 化学萃取 本章主要讨论三元体系的物理萃取。
石油化工学院---Department of Petroleum chemical Engineering
③ 混溶点: 曲线内为两相区,曲线外为单相区,曲线上的点称
为混溶点; ④ 临界混溶点(褶点) :共轭相的组成相同,其位置和物系有关; ⑤ 萃取相和萃余相: 以原溶剂为主的相称为萃余相,以溶剂为 主的相称为萃取相。
石油化工学院---Department of Petroleum chemical Engineering
石油化工学院---Department of Petroleum chemical Engineering
液液萃取的应用
1、在石油化工中的应用 随着石油化工的发展,液液萃取已广泛应用于分离各 种有机物质。轻油裂解和铂重整产生的芳烃混合物的分离是
重要的一例。该混合物中各组分的沸点非常接近,用一般的 分离方法很不经济。工业上采用 Udex 、Shell、 Formex等萃 取流程,分别用环丁砜、四甘醇、N-甲基吡咯烷酮为溶剂, 从裂解汽油的重整油中萃取芳烃。对于难分离的乙苯体系, 组分之间的相对挥发度接近于 1,用精馏方法不仅回流比大, 塔板还高达 300 多块,操作费用极大。可采用萃取操作以 HF-BF3 作萃取剂,从 C8 馏分中分离二甲苯及其同分异构体。
业中用TBP从发酵液中萃取柠檬酸也得到了广泛应用。可以 说,萃取操作已在制药工业、精细化工中占有重要的地位。
大学课件-化工原理下册-萃取2.2
(qms/qmF)
操作线斜率, 趋于分配曲线的斜率
(qmS/qmF) (qms/qmF)min-- 最小溶剂比
P点(夹紧点)所对应的两相联结线和级联线重合, yi=yi+1
夹紧点附近各级无分离能力,N
p
(2) 最小溶剂比的求法
Dmin的位置,既和平衡关系有关,又和分离要求有关。
R2 M2
R'3 R3
M3
B
S
8.3.3多级逆流萃取 一.流程:
二.特点
连续逆流操作,分离程度较高
三.计算
设计型问题:已知S的组成,qmF、xF,
规定 qmS/qmF (溶剂比)和分离要求RN',求N。
解法:每级内平衡
R i-1 i
Ei
Ri E i+1
Ei和Ri平衡,若能确定Ri组成xi和Ei+1组成yi+1之间的关系, 即可求得理论级数(逐级计算) 。
D''
qmS/qmF 较大
MS, D是E1和F的差点, 净物流向左流动, D点必在三角形相图右侧。
qms/qmF
MF, E1升高,D点远离S点。
qms/qmF
qmD=0, D点移到无穷远时, 级联线互相平行。
qms/qmF F为E1和D的和点, D点落在三角形相图左侧, 净物流向右流动。
3.逐级图解 (1)相图:Ri 和Ei互成平衡
已知F、S可确定M,由M、RN可确定E1 由 qmE1 qmF qmS qmRN qmD 可确定 D 点。
A
F
E1
R'N RN
M
D
B
S
由E1通过平衡关系确定R1,R1和D连线确定E2 , 如此交替 直至xi<xN, 则N为理论级数。
第11章:萃取
化工原理——萃取
④E、R脱除溶剂得E0、R0
F E 0 R0
E0
E0 FR 0 F R0 E 0
d
R0 R
E
C
化工原理——萃取
⑤
y0 max A
E
0
FC S x 0 min A F max SC
y0 max ⑥过S做切线Se得 A
e
d
x Amin
R0 R 0
化工原理——萃取
11.2 萃取过程的平衡关系
2.2 平衡相图——溶解度曲线
根据萃取操作中各组分的互溶性,将混合
液分成两类:
பைடு நூலகம்
① A完全溶于B及S,B与S不互溶
B与S部分互溶 ② A完全溶于B,A与S部分互溶 B与S部分互溶
Ⅰ类物系
√
Ⅱ类物系
化工原理——萃取
1.溶解度曲线与平衡连接线
均相区 临界混溶点(P): 两共轭相的组成无限趋近 而变为一相,表示这一组 成的点。 P 溶解度 曲线 联结线 两相区
S / F 较小
S / F 为某数值 化工原理——萃取
11.4 萃取设备
4.1 萃取设备的基本要求
两相充分的接触并伴有较高程度的湍动。
有利于液体的分散与流动。
有利于两相液体的分层。
化工原理——萃取
4.2 萃取设备的分类
项目 逐级接触式 微分接触式
无外加能量
脉冲
筛板塔
脉冲混合-澄清器 混合澄清器 夏贝尔塔
化工原理——萃取
第1级: F E2 R1 E1 即:
A
F E1 R1 E2
第2级:R1 E2 R2 E3 第N级: RN 1 E N RN S
化工原理课件12萃取(LiquidExtraction)

05
萃取过程的优化与改进
提高萃取效率的途径
选择合适的萃取剂
根据待分离物质的特点和分离要 求,选择具有高选择性、高溶解
度、低能耗的萃取剂。
优化萃取工艺参数
通过调整温度、压力、浓度等工 艺参数,提高萃取效率和分离效
果。
强化传质过程
采用多级萃取、逆流萃取等工艺, 增加萃取剂与待分离物质接触机
会,提高传质效率。
3
萃取技术的优化
根据不同天然产物的性质和目标成分,选择合适 的萃取剂和工艺条件,提高萃取效率和纯度。
THANKS
感谢观看
它由多个塔板组成,液体在塔 内逐板下降,同时与上升的气 体或液体逆流接触,实现传质 与分离。
塔式萃取器的优点是处理能力 大、分离效果好,但结构复杂、 造价高、操作维护困难。
离心萃取器
离心萃取器利用离心力的作用使两液 相实现分离。
离心萃取器的优点是处理能力大、分 离效果好、结构简单、操作方便,但 制造成本较高。
04
萃取过程的设备
混合-澄清槽
混合-澄清槽是一种简单的萃取 设备,适用于两相接触后能迅速
分离的情况。
它由一个混合室和一个澄清室组 成,混合室用于使不相溶的两液 相混合,澄清室则用于分离两液
相。
混合-澄清槽结构简单,操作方 便,但处理能力较小,且分离效
果不够理想。
塔式萃取器
塔式萃取器是一种常见的萃取 设备,适用于处理大量物料。
双水相萃取技术
利用两种水相间物质分配的差异,实现高效分离和纯化。
06
萃取过程的实例分析
工业废水处理中的萃取应用
工业废水中的有害物质
01
工业废水可能含有重金属、有机污染物等有害物质,对环境和
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、吸收的理论依据? 2、单组分吸收涉及的组分A、B、S的含义? 3、单组分吸收中气相由?组成,液相由?组成?
4、x、y、X、Y的含义?为何定义X、Y?
5、吸收溶解度曲线?T、p如何影响? 6.吸收过程的相平衡关系如何表达?
编辑ppt
1
第十一章 萃取 Extraction 第一节 概述 第二节 萃取的基本原理 第三节 萃取过程的计算
编辑ppt
12
四、应用场合-之三
热敏性物质的分离:
在生化制药的过程中,生成复杂 的有机液体混合物,这些物质大多为 热敏性混合物。选择适当的溶剂进行 萃取,可避免受热损坏,提高有效物 质的收率。例如青霉素的生产,用玉 米发酵得到的含青霉素的发酵液,以 醋酸丁脂为溶剂,经过多次萃取得到 青霉素的浓溶液。
单元操作
液-液萃取 EXTRACTION
蒸馏 DISTILLATION 吸收 ABSORPTION
操作原理
利用组分在萃取剂中溶解 度不同分离液体混合物
利用组分的挥发度不同分 离液体混合物 利用组分溶解度不同分离 气体混合物
扩散方式
单向扩散
反向扩散 单向扩散
编辑ppt
10
四、应用场合-之一
沸点接近或相对挥发度接近于1的物系分离:
编辑ppt
21
一、三元组成的表示方法-解决方法
利用三角形……
A
A
A
M
B
M
S
B
SB
编辑ppt
M
S
22
一、三元组成的表示方法-△顶点
纯组分 (A、B、S)的表达
A
点A:xA=100%
点B:xB=100%
点S:xS=100%
B
S
编辑ppt
23
一、三元组成的表示方法-△三边
二元混合物(A+B,A+S,B+S)的表达
1
环己烷(A)与苯(B)常压沸点为80.73OC、 80.1OC,α→1,加入糠醛后,α可达到2.7。
编辑ppt
11
四、应用场合-之二
恒沸物分离:
乙醇-水二元 混合物相图
乙醇-水恒沸组成:乙醇 0.894 (mol%),乙醇/水≈9,加入苯,形 成三元恒沸物,乙醇:0.23; 水:0.226,乙醇/水≈1 。
A
A%
三角形任一边上的任一
点代表二元混合物,第三组
分的组成为0。
S%
边上任一点越靠近某一
顶点处,此顶点所代表的组
分在溶液中的浓度越大。
B
S
B%
编辑ppt
24
一、三元组成的表示方法-△内部
三元混合物M(A+B+S)的表达
A
M点:xA =0.4
xB =0.3 xS =0.3
M N
B
S
编辑ppt
25
一、三元组成的表示方法-总结
含稀释剂B多的一相 (B+A少+SR)称为萃余相 (Raffinate ),以R表示。 A的含量以xA表示
E
萃取相
yA R
萃余相
xA
沉降分离
编辑ppt
7
二、简单的萃取过程-脱除溶剂
萃取液E’
萃取相 萃余相
SE
S 脱除溶剂
SR
萃余液R’
萃取相和萃余相脱溶剂后分别得萃取液(Solvent-
free extract, A+B少)和萃余液( Solvent-free raffinate ,B+A少),以E’和R’表示。
编辑ppt
19
一、三元组成的表示方法-问题的提出
yA yB 1 xA xB 1
yA yB 1
xA xS 1
yAyBys 1 xAxBxS 1
在精馏与吸收中
xA已知,xB=1-xA可知; yA已知,yB=1-yA可知
编辑ppt
20
一、三元组成的表示方法-问题的提出
三元物系平衡关系 如何表示?
编辑ppt
8
二、简单的萃取过程-总结
工业萃取过程由三个基本过程组成,即 (1)混合 采取措施使萃取剂和原料液充分混合,
实现溶质A由原溶液向萃取剂传递。 (2)沉降分离 进行萃取相E和萃余相R的分离。 (3)脱除溶剂 萃取相和萃余相脱溶剂得到萃取
液E’和萃余液R’,萃取剂循环使用。
编辑ppt
9
三、萃取过程特点-与蒸馏、吸收比较
溶解度大的组分称为溶质 (Solute ),以A表示;
不溶解或溶解度小的组分称为 稀释剂(Diluter/Diluting agent ),以B表示;
混合槽
编辑ppt
6
二、简单的萃取过程-沉降分离
含萃取剂S多的一相 (A+SE+B少)称为萃取相 (Extract ),以E表示。 A的含量以yA表示
编辑ppt
2
第一节 概述
一、萃取的理论依据 二、简单的萃取过程 三、萃取过程特点 四、应用场合 五、萃取剂S的选择
编辑ppt
3
一、萃取的理论依据
依据液体混合物中各组分在所选择的溶剂 中溶解度的差异分离液体混合物的单元操作 称为液-液萃取,也称溶剂萃取,简称萃取 (Extraction) 。
编辑ppt
4二、简单的萃取过程-工艺流程源自原料液F (A+B)
萃取剂 (S)
萃取相
E
萃余相
R
萃取液E’ -SE
S
-SR 萃余液R’
混合槽
沉降分离 脱除溶剂
编辑ppt
5
二、简单的萃取过程-混合
原料液由溶质A+稀释剂B组成; 选择(的Ex溶tr剂ac称ta为nt萃)取,剂以S表示;原(A料+液B)F
萃取剂 (S)
编辑ppt
17
五、萃取剂S的选择
其他:
萃取剂应满足一般的工艺要 求:稳定性好,腐蚀性小,无毒, 不易着火、爆炸,来源容易,价 格较低等。
编辑ppt
18
第二节 萃取的基本原理
一、三元组成的表示方法 二、物料衡算与杆杠定律 三、三元物系的相平衡关系
四、分配系数kA与选择性系数
五、萃取过程在三角形相图上的表示
编辑ppt
13
四、应用场合-之四
组分浓度低且为难挥发组分的分离:
以乙酸乙酯为萃取剂从 稀醋酸水溶液中回收醋 酸(90%左右)。
编辑ppt
14
五、萃取剂S的选择
选择性好:
编辑ppt
15
五、萃取剂S的选择
易回收:
编辑ppt
16
五、萃取剂S的选择
E、R易分相:
为使萃取相E与萃余相R能较快的分层,要求萃取剂S与 稀释剂B有较大的密度差。
纯物质— 三角形顶点 A、B、S 二元混合物—三角形的边AB、BS、SA
A
三元混合物—三角形内部的点M
如何确定点的坐标?
M
B
S
编辑ppt
26
作业
11.在逆流操作的吸收塔中,于l0l.3kPa(绝)、20℃下用清 水吸收空气-氨混合气中的氨。入塔混合气的流量为l000, 其中氨的分压为1.33kPa,操作条件下的平衡关系为 Y=0.753X。若吸收剂用量为理论最小用量的1.3倍,要求 吸收率为98%,试求操作液气比、吸收剂用量及出塔液相 组成。若操作压力改为202.6kPa(绝),而其他条件不变再 求操作液气比、吸收剂用量及出塔液相组成。
