《化工原理》下册第二章答案
化工原理第四版下册答案

化工原理第四版下册答案化工原理是化学工程专业的一门重要课程,它涉及到化工工艺、原理、设备等方面的知识。
本文将针对化工原理第四版下册的答案进行详细解析,希望能够帮助学习者更好地理解和掌握相关知识。
第一章,化工原理概述。
在化工原理概述这一章节中,主要介绍了化工原理的基本概念、发展历程以及与其他学科的关系。
通过学习这一章节,我们可以了解到化工原理的研究对象、研究内容以及其在化学工程领域中的地位和作用。
第二章,物质的结构与性质。
物质的结构与性质是化工原理中的重要内容,它涉及到物质的微观结构和宏观性质。
学习这一章节,我们可以了解到物质的基本结构、物质的性质与结构之间的关系,以及不同物质在化工过程中的应用。
第三章,化工热力学。
化工热力学是化工工程中的基础课程,它主要研究能量转化和能量传递的规律。
通过学习这一章节,我们可以了解到热力学基本概念、热力学定律、热力学过程等内容,从而为后续的化工工艺设计和优化提供理论支持。
第四章,化工动力学。
化工动力学主要研究化学反应速率、反应机理以及影响反应速率的因素。
通过学习这一章节,我们可以了解到化学反应速率方程、反应速率常数、反应动力学模型等内容,从而为工程实践中的反应器设计和控制提供理论指导。
第五章,化工流体力学。
化工流体力学是研究流体在化工过程中的运动规律和传热、传质等过程的科学。
学习这一章节,我们可以了解到流体的基本性质、流体流动的基本方程、流体的黏性等内容,从而为化工设备的设计和运行提供理论支持。
第六章,传质过程。
传质过程是化工工程中的重要环节,它涉及到物质在不同相之间的传递和分离。
通过学习这一章节,我们可以了解到传质的基本概念、传质系数、传质过程的数学模型等内容,从而为化工分离、萃取、吸附等过程的设计和优化提供理论指导。
第七章,化工过程动态。
化工过程动态研究的是化工过程中的动态行为和过程控制。
学习这一章节,我们可以了解到化工过程的动态特性、过程控制的基本原理、过程控制系统的设计与应用等内容,从而为化工生产过程的稳定运行和优化提供理论支持。
(完整word版)化工原理第二版(下册)夏清贾绍义课后习题解答带图资料

化工原理第二版夏清,贾绍义课后习题解答(夏清、贾绍义主编.化工原理第二版(下册).天津大学出版)社,2011.8.)第1章蒸馏1.已知含苯0.5(摩尔分率)的苯-甲苯混合液,若外压为99kPa,试求该溶液的饱和温度。
苯和甲苯的饱和蒸汽压数据见例1-1附表。
t(℃) 80.1 85 90 95 100 105x 0.962 0.748 0.552 0.386 0.236 0.11解:利用拉乌尔定律计算气液平衡数据查例1-1附表可的得到不同温度下纯组分苯和甲苯的饱和蒸汽压PB *,PA*,由于总压P = 99kPa,则由x = (P-PB *)/(PA*-PB*)可得出液相组成,这样就可以得到一组绘平衡t-x图数据。
以t = 80.1℃为例 x =(99-40)/(101.33-40)= 0.962 同理得到其他温度下液相组成如下表根据表中数据绘出饱和液体线即泡点线由图可得出当x = 0.5时,相应的温度为92℃2.正戊烷(C5H12)和正己烷(C6H14)的饱和蒸汽压数据列于本题附表,试求P = 13.3kPa下该溶液的平衡数据。
温度 C5H12223.1 233.0 244.0 251.0 260.6 275.1 291.7 309.3K C6H14248.2 259.1 276.9 279.0 289.0 304.8 322.8 341.9饱和蒸汽压(kPa) 1.3 2.6 5.3 8.0 13.3 26.6 53.2 101.3解:根据附表数据得出相同温度下C5H12(A)和C6H14(B)的饱和蒸汽压以t = 248.2℃时为例,当t = 248.2℃时 PB* = 1.3kPa查得PA*= 6.843kPa得到其他温度下A¸B的饱和蒸汽压如下表t(℃) 248 251 259.1 260.6 275.1 276.9 279 289 291.7 304.8 309.3PA*(kPa) 6.843 8.00012.472 13.30026.600 29.484 33.42548.873 53.200 89.000101.300PB*(kPa) 1.300 1.634 2.600 2.826 5.027 5.300 8.000 13.300 15.694 26.600 33.250 利用拉乌尔定律计算平衡数据平衡液相组成以260.6℃时为例当t= 260.6℃时 x = (P-PB *)/(PA*-PB*)=(13.3-2.826)/(13.3-2.826)= 1 平衡气相组成以260.6℃为例当t= 260.6℃时 y = PA*x/P = 13.3×1/13.3 = 1同理得出其他温度下平衡气液相组成列表如下t(℃) 260.6 275.1 276.9 279 289x 1 0.3835 0.3308 0.0285 0y 1 0.767 0.733 0.524 0 根据平衡数据绘出t-x-y曲线3.利用习题2的数据,计算:⑴相对挥发度;⑵在平均相对挥发度下的x-y数据,并与习题2 的结果相比较。
化工原理答案下册的.docx

化工原理第二版夏清,贾绍义课后习题解答(夏清、贾绍义主编 . 化工原理第二版(下册). 天津大学出版)社 ,2011.8. )第1 章蒸馏1.已知含苯 0.5 (摩尔分率)的苯 - 甲苯混合液,若外压为 99kPa,试求该溶液的饱和温度。
苯和甲苯的饱和蒸汽压数据见例1-1 附表。
t (℃) 80.1 859095100105x0.9620.7480.5520.3860.2360.11解:利用拉乌尔定律计算气液平衡数据查例 1-1 附表可的得到不同温度下纯组分苯和甲苯的饱和蒸汽压**,由P,PB A于总压P = 99kPa ,则由 x = (P-P***B )/(P A -P B )可得出液相组成,这样就可以得到一组绘平衡 t-x 图数据。
以 t = 80.1℃为例x = ( 99-40 )/ (101.33-40 )= 0.962同理得到其他温度下液相组成如下表根据表中数据绘出饱和液体线即泡点线由图可得出当 x = 0.5时,相应的温度为92℃2. 正戊烷( C5 H12)和正己烷( C6H14)的饱和蒸汽压数据列于本题附表,试求P =13.3kPa 下该溶液的平衡数据。
温度 C H223.1233.0244.0251.0260.6275.1 512291.7309.3K C6H14248.2259.1276.9279.0289.0304.8 322.8341.9饱和蒸汽压 (kPa) 1.3 2.6 5.3 8.0 13.3 26.653.2101.3解:根据附表数据得出相同温度下C5H12( A)和 C6H14(B)的饱和蒸汽压以 t = 248.2*= 1.3kPa ℃时为例,当 t = 248.2 ℃时 P B*查得 P A = 6.843kPa得到其他温度下 A?B 的饱和蒸汽压如下表t( ℃) 248251 259.1 260.6 275.1 276.9 279289 291.7304.8 309.3*P A (kPa) 6.843 8.00012.472 13.30026.600 29.484 33.42548.873 53.200 89.000101.300P B*(kPa) 1.300 1.634 2.600 2.826 5.027 5.300 8.000 13.300 15.694 26.600 33.250利用拉乌尔定律计算平衡数据平衡液相组成以260.6℃时为例当 t= 260.6***)℃时 x = (P-P B)/(P A-P B=( 13.3-2.826) / (13.3-2.826)= 1平衡气相组成以 260.6 ℃为例当 t= 260.6*×1/13.3 = 1℃时 y = P A x/P = 13.3同理得出其他温度下平衡气液相组成列表如下t( ℃ )260.6275.1 276.9 279289x10.38350.33080.02850y10.7670.7330.5240根据平衡数据绘出t-x-y曲线3.利用习题 2 的数据,计算:⑴相对挥发度;⑵在平均相对挥发度下的 x-y 数据,并与习题 2 的结果相比较。
(完整版)化工原理第二版(下册)夏清贾绍义课后习题解答带图

化工原理第二版夏清,贾绍义课后习题解答(夏清、贾绍义主编.化工原理第二版(下册).天津大学出版)社,2011.8.)第1章蒸馏1.已知含苯0.5(摩尔分率)的苯-甲苯混合液,若外压为99kPa,试求该溶液的饱和温度。
苯和甲苯的饱和蒸汽压数据见例1-1附表。
t(℃) 80.1 85 90 95 100 105x 0.962 0.748 0.552 0.386 0.236 0.11解:利用拉乌尔定律计算气液平衡数据查例1-1附表可的得到不同温度下纯组分苯和甲苯的饱和蒸汽压PB *,PA*,由于总压P = 99kPa,则由x = (P-PB *)/(PA*-PB*)可得出液相组成,这样就可以得到一组绘平衡t-x图数据。
以t = 80.1℃为例 x =(99-40)/(101.33-40)= 0.962 同理得到其他温度下液相组成如下表根据表中数据绘出饱和液体线即泡点线由图可得出当x = 0.5时,相应的温度为92℃2.正戊烷(C5H12)和正己烷(C6H14)的饱和蒸汽压数据列于本题附表,试求P = 13.3kPa下该溶液的平衡数据。
温度 C5H12223.1 233.0 244.0 251.0 260.6 275.1 291.7 309.3K C6H14248.2 259.1 276.9 279.0 289.0 304.8 322.8 341.9饱和蒸汽压(kPa) 1.3 2.6 5.3 8.0 13.3 26.6 53.2 101.3解:根据附表数据得出相同温度下C5H12(A)和C6H14(B)的饱和蒸汽压以t = 248.2℃时为例,当t = 248.2℃时 PB* = 1.3kPa查得PA*= 6.843kPa得到其他温度下A¸B的饱和蒸汽压如下表t(℃) 248 251 259.1 260.6 275.1 276.9 279 289 291.7 304.8 309.3PA*(kPa) 6.843 8.00012.472 13.30026.600 29.484 33.42548.873 53.200 89.000101.300PB*(kPa) 1.300 1.634 2.600 2.826 5.027 5.300 8.000 13.300 15.694 26.600 33.250 利用拉乌尔定律计算平衡数据平衡液相组成以260.6℃时为例当t= 260.6℃时 x = (P-PB *)/(PA*-PB*)=(13.3-2.826)/(13.3-2.826)= 1 平衡气相组成以260.6℃为例当t= 260.6℃时 y = PA*x/P = 13.3×1/13.3 = 1同理得出其他温度下平衡气液相组成列表如下t(℃) 260.6 275.1 276.9 279 289x 1 0.3835 0.3308 0.0285 0y 1 0.767 0.733 0.524 0 根据平衡数据绘出t-x-y曲线3.利用习题2的数据,计算:⑴相对挥发度;⑵在平均相对挥发度下的x-y数据,并与习题2 的结果相比较。
化工原理课后习题答案上下册(钟理版)
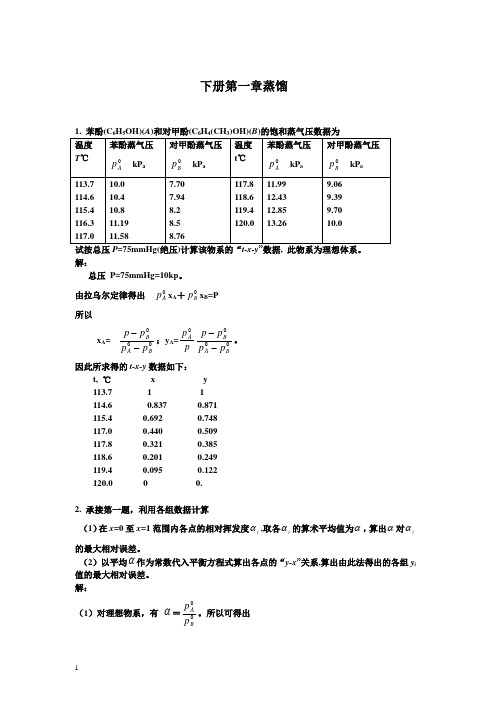
下册第一章蒸馏解:总压 P=75mmHg=10kp 。
由拉乌尔定律得出 0A p x A +0B p x B =P 所以 x A =000B A B p p p p --;y A =p p A 0000BA Bp p p p --。
因此所求得的t-x-y 数据如下:t, ℃ x y 113.7 1 1 114.6 0.837 0.871 115.4 0.692 0.748 117.0 0.440 0.509 117.8 0.321 0.385 118.6 0.201 0.249 119.4 0.095 0.122 120.0 0 0.2. 承接第一题,利用各组数据计算(1)在x=0至x=1范围内各点的相对挥发度i α,取各i α的算术平均值为α,算出α对i α的最大相对误差。
(2)以平均α作为常数代入平衡方程式算出各点的“y-x ”关系,算出由此法得出的各组y i 值的最大相对误差。
解:(1)对理想物系,有 α=00BAp p 。
所以可得出t, ℃ 113.7 114.6 115.4 116.3 117.0 117.8 118.6 119.4 120.0i α 1.299 1.310 1.317 1.316 1.322 1.323 1.324 1.325 1.326算术平均值α=9∑iα=1.318。
α对i α的最大相对误差=%6.0%100)(max=⨯-αααi 。
(2)由xxx x y 318.01318.1)1(1+=-+=αα得出如下数据:t, ℃ 113.7 114.6 115.4 116.3 117.0 117.8 118.6 119.4 120.0 x 1 0.837 0.692 0.558 0.440 0.321 0.201 0.095 0 y 1 0.871 0.748 0.625 0.509 0.384 0.249 0.122 0 各组y i 值的最大相对误差==∇iy y m ax)(0.3%。
化工原理下册答案

化工原理下册答案化工原理是化学工程专业的重要基础课程,它涉及到化工工程的基本原理和理论知识,对于学生来说是一门重要的课程。
下面是化工原理下册的答案,希望对大家的学习有所帮助。
第一章热力学基础。
1. 什么是热力学?热力学是研究能量转化和能量传递规律的科学,它是化工工程中不可或缺的基础理论。
2. 热力学第一定律的表达式是什么?热力学第一定律可以表达为ΔU = Q W,其中ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外界做功。
3. 热力学第二定律的内容是什么?热力学第二定律可以表述为热不可能自发地从低温物体传向高温物体,也可以表述为熵增原理。
第二章物质平衡。
1. 什么是物质平衡?物质平衡是指在化工过程中,各种物质在系统内的输入、输出和积累之间的平衡关系。
2. 如何计算物质平衡?计算物质平衡时,需要根据系统的输入和输出物质量来进行计算,确保输入和输出物质量达到平衡。
3. 物质平衡的应用范围有哪些?物质平衡在化工工程中有着广泛的应用,包括化工反应、化工装置设计等方面。
第三章能量平衡。
1. 能量平衡的基本原理是什么?能量平衡的基本原理是能量守恒定律,即能量不能被创造或者消失,只能从一种形式转化为另一种形式。
2. 能量平衡的计算方法有哪些?能量平衡的计算方法包括热平衡法、热效率法、热损失法等多种方法。
3. 能量平衡在化工工程中的应用有哪些?能量平衡在化工工程中有着重要的应用,可以用于热力学系统的分析和设计。
第四章流体力学。
1. 流体力学的基本概念是什么?流体力学是研究流体静力学、流体动力学和流体力学性能的科学。
2. 流体的黏度是什么?流体的黏度是指流体内部分子间相互作用的阻力,它是流体运动阻力的重要参数。
3. 流体的雷诺数是什么?流体的雷诺数是描述流体流动状态的一个重要无量纲参数,它可以用来判断流体流动的稳定性和不稳定性。
第五章传质过程。
1. 传质过程的基本原理是什么?传质过程是指物质在不同相之间传递的过程,它包括质量传递、热量传递和动量传递。
化工原理第二章习题及答案

第二章流体输送机械一、名词解释(每题2分)1、泵流量泵单位时间输送液体体积量2、压头流体输送设备为单位重量流体所提供的能量3、效率有效功率与轴功率的比值4、轴功率电机为泵轴所提供的功率5、理论压头具有无限多叶片的离心泵为单位重量理想流体所提供的能量6、气缚现象因为泵中存在气体而导致吸不上液体的现象7、离心泵特性曲线在一定转速下,离心泵主要性能参数与流量关系的曲线8、最佳工作点效率最高时所对应的工作点9、气蚀现象泵入口的压力低于所输送液体同温度的饱和蒸汽压力,液体汽化,产生对泵损害或吸不上液体10、安装高度泵正常工作时,泵入口到液面的垂直距离11、允许吸上真空度泵吸入口允许的最低真空度12、气蚀余量泵入口的动压头和静压头高于液体饱和蒸汽压头的数值13、泵的工作点管路特性曲线与泵的特性曲线的交点14、风压风机为单位体积的流体所提供的能量15、风量风机单位时间所输送的气体量,并以进口状态计二、单选择题(每题2分)1、用离心泵将水池的水抽吸到水塔中,若离心泵在正常操作范围内工作,开大出口阀门将导致()A送水量增加,整个管路阻力损失减少B送水量增加,整个管路阻力损失增大C送水量增加,泵的轴功率不变D送水量增加,泵的轴功率下降 A2、以下不是离心式通风机的性能参数( )A风量B扬程C效率D静风压 B3、往复泵适用于( )A大流量且流量要求特别均匀的场合B介质腐蚀性特别强的场合C流量较小,扬程较高的场合D投资较小的场合 C4、离心通风机的全风压等于( )A静风压加通风机出口的动压B离心通风机出口与进口间的压差C离心通风机出口的压力D动风压加静风压 D5、以下型号的泵不是水泵( )AB型BD型CF型Dsh型 C 6、离心泵的调节阀( )A只能安在进口管路上B只能安在出口管路上C安装在进口管路和出口管路上均可D只能安在旁路上 B 7、离心泵的扬程,是指单位重量流体经过泵后以下能量的增加值( )A包括内能在内的总能量B机械能C压能D位能(即实际的升扬高度)B8、流体经过泵后,压力增大∆p N/m2,则单位重量流体压能的增加为( )A ∆pB ∆p/ρC ∆p/ρgD ∆p/2g C9、离心泵的下列部件是用来将动能转变为压能( )A 泵壳和叶轮B 叶轮C 泵壳D 叶轮和导轮 C10、离心泵停车时要( )A先关出口阀后断电B先断电后关出口阀C先关出口阀先断电均可D单级式的先断电,多级式的先关出口阀 A11、离心通风机的铭牌上标明的全风压为100mmH2O意思是( )A 输任何条件的气体介质全风压都达100mmH2OB 输送空气时不论流量多少,全风压都可达100mmH2OC 输送任何气体介质当效率最高时,全风压为100mmH2OD 输送20℃,101325Pa空气,在效率最高时,全风压为100mmH2O D12、离心泵的允许吸上真空高度与以下因素无关( )A当地大气压力B输送液体的温度C流量D泵的吸入管路的长度 D13、如以∆h,允表示汽蚀余量时,p1,允表示泵入口处允许的最低压力,p v为操作温度下液体的饱和蒸汽压,u1为泵进口处的液速,则( )A p1,允= p v + ∆h,允B p1,允/ρg= p v/ρg+ ∆h,允-u12/2gC p1,允/ρg= p v/ρg+ ∆h,允D p1,允/ρg= p v/ρg+ ∆h,允+u12/2g B14、以下种类的泵具有自吸能力( )A往复泵B齿轮泵与漩涡泵C离心泵D旋转泵与漩涡泵 A15、如图示,列1--1与2--2截面的伯努利方程,为:H e=∆z+∆p/ρg+∆(u2/2g)+∑H f,1-2,则∆h f,1-2为( )A 泵的容积损失,水力损失及机械损失之和B 泵的容积损失与水力损失之和C 泵的水力损失D 测压点1至泵进口,以及泵出口至测压点2间的阻力损失D16、离心泵开动以前必须充满液体是为了防止发生( )A气缚现象B汽蚀现象C汽化现象D气浮现象A17、某同学进行离心泵特性曲线测定实验,启动泵后,出水管不出水,泵进口处真空计指示真空度很高,他对故障原因作出了正确判断,排除了故障,你认为以下可能的原因中,哪一个是真正的原因( )A水温太高B真空计坏了C吸入管路堵塞D排出管路堵塞C18、由阀门全开的条件算出在要求流量为V时所需扬程为H e/。
化工原理下册答案夏清

化工原理下册答案夏清化工原理是化学工程专业的重要课程之一,涉及到化工生产的基本原理和技术。
在学习化工原理的过程中,我们经常会遇到一些难题和疑惑,因此答案的获取就显得尤为重要。
下面我将为大家整理化工原理下册的答案,希望能够帮助大家更好地理解和掌握这门课程。
第一章,化工原理概述。
化工原理是化学工程专业的基础课程,主要介绍化工过程中的基本原理和基本技术。
在这一章中,我们学习了化工原理的基本概念和内容,包括化工过程的基本特点、热力学基本原理、物质平衡和能量平衡等内容。
通过学习这些知识,我们可以更好地理解化工过程中的各种现象和规律。
第二章,化工原理的基本原理。
在这一章中,我们学习了化工原理的基本原理,包括物质平衡和能量平衡的基本原理、化工过程中的热力学基本原理等内容。
通过学习这些知识,我们可以更好地掌握化工过程中的基本原理,为实际工程操作提供理论支持。
第三章,化工原理的应用。
在这一章中,我们学习了化工原理的应用,包括化工过程中的热力学计算、物质平衡和能量平衡的应用等内容。
通过学习这些知识,我们可以更好地应用化工原理解决实际工程中的问题,提高工程操作的效率和质量。
第四章,化工原理的发展趋势。
在这一章中,我们学习了化工原理的发展趋势,包括化工技术的发展趋势、化工原理的新理论和新技术等内容。
通过学习这些知识,我们可以更好地了解化工行业的发展方向,为未来的工作和学习提供参考。
总结:通过对化工原理下册的答案整理,我们可以更好地掌握化工原理的基本知识和原理,提高学习效率和学习质量。
希望大家能够认真学习,加强实践,不断提高自己的化工理论水平和实际操作能力。
祝大家学习进步,工作顺利!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单位面积上单位时间的水分蒸发量为
NA
DP RTZPBm
(PA1 PA2 )
DP RTZ
ln
PB 2 PB 1
2.6 105 101.33 8.314 2935 103
ln
101.33 101.33 2.3346
5.03106 kmol /(m2 s)
故液面下降速度:
d d
NA MA L
5.03106 18 9.07 108 m / s 998.2
.求算.
已知:
P NH3
0.987kPa
.相应的溶液浓度 CNH3
可用如下方法算出:
以 100g 水为基准,因为溶液很稀.故可近似认为其密度与水相同.并取其值为
1000kg / m3 .则:
CNH3
1/17 100 1
0.582kmol
/m3
1000
H
C NH 3
/ PNH3
0.582 0.987
解: 这是属于组分 ( A) 通过停滞组分的扩散。
已知扩散距离(静止空气膜厚度)为 Z 5103m .水层表面的水蒸气分压 (20C)
的饱和水蒸气压力为 PA1 2.3346kPa .
静止空气膜层以外;水蒸气分压为 PA2 0
D 2.6105m2 / s.P 101.33kPa.T 273 20 293K
(3)
x
P CO2
E
10.13 1.88 105
5.39 105
因 x 很小,故可近似认为 X x
X
5.39105
kmol(CO2 ) kmol(H 2O)
5.39
10
5
(
44) 18
kg(CO2 ) kg(H 2O)
1.318 10 4
kg(CO2 ) kg ( H 2O)
水层蒸干的时间:
h dh / d
5 10 3 9.07 108
2.205 104 s
6.125h
6. 试根据马克斯韦尔-吉利兰公式分别估算 0 ℃、101.33 kPa 时氨和氯化氢 在空气中的扩散系数 D (m2/s),并将计算结果与表 2-2 中的数据相比较。
解:(1). 氨在空气中的扩散系数. 查表 2.4 知道,空气的分子体积: VB 29.9cm3 / mol
ln
101.33 6.67 101.33 13.33
3.01105 kmol / m2 s
5. 一浅盘内存有 2 mm 厚的水层,在 20 ℃的恒定温度下逐渐蒸发并扩散 到大气中。假定扩散始终是通过一层厚度为 5 mm 的静止空气膜层,此空气膜层 以外的水蒸气分压为零。扩散系数为 2.60×10-5 m2/s,大气压强为 101.33 KPa。 求蒸干水层所需的时间。
(1) O2 与 CO 两种气体作等分子反向扩散。 (2) CO 气体为停滞组分。
解: (1) 等分子反向扩散时 O2 的传递速率:
NA
D RTZ
(PA1
PA2 )
D 0.185cm2 / s 1.8510 5m2 / s.
T 273K
P 101.325kPa.Z 0.2cm 210 3m
氨的分子体积: VA 25.8cm3 / mol
又知 M B 29g / mol.M A 17g / mol
PA1 13.33kPa .PA2 6.67kPa
NA
1.85 105 8.314 273 2 103
(13.33
6.67)
2.71 10 5 O2 通过停滞 CO 的扩散速率
NA
DP RTZPBm
(PA1 PA2 )
DP RTZ
ln
PB 2 PB 1
1.85105 101.33 8.314 273 2 103
化工原理第二章 吸收
1. 从手册中查得 101.33 KPa、25 ℃时,若 100 g 水中含氨 1 g,则此溶液上
方的氨气平衡分压为 0.987 KPa。已知在此组成范围内溶液服从亨利定律,试求 溶解度系数 H (kmol/ (m3·kPa))及相平衡常数 m。
解:(1) 求 H
由 PNH3
CNH3 H
0.590kmol
/(m 3 kPa )
y m x NH3
NH3 NH3
y NH3
P NH3 P
0.987 101.33
0.00974
(2).
求 m .由 xNH3
1/17 0.0105 1/17 100 /18
m
y NH3
/ xNH3
0.00974 0.0105
0.928
2. 101.33 kpa、10 ℃时,氧气在水中的溶解度可用 pO2=3.31×106x 表示。式
解:(1). 求 H 由 H 求算. EM H2O
H
EM H2O
1000 1.88105 18
2.955 104kmol
/(m 3 kPa)
(2). 求 m
m
E
1.88 105 506.6
371
(1) 当 y 0.02 时.100g 水溶解的 CO2
(2)
P CO2
506.6
0.02
10.13kPa
故100 克水中溶有 CO2 0.01318gCO2
4.在 101.33 kPa、0 ℃下的 O2 与 CO 混合气体中发生稳定的分子扩散过程。 已知相距 0.2 cm 的两截面上 O2 的分压分别为 13.33 kPa 和 6.67 kPa,又知扩散 系数为 0.185 cm2/s,试计算下列两种情况下 O2 的传递速率,kmol/(m2·s):
6.43 106
因 xO2 值甚小,故可以认为 X x
即: X O2 xO2 6.43106
所以:溶解度
6.43 10 6 118
32
1.14105 kg(O2)
/
kg ( H 2O)
11.4
g(O2 ) m3( H 2O)
3. 某混合气体中含有 2%(体积)CO2,其余为空气。混合气体的温度为 30 ℃, 总压强为 506.6 kPa。从手册中查得 30 ℃时 CO2 在水中的亨利系数 E=1.88x105 KPa,试求溶解度系数 H (kmol/(m3·kPa、))及相平衡常数 m,并计算每 100 克与该气体相平衡的水中溶有多少克 CO2。
中:PO2 为氧在气相中的分压,kPa、x 为氧在液相中的摩尔分数。试求在此温
度及压强下与空气充分接触后的水中,每立方米溶有多少克氧。
解: 氧在空气中的摩尔分数为 0.21 .故:
PO2 PyO2 101.33 0.21 21.28kPa
xO2
PO2 3.31106
21.28 3.3110 6
