大学无机化学经典课件第11章 f区元素
合集下载
无机化学课件:f 区元素

氧化态特征
镧系元素全部都能形成稳定的 + 3 氧化态。
La3+(4f 0), Gd3+(4f 7) 和 Lu3+(4f 14) 处于稳定结构, 获得 +2 和 +4 氧化态是相当困难的; Ce3+(4f 1) 和 Tb3+(4f 8) 失去一个电子即达稳定结构,因而出现 +4 氧 化态;Eu3+(4f 6) 和 Yb3+(4f 13) 接受一个电子即达稳定结 构,因而易出现 +2 氧化态 。
Chapter9 f-Block Elements
f 区元素
f区元素 在周期表 中的位置
镧系元素的电子构型和性质
元素 Ln电子组态 Ln3+电子组态 常见氧化态 原子半径/pm Ln3+半径 /pm EӨ/V
57La 4f 05d16s2
4f0
58Ce 4f 15d16s2
4f1
59Pr
4f 3 6s2
4. 镧系收缩
定 义 指镧系元素的离子半径随原子序数的增加 而依次减小的现象 。
原子半径/pm
210.0
Eu
205.0 200.0
Yb
195.0
190.0
185.0
180.0
175.0
170.0
165.0
160.0
55 57 59 61 63 65 67 69 71
原子序数
原子半径
Gd
离子半径
产生原因 随原子序数增大,电子填入4 f 层,f 电子
原子半径/pm
210.0 205.0 200.0 195.0 190.0 185.0 180.0 175.0 170.0 165.0 160.0
无机化学区过渡元素优秀课件

另一方面, 原子半径不是单 调地减小, 而是一条两峰一谷的 曲线。
造成这种两峰一谷的原因有三个:
其一为电子的精细结构, 即由于具有半充满 f 层(f7)的 Eu 和全充满 f 层(f14)的Yb 只用2个 6s2 电子形成金属键, 因 而键较弱、核间距较大, 故在Eu和Yb处出现两个峰值, 而Ce 平均用3.1个电子成键, 金属键较强, 其半径略小于Pr, 故在 Ce处微凹成一小谷。其余镧系元素均以三个电子成键, 故随 原子序数的增大, 半径均匀减小。
由于La到Lu的15个元素在物理性质、化学性质上的相 似性和连续性, 人们习惯上把La(4f0)到Lu(4f14)的15个元素 统称为镧系元素(简写为Ln),
同样地, 把Ac(5f0)到Lr(5f14)的15个元素统称为锕系 元素(简写为An)。这样, f区元素包含了由4f0到4f14的15 个镧系元素和由5f0到5f14的15个锕系元素。
La、Gd、Lu的构型可以 用f0、f7、f14(全空、半满和全 全满)的洪特规则来解释, 但Ce的结构尚不能得到满意的解释, 有 人认为是接近全空的缓故。
这两种电子结构可以用来说明镧系元素化学
性质的差异。
这些元素在参加化学反应时需要失去价电子, 由于4f轨道被外层电子有效地屏蔽着, 且由于 E4fE5d, 因而在结构为4fn6s2 的情况下, f电子要参 与反应, 必须先得由4f 轨道跃迁到 5d 轨道。这样, 由于电子构型不同, 所需激发能不同, 元素的化学 活泼性就有了差异。
10.1.1 镧系元素的价电子层结构
下表列出镧系元素在气态时和在固态时原子的电子层结构。
镧系元素气态原子的4f轨 道的充填呈现两种构型, 即4fn-1 5d16s2和4fn6s2, 这两种电子构型 的相对能量如左图所示。
造成这种两峰一谷的原因有三个:
其一为电子的精细结构, 即由于具有半充满 f 层(f7)的 Eu 和全充满 f 层(f14)的Yb 只用2个 6s2 电子形成金属键, 因 而键较弱、核间距较大, 故在Eu和Yb处出现两个峰值, 而Ce 平均用3.1个电子成键, 金属键较强, 其半径略小于Pr, 故在 Ce处微凹成一小谷。其余镧系元素均以三个电子成键, 故随 原子序数的增大, 半径均匀减小。
由于La到Lu的15个元素在物理性质、化学性质上的相 似性和连续性, 人们习惯上把La(4f0)到Lu(4f14)的15个元素 统称为镧系元素(简写为Ln),
同样地, 把Ac(5f0)到Lr(5f14)的15个元素统称为锕系 元素(简写为An)。这样, f区元素包含了由4f0到4f14的15 个镧系元素和由5f0到5f14的15个锕系元素。
La、Gd、Lu的构型可以 用f0、f7、f14(全空、半满和全 全满)的洪特规则来解释, 但Ce的结构尚不能得到满意的解释, 有 人认为是接近全空的缓故。
这两种电子结构可以用来说明镧系元素化学
性质的差异。
这些元素在参加化学反应时需要失去价电子, 由于4f轨道被外层电子有效地屏蔽着, 且由于 E4fE5d, 因而在结构为4fn6s2 的情况下, f电子要参 与反应, 必须先得由4f 轨道跃迁到 5d 轨道。这样, 由于电子构型不同, 所需激发能不同, 元素的化学 活泼性就有了差异。
10.1.1 镧系元素的价电子层结构
下表列出镧系元素在气态时和在固态时原子的电子层结构。
镧系元素气态原子的4f轨 道的充填呈现两种构型, 即4fn-1 5d16s2和4fn6s2, 这两种电子构型 的相对能量如左图所示。
无机化学 卤素和氧族元素-11.1-2概述+卤族元素

碘(I2) 固体 113.5 184.3
颜色* 浅黄 黄绿 红棕 紫黑
溶解度 分解水 在水中溶 易溶于 解度不大 有机溶剂
毒性
具有刺激性气味,并有毒
毒性减小
11.2.2 卤素单质
2.化学性质
氧化性
1 2
X2
+ e-
→ X-
F2 > Cl2 > Br2 > I2
电极电势:
F2/F- Cl2/Cl- Br2/Br- I2/I-
黄绿 紫 红棕 紫黑
溶解度 分解水 在水中溶 易溶于
解度不大 有机溶剂
I2易溶于碘化物(如KI)中→I3I2 + I- I3-
11.2.2 卤素单质
1.物理性质
氟(F2)
集聚状态 气体 熔点/℃ -219.6 沸点/℃ -188
氯(Cl2) 气体 -101 -34.6
溴(Br2) 液体 –7.2 58.76
P区元素的特点
(3)金属的熔点较低
0
ⅢA ⅣA ⅤA ⅥA ⅦA He 氦
2 B 硼 C 碳 N 氮 O 氧 F 氟 Ne 氖
3
Al 铝 660.4℃
Si 硅
4
Ga 镓 29.78 ℃
Ge 锗 973.4 ℃
P磷 As 砷
S 硫这C些l 氯金属Ar 氩 彼此可形成
Se 硒低B熔r 溴合金Kr 氪
5
In 铟 156.6 ℃
Sn 锡 231.9 ℃
Sb 锑 630.5
℃
Te 碲
I
碘 Xe 氙
6
Tl 铊 303.5 ℃
Pb 铅 327.5 ℃
Bi 铋 271.3 ℃
Po
At 砹 Rn 氡
无机化学ds区、d区和f区过度元素ppt课件

上页 下页 目录 返回
8.2 铜族和锌族化合物 8.2.1 概述 价电子构型: (n-1)d10ns1-2 对于铜族元素,又称IB族,可失去s上的电子,又可失 去d上电子,氧化数+1、+2、+3。常见的是:Cu→+2, Ag→+1,Au→+3。 因 IB 族离子具有较强的极化力,变形性也大,故其二 元化合物一般有相当程度的共价性,难溶于水。 对于ⅡB族,只能失去最外层2个电子,形成+2价化合 物。汞有+1(以双聚离子[Hg-Hg]2+形式存在) 从 Zn2+→Cd2+→Hg2+ 极化力和变形性依次增强,当与 易变形的阴离子形成的化合物,有相当程度的共价性, 所以Hg2+的这类化合物溶解度较小,且显色。
上页 下页 目录 返回
AgNO3: 最重要的可溶性银盐,Ag与65%HNO3,反应后制得, Ag+具有氧化性 。 遇光或加热易分解而析出银,注意保存在棕色瓶中。 2AgNO3→2Ag+2NO2+O2 AgI在人工降雨中作冰核形成剂 HgCl2: Hg取sp杂化,为共价化合物,直线构型。熔点较低 (280℃),易升华,故俗名升汞,能溶于水(25℃, 7g/100g水),有毒,稀溶液可杀菌,∴外科用作手术器 械的消毒剂。
无机化学ds区 、d区和f区过 度元素
8.1 过渡元素概述
8.1.1 基本划区 价电子构型:(n-1)d1-10ns1-2 铜族:货币元素 锌族:低熔点重金属;汞(常温下唯一的一种液体金属) 钒族:酸土元素 铁系元素 铂系元素 镧系元素和锕系元素
上页 下页 目录 返回
8.1.2 过渡元素的特性 ● 过渡元素都是金属 ● 许多元素形成多种氧化态 除了s电子参与成键,d电子也部分或全部参与成键( ⅡB族除外) ,从而导致丰富的氧化还原行为。 ● 过渡元素的水合离子多具有特征颜色 过渡元素的离子在水溶液中常呈现一定的颜色,这与该 离子存在未成对d电子有关, d-d跃迁,一般d0, d10没有颜 色。 ● 形成配合物的能力比较强 过渡元素的离子存在空的ns,np和部分填充或全空的(n1)d轨道,可接受配位体的出对孤对电子。
第11章 重要的生命元素

• 镁和钙的碳酸盐、硝酸盐、草酸盐和氢氧化物加 热,都可生成相应的氧化物。
• 氧化镁俗称苦土,是一种碱性白色粉末,难溶于 水,但可与水反应生成Mg(OH)2。氧化镁熔点约 为2850℃,可作耐火材料、润滑剂以及抑酸剂等 使用。
• 氧化钙俗称生石灰,是一种白色块状或粉末状碱 性放固出体 大。 量它 的微 热溶。于氧水化,钙可熔与点水为作26用15生℃成,C具a有(O强H)吸2, 湿性,可作耐火材料和干燥剂。
2. 钠和钾
(1)金属钠和钾 与水反应可释放出大量热 ;
(2) 氢氧化钠(钾) LiOH为中强碱外,其余均为强碱 ; 碱金属氢氧化物中以NaOH最重要。氢氧化钠又称
烧碱,它是实验室常用的重要试剂,也是重要的工 业原料。它能除去空气中的酸性物质如二氧化碳、 二氧化硫、二氧化氮、硫化氢等,NaOH易于融化, 能溶解某些金属氧化物和非金属氧化物,因此常用 于溶解矿物试样。
Fe Ca Mg K Ti
质量分数/% 1.50 1.48 1.39 1.08 0.22
11.1.2 元素的分类
1.金属和非金属元素
按长式周期表中硼—硅—砷—碲—砹和铝—锗— 锑—钋之间的对角线来区分。 位于对角线左下方的都是金属元素; 右上方的都是非金属元素。 对角线附近的锗、砷、锑、碲称为准金属元素。
11.1 元素概述
11.1.1 元素的分布
地球上天然存在的元素主要存在于岩石圈、水圈和 大气圈。
元素在地壳中的含量称为丰度,常用质量 分数表示。
11-1地球上分布最广的10种元素的质量分数
元素符号
O H Si Al Na
质量分数/% 52.32 16.95 1 6.67 5.53 1.95
元素符号
稀有元素也可继续分为:轻稀有金属、高熔点 稀有金属、分散稀有元素、稀有气体、稀土金属、 放射性稀有元素等。
• 氧化镁俗称苦土,是一种碱性白色粉末,难溶于 水,但可与水反应生成Mg(OH)2。氧化镁熔点约 为2850℃,可作耐火材料、润滑剂以及抑酸剂等 使用。
• 氧化钙俗称生石灰,是一种白色块状或粉末状碱 性放固出体 大。 量它 的微 热溶。于氧水化,钙可熔与点水为作26用15生℃成,C具a有(O强H)吸2, 湿性,可作耐火材料和干燥剂。
2. 钠和钾
(1)金属钠和钾 与水反应可释放出大量热 ;
(2) 氢氧化钠(钾) LiOH为中强碱外,其余均为强碱 ; 碱金属氢氧化物中以NaOH最重要。氢氧化钠又称
烧碱,它是实验室常用的重要试剂,也是重要的工 业原料。它能除去空气中的酸性物质如二氧化碳、 二氧化硫、二氧化氮、硫化氢等,NaOH易于融化, 能溶解某些金属氧化物和非金属氧化物,因此常用 于溶解矿物试样。
Fe Ca Mg K Ti
质量分数/% 1.50 1.48 1.39 1.08 0.22
11.1.2 元素的分类
1.金属和非金属元素
按长式周期表中硼—硅—砷—碲—砹和铝—锗— 锑—钋之间的对角线来区分。 位于对角线左下方的都是金属元素; 右上方的都是非金属元素。 对角线附近的锗、砷、锑、碲称为准金属元素。
11.1 元素概述
11.1.1 元素的分布
地球上天然存在的元素主要存在于岩石圈、水圈和 大气圈。
元素在地壳中的含量称为丰度,常用质量 分数表示。
11-1地球上分布最广的10种元素的质量分数
元素符号
O H Si Al Na
质量分数/% 52.32 16.95 1 6.67 5.53 1.95
元素符号
稀有元素也可继续分为:轻稀有金属、高熔点 稀有金属、分散稀有元素、稀有气体、稀土金属、 放射性稀有元素等。
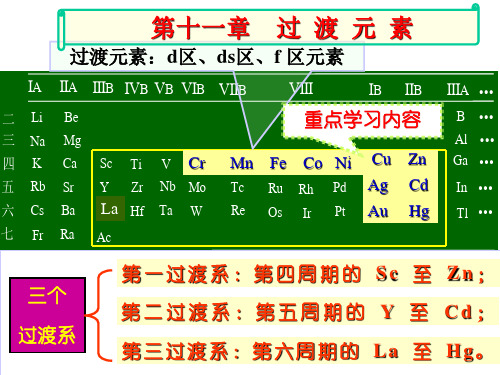
第11章 11.1-6过渡元素
Cr(OH)3+OH-
=Cr(OH)
4
高温灼烧后的Cr2O3既不溶于酸也不溶于碱, 但与酸性熔剂如焦硫酸钾K2S2O7共熔时,可转变 成可溶性铬(Ⅲ)盐:
亮绿色
共熔 Cr2O3 + 3K2S2O7 = Cr2(SO4)3 + 3K2SO4
亚铬酸盐的还原性 P328
在碱性溶液中,[Cr(OH)4]- 或 CrO2- 均有 较强还原性:
在弱碱性条件下,丁二酮肟与Ni2+可形成鲜红色螯合物沉淀
2 CH3 C
CH3 C
OH N
+ 2+
Ni N
OH
OH O
CH3 C N
2+
N C CH3
Ni
CH3 C
NOH
N O
C
CH3
+
2
+
H
定性分析中用于鉴定 P174
Cu2O P343、Cu(OH)2 P344主要化学性质
Cu2O溶于稀硫酸,立即发生歧化反应: Cu2O + H2SO4 = Cu2SO4 + H2O
若 MnO4- 过量: 2 MnO4- + 3Mn2+ + H2O = 5MnO2↓+ 4H+ B. 中性、微酸性或微碱性溶液中, MnO4- 还原产物是MnO2:
2MnO4- + 3SO32- + H2O = 2MnO2↓ + 3SO42- + 2OHC. 强碱性溶液中, MnO4- 过量时, 其还原产物是MnO42-:
合
乙醚
用于鉴定Co2+
物
硫氰配合物
Co2+ + 4SCN- =[Co(SCN)4]2- (宝石蓝色)
无机化学课件第十一章

I2(g) + H2(g) 催化剂,Δ 2 HI(g)
3. 存在、分离、性质
氟广泛存在于自然界 萤石(CaF2) 冰晶石(Na3AlF6) 氟磷灰石(Ca3(PO4)2CaCFCl)2
氯: 主要以海水和内地盐湖中的NaCl形式存在
溴,碘:以Na,K,Mg的无机盐形 式存在于海水中
分离:从卤化物中分离卤素单质
2 P(s) + 3 Br2(g) 2 P(s) + 5 I2(g)
2 PBr3(l) 2 PCl3(s)
(无色发烟) (红色)
与 H2 的反应 在低温下,暗处,F2 可与 H2 发生剧烈反应,放出大
量热,导致爆炸。
F2(g) + H2(g)
2 HF(g)
Cl2 在常温下与H2 缓慢反应, 但在紫外光照射下,可
1.强氧化性 F ,Cl ,Br ,I 能力依次减弱
2
2 22
2.与单质作用
F2 在任何温度下都可与金属直接化合,生成高价氟 化物。F2 与 Cu、Ni、Mg 作用时由于金属表面生成一层 致密氟化物保护膜而中止反应。所以 F2 可储存在 Cu、 Ni、Mg 或合金制成的容器中。
Cl2 可与各种金属作用,但干燥的 Cl2 不与 Fe 反应, 因此,Cl2 可储存在铁罐中。
烈。
2 S(s) + Cl2(g)
S2Cl2(l)
(红黄色液体)
S(s) + Cl2(g)(过量)
SCl2(l) (深红色发烟液体)
2 P(s) + 3 Cl2(g)
2 PCl3(l) (无色发烟液体)
2 P(s) + 5 Cl2(g)(过量)
2 PCl5(s) (淡黄色固体)
3. 存在、分离、性质
氟广泛存在于自然界 萤石(CaF2) 冰晶石(Na3AlF6) 氟磷灰石(Ca3(PO4)2CaCFCl)2
氯: 主要以海水和内地盐湖中的NaCl形式存在
溴,碘:以Na,K,Mg的无机盐形 式存在于海水中
分离:从卤化物中分离卤素单质
2 P(s) + 3 Br2(g) 2 P(s) + 5 I2(g)
2 PBr3(l) 2 PCl3(s)
(无色发烟) (红色)
与 H2 的反应 在低温下,暗处,F2 可与 H2 发生剧烈反应,放出大
量热,导致爆炸。
F2(g) + H2(g)
2 HF(g)
Cl2 在常温下与H2 缓慢反应, 但在紫外光照射下,可
1.强氧化性 F ,Cl ,Br ,I 能力依次减弱
2
2 22
2.与单质作用
F2 在任何温度下都可与金属直接化合,生成高价氟 化物。F2 与 Cu、Ni、Mg 作用时由于金属表面生成一层 致密氟化物保护膜而中止反应。所以 F2 可储存在 Cu、 Ni、Mg 或合金制成的容器中。
Cl2 可与各种金属作用,但干燥的 Cl2 不与 Fe 反应, 因此,Cl2 可储存在铁罐中。
烈。
2 S(s) + Cl2(g)
S2Cl2(l)
(红黄色液体)
S(s) + Cl2(g)(过量)
SCl2(l) (深红色发烟液体)
2 P(s) + 3 Cl2(g)
2 PCl3(l) (无色发烟液体)
2 P(s) + 5 Cl2(g)(过量)
2 PCl5(s) (淡黄色固体)
无机化学-11配位化合物

— — — t2g (dxy,dyz,dxz)
— — eg (dx2-y2,dz2)
+6Dq
5个d轨道
4Dq
01
02
03
04
05
06
*/90
四面体场中的能级分裂
*/90
— — — t2 (dxy,dyz,dxz)
*/90
配体与配位原子 配体 配合物内界之中,位于中心原子周围,并沿一定的方向与之直接形成配位键的离子或分子。 阴离子配体:SCN-、NCS-、CN-、OH-、NO2-、S2O32-、C2O42-、X-、NH2-、Y4-等; 中性分子配体:NH3、H2O、CO、en等。
*/90
配位原子
配位体中提供孤对电子,直接与中心原子结合的原子。 位于周期系p区的18个元素原子均能做配位原子。常见的有N,O,C,P,S和卤素原子。 一个配位体上可以有一个或多个配位原子和中心原子成键。
*/90
八面体场中中心离子5个d 轨道与配体的相对位置
*/90
成键方向对d轨道能级的影响
eg t2g
八面体场中5个d 轨道与配体的相对位置
*/90
自由离子
01
球形场
02
八面体场
03
八面体场中d轨道能级分裂
04
*/90
在Oh八面体配位场中d轨道的分裂
— — — — — ----------------
*/90
外轨型和内轨型配合物 外轨型配合物 中心原子提供的杂化轨道全部来自最外电子层,如sp,sp3,sp3d2杂化时。
*/90
[FeF6]3- sp3d2杂化 正八面体
*/90
内轨型配合物 中心原子提供的杂化轨道有一部分来自次外电子层,如dsp2,d2sp3杂化时。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(7) 能源:如储氢材料 LaNi5 (8) 原子能工业:Sm Gd Dy Lu强烈吸收中子,控制反应速度。
(9) 农业:氯化稀土,硝酸稀土制成
Ln(OH)3为离子型碱性氢氧化物,碱性比Ca(OH)2弱, 但比Al(OH)3强。
酸性 La(OH)3 → Lu(OH)3 增大
Ksp: 10-9 沉淀pH: 7.82
10-24 6.30
Ln(OH)3受热分解为LnO(OH),继续受热变成Ln2O3。
△
△
Ln(OH)3 → LnO(OH) → Ln2O3
Ln(OH)3 ↓
分离 控制pH=5~7
Ln3+ Eu3+
Zn-Hg
Ln3+ Eu2+
NH3·H2O NH4Cl
Ln(OH)3 ↓ Eu2+
离子交换法:
Ln系元素常伴生一起, 难以分离,可用离子交换法
Ln3+(aq)+3RSO3-H+ (RSO3)3Ln + 3H+(aq)
讨论
a: 影响交换因素: 电荷,半径。 b: Ln系中哪个更容易被交换?
③
80pm 70pm
62pm
④
Hf(IV) Ta(V)
分接近、 化学性质十分相近,常伴 生在一起,难以分离。
W(VI)
62pm
3. f 区元素的氧化态
Ln系: +3为特征氧化态
Ce:4f15d16s2 Tb :4f96s2
Eu:4f76s2
Yb:4f146s2
Ln + Y + Sc
轻稀土 铈组
重稀土 钇组
La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu (Y) (Sc)
2. 存在
稀土元素并不稀少,但在地壳中分布分散,彼
此性质相似,难以提取、分离。
我国稀土——储量大、分布广、矿种齐全、易开采 南方以重稀土为主,内蒙古以轻稀土为主。
Y2O3:Eu,Y2O2S:Eu Gd2O2S:Tb LaOBr:Tb:Yb Y2O2S:Tb:Dy
红色 绿色 蓝色 黄色
(5)磁性材料
阿 尔
法
磁
钕铁硼系列、钕钛硼
谱
系列的稀土永磁铁
仪
(6)超导材料:
1986年,Bedonorz和Muller制出,35K BaxLa5-xCu5O5(3-y) (x=1或0.75),由此获得1987年诺贝尔物理奖。
LnCl3·6H2O ==== LnOCl+HCl↑+5H2O
Ln2O3+C+Cl2 → LnCl3+CO
Ln2O3+SOCl2 → LnCl3+SO2↑
要得到无水 氯化物,要HCl
气流加热
Ln2O3+NH4Cl → LnCl3+NH3↑+H2O
△
Ln2(C2O4)3
Ln2O3 +CO↑+CO2 ↑
大学无机化学经典课件第11章 f区 元素
4f76s2
4f146s2
4f7
(1)特点
原子半径缩小缓慢,相邻元素递减1pm,总的缩小约14pm。
(2) 后果
① Y3+半径88pm落在Er3+88.1pm附近,Y进入稀土元素。
② Sc3+半径接近Lu3+,常与Y3+共生,Sc也成为稀土元
素。 ② Zr(IV) Nb(V)
Ce、Tb可以呈现+4价 Eu、Yb可以呈现+2价
Ac系元素 氧化态多样性,这是Ac系与Ln系的不同之处
4. 镧系元素颜色
f-f 跃迁引起
La3+ Ce3+ Pr3+ Nd3+ Pm3+ Sm3+ Eu3+ Gd3+
无 无 绿 淡红 粉红、粉黄 黄 无 无
Lu3+ Yb3+ Tm3+ Er3+ Ho 3+ Dy3+ Tb3+ Gd3+
萃取剂一般分为三类:酸性萃取剂如P204(酸性磷酸酯); 中性萃取剂如TBP(磷酸三丁酯);离子缔合萃取剂如胺类。
Ce(NO3)62Ln3+
+ TBP
HNO3 8~15mol•L-1
水层:Ln3+
TBP层: H2Ce(NO3) 6
H2O2
水层 Ce3+
TBP层
11.3 稀土元素(RE)
1. 概念:
4. 氧化态为+4和+2的化合物
铈(Ce)、镨(Pr)、铽(Tb)、镝(Dy)都能形成+4氧化态的化 合物,其中以四价铈的化合物最重要。四价铈化合物既能存 在于水溶液中,又能存在于固体中。四价均是强氧化剂。
2CeO2+8HCl = 2CeCl3 + Cl2 + 4H2O 2CeO2 + 2KI + 8HCl = 2CeCl3 + I2 + 2KCl + 4H2O
Ce(OH)4为棕色沉淀物,溶度积很小(Ksp=4×10-51), 使Ce(OH)4沉淀的pH为0.7~1.0,而使Ce(OH)3沉淀需近中性条 件。如用足量的H2O2(或O2、Cl2、O3等)则可把Ce(Ⅲ)完全 氧化成Ce(OH)4,这是从Ln3+中分离出Ce的一种有效方法。
3. 盐类
强酸盐大多可溶(SO42-盐微溶), 弱酸盐难溶。 △
11.2 镧系元素重要化合物
1. Ln系离子的成键特征 (n-2)f0~14(n-1)d0~1ns2
Ln3+: 4fn5s25p6 硬酸,与F-、O2-硬碱结合稳定; 半径大,配位数6~12。
2. 氢氧化物
Ln(Ⅲ)的盐溶液中加入NaOH或NH3•H2O均可沉淀出 Ln(OH)3,它是一种胶状沉淀。
钐(Sm)、铕(Eu)和镱(Yb)能形成+2氧化态化合物,Sm2+, Eu2+, Yb2+具有不同程度的还原性,铕(Ⅱ)盐的结构类似于Ba, Sr相应的化合物,如EuSO4同BaSO4结构相同,难溶于水。
5. 分离
氧化还原法:
Ln3+ Ce3+
H2O2或O2
Ln3+ Ce4+
pH=0.7~1.0
Ln3+ Ce(OH)4↓
La3+最易,Lu3+最不易。
c:如何淋洗,哪个离子最先淋洗下来? 用配合剂淋洗, EDTA、C6H5O72Lu3+首先被淋洗, La3+最后被淋洗
溶剂萃取法
溶剂萃取分离法是指含有被分离物质的水溶液与互不混溶 的有机溶剂接触,借助于萃取剂的作用,使一种或几种组分进 入有机相,而另一组分仍留在水相,从而达到分离的目的。
鄂博矿
独居石(Ce,La, Nd,Th)[PO4] 棕红色、黄色,有时褐黄 色,油脂光泽
白云矿 氟碳铈矿 MCO3F
3. 用途:
(1) 冶金工业: 稀土产量一半用于冶金工业
(2) 化学工业: 稀土催化剂 石油催化裂解,使用镧系元素的氯化物,磷酸盐
(3) 玻璃工业:
(4) 光学材料
La、Nd、Sm、Eu
