【通用】《物理化学(第五版)》第九章复习题答案.ppt
南京大学物理化学下册(第五版)复习题解答:最新整理

物理化学下册课后复习题答案第八章电解质溶液第九章可逆电池电动势及其应用第十章电解与极化作用第十一章化学动力学(一)第十二章化学动力学基础(二)第十三章1.比表面有哪能几种表示方法?表面张力与表面Gibbs自由能有哪些异同点?答:A0= As/m或A0= As/V;表面张力又可称为表面Gibbs自由能,二者数值一样。
但一个是从能量角度研究表面现象,另一个是从力的角度研究表面现象;故二者物理意义不同;单位不同。
2.为什么气泡、小液滴、肥皂泡等都呈圆形?玻璃管口加热后会变得光滑并缩小(俗称圆口),这些现象的本是什么?用同一滴管滴出相同体积的苯。
水和NaCl 溶液,所得的液滴数是否相同弯曲液面有附加压力,其最终会将不规则的液面变为圆形或球形;球形表面积最小,表面自由能最低,最稳定;不相同。
3.用学到的关于界面现角的知识解释以下几种做法或现象的基体原理:①人工降雨;②有机蒸馏中加沸石;③多孔固体吸附蒸气时的毛细凝聚;④过饱和溶液,过饱和蒸气,过冷液体等过饱和现象;⑤重量分析中的“陈化”过程;⑥喷洒农药时,为何常常在农药中加入少量表面活性剂这些现象都可以用开尔文公式说明,①、②、④、⑤是新相刚形面时的体积小,曲率半径小,对与之平衡的旧相有更加苛刻的条件要求。
③多孔固体吸附蒸气时,被吸附的气体的液相对毛细管是润湿的,其曲率半径小零,当气体的分压小于其饱和蒸气压时,就可以发生凝聚。
⑥喷洒农药时,在农药中加入少量表面活性剂,可以降低药液的表面张力,使药液在叶面上铺展。
4.在三通活塞的两端涂上肥皂液,关断右端通路,在左端吹一个大泡,然后关闭左端,在右端吹一个小泡,最后让左右两端相通。
试问当将两管接通后,两泡的大小有何变化?到何时达到平衡?讲出变化的原因及平衡时两泡的曲率半径的比值。
小球更小,大球更大;最后小泡变成一个与大泡曲率半径相同的弧;由于小泡的附加压力大,所以大泡变大,小泡变小,最后使两泡的曲率半径相同5.因系统的Gibbs自由能越低,系统越稳定,所以物体总有降低本身表面Giibs自由能的趋势。
物理化学傅献彩(下册)第五版课后习题答案解析精选全文完整版

专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
欢送您的光临,Word文档下载后可修改编辑.双击可删除页眉页脚.谢谢!你的意见是我进步的动力,希望您提出您珍贵的意见!让我们共同学习共同进步!学无止境.更上一层楼。
专ቤተ መጻሕፍቲ ባይዱ技术资料整理分享
可编辑修改精选全文完整版
WORD格式可编辑
物理化学傅献彩下册第五版课后习题答案
第九章可逆电池的电动势及其应用
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
(完整word版)《物理化学》高等教育出版(第五版)第九章

第九章电解质溶液练习题一、判断题:1.溶液是电中性的,正、负离子所带总电量相等,则正、负离子离子的迁移数也相等。
2.离子迁移数与离子速率成正比,某正离子的运动速率一定时,其迁移数也一定。
3.离子的摩尔电导率与其价态有关系。
4.电解质溶液中各离子迁移数之和为1。
5.电解池通过l F电量时,可以使1mol物质电解。
6.因离子在电场作用下可以定向移动,所以测定电解质溶液的电导率时要用直流电桥。
7.无限稀电解质溶液的摩尔电导率可以看成是正、负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。
8.电解质的无限稀摩尔电导率Λ∞m可以由Λm作图外推到c1/2 = 0得到。
下列关系式是否正确:(1) Λ∞,1<Λ∞,2<Λ∞,3<Λ∞,4(2)κ1=κ2=κ3=κ4(3)Λ∞,1=Λ∞,2=Λ∞,3=Λ∞,4(4)Λm,1=Λm,2=Λm,3=Λm,410.德拜—休克尔公式适用于强电解质。
11.对于BaCl2溶液,以下等式成立:(1) a = γb/b0;(2) a = a+·a - ; (3) γ± = γ+·γ - 2;(4) b = b+·b-;(5) b±3 = b+·b-2; (6) b± = 4b3。
12.若a(CaF2) = 0.5,则a(Ca2+) = 0.5 ,a(F-) = 1。
二、单选题:1.下列溶液中哪个溶液的摩尔电导最大:(A) 0.1M KCl水溶液;(B) 0.001M HCl水溶液;(C) 0.001M KOH水溶液;(D) 0.001M KCl水溶液。
2.对于混合电解质溶液,下列表征导电性的量中哪个不具有加和性:(A) 电导;(B) 电导率;(C) 摩尔电导率;(D) 极限摩尔电导。
3.在一定温度和较小的浓度情况下,增大强电解质溶液的浓度,则溶液的电导率κ与摩尔电导Λm变化为:(A) κ增大,Λm增大;(B) κ增大,Λm减少;(C) κ减少,Λm增大;(D) κ减少,Λm减少。
物理化学傅献彩(下册)第五版课后习题答案解析

专业技术资料整理分享
word格式可编辑专业技术资料整理分享物理化学傅献彩下册第五版课后习题答案第九章可逆电池的电动势及其应用word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享欢迎您的光临word文档下载后可修改编辑
西大物理化学第五版课后习题及答案PPT教学课件

分子反应动力学已成为非常活跃的学科。
2020/10/16
10
§0.1 物理化学的建立与发展
(4) 从定性到定量 随着计算机技术的飞速发展,大大缩短了数 据处理的时间,并可进行自动记录和人工拟合。
使许多以前只能做定性研究的课题现在可进 行定量监测,做原位反应,如:
2020/10/16
М В Ломоносов 4
§0.1 物理化学的建立与发展
1887年德国科学家W.Ostwald和荷兰科学家J.H. van’t Hoff 合办的《物理化学杂志》 (德文)创刊。
W. Ostwald
J. H. van’t Hoff
(1853-1932)
2020/10/16
(1852-1911) 5
IRFT -IR ESR NMR ESCA
利用计算机还可以进行模拟放大和分子设计。
2020/10/16
11
§0.1 物理化学的建立与发展
(5) 从单一学科到边缘学科
化学学科 内部及与其他 学科相互渗透、 相互结合,形 成了许多极具 药学 生命力的边缘 学科,如:
计算
材料
计算 化学
材料 化学
药物 化学
§0.1 物理化学的建立与发展
20世纪前期迅速发展 新测试手段和
新数据处理方法不 断涌现。
形成了许多 新的分支领域, 如:
2020/10/16
胶 体 化 学
物理化学
溶 液 化 学
6
§0.1 物理化学的建立与发展
20世纪中叶后发展趋势和特点:
(1) 从宏观到微观
(2) 从体相到表相
(3) 从静态到动态
物理化学答案——第九章-化学动力学基础
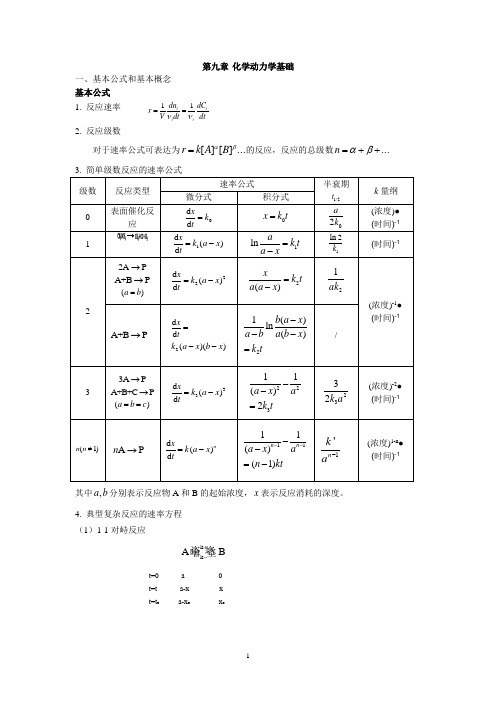
第九章 化学动力学基础一、基本公式和基本概念 基本公式 1. 反应速率 11i ii i dn dC r V dtdtνν==2. 反应级数对于速率公式可表达为...][][βαB A k r =的反应,反应的总级数...++=βαn 3. 简单级数反应的速率公式 级数 反应类型 速率公式半衰期 1/2tk 量纲微分式积分式0 表面催化反应0d d x k t =0x k t = 02a k (浓度)● (时间)-1 11d ()d x k a x t=-1lna k t a x=-1ln 2k(时间)-122A P→A +B P →()a b =22d ()d x k a x t=-2()x k t a a x =-21ak(浓度)-1●(时间)-1A +B P →2d d ()()xtk a x b x =--21()ln()b a x a b a b x k t---=/33A P→A +B +C P→()a b c ==33d ()d x k a x t=-22311()2a x a k t --=2332k a(浓度)-2● (时间)-1(1)n n ≠A P n →d ()d nx k a x t=-1111()(1)n n a x an kt----=-1'n k a-(浓度)1-n ● (时间)-1其中,a b 分别表示反应物A 和B 的起始浓度,x 表示反应消耗的深度。
4. 典型复杂反应的速率方程 (1)1-1对峙反应k k A B +-t=0 a 0 t=t a-x x t=t e a-x e x e速率方程: ()kk te e x x x e +--+-=(2)平行反应最简单的平行反应是由两个一级基元反应组成的平行反应:x=x 1+x 2速率方程:tk k aex a )(21+-=-产物B 和C 的浓度比由竞争反应的速率决定:2121k k x x = (3)连续反应最简单的连续反应是两个单向连续的一级反应:C B A kk −→−−→−21t=0 a 0 0 t=t x y z 速率方程:1k tx ae-=)(21121tk tk eek k a k y ----=]1[21121122tk tk ek k k ek k k a z ---+--=中间产物B 的浓度在反应过程中出现极大值:122)(21k k k m k k a y -=,出现极大值的时间为:2121)ln(k k k k tm-=5. 温度对反应速率的影响 (1)阿累尼乌斯经验公式2ln RTE dTk d a =阿累尼乌斯公式的指数函数式: RTE a Aek -=k 1k 2A a-xCx 2 B x 1(2)阿累尼乌斯活化能基元反应的活化能是活化分子的平均能量与所有分子平均能量之差。
《物理化学》第五版-(傅献彩主编)复习题答案--(全)

微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享1
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享2
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享11
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享12
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享
第十一章 表面现象
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享45
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享46
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 第三章 热力学第二定律
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享9
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享10
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享13
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享
物理化学傅献彩下册第五版课后习题答案

物理化学傅献彩下册第五版课后习题答案 6 / 26
物理化学傅献彩下册第五版课后习题答案 7 / 26
物理化学傅献彩下册第五版课后习题答案 8 / 26
物理化学傅献彩下册第五版课后习题答案 9 / 26
物理化学傅献彩下册第五版课后习题答案 10 / 26
物理化学傅献彩下册第五版课后习题答案 11 / 26
物理化学傅献彩下册第五版课后习题答案 12 / 26
物理化学傅献彩下册第五版课后习题答案 13 / 26
物理化学傅献彩下册第五版课后习题答案 14 / 26
物理化学傅献彩下册第五版课后习题答案 15 / 26
物理化学傅献彩下册第五版课后习题答案 16 / 26
物理化学傅献彩下册第五版课后习题答案 17 / 26
物理化学傅献彩下册第五版课后习题答案 24 / 26
物理化学傅献彩下册第五版课后习题答案 25 / 26
物理化学傅献彩下册第五版课后习题答案 26 / 26
物理化学傅献彩下册第五版课后习题答案
物理化学傅献彩下册第五版课后习题答案
第九章 可逆电池的电动势及其应用
1 / 26
物理化学傅献彩下册第五版课后习题答案 2 / 26
物理化学傅献彩下册第五版课后习题答案 3 / 26
物理化学傅献彩下册第五版课后习题答案 4 / 26
物理化学傅献彩下册第五版课后习题答案 5 / 26
物理化学傅献彩下册第五版课后习题答案 18 / 26
物理化学傅献彩下册第五版课后习题答案 19 / 26
物理化学傅献彩下册第五版课后习题答案 20 / 26
物理化学傅献彩下册第五版课后习题答案 21 / 26
物理化学傅献彩下册第五版课后习题答案 22 / 26
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
演示课件
复习题
7.在公式ΔrGmΘ=-zEΘF中,ΔrGmΘ是否表示 该电池各物都处于标准态时,电池反应的 Gibbs自由能变化值?
答:在公式ΔrGmΘ=-zEΘF中,ΔrGmΘ表示该 电池各物都处于标准态时,在T,p保持不变 的条件下,按电池反应进行1mol的反应时 系统的Gibbs自由能变化值。
ln
m m'
高价型:Mz+Az-(m1)|Mz+Az-(m2)
E
j=
t z
- t- z 演示课-件
RT F
ln
m1 m2
基本公式
用可逆电池的测定值计算热力学函数变化
值
rGm zFE , rGm zFE
E
RT zF
ln
K
a
r Sm
( r Gm T
)p
E zF (T ) p
E
QR
T rSm
答:可逆电极有三种类型: (1)金属气体电极 如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s) (2)金属难溶盐和金属难溶氧化物电极 如:
Ag(s)|AgCl(s)|Cl-(m) AgCl(s)+ e- = Ag(s)+Cl-(m) (3)氧化还原电极 如: Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2) 对于气体电极和氧化还原电极,在书写时要标明电极
反应所依附的惰性金属。
演示课件
复习题
2.什么叫电池的电动势?用伏特表侧得的电 池的端电压与电池的电动势是否相同?为何 在测电动势时要用对消法?
答:正、负两端的电势差叫电动势。不同。 当把伏特计与电池接通后,必须有适量的 电流通过才能使伏特计显示, 这样电池中 发生化学反应, 溶液浓度发生改变, 同时 电池有内阻,也会有电压降,所以只能在 没有电流通过的情况下才能测量电池的电 动势。
答:电极电势不是电极表面与电解质溶液之 间的电势差。单个电势是无法测量的。用 Nernst方程进行计算:
(Ox Red )
RT ln
(Ox Re d )
zF
B
avB B
演示课件
复习题
6.如果规定标准氢电极的电极电势为1.0V, 则各电极的还原电极电势将如何变化?电池 的电动势将如何变化?
不同状态,EΘ处在标准态,不是平衡态(在平衡态时所
有的电动势都等于零,因为ΔrGmΘ等于零)。KΘ处在平 衡态,而不是标准态(在标准态时平衡常数都等于1)。
演示课件
复习题
9.联系电化学与热力学的主要公式是什么?电 化学中能用实验测定哪些数据?如何用电动势 法测定下述各热力学数据?试写出所设计的电 池、应测的数据及计算公式。
作业辅导——第九章
演示课件
小结
演示课件
应用
(计1)算用如实下验的测热定力可学逆函电数池的的变E,化E值Θ, TE
,就可以
p
ΔQrRG。m,ΔrGmΘ,ΔrHm和ΔrSm和可逆电池的热效应
(2)求化学反应的平衡常数。只要能设计合适的 电池,使电池反应就是所要的化学反应,则有 了该电池的标准电动势就能计算相应的平街常 数活。度如积氧Ks化pΘ,还水原的反解应离的平平衡衡常常数数KKwaΘΘ,等难。溶盐的
演示课件
复习题
8.有哪些求算标准电动势EΘ的方法?在公式E
RT zF
ln K
中,EΘ是否是电池反应达平衡时的电动势?KΘ是否是
电池中各物质都处于标准态时的平衡常数?
答:求算标准电动势EΘ的方法较多,常用的有:
公式
E
E
RT zF
ln K
是由, EΔ rGmΘzrGF联m ,系E在 R一zFT 起ln K, 但EΘ和KΘ处在
演示课件
复习题
3.为什么Weslon标准电池的负极采用含有 Cd的质量分数约为0.04~0.12的Cd一Hg齐 时,标准电池都有稳定的电动势值?试用 Cd一Hg的二元相图说明。标准电池的电动 势会随温度而变化吗?
演示课件
答:在Cd一Hg的二元相图上,Cd的质量 分数约为0.04~0.12的Cd一Hg齐落在与Cd 一Hg固溶体的两相平衡区,在一定温度下 Cd一Hg齐的活度有定值。因为标准电池的 电动势在定温下只与Cd一Hg齐的活度有关, 所以电动势也有定值,但电动势会随温度 而改变。
zFT ( T
)p
r Hm
rGm
TrSm
zFE
zFT
(
E T
)
p
演示课件
基本公式
浓度积 pH值
K
sp
exp
zE F RT
pH x
pH a
Ea Ex F
RT ln10
膜电势
, RT ln am
F
am
演示课件
复习题
1.可逆电极有哪些主要类型?每种类型试举一例,并写 出该电极的还原反应。对于气体电极和氧化还原电极 在书写电极表示式时应注意什么问题?
ln
aFf aGg aAa aBb
演示课件
基本公式
可逆电极反应的 Nernst方程
电极反应:mOx(氧化态)+ze→nRed(还原态)
液接电势计算公式 (Ox Red)
(Ox Re d )
RT zF
ln
an Re d
aOmx
PtE,Hj=2t(-pt)|HRFTClnlm(mm'=)2|tH-C1 lRF(Tmln ’mm' )|E=HE2c+(pE)j=,P2ttFRT
演示课件
应用
(7)利用醌氢酿电极或玻璃电极测定溶液的pH。 (8)进行电势滴定,从滴定终点测定离子的浓度。 (9)利用电势—pH图,指导湿法冶金和金属防
腐等。
演示课件
基本公式
电化学与热力学的联系公式
可逆电池反应的 Nernst方程
对于可逆的电池反应:aA+bB = fF +gG
E
E
RT zF
演示课件
应用
(3)判断化学反应的方向。只要能设计合适 的电池,使电池反应就是所要的化学反应, 则根据电动势的正、负,就可以判断化学 反应的方向,若E>0.反应能正向进行,反 之则逆向反应是自发的。
(4)求电解质溶液的平均离子活度因子γ±。 (5)求未知电极的标准电极电势中φΘ。 (6)从液体接界电势计算离子的迁移数。
演示课件
复习题
4.用书面表示电池时有哪些通用符号?为什 么电极电势有正、有负?用实验能测到负 的电动势吗?
答:用“|”表示不同界面,用“||”表示盐 桥。电极电势有正有负是相对于标准氢电 极而言的。不能测到负电势。
演示课件
复习题
5.电极电势是否就是电极表面与电解质溶液 之间的电势差?单个电极的电势能否测量?如 何用Nernst方程计算电极的还原电势?
