氢氧化钾乙醇标准滴定溶液
氢氧化钾乙醇溶液的配制

氢氧化钾乙醇溶液的配制氢氧化钾乙醇溶液是一种常用的化学试剂,具有很多应用领域。
它是由氢氧化钾和乙醇按一定比例配制而成的溶液。
下面将详细介绍氢氧化钾乙醇溶液的配制方法及其特点。
氢氧化钾乙醇溶液的配制需要准备好氢氧化钾和乙醇两种原料。
氢氧化钾是一种强碱,常见的形态是固体颗粒。
而乙醇则是一种无色的液体,具有良好的溶解性。
为了保证配制的溶液浓度准确,可以使用浓度计来测量氢氧化钾和乙醇的浓度。
按照所需配制溶液的浓度要求确定氢氧化钾和乙醇的比例。
在配制过程中,需要注意溶液的浓度和配制量的准确性。
一般情况下,氢氧化钾的浓度可以根据实际需求选择,常见的有10%、20%等浓度。
而乙醇的浓度则可以根据所需的溶液浓度进行调整。
在实际配制过程中,可以先将适量的乙醇倒入容器中,然后逐渐加入氢氧化钾。
在加入氢氧化钾的过程中,需要搅拌均匀,以保证溶液的均匀性。
同时,也要注意加入氢氧化钾的速度,过快可能导致溶液剧烈反应,产生大量热量,引起溶液的喷溅。
在配制过程中,还需要注意安全问题。
氢氧化钾是一种强碱,具有腐蚀性,容易引起皮肤和眼睛的灼伤。
因此,在操作过程中必须佩戴好防护手套、护目镜等安全装备,以避免伤害发生。
配制完成后,可以使用酸碱指示剂对溶液进行酸碱性测试。
一般情况下,氢氧化钾乙醇溶液呈碱性,可以使用酸性指示剂,如酚酞溶液,进行测试。
如果溶液呈现红色,则说明溶液为碱性。
氢氧化钾乙醇溶液具有很多应用领域。
在化学实验中,它常用于酸碱中和实验、配制其他化学试剂等。
此外,在工业生产中,氢氧化钾乙醇溶液也可以用作催化剂、脱水剂等。
氢氧化钾乙醇溶液是一种常用的化学试剂,配制方法相对简单。
在配制过程中需要注意操作安全,确保配制的溶液浓度准确。
配制完成后,可以根据需要进行酸碱性测试,并广泛应用于实验和工业生产中。
一些标准滴定液的配制和标定

一些标准滴定溶液的配制和标定以下标准溶液的配制包括:乙二胺四醋酸二钠滴定液(0.05mol/L);乙醇制氢氧化钾滴定液(0.5mol/L);四苯硼钠滴定液(0.02mol/L)(C6H5);甲醇钠滴定液(0.1mol/L);甲醇锂滴定液(0.1mol/L);亚硝酸钠滴定液(0.1mol/L);草酸滴定液(0.05mol/L);氢氧化四丁基铵滴定液(0.1mol/L);氢氧化钠滴定液(1、0.5或0.1mol/L);重铬酸钾滴定液(0.01667mol/L);烃铵盐滴定液(0.01mol/L);盐酸滴定液(1、0.5、0.2或0.1mol/L);高氯酸滴定液(0.1mol/L);高氯酸钡滴定液(0.05mol/L);高锰酸钾滴定液(0.02mol/L);硝酸汞滴定液(0.02或0.05mol/L)硝酸银滴定液(0.1mol/L);硫代硫酸钠滴定液(0.1mol/L);硫氰酸铵滴定液(0.1mol/L);硫酸滴定液(0.5、0.25、0.1或0.05mol/L);硫酸亚铁铵滴定液(0.1mol/L);硫酸铈滴定液(0.1mol/L);锌滴定液(0.05mol/L);碘滴定液(0.1mol/L);碘酸钾滴定液(0.05或0.01667mol/L);溴滴定液(0.1mol/L);溴酸钾滴定液(0.01667mol/L)。
乙二胺四醋酸二钠滴定液(0.05mol/L)C10H14N2Na2O8?2H2O=372.2418.61g→1000ml【配制】取乙二胺四醋酸二钠19g,加适量的水使溶解成1000ml,摇匀。
【标定】取于约800℃灼烧至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3ml使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml与氨-氯化铵缓冲液(pH10.0)10ml,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。
氢氧化钾乙醇标准溶液的配制与标定

氢氧化钾乙醇标准溶液的配制与标定1. 配制氢氧化钾乙醇标准溶液1.1 前期准备首先,咱们得搞清楚啥是氢氧化钾(KOH)和乙醇(C₂H₅OH)。
氢氧化钾听着就像是魔法药水,其实就是一种常见的碱性化学品,平时我们用来调节溶液的pH值。
乙醇呢,就是我们生活中常见的酒精,不是拿来喝的那种,而是用来做溶剂的。
配制这种标准溶液,关键在于准确度,不然你的化学实验就得像一场闹剧了。
1.2 所需材料和工具我们需要的材料有:氢氧化钾(粉末状的)、乙醇(最好是纯度高点的)、一只精密的电子天平、量筒、烧杯、滴定管等。
这些工具就像我们做菜时的锅碗瓢盆,缺一不可。
记得要有耐心,一点一滴都很重要。
1.3 实际操作开始之前,先来个简单的洁净工作吧。
把你的烧杯、量筒这些都洗干净,擦干后备用。
然后,我们就可以开始称量氢氧化钾了。
为了确保溶液的准确浓度,我们需要在电子天平上称量出精确的氢氧化钾量。
比如说,你需要配制0.1 mol/L的溶液,就要称取相应量的氢氧化钾。
称量完毕,接下来把氢氧化钾倒入烧杯中。
将乙醇倒入量筒中,然后将乙醇慢慢加入氢氧化钾中,搅拌至完全溶解。
这一步就像是把面粉和水搅拌成面团一样,搅拌的时候注意均匀,不然溶液可能会有沉淀。
搅拌好后,就得把它过滤一下,以确保里面没有杂质。
最终,我们得到的就是氢氧化钾乙醇标准溶液了。
2. 标定氢氧化钾乙醇标准溶液2.1 标定的必要性标定是为了确保你的标准溶液的浓度准确无误。
要是你配制的溶液浓度不对,那你的实验结果就可能会大打折扣。
这就像你买了一瓶酒,标签上写着“50度”,但实际喝起来却是“20度”,那不是让人大跌眼镜吗?标定就是为了避免这种尴尬。
2.2 标定步骤标定氢氧化钾乙醇标准溶液的过程稍微复杂一点,但也不是很难。
首先,你需要用到一种已知浓度的酸,通常是盐酸。
将盐酸滴入氢氧化钾乙醇标准溶液中,直到溶液的颜色发生变化。
这个过程叫做滴定,颜色的变化通常通过指示剂来观察。
滴定的时候,慢慢加盐酸,边加边搅拌,直到颜色变化为止。
氢氧化钾乙醇滴定液沉淀的原因

氢氧化钾乙醇滴定液沉淀的原因关于氢氧化钾乙醇滴定液沉淀的原因,今天我就来给大家详细解说一下。
话说在化学实验室里,我们经常会使用氢氧化钾乙醇滴定液来进行滴定实验,这是一种常用的实验方法,不过有时候我们会发现滴定液里面出现了沉淀。
那么为什么会有这种情况呢?让我们一起来揭开这个谜底吧!首先,让我们来看一看氢氧化钾乙醇滴定液的原理。
嘿,这货其实就是由氢氧化钾和乙醇这两个小伙伴组成的。
呐,它们俩可是好基友啊,合在一起才能发挥出最强大的实验功效嘛!当我们使用滴定液的时候,很多时候我们会加入一些试剂,比如说酸,为的就是帮助我们更准确地测量出滴定液中所含物质的量。
可是,唉呀呀,就是因为这些试剂的加入,才导致了滴定液中出现了沉淀。
究其原因,主要有两个方面。
第一,有的试剂和滴定液中的成分发生了剧烈的化学反应,导致了产生了沉淀。
咋不好意思,彼此之间的化学结合可真是复杂啊,就像连个不相干的人突然要组成家庭,必然会有各种矛盾冲突。
有时候,他们们之间的反应就像是火药桶一样,轰隆一声,沉淀就出现了。
第二,还有一种情况是滴定液中的成分本身就容易生成沉淀。
是的,有一些物质天生不和平,见面就开始闹别扭,引发了剧烈的反应。
就像是一对互相嫌弃的狗熊,只要一接触就会发生摩擦,结果就是产生了沉淀。
咳咳,不如我们来举个例子吧,说起来你们也能更好地理解。
咱们假设滴定液中的成分为氢氧化钾小弟和乙醇小妹妹,然后我们再加上一点试剂小混混(注意,这里的小混混可不是什么好娃娃哦)。
氢氧化钾小弟和乙醇小妹妹刚开始相处的时候,还是非常融洽的,就像二哈和柯基一样和谐相处。
可是,一旦小混混出现在他们面前,他们就开始变得不安定起来,斗起来了。
于是乎,沉淀就在滴定液中诞生了,就像是一坨黏糊糊的热狗屎!当然,这也不是说所有的滴定液都会产生沉淀啦。
有时候,我们可以通过选择合适的试剂或者调整滴定液的浓度,来避免沉淀的产生。
这就像是找到了化学界的绝世美女,虽然她爱生气,但只要我们用心去对待她,她还是会和我们和平相处的。
氢氧化钾--乙醇标准溶液

称准至0.0002克溶于适量水中(加水量见表2)加热至沸,加入2-3滴酚酞指示剂,用配好溶液滴定至溶液呈粉红色即为终点。
2、计算:
m——苯二甲酸氢钾之质量(克)
V1——氢氧化钠溶液用量(毫升)
氢氧化钾--乙醇标准溶液加入收藏
设为首页
联系站长
| 网站首页 | 资料中心 | 下载中心 | 化验员培训 | 论坛 | 化验室设计 | 化验室管理 | 化验室安全 | 展会信息 | 求职招聘 |
二、标定:
1、标定方法:
称取于105-110烘至恒要的苯二甲酸氢钾(数量见表2)
表 2
名称/浓度 0.05M0.1M0.5M1 M
苯二甲酸氢钾 0.2-0.3克0.4-0.6克2-3克4-5克
下一篇文章: 高 氯 酸 钡 标 准 溶 液 配 制 与 标 定
【发表评论】【加入收藏】【告诉好友】【打印此文】【关闭窗口】
最新热点最新推荐相关文章
电子天平的维护保养
GB/T 14699.1—2005 饲料采
DDS-307说明书
作者:佚名 文章来源:本站原创 点击数:8773 更新时间:2007-12-6
1M、0.5M、0.1M、0.05M氢氧化钾乙醇标准溶液
一、配制:
称取不同数量的氢氧化钾,加适量水溶解然后用乙醇稀至刻度,混匀保存在具塞瓶中静置24小时后取上层清液标定。(配制时KOH加入量如表1)
表 1
加入量/浓度0.05M0.1M0.5M1 M
KOH3.5克7.5克35克70克
水50100100150
乙 醇 950900900850
配 制 量1000100010001000
标准溶液的密封保存时间

标准溶液的密封保存时间
1、除另有规定外,标准滴定溶液在10℃~30℃下,密封保存时间一般不超过6个月;碘标准滴定溶液,0.1mol/L亚硝酸钠标准滴定溶液密封保存时间为4个月;高氯酸标准滴定溶液、氢氧化钾-乙醇标准滴定溶液,硫酸铁铵标准滴定溶液密封保存时间为2个月。
超过保存时间的标准滴定溶液进行复标定后可以继续使用。
2、标准滴定溶液在10℃~30℃下,开封使用过的标准滴定溶液保存时间一般不超过2个月(倾出溶液后立即盖紧);碘标准滴定溶液、氢氧化钾-乙醇标准滴定溶液一般不超过1个月;0.1mol/L亚硝酸钠标准滴定溶液一般不超过15d;高氯酸标准滴定溶液开封后当天使用。
3、当标准滴定溶液出现浑浊,沉淀,颜色变化等现象时,应重新制备。
4、贮存标准滴定溶液的容器,其材料不应与溶液起理化作用,壁厚最薄处不小于0.5mm。
2020版《中国药典》乙醇制氢氧化钾滴定液配制与标定操作规程
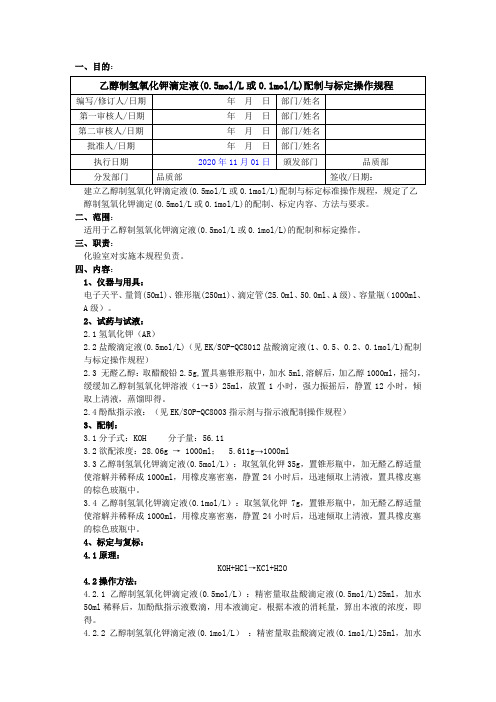
一、目的:醇制氢氧化钾滴定(0.5mol/L或0.1mol/L)的配制、标定内容、方法与要求。
二、范围:适用于乙醇制氢氧化钾滴定液(0.5mol/L或0.1mol/L)的配制和标定操作。
三、职责:化验室对实施本规程负责。
四、内容:1、仪器与用具:电子天平、量筒(50ml)、锥形瓶(250m1)、滴定管(25.0ml、50.0ml、A级)、容量瓶(1000ml、A级)。
2、试药与试液:2.1氢氧化钾(AR)2.2盐酸滴定液(0.5mol/L)(见EK/SOP-QC8012盐酸滴定液(1、0.5、0.2、0.1mol/L)配制与标定操作规程)2.3 无醛乙醇:取醋酸铅2.5g,置具塞锥形瓶中,加水5ml,溶解后,加乙醇1000ml,摇匀,缓缓加乙醇制氢氧化钾溶液(1→5)25ml,放置1小时,强力振摇后,静置12小时,倾取上清液,蒸馏即得。
2.4酚酞指示液:(见EK/SOP-QC8003指示剂与指示液配制操作规程)3、配制:3.1分子式:KOH 分子量:56.113.2欲配浓度:28.06g → 1000ml; 5.611g→1000ml3.3乙醇制氢氧化钾滴定液(0.5mol/L):取氢氧化钾35g,置锥形瓶中,加无醛乙醇适量使溶解并稀释成1000ml,用橡皮塞密塞,静置24小时后,迅速倾取上清液,置具橡皮塞的棕色玻瓶中。
3.4乙醇制氢氧化钾滴定液(0.1mol/L):取氢氧化钾7g,置锥形瓶中,加无醛乙醇适量使溶解并稀释成1000ml,用橡皮塞密塞,静置24小时后,迅速倾取上清液,置具橡皮塞的棕色玻瓶中。
4、标定与复标:4.1原理:KOH+HCl→KCl+H2O4.2操作方法:4.2.1乙醇制氢氧化钾滴定液(0.5mol/L):精密量取盐酸滴定液(0.5mol/L)25ml,加水50ml稀释后,加酚酞指示液数滴,用本液滴定。
根据本液的消耗量,算出本液的浓度,即得。
4.2.2乙醇制氢氧化钾滴定液(0.1mol/L):精密量取盐酸滴定液(0.1mol/L)25ml,加水50ml 稀释后,加酚酞指示液数滴,用本液滴定。
中国药典皂化值的测定原理

中国药典皂化值的测定原理
皂化值含量测定试验
(一)试验原理:
在回流条件下将样品和氢氧化钾-乙醇溶液一起煮沸,随后用标定的盐酸溶液滴定过量的氢氧化钾。
(二)试剂和材料:
1.氢氧化钾-乙醇溶液:大约0.5mol/L氢氧化钾溶解在95%(体积分数)乙醇中,此溶液应为无色或淡黄色。
2.盐酸标准滴定溶液[c(HCl)=0.5mol/L]。
3.酚酞指示剂:10g溶于95%(体积分数)乙醇。
4.碱性蓝(6B)指示剂:碱性蓝(6B)20g/L溶于95%(体积分数)乙醇。
(三)试验步骤:
称取试样样品2g,准确到0.005g于锥形瓶中(以皂化值170-200为依据,被测样量为2g。
对于其他范围的皂化值,样量将以一半氢氧化钾-乙醇溶液被中和为依据而改变)。
用移液管将25.0mL氢氧化钾-乙醇溶液加到试样中,连接球形冷令凝管和磨口锥形瓶,并将锥形油脂维持沸腾状态60min。
难于皂化的需煮沸2h。
加2-3滴酚酞指示剂于热溶液中,并用盐酸标准滴定溶液滴定到指示剂的粉色刚好消失,且0.5min內不会出现粉色即为终点。
若皂化液是深色的。
则用0.5mL-1mL的碱性蓝(6B)指示剂。
(四)质量控制:
1.两次平行试验结果允许相差不超过0.2 mgkOH/ g;
2.如样品的皂化值值(以KOH计)(mg/g)测定结果不在理论值范围内,则应保存检测原始记录,并安排进行复测。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氢氧化钾---乙醇标准滴定溶液
GB/T 601--2002
氢氧化钾---乙醇标准滴定溶液 c(KOH)=0.10mol/L
1.1 配制:
称取8克氢氧化钾,置于聚乙烯容器中,加少量水(约5毫升)溶解,用乙醇(95%)稀释至1000毫升,密闭放置24小时,用塑料管虹吸上层清液至另一聚乙烯容器中。
1.2 标定:
称取0.75克于105℃~110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,于50毫升无二氧化碳的水中,加2滴酚酞指示液(10g/L),用配制好的氢氧化钾---乙醇溶液滴定至溶液呈粉红色,同时做空白试验。
临用前标定。
氢氧化钾---乙醇标准滴定溶液的浓度 c(KOH),数值以摩尔每升(mol/L)表示,按式(32)计算:
(32)
式中:
m----邻苯二甲酸氢钾的质量的准确数值,单位为克(g);
V
1
---氢氧化钾---乙醇溶液的体积的数值,单位为毫升(ml);
V
2
---空白试验氢氧化钾---乙醇溶液的体积的数值,单位为毫升(ml);
M---邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔每升(g/mol)[M
(KHC
8H
4
O
4
)]=204.22]。
氢氧化钠标准滴定液
GB/T 601-2002
1.1.配制
称取100g氢氧化钠,溶于100ml无二氧化碳的水中,摇均,注入聚乙烯容器中,密封放置至溶液清亮。
按表1的规定,用塑料管量取上层清液,用无二氧化碳的水稀释至1000ml,摇均。
表 1
氢氧化钠标准滴定液的浓度 C(NaOH)/mol/L 氢氧化钠溶液的
1 54
0.5 27
0.1 5.4
1.2. 标定
按表2的规定称取于105℃~110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化
碳的水溶解,加两滴酚酞指示液(10g/L),用配好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30秒。
同时做空白。
表 2
氢氧化钠标准滴定液的浓度 C(NaOH)/mol/L 工作基准试剂邻苯二甲酸氢钾的质量m/g
1 7.5
0.5 3.6
0.1 0.75
氢氧化钠标准滴定液的浓度C(NaOH),数值以摩尔每升(mol/L)表示,按式(1)计算:
(1)
式中:
m-----邻苯二甲酸氢钾的质量的准确数值,单位为克(g);
V1---氢氧化钠溶液的体积的数值,单位是毫升(mL);
V2---空白试验氢氧化钠溶液的体积的数值,单位是毫升(mL);
M--- 邻苯二甲酸氢钾的摩尔质量的数值,单位为克没摩尔(g/mol)[M(KHC8H4O4)=204.22]。
氢氧化钾--乙醇标准溶液
GBT 601-2002
作者:佚名文章来源:本站原创点击数:5499 更新时间:2007-12-6
1M、0.5M、0.1M、0.05M氢氧化钾乙醇标准溶液
一、配制:
称取不同数量的氢氧化钾,加适量水溶解然后用乙醇稀至刻度,混匀保存在具塞瓶中静置24小时后取上层清液标定。
(配制时KOH加入量如表1)
表1
加入量/浓度0.05M 0.1M 0.5M 1 M
KOH3.5克7.5克35克70克
水50100100150
乙醇950900900850
配制量1000100010001000
二、标定:
1、标定方法:
称取于105-110烘至恒要的苯二甲酸氢钾(数量见表2)
表2
名称/浓度0.05M 0.1M 0.5M 1 M
苯二甲酸氢钾0.2-0.3克0.4-0.6克2-3克4-5克
水30 30 50 50
称准至0.0002克溶于适量水中(加水量见表2)加热至沸,加入2-3滴酚酞指示剂,用配好溶液滴定至溶液呈粉红色即为终点。
2、计算:
…
m——邻苯二甲酸氢钾之质量(克)
V1——氢氧化钠溶液用量(毫升)
V2——空白氢氧化钠溶液用量(毫升)
M---邻苯二甲酸氢钾的摩尔质量的数值,单位为克没摩尔(g/mol)[M(KHC8H4O4)=204.22]
3、注意事项:溶液有效期一个月。
