电解质和非电解质.pptx
合集下载
电解质概念及其分类PPT通用课件.ppt

练习:
5.下关于电解质离的叙述正确的是_B_D_ A.碳酸钙在水中的溶解度小,其溶液的电阻 率很大,所以碳酸钙是弱电解质。
B.碳酸钙在中的溶解度虽小,但溶解碳酸钙 全部电离,所以碳酸钙是电解质。 C.三氧化硫溶于水所得溶液导性很好,所以 三氧化硫是强解质。
D.水难电离,纯水几乎不导电,所以水是弱 电解质。
接上页:
稀H2SO4和氨水是混合物,自然不是电解质。SO3、 SO2、NH3的水溶液能够导电,但导电的原因是它 们与水反应后的生成物H2SO3 、H2SO4、NH3·H2O 电离出的离子所致,并非它们自身电离出自由移 动的离子,所以SO3、SO2、NH3不是电解质。某些 离子化合物,如Na2O、CaO等,虽然它们溶于水 后电离出的离子不是自身电离出来得,但在熔化 时自身可以电离,故属于电解质。
练习:
6.某固态化合物不导电,但熔化或溶于水都 能全电离则该合物是___C___
A.非电解质
B.共价化合物
C.离子化合物
D.弱电解质
7.下列叙术正确的是___D_____
A.液态HCl不导电,所以HCl不是电解质。
B.NH3的水溶液能导电,所以NH3是电解质。
C.强电解质都是离子合物。
D.BaSO4难溶于水,但溶于水部分能完全电离, 所BaSO4是电解质。
A.其水溶液能导电 B.极易溶于水 C.是一种具有刺激性气味的气体 D.熔化状态下不导电
练习:
9.下列物质中属于导电性最强的电
解质的是( B )
A.无水硫酸
B.熔融的氯化钾
C.稀盐酸
D.固体氯化钠
溶液的导电能力:主要取决于溶液 中自由移动的离子的浓度及其所带 的电荷的多少。
②以上物质属于电解质的是_①__③__⑤__⑧__要有自由移动的电荷,金属导 电是因为金属中存在自由移动的电子,电解质溶 液(或者熔融态)导电是因为存在自由移动的离 子。在固态的离子化合物中,虽然有阴阳离子, 但由于强烈的静电作用,离子并不能自由移动。 因此NaCl晶体、CuSO4·5H2O晶体都不导电。
电解质和非电解质 课件

知识点 2 电解质的电离与溶液的导电性
【例题2】 下列叙述正确的是( ) A.NaCl溶液在电流作用下电离成Na+和ClB.NaCl是电解质,故NaCl晶体能导电 C.氯化氢溶于水能导电,但液态氯化氢不能导电 D.导电性强的溶液里自由移动离子数目一定比导电性弱的溶液 里自由移动离子数目多 解析:NaCl固体溶于水,在水分子的作用下,电离出自由移动的Na+ 和Cl-,而不是电流的作用,A错误;NaCl是电解质,但晶体中Na+和Cl不能自由移动,故NaCl晶体不导电,B错误;HCl液态时不导电,但溶 于水能电离出H+和Cl-,故C正确;溶液导电性强弱与离子的浓度和 离子所带电荷多少有关,而非离子数目,D错误。 答案:C
CO2和SO2的水溶液均导电,它们是电解质吗? 提示:不是。电解质必须是在水溶液里或熔融状态下自身发生电 离的化合物,而CO2和SO2的水溶液之所以导电,是因为它们与水反 应生成了电解质H2CO3和H2SO3,所以CO2和SO2是非电解质。
二、电解质的电离
1.定义
电解质在水溶液里或熔融状态下离解成自由移动离子的过程。
三、电离方程式的书写要点 1.质量守恒:“ ”两边原子种类、数目、质量不变。 2.电荷守恒:正电荷总数=负电荷总数。 3.电离过程中,原子团并不拆开。 4.元素或原子团的正价数等于形成的阳离子所带的正电荷数。 同理,元素或原子团的负价数等于形成的阴离子所带的负电荷数。 离子的个数用阿拉伯数字标在离子符号之前。
点拨电解质的电离与是否有外加电流没有关系,电解质电离的外 部条件是将电解质溶于水或者将电解质熔化。
知识点 3 电离方程式的书写
【例题 3】 下列电离方程式书写正确的是( )
A.NaOH B.NaOH
《电解质和非电解质》ppt课件

.
平常接触到的电解质有哪些呢 电解质
.
平常接触到的非电解质有哪些呢 蔗糖、乙醇等大多数有机物 特例: CH3COOH
.
【活学活用】
以下物质哪些是电解质?哪些是非电解④H2SO4⑤碳
棒 ⑥ KOH ⑦熔融形状的KNO3 ⑧葡萄糖
电解质:④ ⑥ ⑦
非电解质: ⑧
区别 发生电离
下本身不能发生电离
物质 ①酸 ②碱 ③盐④金属氧化物 ①部分非金属氧化物②
类型
部分非金属氢化物③部
分有机物
.
.
能导电:①②④⑤⑥ ⑦
SO2
.
为什么电解质在水溶液里或熔融形状下可 以导电
.
缘由:是由于它们在水溶液 里或熔融形状下电离出自在 挪动的离子。
.
例:NaCl在水中的溶解和电离
.
结论
电解质之所以导电,是由于它们在水溶液 里或熔融形状下电离出自在挪动的离子。
.
问题处理
SO2 水溶液能导电,但不是电解质 SO2+H2O⇌H2SO3 ⇅ H++SO32-
铁、铜、水、NaOH溶液、蔗糖、 HCl溶液、乙醇
能导电: 铁、铜、水、NaOH溶液、 HCl溶液
不能导电:蔗糖、乙醇
.
电解质和非电解质
.
电解质:在水溶液里或熔融形状下能导电的化 合物. 如:NaOH、 NaCl、 Na2O
非电解质:在水溶液里或熔融形状下都不导电 的化合物. 如:蔗糖、乙醇等。
SO2 水溶液能导电,是SO2和H2O发生反响 生成的亚硫酸部分电离产生的H+和SO32导电。
SO2为非电解质,类似的物质还有: CO2、 NH3
.
化 合 物
.
平常接触到的电解质有哪些呢 电解质
.
平常接触到的非电解质有哪些呢 蔗糖、乙醇等大多数有机物 特例: CH3COOH
.
【活学活用】
以下物质哪些是电解质?哪些是非电解④H2SO4⑤碳
棒 ⑥ KOH ⑦熔融形状的KNO3 ⑧葡萄糖
电解质:④ ⑥ ⑦
非电解质: ⑧
区别 发生电离
下本身不能发生电离
物质 ①酸 ②碱 ③盐④金属氧化物 ①部分非金属氧化物②
类型
部分非金属氢化物③部
分有机物
.
.
能导电:①②④⑤⑥ ⑦
SO2
.
为什么电解质在水溶液里或熔融形状下可 以导电
.
缘由:是由于它们在水溶液 里或熔融形状下电离出自在 挪动的离子。
.
例:NaCl在水中的溶解和电离
.
结论
电解质之所以导电,是由于它们在水溶液 里或熔融形状下电离出自在挪动的离子。
.
问题处理
SO2 水溶液能导电,但不是电解质 SO2+H2O⇌H2SO3 ⇅ H++SO32-
铁、铜、水、NaOH溶液、蔗糖、 HCl溶液、乙醇
能导电: 铁、铜、水、NaOH溶液、 HCl溶液
不能导电:蔗糖、乙醇
.
电解质和非电解质
.
电解质:在水溶液里或熔融形状下能导电的化 合物. 如:NaOH、 NaCl、 Na2O
非电解质:在水溶液里或熔融形状下都不导电 的化合物. 如:蔗糖、乙醇等。
SO2 水溶液能导电,是SO2和H2O发生反响 生成的亚硫酸部分电离产生的H+和SO32导电。
SO2为非电解质,类似的物质还有: CO2、 NH3
.
化 合 物
.
高一化学电解质和非电解质精品PPT课件

不可拆:弱酸、弱碱、难溶性盐、气体、氧化物、 水、单质
查 原子个数守恒和电荷守恒
写出下列反应的离子方程式:
(1)Na2CO3 + HCl (3)NaHCO3 + HCl
NaOH
(2)CaCO3 + HCl (4)NaHCO3 +
(5)CuSO4 + Ba(OH)2 (6)Na + H2O (7)Na2O2 + H2O
电解质
分类依据 强电解质:全部电离(强酸、强碱、大部分盐)
三大强酸: H2SO4 、HNO3 、HCl 四大强碱: NaOH、KOH、Ca(OH)2、 B大a部(O分H盐)2:包含难溶性盐(如:BaSO4) 弱电解质:部分电离(弱酸、弱碱、水)
难电离物质:弱酸(CH3COOH、H2CO3 、 H2SO3 );
电解质
电解质 非电解质 非电解质
1、下列物质中导电性最差的是( )
A. 熔融的氯化物
B. 固态钾
C. 盐酸溶液
D.固态氯化钾
2、下列说法正确的是( ) A、液态HCl和固态NaCl均不能导电,所以HCl和NaCl 是非电解质 B、NH3和CO2的水溶液均能导电,所以NH3和CO2是 电解质 C、铜和石墨均能导电,所以它们是电解质 D、蔗糖和酒精在溶于水和熔化时均不能导电,所以它 们是非电解质
可变价较多的元素: N : -3、0、+1、+2、+4、+5
Cl : -1、0、+1、+5、+7 S : -2、0、+4、+6
△ NH4NO3 ==== N2O↑ + 2H2O
↑
2、箭头从反应物指向产物
H2S + H2SO4 == S + SO2↑ + 2H2O “就近原则”——将化合价从小到大排列,反应物的
查 原子个数守恒和电荷守恒
写出下列反应的离子方程式:
(1)Na2CO3 + HCl (3)NaHCO3 + HCl
NaOH
(2)CaCO3 + HCl (4)NaHCO3 +
(5)CuSO4 + Ba(OH)2 (6)Na + H2O (7)Na2O2 + H2O
电解质
分类依据 强电解质:全部电离(强酸、强碱、大部分盐)
三大强酸: H2SO4 、HNO3 、HCl 四大强碱: NaOH、KOH、Ca(OH)2、 B大a部(O分H盐)2:包含难溶性盐(如:BaSO4) 弱电解质:部分电离(弱酸、弱碱、水)
难电离物质:弱酸(CH3COOH、H2CO3 、 H2SO3 );
电解质
电解质 非电解质 非电解质
1、下列物质中导电性最差的是( )
A. 熔融的氯化物
B. 固态钾
C. 盐酸溶液
D.固态氯化钾
2、下列说法正确的是( ) A、液态HCl和固态NaCl均不能导电,所以HCl和NaCl 是非电解质 B、NH3和CO2的水溶液均能导电,所以NH3和CO2是 电解质 C、铜和石墨均能导电,所以它们是电解质 D、蔗糖和酒精在溶于水和熔化时均不能导电,所以它 们是非电解质
可变价较多的元素: N : -3、0、+1、+2、+4、+5
Cl : -1、0、+1、+5、+7 S : -2、0、+4、+6
△ NH4NO3 ==== N2O↑ + 2H2O
↑
2、箭头从反应物指向产物
H2S + H2SO4 == S + SO2↑ + 2H2O “就近原则”——将化合价从小到大排列,反应物的
电解质和非电解质课件

03
CHAPTER
非电解质的分类和特性
有机非电解质
有机非电解质是指分子结构中不含离 子键的有机化合物。
有机非电解质的溶解性通常与溶剂的 性质有关,它们在水中具有一定的溶 解度,但在有机溶剂中的溶解度更大 。
这类化合物通常由碳、氢、氧、氮等 元素组成,常见的有机非电解质包括 乙醇、乙酸、蔗糖等。
有机非电解质在化学反应中通常表现 出较弱的酸性或碱性,因此对酸碱指 示剂的颜色变化不明显。
电解质的电离平衡
总结词
在一定条件下,电解质在水中电离和结合成离子的速率相等 ,达到动态平衡状态,称为电离平衡。
详细描述
当电解质在水中电离时,会有一部分离子重新结合成分子。 在一定的温度下,电离和结合的速率相等,溶液中的离子浓 度不再发生变化,此时达到电离平衡状态。温度、浓度等因 素会影响电解质的电离平衡状态。
非电解质
非电解质是指在溶液或熔融状态 下不能导电的化合物。
分类
电解质分类
强电解质和弱电解质。
非电解质分类
有机非电解质和无机非电解质。
特性
电解质特性
在溶液中能电离出自由移动的离子, 具有导电性。
非电解质特性
在溶液中不能电离出自由移动的离子 ,不具有导电性。
02
CHAPTER
电解质的分类和特性
强电解质
联系
都属于化合物
电解质和非电解质都是化合物,不是单质或混合物。
水溶液中可能存在电离平衡
电解质在水中可以发生电离,形成自由移动的离子;非电解质在水 中可能也会发生某种程度的电离或水解。
都可能具有导电性
某些非电解质在特定条件下,如溶解在有机溶剂中,也可能表现出 一定的导电性。
应用场景
电解质和非电解质PPT课件
在溶液中 的存在形
式
本身能电离
阴阳离子 可能存在分子
本身不能电离 只有分子
包含的物质种 类
非金属氧化物、某 酸、碱、盐、水、 些非金属氢化物 活泼金属氧化物 (如: NH3 )、绝
大多数有机物(如 酒精、蔗糖)等
课堂练习二
判断正误
(1)NaCl溶液导电,所以NaCl溶液是电解质;
(2)固体NaCl不导电,但NaCl是电解质;
氯化钠溶液导电性实验
几种物质的导电性试验结果
物质
状态 水溶液 熔化状
态
食盐 NaCl
能 能
氢氧 化钾 KOH
能
能
氯化 氢 HCl 能
不能
一、电解质
1、电解质:在水溶液里或熔融状态
下能够导电的化合物叫做电解质。
联想·质疑
问题1 金属导电的原因是什么?
金属导电是因为存在自由移动 的电子。
联想·质疑
是 ③⑨
;
(3问题1 身体有汗的人为何接触使
用着的电器容易发生触电事故?
汗液为电解质溶液可导电,所以 易发生触电事故。
问题2 1、电离与通电有关吗?
2、电离的条件。 答:1、电离与通电与否无关。 2、溶于水或熔融可导致电离。
课后作业
课课练p6
谢谢!!!
蔗电解质非电解质相同点本质区别在溶液中的存在形本身能电离本身不能电离阴阳离子可能存在分子只有分子活泼金属氧化物非金属氧化物某些非金属氢化物大多数有机物如酒精蔗糖等化合物化合物课堂练习二判断正误1nacl溶液导电所以nacl溶液是电解质
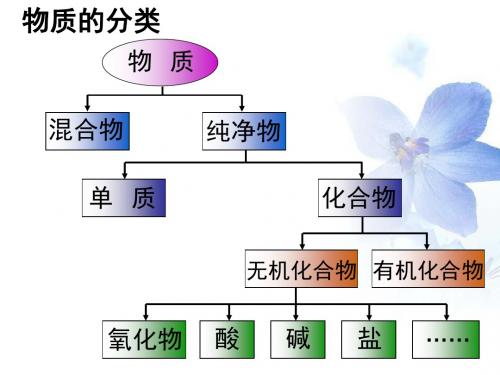
物质的分类
物质
混合物
纯净物
单质
化合物
无机化合物 有机化合物
氧化物 酸 碱 盐 ……
电解质和非电解质 ppt课件
离子反应
酸碱盐在水溶液中的电离
(2)电离方程式的书写
①式子左边书写化学式,表示电解质还未电离时 的状态;右边书写离子符号,表示电解质电离产
生的离子。 CuSO4== Cu2++SO42-
②正确书写离子符号
H2SO4
H2+ + SO42-
③遵守质量守恒定律和电荷守恒定律
MgCl2
Mg2++ Cl-
在相同条件下,取决于自由移动 离子的浓度和离子所带的电荷
5、电解质溶液中的电荷守恒
阳离子所带的正电荷总数等于阴离 子所带的负电荷总数
强酸
强碱
离子化
强电解质 几乎所有的盐 合物
电解质
金属氧化物
弱酸
化合物
弱电解质 弱碱
水
非电解质
如:蔗糖、酒精等
讨论:下列物质能导电的是_①_③_⑥_属于 电解质的是:__②_⑤_⑨__属于非电解质
④⑦⑧
①Cu ② NaCl固体 ③盐酸 ④CO2 ⑤HCl ⑥ KOH溶液 ⑦蔗糖 ⑧酒精 ⑨BaSO4
(2)电解质和非电解质的物质种类
电解质:酸、碱、盐、水和部分金属 氧化物. 非电解质:大多数有机物和除水外的非 金属氧化物.
小试身手:
下列属铜 ②固态NaCl ③O2 ④H2SO4 ⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨葡萄糖 ⑩CO2
电解质:②④⑧
非电解质:⑨⑩ 能导电:①⑤⑦⑧
3.强电解质和弱电解质 (1)定义: 强电解质:在水溶液中或熔融状态下能 完全电离的电解质。
弱电解质:弱酸、弱碱、水。
(4)电离方程式的书写区别:
强电解质用 表示
弱电解质用 表示
酸碱盐在水溶液中的电离
(2)电离方程式的书写
①式子左边书写化学式,表示电解质还未电离时 的状态;右边书写离子符号,表示电解质电离产
生的离子。 CuSO4== Cu2++SO42-
②正确书写离子符号
H2SO4
H2+ + SO42-
③遵守质量守恒定律和电荷守恒定律
MgCl2
Mg2++ Cl-
在相同条件下,取决于自由移动 离子的浓度和离子所带的电荷
5、电解质溶液中的电荷守恒
阳离子所带的正电荷总数等于阴离 子所带的负电荷总数
强酸
强碱
离子化
强电解质 几乎所有的盐 合物
电解质
金属氧化物
弱酸
化合物
弱电解质 弱碱
水
非电解质
如:蔗糖、酒精等
讨论:下列物质能导电的是_①_③_⑥_属于 电解质的是:__②_⑤_⑨__属于非电解质
④⑦⑧
①Cu ② NaCl固体 ③盐酸 ④CO2 ⑤HCl ⑥ KOH溶液 ⑦蔗糖 ⑧酒精 ⑨BaSO4
(2)电解质和非电解质的物质种类
电解质:酸、碱、盐、水和部分金属 氧化物. 非电解质:大多数有机物和除水外的非 金属氧化物.
小试身手:
下列属铜 ②固态NaCl ③O2 ④H2SO4 ⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨葡萄糖 ⑩CO2
电解质:②④⑧
非电解质:⑨⑩ 能导电:①⑤⑦⑧
3.强电解质和弱电解质 (1)定义: 强电解质:在水溶液中或熔融状态下能 完全电离的电解质。
弱电解质:弱酸、弱碱、水。
(4)电离方程式的书写区别:
强电解质用 表示
弱电解质用 表示
《电解质与非电解质》课件
电解质与非电解质的比较
电解质
能在溶液中产生离子
非电解质
不能产生离子
电解质与非电解质的溶解性
电解质
可溶于水和其他极性溶剂
非电解质
通常溶于非极性溶剂
电解质的导电性
1 电解质溶液能导电
2 非电解质不能导电
因为离子在溶液中能自由移动,带电荷的 离子能够传导电流。
因为非电解质溶液中没有离子可以传导电 流。
2 分为强电解质和弱电解质
电解质在溶液中能迅速分解成离子,并导 电。
强电解质在溶液中完全离解生成离子,如 强酸和强碱;弱电解质在溶液中只部分离 解生成离子,如弱酸和弱碱。
非电解质的特点与分类
1 不能产生离子Biblioteka 2 分为有机和无机非电解质
非电解质溶解时不会产生离子,不导电。
有机非电解质是由碳和氢组成的化合物, 如脂肪、糖类和醇类;无机非电解质是其 他类型的化合物,如水和二氧化碳。
电解质与非电解质在生活中的应用
电解质应用
用于制作电池、电解过程和水处理。
非电解质应用
用于食物加工、药物制备和化妆品生产。
《电解质与非电解质》 PPT课件
本PPT课件将介绍电解质与非电解质的定义,电解质的特点与分类,非电解 质的特点与分类,以及它们在生活中的应用。
电解质与非电解质的定义
电解质是能在溶液中产生离子的化合物,如盐类和酸碱物质;非电解质是不 能产生离子的化合物,如脂肪、糖类和醇类物质。
电解质的特点与分类
1 离子形成能力强
电解质和非电解质PPT课件
以下是氢氧化钠,氢氧化钡的电离方程 式
阳离子
阴 盐在水溶液中可电离出金属阳离子和酸根 阴离子。 zxxkw
• 盐的电离通式:盐=金属离子+酸根离子 • 以下是氯化钠,碳酸钠,硫酸铜的电离方
程式
阳离子
阴离子
2021
14
2.电解质是指化合物本质(纯净物),而不是指它的溶 液,它的溶液可称为电解质溶液(混合物)如:盐酸。
3.C它O们2 本、身SO不2 是、电NH解3等质物,而质是的非水电溶解液质虽. 然能导电,但
4.电解质本身不一定能导电,能导电的不一定是电解 质.
2021
2
【问题解决】
判断下列说法是否正确。
× A:NaCl溶液导电,所以NaCl溶液是电解质;
2021
6
书写电离方程式时应特别注意
①写出物质正确的化学式是正确书写电离方程式的 基础。
zxxkw
②要正确书写出电离的阳离子、阴离子的符号。 ③含有原子团的物质电离时,原子团应作为一个整
体,不能分开。 ④表示离子数目的数字要写在离子符号的前面, ⑤在电离方程式中,阴阳离子所带正负电荷的总数
必须相等。
电解质和非电解质
1、电解质和非电解质
zxxkw
学科网
在水溶液中或熔化状态下能导电 学.科.网 的化合物,叫做电解质。
在水溶液中和熔 化状态下都不能 导电的化合物, 叫做非电解质。
2021
1
• 电解质:酸、碱、盐、水、部分金属氧化物等 • 非电解质:多数有机物、非金属氧化物等。
• 概念理解注意点:
1.电解质必须是化合物,一切单质既不是电解质也不 是非电解质。
• ⑩蔗糖(C12H2学2科网O11)
电解质: ② ⑤ ⑧ ⑨ 非电解质: ③ ④ ⑩
阳离子
阴 盐在水溶液中可电离出金属阳离子和酸根 阴离子。 zxxkw
• 盐的电离通式:盐=金属离子+酸根离子 • 以下是氯化钠,碳酸钠,硫酸铜的电离方
程式
阳离子
阴离子
2021
14
2.电解质是指化合物本质(纯净物),而不是指它的溶 液,它的溶液可称为电解质溶液(混合物)如:盐酸。
3.C它O们2 本、身SO不2 是、电NH解3等质物,而质是的非水电溶解液质虽. 然能导电,但
4.电解质本身不一定能导电,能导电的不一定是电解 质.
2021
2
【问题解决】
判断下列说法是否正确。
× A:NaCl溶液导电,所以NaCl溶液是电解质;
2021
6
书写电离方程式时应特别注意
①写出物质正确的化学式是正确书写电离方程式的 基础。
zxxkw
②要正确书写出电离的阳离子、阴离子的符号。 ③含有原子团的物质电离时,原子团应作为一个整
体,不能分开。 ④表示离子数目的数字要写在离子符号的前面, ⑤在电离方程式中,阴阳离子所带正负电荷的总数
必须相等。
电解质和非电解质
1、电解质和非电解质
zxxkw
学科网
在水溶液中或熔化状态下能导电 学.科.网 的化合物,叫做电解质。
在水溶液中和熔 化状态下都不能 导电的化合物, 叫做非电解质。
2021
1
• 电解质:酸、碱、盐、水、部分金属氧化物等 • 非电解质:多数有机物、非金属氧化物等。
• 概念理解注意点:
1.电解质必须是化合物,一切单质既不是电解质也不 是非电解质。
• ⑩蔗糖(C12H2学2科网O11)
电解质: ② ⑤ ⑧ ⑨ 非电解质: ③ ④ ⑩
(一)电解质和非电解质
程式 1、Fe和CuSO4溶液反应 、 和 2、醋酸溶液与氢氧化钠溶液反应 、 3、盐酸和氢氧化钙溶液反应 、 4、硫酸和氢氧化钡溶液反应 、 5、氯气与水反应 、 6、过氧化钠与水反应 、 7、醋酸溶液与氨水反应 、 8、氯气与氢氧化钠溶液反应 、
*酸、碱、盐的溶解性: 酸 盐的溶解性 (1)除硅酸 2SiO3)外,其余酸都可溶。 除硅酸(H 外 其余酸都可溶。 除硅酸 其余酸都可溶 (2)NaOH、KOH、Ba(OH)2、NH3.H2O可 、 可 、 ( ) 溶,Ca(OH)2微溶,其余碱不溶。 微溶 其余碱不溶。 其余碱不溶 (3) 钾、钠、硝、氨盐可溶。 氨盐可溶。 盐酸盐除银盐、亚汞盐 盐酸盐除银盐、亚汞盐AgCl、Hg2Cl2 、 硫酸盐除钡盐、铅盐 硫酸盐除钡盐、铅盐BaSO4、PbSO4(CaSO4、 Ag2SO4微溶) 微溶) 碳酸、磷酸盐大多不溶。 碳酸、磷酸盐大多不溶。
四、强、弱电解质 (一)电解质和非电解质 电解质 定义 物质种类 能否电离 非电解质
在水溶液里或 在水溶液和 在水溶液里或熔化 在水溶液和熔化状 都不导电的 状态下能够导电的 态都不导电的化合 化合物 物 酸、碱、盐等化合 大多数有机化合物、 大多数有机化合物、 物及水 CO2、SO2、NH3等 能 否 只有分子
例:下列各组离子中的离子,能在溶液中大量共存 下列各组离子中的离子, 的是 ( ) A、Na+、Mg2+ 、 Cl—、OH— 、 B、H+ 、 Ca2+ 、 CO32—、NO3— 、 C、Cu2+ 、 K+ 、 SO42—、NO3— 、 D、Na+ 、 HCO3—、OH—、Ca2+ 、
*离子共存: 离子共存: 离子共存
(
)
*酸、碱、盐的溶解性: 酸 盐的溶解性 (1)除硅酸 2SiO3)外,其余酸都可溶。 除硅酸(H 外 其余酸都可溶。 除硅酸 其余酸都可溶 (2)NaOH、KOH、Ba(OH)2、NH3.H2O可 、 可 、 ( ) 溶,Ca(OH)2微溶,其余碱不溶。 微溶 其余碱不溶。 其余碱不溶 (3) 钾、钠、硝、氨盐可溶。 氨盐可溶。 盐酸盐除银盐、亚汞盐 盐酸盐除银盐、亚汞盐AgCl、Hg2Cl2 、 硫酸盐除钡盐、铅盐 硫酸盐除钡盐、铅盐BaSO4、PbSO4(CaSO4、 Ag2SO4微溶) 微溶) 碳酸、磷酸盐大多不溶。 碳酸、磷酸盐大多不溶。
四、强、弱电解质 (一)电解质和非电解质 电解质 定义 物质种类 能否电离 非电解质
在水溶液里或 在水溶液和 在水溶液里或熔化 在水溶液和熔化状 都不导电的 状态下能够导电的 态都不导电的化合 化合物 物 酸、碱、盐等化合 大多数有机化合物、 大多数有机化合物、 物及水 CO2、SO2、NH3等 能 否 只有分子
例:下列各组离子中的离子,能在溶液中大量共存 下列各组离子中的离子, 的是 ( ) A、Na+、Mg2+ 、 Cl—、OH— 、 B、H+ 、 Ca2+ 、 CO32—、NO3— 、 C、Cu2+ 、 K+ 、 SO42—、NO3— 、 D、Na+ 、 HCO3—、OH—、Ca2+ 、
*离子共存: 离子共存: 离子共存
(
)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
平时接触到的非电解质有哪些呢 蔗糖、乙醇等大多数有机物
特例: CH3COOH
【活学活用】
下列物质哪些是电解质?哪些是非电解质?哪
些能导电?
①金属铜 ②SO2水溶液③O2 ④H2SO4⑤碳棒 ⑥ KOH ⑦熔融状态的KNO3 ⑧葡萄糖 电解质:④ ⑥ ⑦
非电解质: ⑧
能导电:①②④⑤⑥ ⑦
SO2
为什么电解质在水溶液里或熔融状态下能 够导电
SO2为非电解质,类似的物质还有: CO2、 NH3
化 合 物
电解质和非电解质的比较:
电解质
非电解质
相同 点
均为化合物
不同 水溶液或熔融状态能导电 点
水溶液和熔融状态都不 能导电
本质 在水溶液中或熔融状态下自身能 在水溶液中和熔融状态
区别 发生电离
下自身不能发生电离
物质 ①酸 ②碱 ③盐④金属氧化物 ①部分非金属氧化物②
类因:是由于它们在水溶液里或熔融
状态下电离出自由移动的离子。
例:NaCl在水中的溶解和电离
结论
电解质之所以导电,是由于它们在水溶液 里或熔融状态下电离出自由移动的离子。
问题解决
SO2 水溶液能导电,但不是电解质
SO2+H2O⇌H2SO3
⇅
H++SO32S生O成2 的水亚溶硫液酸能部导分电电,离是产SO生2和的HH2+O和发S生O3反2-应导 电。
铁、铜、水、NaOH溶液、蔗糖、 HCl溶液、乙醇
能导电: 铁、铜、水、NaOH溶液、 HCl溶液
不能导电:蔗糖、乙醇
电解质和非电解质
电解质:在水溶液里或熔融状态下能导电的化 合物. 如:NaOH、 NaCl、 Na2O
非电解质:在水溶液里或熔融状态下都不导电 的化合物. 如:蔗糖、乙醇等。
平时接触到的电解质有哪些呢 电解质
