第-1章--化学热力学基础习题解答(二)
第1章化学热力学基础复习题

化学热力学基础复习题一、是非题下列各题的叙述是否正确?正确的在题后括号内画“√”,错误的画“⨯”1 在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。
( )1答:⨯2 25℃时H2(g)的标准摩尔燃烧焓在量值上等于25℃时H2O(g)的标准摩尔生成焓。
()2答: √p423 稳定态单质的∆f H m (800K)=0 。
( )3答: √4 d U=nC v,m d T公式对一定量的理想气体的任何pVT过程都适用。
( )4答: √p325 系统处于热力学平衡态时,其所有的宏观性质都不随时间而变。
()5答:√6 若系统的所有宏观性质均不随时间而变,则该系统一定处于平衡态。
()6答: √7 隔离系统的热力学能是守恒的。
()7答:√8隔离系统的熵是守恒的。
()8答:⨯9 一定量理想气体的熵只是温度的函数。
()9答:⨯10 绝热过程都是定熵过程。
()10答:⨯11 一个系统从始态到终态,只有进行可逆过程才有熵变。
()11答:⨯12 系统从同一始态出发,经绝热不可逆过程到达的终态,若经绝热可逆过程,则一定达不到此终态。
()12答: √13 热力学第二定律的克劳修斯说法是:热从低温物体传到高温物体是不可能的。
()13答:⨯p5114 系统经历一个不可逆循环过程,其熵变> 0。
()14答:⨯p5115 系统由状态1经定温、定压过程变化到状态2,非体积功W’<0,且有W’>∆G和∆G <0,则此状态变化一定能发生。
()15答: √16 绝热不可逆膨胀过程中∆S >0,则其相反的过程即绝热不可逆压缩过程中∆S <0。
()16答:⨯17 临界温度是气体加压液化所允许的最高温度。
( )17答:√18 化学势是一广度量。
()18 答: ⨯19 只有广度性质才有偏摩尔量。
( )19答: √20 ),(,,B B C C n V S n U ≠⎪⎪⎭⎫ ⎝⎛∂∂ 是偏摩尔热力学能,不是化学势。
第一章化学热力学习题参考答案
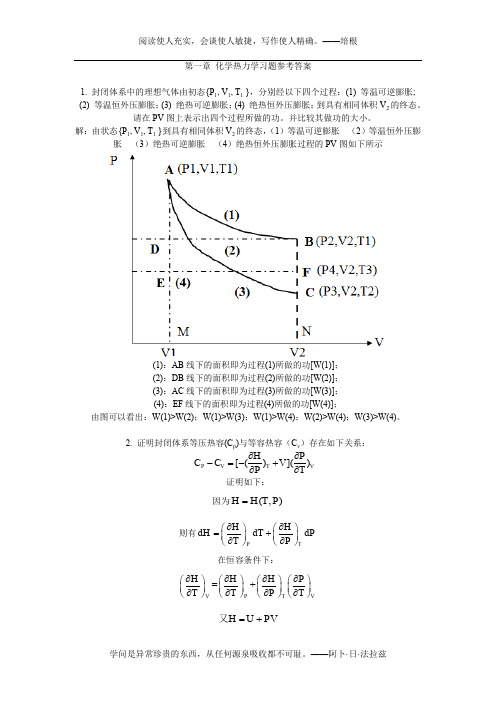
第一章 化学热力学习题参考答案1. 封闭体系中的理想气体由初态{P 1, V 1, T 1 },分别经以下四个过程:(1) 等温可逆膨胀;(2) 等温恒外压膨胀;(3) 绝热可逆膨胀;(4) 绝热恒外压膨胀;到具有相同体积V 2的终态。
请在PV 图上表示出四个过程所做的功。
并比较其做功的大小。
解:由状态{P 1, V 1, T 1 }到具有相同体积V 2的终态,(1)等温可逆膨胀 (2)等温恒外压膨胀 (3)绝热可逆膨胀 (4)绝热恒外压膨胀过程的PV 图如下所示(1):AB 线下的面积即为过程(1)所做的功[W(1)];(2):DB 线下的面积即为过程(2)所做的功[W(2)];(3):AC 线下的面积即为过程(3)所做的功[W(3)];(4):EF 线下的面积即为过程(4)所做的功[W(4)];由图可以看出:W(1)>W(2);W(1)>W(3);W(1)>W(4);W(2)>W(4);W(3)>W(4)。
2. 证明封闭体系等压热容(C p )与等容热容(C v )存在如下关系:[()]()P V T V H P C C V P T∂∂-=-+∂∂ 证明如下:因为(,)H H T P = 则有∂∂⎛⎫⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭P TH H dH dT dP T P 在恒容条件下:V =+P P T V H H H P T T T ∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫ ⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭H U PV =+又U ()则 V V P T VPV H H P T T T P T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫+=+ ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭ U ()=+移项得: P V T V VH H P PV T T P T T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫-- ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭ =V P V T V H P C C P T ⎡⎤∂∂⎛⎫⎛⎫-=- ⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦=V P V T VH P C C P T ⎡⎤∂∂⎛⎫⎛⎫-- ⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦即3. 令 H = H(T, P) 和 S = S(T, P), 根据热力学关系式推导以下关系式:(1)2211[()]T P P P T P V H C dT T V dP T∂∆=+-+∂⎰⎰ (2)2211[()]T P P P T P C V S dT dP T T ∂∆=+-∂⎰⎰ 解答:(1)式证明:()()因为 p T H H dH dT dp T p∂∂=+∂∂ () (1)T H CpdT dp p ∂=+∂ dH TdS Vdp =+又()()T T H S T V p p∂∂=+∂∂则 (2) ()()T P S V p T ∂∂=-∂∂且有麦克斯韦关系式 (3) 将(2)和(3)式代入(1)式得:[()]p P V dH C dT T V dp T ∂=+-+∂ 积分得:2211[()]T P P P T P V H C dT T V dP T∂∆=+-+∂⎰⎰ (2)式证明:因为()()(4)P T S S dS dT dP T P∂∂=+∂∂ 将(3)式代入(4)式得:()[()](5)P p S V dS dT dP T T ∂∂=+-∂∂据dH TdS VdP =+得:()P H T S ∂=∂,即()()P P H T T T S∂∂=∂∂ 因而有:1()()(6)P P P C S H T T T T∂∂==∂∂ 将(6)式代入(5)式得:[()](7)P P C V dS dT dP T T∂=+-∂对(7)式积分得:2211[()]T P P P T P C V S dT dP T T∂∆=+-∂⎰⎰4. 证明卡诺循环中证明:卡诺循环P-V 图如下: Q 2卡诺循环经如下过程(理想气体)1、等温可逆膨胀22U 0T Q W ∆=+=,2222121ln V T V V Q W PdV nRT V =-==⎰ 2、绝热可逆膨胀1,112()Q V U Q W C T T ∆=+=-,,10,Q Q U W =∆=,113222311Q V V nRT V W PdV V γγ-⎡⎤⎛⎫⎢⎥==- ⎪-⎢⎥⎝⎭⎣⎦⎰3、等温可逆压缩Q 211U 0T Q W ∆=+=4411313ln VT V V Q W PdV nRT V =-==⎰ 4、绝热可逆压缩2,221()Q V U Q W C T T ∆=+=-220,,Q Q U W =∆=,214213411Q V V nRT V W PdV V -⎡⎤⎛⎫⎢⎥=-=- ⎪-⎢⎥⎝⎭⎣⎦⎰γγ 12,1,2,Q Q U U W W ∆=-∆=-可知则 12144323,V V V V V V V V ==则有即或:根据绝热可逆过程方程PV =常数可得:1423V V V V = 整个循环过程中:2,11,221T Q T Q T T W W W W W W W =+++=+2211,T T W Q W Q ==又2421131232221ln ln =ln V V nRT nRT V V Q Q W V Q Q nRT V η++==故有1423V V V V =又1221222=Q Q T T W Q Q T η+-==所以有5. 理想气体从始态(P 1, V 1, T 1)到终态 (P 2, V 2, T 2),设计三条不同路径,计算熵变,并证明三条路径所得结果一致。
第一章化学热力学基础参考答案

第一章2.计算下行反应的标准反应焓变△r Hθm:解:①2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s)△f Hθm(kJ•mol-1) 0 -824.2 -1675.7 0 △r Hθm=△f Hθm(Al2O3,s)+2△f Hθm(Fe,s)-2△f Hθm(Al,s)- △f Hθm(Fe2O3 ,s)= -1675.7 + 2×0 - 2×0 - (-824.2)= - 851.5 (kJ•mol-1)②C2H2 (g) + H2(g) → C2H4(g)△f Hθm(kJ•mol-1) 226.73 0 52.26△r Hθm = △f Hθm(C2H4 ,g) - △f Hθm(C2H2,g) - △f Hθm(H2,g)= 52.26 - 226.73 - 0= -174.47 (kJ•mol-1)3. 由下列化学方程式计算液体过氧化氢在298 K时的△f Hθm(H2O2,l):① H2 (g) + 1/2O2 (g) = H2O (g) △r Hθm = - 214.82 kJ•mol-1② 2H(g) + O(g) = H2O (g) △r Hθm = - 926.92 kJ•mol-1③ 2H(g) + 2O(g) = H2O2 (g) △r Hθm = - 1070.6 kJ•mol-1④ 2O(g) = O2 (g) △r Hθm = - 498.34 kJ•mol-1⑤ H2O2 (l) = H2O2 (g) △r Hθm= 51.46 kJ•mol-1解:方法1:根据盖斯定律有:[(方程①-方程②+方程③-方程⑤)×2-方程④]÷2可得以下方程⑥H2(g)+O2(g)=H2O2(l) △r Hθm△r Hθm=[(△r Hθ1-△r Hθ2+△r Hθ3-△r Hθ5) ×2-△r Hθ4] ÷2={[-214.82-(-926.92)+(-1070.6)-51.46] ×2-(-498.34)} ÷2=[(-409.96)×2+498.34] ÷2=(-321.58) ÷2= -160.79(kJ•mol-1)△f Hθm(H2O2 ,l)= △r Hθm= -160.79 kJ•mol-1方法2:(1)由①可知H2O的△f Hθm(H2O,g)= - 214.82 kJ•mol-1(2)根据④计算O的△f Hθm(O,g)2O(g) = O2 (g) △r Hθm = - 498.34 kJ•mol-1△r Hθm = △f Hθm(O2 ,g)- 2△f Hθm(O,g)= 0 - 2△f Hθm(O,g)= - 498.34 kJ•mol-1△f Hθm(O,g)= 249.17 kJ•mol-1(3) 根据②求算△f Hθm(H,g)2H(g) + O(g) = H2O (g) △r Hθm = - 926.92 kJ•mol-1△f Hθm(kJ•mol-1) 249.17 - 214.82△r Hθm = △f Hθm(H2O,g) - 2△f Hθm(H,g) -△f Hθm(O,g)= - 214.82 - 2△f Hθm(H,g)- 249.17= - 926.92△f Hθm(H,g)= 231.465 kJ•mol-1(4) 根据③求算△f Hθm(H2O2 ,g)2H(g) + 2O(g) = H2O2 (g) △r Hθm = - 1070.6 kJ•mol-1△f Hθm(kJ•mol-1) 231.465 249.17△r Hθm = △f Hθm(H2O2 ,g) - 2△f Hθm(H,g) -2△f Hθm(O,g)=△f Hθm(H2O2 ,g) -2×231.465 - 2×249.17= - 1070.6△f Hθm(H2O2 ,g)= - 109.33 kJ•mol-1(5) 根据⑤求算△f Hθm(H2O2 ,l)H2O2 (l) = H2O2 (g) △r Hθm= 51.46 kJ•mol-1△f Hθm(kJ•mol-1) -109.33△r Hθm = △f Hθm(H2O2 ,g) - △f Hθm(H2O2 ,l)= -109.33 - △f Hθm(H2O2 ,l)= 51.46△f Hθm(H2O2 ,l)= -160.79 kJ•mol-14. 在373 K,101.3 kPa下,2.0 mol H2和1.0 mol O2反应,生成2.0 mol的水蒸气,总共放热484 kJ的热量,求该反应的△r H m和△U。
第1章化学热力学基础习题解答.doc

A r H/fX298J5/C) = 2x(-393.5U^7w/-1) + 2x(-285.8V-m^/-,)-(-484.5U-m<?/-1)= S14AU-mol-i7.关于热力学第二定律,下列说法不正确的是(D )A.第二类永动机是不可能制造出来的B.把热从低温物体传到高温物体,不引起其他变化是不可能的C.一切实际过程都是热力学不可逆过程D.功可以全部转化力热,但热一定不能全部转化力功这是有条件的,即在不引起环境改变的前提下(不留下痕迹)二、填空题(在以下各小题中岡有“_________ 处填上答案)1.物理量Q (热量)、T (热力学温度)、V (系统体积)、W (功),其中属于状态函数的是_T、V ;与过程有关的量是_Q、W ;状态函数中属于广度量的是_ V •.属于强度景的是_ T 。
2.0', = AU、,的应用条件是_ 恒容;W =0 ; 封闭系统。
100嫩W v 、Q 、AU #AHo解:G )由^2C Cp ,”t _pjn _Q 7=C ZAWI -/? = 28.8-8.314i 43p }V } _ 3.04x10s P6zxl.43xl0-3m 3RT' 8.314J • jnol~l • /C 1x 298.15尺Q=0W v =AU = U(T 2 - 7;) = n(C p .m - /?)(r 2 - 7;) =0.175 x (28.8 - 8.314) x (225 -298.15) -2627\H = nC 戸(72-7;) = 0.175X 28.8X (225-298.15) = -368.6J3. lOOg 液体苯在正常沸点80.2°C 及101.325kPa 下蒸发为苯蒸气,己知苯的摩尔蒸发潜 热2\哪//,。
=30.810以’/^厂1,试求上述蒸发过程的W v 、Q 、Z\U 和Z\H 。
苯的摩尔质量 A/QH6 =78。
第 1章 化学热力学基础习题解答(一)

根据反应 ,该反应的标准摩尔焓就是CH3COOH(l)的标准摩尔燃烧焓[变],而
7.关于热力学第二定律,下列说法不正确的是(D)
A .第二类永动机是不可能制造出来的
B.把热从低温物体传到高温物体,不引起其他变化是不可能的
C.一切实际过程都是热力学不可逆过程
2.热力学能是系统的状态函数,若某一系统从一始态出发经一循环过程又回到始态,则系统热力学能的增量是(A)
A.ΔU=0B.ΔU>0C.ΔU<0
U2=U1,U2—U1=0
3.对于封闭系统来说,当过程的始终态确定后,下列各项中(A)无确定值。
A. QB. Q+WC.W (当Q=0时)D.Q (当W=0时)
2. 的应用条件是恒容;W/=0;封闭系统。
3.已知反应
(i)
(ii)
则反应(iii) 的 为206.2kJ﹒mol-1。
反应(iii)=反应(ii)—反应(i)
4.已知298.15K时C2H4(g)、 及 的标准摩尔燃烧焓[变] (298.15K)分别为-1411 ,-1560 及-285.8 ,则 反应的标准摩尔焓[变] 为-136.8 kJ﹒mol-1。
第1章化学热力学基础(一)
一、选择题(均为单选题,将正确选项填在各题后的括号内)
1.系统的下列各组物理量中都是状态函数的是(C)
A.T,P,V,QB.m,Vm,Cp,ΔVC.T,P,V, nD.T,P,U,W
原因:A中T,P,V是,Q不是,是过程量;B中Vm,Cp是,m不是,ΔV是状态函数的
变化,D中T,P,U是,W不是
的燃烧反应就是 的生成反应
4.反应 的标准摩尔焓[变] (T)即是 的标准摩尔生成焓[变] (T)。(×)
--万洪文《物理化学》教材习题解答

第一篇化学热力学第一章热力学基本定律.1-1 0.1kg C6H6(l)在,沸点353.35K下蒸发,已知(C6H6) =30.80 kJ mol-1。
试计算此过程Q,W,ΔU和ΔH值。
解:等温等压相变。
n/mol =100/78 , ΔH = Q = n = 39.5 kJ , W= - nRT = -3.77 kJ , ΔU =Q+W=35.7 kJ1-2 设一礼堂的体积是1000m3,室温是290K,气压为pϑ,今欲将温度升至300K,需吸收热量多少?(若将空气视为理想气体,并已知其C p,m为29.29 J K-1·mol-1。
)解:理想气体等压升温(n变)。
Q=nC p,m△T=(1000pϑ)/(8.314×290)×C p,m△T=1.2×107J 1-3 2 mol单原子理想气体,由600K,1.0MPa对抗恒外压绝热膨胀到。
计算该过程的Q、W、ΔU和ΔH。
(Cp ,m=2.5 R)解:理想气体绝热不可逆膨胀Q=0 。
ΔU=W ,即nC V,m(T2-T1)= - p2 (V2-V1), 因V2= nRT2/ p2, V1= nRT1/ p1,求出T2=384K。
ΔU=W=nCV,m(T2-T1)=-5.39kJ ,ΔH=nC p,m(T2-T1)=-8.98 kJ1-4 在298.15K,6×101.3kPa压力下,1 mol单原子理想气体进行绝热膨胀,最后压力为pϑ,若为;(1)可逆膨胀(2)对抗恒外压膨胀,求上述二绝热膨胀过程的气体的最终温度;气体对外界所作的功;气体的热力学能变化及焓变。
(已知C p,m=2.5 R)。
解:(1)绝热可逆膨胀:γ=5/3 , 过程方程p11-γT1γ= p21-γT2γ, T2=145.6 K ,ΔU=W=nC V,m(T2-T1)=-1.9 kJ , ΔH=nC p,m(T2-T1)=-3.17kJ(2)对抗恒外压膨胀,利用ΔU=W ,即nC V,m(T2-T1)= - p2 (V2-V1) ,求出T2=198.8K。
第1章化学热力学基础习题解答二

第 1章 化学热力学基础(二)一、选择题(均为单选题,将正确选项填在各题后的括号内)8. 1 mol 理想气体,从同一始态出发经过绝热可逆压缩和绝热不可逆压缩到系统压力相同的终态,终态的熵分别为S 1和S 2,则两者关系为( B )A. S 1 = S 2B. S 1 < S 2C. S 1 >S 2D. S 1 ≥ S 2 始终态相同时,不可逆过程的熵变大于可逆过程9. 根据熵增加原理知,若从ΔS >0判定过程一定是自发过程,那么该系统一定是( C )A. 封闭系统B. 绝热系统C. 隔离系统D. 敞开系统10. 关于偏摩尔量,下列叙述正确的是( C ) A. 偏摩尔量是状态函数,其值与物质的数量有关 B. 在多组分多相系统中不存在偏摩尔量 C. 系统的强度性质没有偏摩尔量 D. 偏摩尔量的值只能大于或等于零11. 对封闭的单组分均相系统且'0W =时,()T G p∂∂的量值为( B )。
A. <0B. >0C. = 0D. 前述三种情况无法判断 根据p 69公式(1-128)(),0,T G V V p∂=>∂所以()0,T G p∂>∂12. 下面哪一个关系式是不正确的?( D ) A. ()p GS T∂=-∂ B. ()T G V p ∂=∂C. 2()V A T U T T ∂⎡⎤=-⎢⎥∂⎣⎦ D. ()pG T H T T ∂⎡⎤=-⎢⎥∂⎣⎦ 正确的应该是2()pG T H T T ∂⎡⎤=-⎢⎥∂⎣⎦ 二、填空题(在以下各小题中画有” ”处填上答案)5. 热力学第二定律的经典表述之一为___不可能将热从低温物体转移到高温物体而不留下其他变化 ,数学表达式为 __ Q dS Tδ≥,“>”不可逆,“=”可逆 。
答克劳修斯说与开尔文说都算对,但要求“之一”答第一种说法即克劳修斯说更妥当一些。
P 486. 在隔离系统中进行的可逆过程S ∆___=0__;进行的不可逆过程S ∆__>0_。
马沛生 主编 化工热力学 第一章习题解答

第一章习题解答一、问答题:1-1化工热力学与哪些学科相邻?化工热力学与物理化学中的化学热力学有哪些异同点?【参考答案】:高等数学、物理化学是化工热力学的基础,而化工热力学又是《化工原理》、《化工设计》、《反应工程》、《化工分离过程》等课程的基础和指导。
化工热力学是以化学热力学和工程热力学为基础。
化工热力学与化学热力学的共同点为:两者都是利用热力学第一、第二定律解决问题;区别在于:化学热力学的处理对象是理想气体、理想溶液、封闭体系;而化工热力学面对的是实际气体、实际溶液、流动体系,因此化工热力学要比化学热力学要复杂得多。
1-2化工热力学在化学工程与工艺专业知识构成中居于什么位置?【参考答案】:化工热力学与其它化学工程分支学科间的关系如下图所示,可以看出,化工热力学在化学工程中有极其重要的作用。
1-3化工热力学有些什么实际应用?请举例说明。
【参考答案】:①确定化学反应发生的可能性及其方向,确定反应平衡条件和平衡时体系的状态。
(可行性分析)②描述能量转换的规律,确定某种能量向目标能量转换的最大效率。
(能量有效利用)③描述物态变化的规律和状态性质。
④确定相变发生的可能性及其方向,确定相平衡条件和相平衡时体系的状态。
⑤通过模拟计算,得到最优操作条件,代替耗费巨大的中间试验。
化工热力学最直接的应用就是精馏塔的设计:1)汽液平衡线是确定精馏塔理论板数的依据,可以说没有化工热力学的汽液平衡数据就没有精馏塔的设计;2)精馏塔再沸器提供的热量离不开化工热力学的焓的数据。
由此可见,化工热力学在既涉及到相平衡问题又涉及到能量有效利用的分离过程中有着举足轻重的作用。
1-4化工热力学能为目前全世界提倡的“节能减排”做些什么?【参考答案】:化工热力学是化学工程的一个重要分支,它的最根本任务就是利用热力学第一、第二定律给出物质和能量的最大利用极限,有效地降低生产能耗,减少污染。
因此毫不夸张地说:化工热力学就是为节能减排而生的!1-5化工热力学的研究特点是什么?【参考答案】:化工热力学的研究特点:(1)从局部的实验数据加半经验模型来推算系统完整的信息;(2)从常温常压的物性数据来推算苛刻条件下的性质;(3)从容易获得的物性数据(p、V、T、x)来推算较难测定或不可测试的数据(y,H,S,G);(4)从纯物质的性质利用混合规则求取混合物的性质;(5)以理想态为标准态加上校正,求取真实物质的性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 1章 化学热力学基础(二)
一、选择题(均为单选题,将正确选项填在各题后的括号内)
8. 1 mol 理想气体,从同一始态出发经过绝热可逆压缩和绝热不可逆压缩到系统压力相同的终态,终态的熵分别为S 1和S 2,则两者关系为( B )
A. S 1 = S 2
B. S 1 < S 2
C. S 1 >S 2
D. S 1 ≥ S 2
始终态相同时,不可逆过程的熵变大于可逆过程
9.根据熵增加原理知,若从ΔS >0判定过程一定是自发过程,那么该系统一定是
(C )
A.封闭系统
B.绝热系统
C.隔离系统
D.敞开系统
10. 关于偏摩尔量,下列叙述正确的是( C )
A. 偏摩尔量是状态函数,其值与物质的数量有关
B. 在多组分多相系统中不存在偏摩尔量
C. 系统的强度性质没有偏摩尔量
D. 偏摩尔量的值只能大于或等于零
11.对封闭的单组分均相系统且'0W =时,()T G
p ∂∂的量值为( B )。
A. <0
B. >0
C. = 0
D. 前述三种情况无法判断 根据p 69公式(1-128)(),0,T G
V V p ∂=>∂所以()0,T G p ∂>∂
12.下面哪一个关系式是不正确的?( D )
A. ()p G S T
∂=-∂ B. ()T G V p ∂=∂ C. 2()V A T U T T ∂⎡⎤=-⎢⎥∂⎣⎦ D. ()p
G T H T T ∂⎡⎤=-⎢⎥∂⎣⎦ 正确的应该是2()p
G T H T T ∂⎡⎤=-⎢⎥∂⎣⎦ 二、填空题(在以下各小题中画有””处填上答案)
5.热力学第二定律的经典表述之一为___不可能将热从低温物体转移到高温物体而
不留下其他变化,数学表达式为__Q
dS T δ≥,“>”不可逆,“=”可逆。
答克劳修斯说与开尔文说都算对,但要求“之一”答第一种说法即克劳修斯说更妥当一些。
P 48
6.在隔离系统中进行的可逆过程S ∆___=0__;进行的不可逆过程S ∆__>0_。
7.纯物质完美晶体__0K__时熵值为零。
8. 理想气体混合物中组分B 的化学势μB 与温度T 及组分B 的分压 P B 的关系是 μB __(,)ln B B p g T RT p
θθμ=+, 其标准态选为温度为T ,压力为p θ的纯理想 气体__。
三、是非题(下述各题中的说法是否正确?正确的在题后括号内画“√”,错误的画“×”)
5.100℃、101325Pa 时2H ()O l 变为2H ()O g ,该过程的熵变为0。
( ×)
6.一定量理想气体的熵只是温度的函数。
( ×)
7.任何一个偏摩尔量均是温度、压力和组成的函数。
( √) 8.,,()()c S V n c B B
U n ≠∂∂是偏摩尔热力学能,不是化学势。
( × ) 偏摩尔量是在恒定温度和恒定压力条件下,在恒S 恒V 下不是偏摩尔量。
四、计算题及证明(推导)题
8. 2 mol 27℃20dm 3理想气体,在定温条件下膨胀到49.2dm 3,假定过程为:(i )可逆膨胀;(ii )自由膨胀;(iii )对抗恒外压为5
1.01310⨯Pa 膨胀。
计算各过程的W V 、Q 、ΔU 、 ΔH 和ΔS 。
解:(i )∵0dT =∴0U H ∆=∆= 112149.2ln 28.314300ln 20 4500 4.5V V W nRT mol J mol K K V J kJ
--=-=-⨯⋅⋅⨯⨯=-=-
4.5Q W kJ =-=
1450015300sy Q J S J K T K
-∆===⋅
或 1112149.2ln 28.314ln 1520
sy V S nR mol J mol K J k V ---∆==⨯⋅⋅⨯=⋅ (ii )∵0dT =∴0U H ∆=∆=
又∵0su p =∴0V W =∴Q=0
115sy S J K -∆=⋅
(iii )∵0dT =∴0U H ∆=∆=
又∵51.01310su p Pa =⨯
∴533
21() 1.01310(49.220)10 2.95V su W p V V Pa m kJ -=--=-⨯⨯-⨯=-
2.95V Q W kJ =-=
115sy S J K -∆=⋅
9. 8 mol 某理想气体(C P,m = 26.1011J K mol --⋅⋅)由始态(400K ,0.20 MPa )分别经下列三个不同过程变到该过程指定的终态,分别计算各过程的W V 、Q 、ΔU 、ΔH 、ΔS 、ΔA 和ΔG 。
过程I :定温可逆膨胀到0.10 MPa ;过程II :自由膨胀到0.10 MPa ;过程III :定温下对抗恒外压0.10 MPa 膨胀到0.10 MPa 。
解:过程I :∵0dT =∴0U H ∆=∆=
22
11
11ln ln 0.188.314400ln
18.4410.2V V p W nRT nRT V p mol J mol K K kJ --=-==⨯⋅⨯⨯=- 18.441Q W kJ =-=
11844146.10400
Q S J K T -∆===⋅ 21ln
18.441p A G nRT kJ p ∆=∆==- 过程II :∵0dT =∴0U H ∆=∆=
又∵0su p =∴0V W =∴Q=0
118.441S J K -∆=⋅
18.441A G kJ ∆=∆=-
过程III :∵0dT =∴0U H ∆=∆=
2212211()(
)(1)0.188.314400(1=13.300.2V su nRT nRT p W p V V p nRT p p p kJ =--=--=--=-⨯⨯⨯--)
13.30Q W kJ =-=
11844146.10400
Q S J K T -∆===⋅ 18.441A G kJ ∆=∆=-
10. 1mol 水蒸气在100℃及101.325kPa 下可逆地凝结为液体水,水的汽化热为22581J g -⋅,假定水蒸气是理想气体,试计算此凝结过程的W V 、Q 、ΔU 、ΔH 、ΔS 、ΔA 和ΔG 。
解:22373()(p K H O g H O l θ
)
11122581840.64m Vap m H H J g g mol kJ mol θθ---∆=∆=-⋅⨯⋅=-⋅
由于是可逆相变,所以0G ∆=
40.64p Vap m Q H n H kJ θ=∆=∆=-
18.314373.153102 3.012V W nRT J kJ ==⨯⨯==
37.53p V U Q W kJ ∆=+=
3
140.6410108.9373.15
p Q S J K T --⨯∆===-⋅ 3.012V A W kJ ∆==
11. 由(,)V f T p =出发,证明()()()1p T V T V p V p T
∂∂∂=-∂∂∂ 证明:由(,)V f T p =,有
p T
V V dV dT dp T P ∂∂⎛⎫⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭
令0dV = 则0p T
V V dT dp T P ∂∂⎛⎫⎛⎫+= ⎪ ⎪∂∂⎝⎭⎝⎭ T p
V V dp dT P T ∂∂⎛⎫⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭ 给两边同乘以1p
T T V ∂⎛⎫ ⎪∂∂⎝⎭得 ()()()1p T V T V p V p T
∂∂∂=-∂∂∂证毕 12. 试推导下式:()()T p H V V T p T
∂∂=-∂∂ 证明:由,dH TdS VdP =+在定T 下两边同除以dp
得 ()T T
H S T V p p ⎛⎫∂∂=+ ⎪∂∂⎝⎭ 将麦氏关系式p T S V p T ⎛⎫∂∂⎛⎫=-
⎪ ⎪∂∂⎝⎭⎝⎭代入得 ()() T p H V V T p T
∂∂=-∂∂证毕 13. 试从热力学基本方程出发,证明理想气体(
)0T H p ∂=∂。
证明:由,dH TdS VdP =+在定T 下两边同除以dp
得 ()T T
H S T V p p ⎛⎫∂∂=+ ⎪∂∂⎝⎭ 将麦氏关系式p T S V p T ⎛⎫∂∂⎛⎫=-
⎪ ⎪∂∂⎝⎭⎝⎭代入得 ()() T p H V V T p T
∂∂=-∂∂ 在恒压下,对nRT V p =
两边求T 的偏导得
p
V nR T p ∂⎛⎫= ⎪∂⎝⎭,将此式代入上式得 () ==0T H nR V T V V p p ∂=--∂ 即()0T H p
∂=∂ ,证毕。
14. 证明:(
)()()T p T U V V T p p T p ∂∂∂=--∂∂∂ 证明:由dU TdS pdV =-在定T 下两边同除以dp
得 ()T T T
U S V T p p p p ⎛⎫⎛⎫∂∂∂=- ⎪ ⎪∂∂∂⎝⎭⎝⎭ 将麦氏关系式p T S V p T ⎛⎫∂∂⎛⎫=-
⎪ ⎪∂∂⎝⎭⎝⎭代入得 ()T p T
U V V T p p T p ⎛⎫∂∂∂⎛⎫=-- ⎪ ⎪∂∂∂⎝⎭⎝⎭ ,证毕。
