中考化学分析计算题训练
2023年中考化学分析专题课件——综合计算题

(写化学式)。
(3)若用该工艺制备了1 000 g铁铜双金属粉末产品,其中Cu单
质的质量分数为19.2%。计算置换这些Cu单质所需还原铁粉
的质量(写出计算过程)。
(4)“干燥还原”可在不同的温度下进行,产品中氧元素的质量
分数随温度的变化如图2所示。若(3)中产品是在500 ℃时干
燥还原后得到的,则其中最多含Fe元素
过氧化氢溶液浓度越高,过氧化氢分解速率越快 。
图2
g。
(3)计算实验Ⅰ条件下H2O2完全分解所得氧气的质量,并写出
具体计算过程(1.5%~5.0% H2O2溶液的密度取值1.0 g/mL)。
解:参与反应的过氧化氢质量=10 mL×1.0 g/mL×3.4%=
0.34 g,设生成氧气的质量为x。
2H2O2
(t)
A 石灰石
100
90%
200
14.4
B 熟石灰
74
94%
500
14.6
(高阶思维·分析评价类)方法B比方法A除SO2的量略大,而且
①方法B比A吸收
工业上多数采用方法B。其原因分别是__________________
效率高(或:熟石灰与SO
____________________________________________________
。
(4)(高阶思维·解释说明类)某同学认为催化剂在催化某化学
反应中质量和化学性质不变,因此催化剂是不参加该反应的。
请分析该说法不合理的原因是 催化剂可以先参加第一步_
反应,然后在第二步反应中作为产物再生成 。
4.选择优质炼铁原料十分重要。某化学兴趣小组的同学为了
测定某赤铁矿石中氧化铁的质量分数,按甲、乙两种方案进
初三化学化学计算题解题技巧分析及练习题(含答案)含解析

初三化学化学计算题解题技巧分析及练习题(含答案)含解析一、中考化学计算题1.现将100 g溶质质量分数为9.8%的稀硫酸与一定质量的氯化钡溶液恰好完全反应后,过滤得到284.7 g滤液。
计算:(1)生成硫酸钡沉淀的质量。
(2)氯化钡溶液中溶质的质量分数。
【答案】(1)生成硫酸钡沉淀的质量为23.3 g。
(2)氯化钡溶液中溶质的质量分数为10%。
【解析】试题分析:解:设生成硫酸钡沉淀的质量为x,反应的氯化钡的质量为y。
H2SO4质量为:10 0g×9.8%=9.8 gBaCl2 + H2SO4 = BaSO4↓ + 2HCl208 98 233y9.8 g x233/98 =x/9.8x=23.3 g208/98 =y/9.8y=20.8 g(2)氯化钡溶液的质量为:284.7 g+23.3 g-100 g=208 g氯化钡溶液的溶质质量分数为:20.8 g/208 g×100%=10%考点:根据化学方程式的计算溶质的质量分数2.有一赤铁矿样品(主要成分为Fe2O3),某学校化学兴趣小组为了测得样品中氧化铁的质量分数,进行了如下探究:小明取10 g赤铁矿样品(杂质不溶于水和酸),不断加入稀盐酸到固体的质量不再减少,加入稀盐酸的量如图所示。
求:(1)赤铁矿中氧化铁的质量分数是________________。
(2)计算所使用的稀盐酸的溶质质量分数____________。
【答案】 80% 10%【解析】氧化铁和稀盐酸反应生成易溶于水的氯化铁和水,所以反应中固体质量减少,最终不溶的固体是杂质,所以氧化铁的质量为:10g-2g=8g,设所使用的稀盐酸的溶质质量为x,Fe2O3+6HCl=2FeCl3+3H2O160 2198g x160/8g=219/xx=10.95g所以所使用的稀盐酸的溶质质量分数为:10.95g÷109.5g×100%=10%;答:略点睛:方程式的计算,关键根据化学反应方程式找出相关物质的质量关系,利用反应中物质的质量比不变进行列比例计算,易错点是,由方程式求质量比算数错误,所以这一步要仔细检查。
中考化学精炼本 第二部分 题型突破练八 分析与计算题

(1)所取粉末中氧化铜的质量为 8(2分)g 。 (2)计算反应后所得溶液中溶质的质量分数。 (温馨提示:CuO+H2SO4===CuSO4+H2O)
解:(2)设反应生成硫酸铜的质量为 x。
CuO+H2SO4===CuSO4+H2O
80 160
8g x
18600=8xg
x=16 g(2 分)
反应后所得溶液中溶质的质量分数为
8
16 g g+192
g×100%=8%(2 分)
答:反应后所得溶液中溶质的质量分数是 8%。
13.(2021·邵阳)将木炭与氧化铜的粉末均匀混合,放入试管中高温加 热至质量不再变化,冷却后粉末质量为 16.8 克,把该粉末全部倒入烧杯 中。加入足量的稀硫酸搅拌,得到蓝色溶液和红色不溶物,经过滤、洗 涤、干燥,所得红色不溶物的质量为 12.8 克。固体物质与所加稀硫酸之 间的关系如图所示,则:
Na2CO3+CaCl2===CaCO3↓+2NaCl
刚好不再产生气体时,溶液中溶质的质量分数是
23.4 g 82.8 g+160 g-8.8 g×100%=10%。(2 分)
答:刚好不再产生气体时,溶液中溶质的质量分数是 10%。
12.某课外兴趣小组同学取一定量含铜粉的氧化铜粉末,放入烧杯中,加 入 192 g 稀硫酸,搅拌,恰好完全反应后过滤(损耗忽略不计),烧杯中 剩余固体的质量随时间变化情况如图所示。
解:(2)设样品中碳酸钠质量为 x。 最终生成二氧化碳质量:60 g+6 g-63.8 g=2.2 g(1 分) Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
106 44 x 2.2 g 14046=2.x2 g x=5.3 g(2 分) 样品中 Na2CO3 的质量分数是 56.3gg×100%≈88.3%(1 分) 答:样品中 Na2CO3 的质量分数是 88.3%。
初三化学化学计算题解题技巧分析及练习题(含答案)含解析 (2)

初三化学化学计算题解题技巧分析及练习题(含答案)含解析一、中考化学计算题1.现有l00g 8%的NaOH溶液,通过计算回答下列有关问题:(1)若用该溶液吸收CO2,最多可以生成Na2CO3多少克?____(写出详细计算过程)(2)当NaOH全部转化成为Na2CO3后,Na2CO3还会继续与CO2、H2O发生反应:Na2CO3+CO2+H2O=2NaHCO3,直至Na2CO3完全反应完。
请在如图画出利用l00g8%的NaOH 溶液吸收CO2与生成NaHCO3的曲线。
____(3)现有三种溶液:①100g8%NaOH溶液、②100g8%NaOH溶液吸收CO2转化为Na2CO3溶液、③100g8%NaOH溶液吸收过量CO2转化为NaHCO3溶液,分别用相同质量分数的硫酸与上述三种溶液恰好完全反应,需要的硫酸的质量_____(选填“相等”或“不相等”),原因是_____。
【答案】10.6g 相等三种溶液中所含的钠元素质量相等,与硫酸反应产生的Na2SO4质量相等,故消耗同种硫酸的质量相等【解析】【详解】(1)100g8%的NaOH溶液中含NaOH的质量=100g×8%=8g(2)设碳酸钠的质量为x,与氢氧化钠反应的二氧化碳的质量为y,碳酸氢钠的质量为z,和碳酸钠反应的二氧化碳的质量为a根据2NaOH+CO2=Na2CO3+H2O和 Na2CO3+CO2+H2O=2NaHCO3,可得关系式为:22323 2NaOH~CO~Na CO CO~2NaHCO8044106441688g y x a z804410644168====8g y x a zx=10.6gy=4.4gz =16.8ga=4.4g利用l00g8%的NaOH溶液吸收CO2与生成NaHCO3的曲线,起点4.4、拐点(8.8,16.8)。
如图:(3)三种溶液中所含的钠元素质量相等,根据钠元素守恒和硫元素守恒,可知与硫酸反应产生的Na2SO4质量相等,故消耗同种硫酸的质量相等。
中考化学计算题专题复习含答案解析

精品基础教育教学资料,仅供参考,需要可下载使用!中考化学计算题专题复习含答案解析专题: 计算题(一)【寻找纯净物质量】形式1直接读取纯净物质量例1取50克一定溶质质量分数的碳酸钠溶液于烧杯中,逐滴滴入足量的氯化钡溶液,充分反应后将沉淀过滤,洗涤烘干,共得到9.85克固体物质。
求碳酸钠溶液中溶质质量时,直接代入化学方程式中纯净物的质量为________克。
例2小杨同学取50.0 g样品置于烧杯中,逐滴加入氢氧化钠溶液,加入氢氧化钠溶液质量和生成沉淀质量的关系如图所示,求硫酸铜溶液中溶质的质量时,直接代入化学方程式中纯净物的质量为________。
例3化学兴趣小组按下列实验测定部分变质的NaOH固体中Na2CO3的质量时,直接代入化学方程式中纯净物的质量为________。
例4向100 g BaCl2溶液中滴加Na2SO4溶液至完全反应。
反应过程中生成沉淀的质量与滴加Na2SO4溶液的质量关系如下表所示:滴加Na2SO4溶液的质量/g1*******生成沉淀的质量/g 2.33 4.66 6.99 6.99(1)求BaCl2溶液中溶质的质量时,直接代入化学方程式中纯净物的质量为________。
(2)求硫酸钠溶液中溶质质量分数时,应代入化学方程式中纯净物的质量为________,硫酸钠溶液的质量为________。
形式2根据质量差求纯净物质量例5某学习小组测定某工业废水(含有H2SO4、HNO3,不含固体杂质)中H2SO4的含量。
取100 g 废水于烧杯中,加入100 g BaCl2溶液,恰好完全反应,经过滤得到176.7 g 溶液。
(可溶性杂质不参加反应,过滤后滤液的损失忽略不计)求该工业废水中硫酸的质量时,直接代入化学方程式中纯净物的质量为______________(只写计算过程)。
例6在实验室加热32.5 g二氧化锰和氯酸钾的固体混合物制取氧气时,剩余固体物质的质量变化如图所示。
求固体混合物中氯酸钾的质量时,直接代入化学方程式中纯净物的质量为____________(只写计算过程)。
初中化学化学计算题解题技巧分析及练习题(含答案)及解析
初中化学化学计算题解题技巧分析及练习题(含答案)及解析一、中考化学计算题1.某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。
请你计算:(1)若要清洗1000kg的这种石油产品,需要_____kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。
每处理1000kg这种产品,他们可以节约多少经费_____?请你写出具体的计算过程。
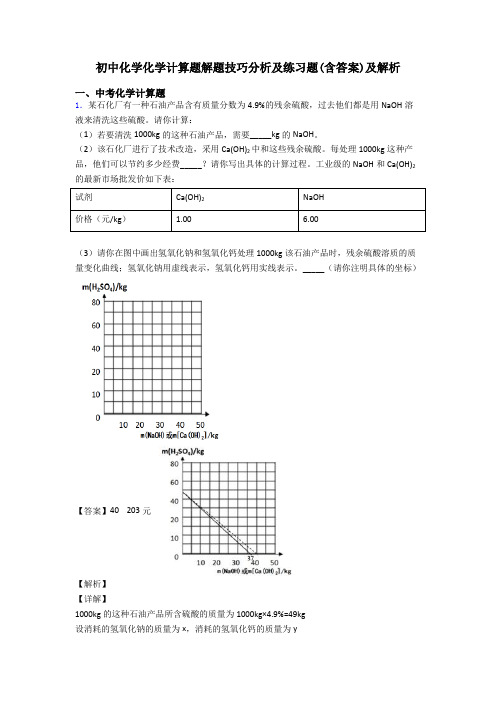
工业级的NaOH和Ca(OH)2的最新市场批发价如下表:试剂Ca(OH)2NaOH价格(元/kg) 1.00 6.00(3)请你在图中画出氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。
_____(请你注明具体的坐标)【答案】40 203元【解析】【详解】1000kg的这种石油产品所含硫酸的质量为1000kg×4.9%=49kg设消耗的氢氧化钠的质量为x,消耗的氢氧化钙的质量为y根据2NaOH+H2SO4=Na2SO4+2H2O和Ca(OH)2+H2SO4=CaSO4+2H2O可得关系式为242 2NaOH H SO Ca(OH)809874x49kg y::809874==x49kg yx=40kgy=37kg每处理1000kg这种产品,他们可以节约经费为6.00元/kg×40kg-1.00元/kg×37kg=203元图中画出用氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线“…”表示,氢氧化钙用实线“一”表示,答:(1)若要清洗1000kg的这种石油产品,需要 40kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。
每处理1000kg这种产品,他们可以节约203元经费。
(3)残余硫酸溶质的质量变化曲线;氢氧化钠用虚线“…”表示,氢氧化钙用实线“一”表示,2.某化学兴趣小组对某铜锌合金样品进行探究实验,称取样品10.0 g,再用100.0 g稀硫酸溶液逐滴滴入,实验情况如图所示。
2024年中考化学专题训练——有关质量守恒定律的计算
2024年中考化学专题训练——有关质量守恒定律的计算一、选择题1.现有8gA 和足量B 在一定条件下充分反应,生成22gC 和18gD,则参加反应的A 和B 的质量比是A.4:11B.1 :2C.1 :4D.11 :9 2.现将20克A和足量B混合加热,A与B发生化学反应,20克A完全反应后生成16克C和8克D,则参加反应的B与生成的C的质量比是A.1∶4B.5∶4C.2∶1D.1:23.一定量的溶液中含有KOH和K2CO3两种溶质,向其中加入l00g溶质质量分数为7.3℅的稀HCl,恰好完全反应且溶液呈中性,将反应后的溶液蒸干,所得固体的质量是A.7.45g B.14.9g C.5. 6g D.13. 8g4.现将10gA和足量B混合加热,A和B发生化学反应,10gA完全反应后生成8gC 和4gD,则参加反应的A和B的质量比是()A.1:1B.2:1C.4:1D.5:15.下列叙述不正确...的是()A.Na2CO3、HNO3、BaCl2、HCl这四种物质的溶液,不用外加....试剂就可以将它们一一鉴别出来B.金属与稀硫酸溶液发生反应后,溶液的质量一定增大C.在电解水的实验中,为增强导电性,可加入少量烧碱或硫酸D.加热氯酸钾和二氧化锰的混合物,一段时间后固体中二氧化锰的质量分数变大6.在化学反应A+B=C+D中,6gA与8gB恰好完全反应,生成9gD.则生成C物质的质量是()A.7g B.5g C.8g D.6g7.化学反应A2+2B===2AB中,A2与B反应的质量关系如图所示,现将12g A2和12g B 充分反应,则生成AB的质量为A.24gB.21gC.18gD.15g8.30g某有机物M在氧气中完全燃烧,生成44gCO2和18gH2O,下列说法不正确的是()A.M含有C、H、O三种元素B.M中氧元素的质量分数约为53.3%C.完全燃烧时,M与消耗O2的质量比为15:16D.3.0gM在2.4gO2氧气中燃烧生成2.4gCO、1.2CO2和1.8gH2O9.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应A.该反应为分解反应B.丙可能为该反应的催化剂C.甲、乙两种物质间参加反应的质量比为1:4D.乙、丁两种物质间反应的质量比为7:510.在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下A.W可能是单质B.Y可能是催化剂C.该反应是分解反应D.反应后Z物质的质量为86.4g二、计算题11.碳酸钠俗称纯碱、苏打。
【化学】中考化学化学计算题解题技巧分析及练习题(含答案) (3)
【化学】中考化学化学计算题解题技巧分析及练习题(含答案)一、中考化学计算题1.为了节约林木资源,近几年兴起了石头纸,石头纸可用沿海水产养殖中产生的大量废弃贝壳制得。
某化学兴趣小组同学为了测定某种贝壳中碳酸钙的质量分数,将100g 稀盐酸分五次加入盛有12g 贝壳的烧 杯中,充分反应后测得烧杯内物质的质量如表所示(贝壳中其它物质不与盐酸反应且不溶于水)。
请你计 算:(1)贝壳中碳酸钙的质量分数______(精确到0.1%);(2)稀盐酸与贝壳恰好完全反应后所得溶液中溶质的质量分数_____(精确到0.1%)。
【答案】83.3% 10.9% 【解析】 【分析】根据质量守恒定律,反应前反应物的总质量等于反应后生成的生成物的总质量,减少的质量即为生成的二氧化碳的质量。
【详解】(1)第一次生成的二氧化碳气体的质量为20g+12g-30.9g=1.1g ,第二次生成的二氧化碳气体的质量为20g+20g+12g-49.5g=2.2g ,第四次生成的二氧化碳气体的质量为80g+12g-87.6g=4.4g ,第五次生成的二氧化碳气体的质量为100g+12g-107.6g=4.4g ,则第四次碳酸钙已反应完全。
设贝壳中碳酸钙的质量分数为x3222CaCO +2 HCl =CaCl +CO +H O1004412g x4.4g↑⨯ 10044=12g x 4.4g⨯x 83.3%≈(2)设稀盐酸与贝壳恰好完全反应后所得溶液中溶质的质量为y ,反应碳酸钙的质量为z3222CaCO +2 HCl =CaCl +CO +H O 10011144zy4.4g↑11144100==y 4.4g zy=11.1gz=10g稀盐酸与贝壳恰好完全反应后所得溶液中溶质的质量分数为11.1g100%10.9%100g+12g-10g⨯≈答:贝壳中碳酸钙的质量分数为83.3%,稀盐酸与贝壳恰好完全反应后所得溶液中溶质的质量分数为10.9%。
【化学】中考化学初中化学化学计算题解题技巧分析及练习题(含答案)
【化学】中考化学初中化学化学计算题解题技巧分析及练习题(含答案)一、中考化学计算题1.某品牌纯碱中含有杂质NaCl ,化学兴趣小组的同学进行了如下实验探究:称取12g 样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图(1)纯碱恰好完全反应时,生成CO 2的质量为___g(2)计算该样品中含杂质的质量分数是多少?(计算结果保留一位小数,下同)____________(3)计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是多少?____________【答案】4.4g 11.7% 16.3%【解析】【分析】(2)根据题意可知:已知量为二氧化碳的质量,未知量为样品中含杂质的质量分数。
解题思路为:可根据反应中二氧化碳与碳酸钠的质量关系求出碳酸钠的质量。
进一步可求出样品中含氯化钠的质量分数。
(3)根据题意可知:已知量为二氧化碳的质量,未知量为所得溶液中溶质的质量分数。
解题思路为:所得溶液为氯化钠溶液,可根据反应中二氧化碳与氯化钠的质量关系求出生成氯化钠的质量。
再加上样品中原有氯化钠的质量,即为所得溶液中的溶质的质量。
再根据质量守恒定律可求出所得溶液的质量。
最后可计算出所得溶液中溶质的质量分数。
具体过程如下:【详解】(1)纯碱样品中的主要成分为碳酸钠,可与盐酸反应生成二氧化碳气体。
根据图示可知:当加入73g 稀盐酸时,生成气体的质量达到了最大值,即此时碳酸钠恰好完全反应。
所以恰好完全反应时生成二氧化碳的质量为4.4g 。
(2)解:设样品中含碳酸钠的质量为x ,反应生成氯化钠的质量为y2322Na CO 2HCl 2NaCl H O +=++CO 10611744x y 4.4g106x =44 4.4gx=10.6g 117y=44 4.4g y=11.7g样品中含杂质的质量分数为:12g-10.6g×100%11.7% 12g≈(3)所得溶液中溶质的质量分数为:12g-10.6g+11.7g×100%16.3% 12g+73g-4.4g≈答:(1)生成二氧化碳的质量为4.4g;(2)样品中含杂质的质量分数为11.7%;(3)所得溶液中溶质的质量分数为16.3%。
(化学) 中考化学化学计算题专项训练100(附答案)含解析
(化学) 中考化学化学计算题专项训练100(附答案)含解析一、中考化学计算题1.我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:方案一: 取10g 石灰石粉末样品置于下图所示装置,充分加热至质量恒定,冷却后称得固体质量为8.12g方案二:另取10g 同质地石灰石颗粒样品,置于烧杯中加足量稀盐酸,充分反应后称得混合物的总质量减少了4.27g 相关资料:当地石灰石含有的主要杂技为二氧化硅,其化学性质稳定,加热不易分解且不与盐酸发生化学反应.计算出两种方案测得的石灰石中碳酸钙的质量分数: (1)方案一中碳酸钙的质量分数是_______________________;(2)方案二中碳酸钙的质量分数是_______________________.(精确到0.1%) 比较两方案测量的结果,分析两方案误差较大的可能原因?______【答案】42.7% 97% 石灰石分解需要高温,两方案误差较大的原因可能是酒精灯火焰温度偏低,石灰石粉末未能充分分解,引起误差较大. 【解析】 【分析】 【详解】(1)生成二氧化碳的质量为10g-8.12g=1.88g 设生成1.88g 二氧化碳需碳酸钙的质量为x32CaCO CaO +10044x1.88CO g高温10044=x 1.88gx=4.27g石灰石样品中碳酸钙的质量分数为4.27g100%=42.7% 10g⨯(2)混合物的总质量减少了4.27g说明生成了4.27g二氧化碳设样品中的碳酸钙的质量为y3222CaCO+2HCl=CaCl+H O+CO10044y 4.27g↑10044=y 4.27gy=9.7g石灰石样品中碳酸钙的质量分数为9.7g100%=97% 10g⨯石灰石分解需要高温,两方案误差较大的原因可能是酒精灯火焰温度偏低,石灰石粉末未能充分分解,引起误差较大。
2.实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中考化学分析计算题训练1.海洋蕴藏的资源极其丰富,是保证人类可持续发展的重要财富。
(1)海洋中生物种类繁多,其中鱼、虾、蟹、贝类、藻类等所有生物组成了 。
(2)巨大的海浪能为人类发电。
最近科技人员将一些圆柱体浮标放入海中,这些浮标会随波浪起伏,从而使置于海底的发电机发电。
若功率为104千瓦的发电机一天不间断发电,产生的电能可供应220V40W 的灯泡使用多少小时?(3)目前,海洋污染日益严重。
据统计,去年5月份我省就发生赤潮30次。
赤潮是由于海水中 等元素含量过高,导致藻类植物大量繁殖,使水质处于富营养化状态,从而超过了海洋生态系统的自动调节能力而造成的。
从海洋生态系统的组成成分角度看,这些藻类植物属于 。
2.统计资料显示,2012年末温州市汽车拥有量达96.97万辆,每百户城镇居民家用汽车拥有量35.3辆,以下是一辆小汽车的有关数据: (g=10 N /kg ,1L=10-3m 3)小汽车的质量1200kg 小汽车的额定功率90kW每个轮胎与地面的接触面积500cm 2100km 耗油量10L 汽油的密度0.71×103kg /m 3 汽油的价格6.25元/L求:(1) 若该小汽车行驶100km ,则需耗油______ ▲______千克(2) 该小汽车静止在水平地面上时,对地面的压强是多大? (3)假若该小汽车在水平路面上以额定功率匀速直线行驶,速度为90Km/小时请计算该车10s 内牵引力所做的功和地面对小汽车的摩擦力3.小明在观看了宾馆等处的光电烟雾探测器(如右图)后,自己设计了一只“火灾报警器”。
该报警器由“控制电路”和“工作电路”所组成,其中“控制电路”由光敏电阻R 、电磁铁(线圈阻值R 0=15Ω)、电源U=6V 、开关等组成;“工作电路”由工作电源电铃、导线等组成。
小明的设计思想:当光敏电阻接收到的光照减弱到一定程度时,工作电路接通,电铃报警。
已知该光敏电阻的阻值R 与光强E 之间的一组实验数据如下表所示:(“光强”表示光强弱的程度,符号为E ,单位为cd 。
)(1)分析上表数据,根据光敏电阻的阻值R 随光强E 变化的规律,试填写表格空格处的电阻,并归纳出光敏电阻的阻值R 随光强E 变化的关系式为R=▲ 。
(2)闭合电键S ,如果当线圈中的电流大于或等于250 mA 时,继电器的衔铁被吸合,则光敏电阻接收到的光照强度需要在多少cd 以上?(3)按小明的设计,当室内烟雾增大时,光照减弱,光敏电阻的阻值增大到一定值时,衔铁与 ▲ (“上方”或“下方” )的M 、N 接触,电铃工作报警。
(4)当光照强度为4.0cd 时,光敏电阻消耗的功率为多少?4.现有铜与金属镁、铁、锌中的一种组成的混合物,现欲测定其组成。
【查阅资料】镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属化合物和氢气。
【实验步骤及数据】取该混合物粉末8.0 g 放入烧杯中,将140.0 g 溶质的质量分数为14.0%的稀硫酸平均分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如图:通过计算(写出计算过程),求:(1)该混合物粉末中铜的质量分数?(2)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?(3)实验室有一瓶浓硫酸,仔细观察标签:现要将100g 这种浓硫酸稀释为质量分数为实验所用的稀硫酸,需要加水的质量是 。
光强E/cd1.02.03.04.05.06.0 光敏电阻R/Ω 36.0 18.0 12.0 9.0 ▲ 6.0 硫酸(500 mL )品名:硫酸 化学式:H 2SO 4 相对分子质量:98 密度:1.84 g/cm 3溶质质量分数:98%后续装置略 水垢浓硫酸 Ⅰ ⅡB NaOH 溶A 碱石灰 0 30 60 90 120 时间/s 增加的质量/g 10 20 30 40 请写出稀释时应注意事项5.如右图甲所示,电源电压恒定,R1是一个定值电阻,R2是滑动变阻器,小灯泡L 的额定电压为6V ,图25乙是通过小灯泡L 的电流随两端电压变化的曲线。
当开关S1闭合,S2断开,滑动变阻器的滑片P 滑至最左端时,小灯泡L 恰好正常发光;滑动变阻器的滑片P 滑至最右端时,电压表的示数为5V 。
当开关S1、S2都闭合,滑动变阻器的滑片P 滑至最左端时,电流表的示数为0.8A ,R1消耗的功率为P1;求:(1)小灯泡的额定功率PL ;(2)滑动变阻器的最大阻值R2;(3)定值电阻R1,消耗的功率P1。
6.某学习小组想探究热水壶底部水垢的主要成分。
该小组同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐、碱的混合物)。
同时,他们还查阅到有关物质的溶解性,认为水垢的主要成分一定含有Mg(OH)2和CaCO3,可能含有Ca(OH)2和MgCO3。
⑴甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液后加入____,没有白色沉淀,说明水垢中无Ca(OH)2。
⑵乙同学设计了如下实验,进一步确定水垢中含有碳酸盐的成分。
其主要实验步骤如下:按下图(左)组装仪器,将50g 水垢试样研碎后放入锥形瓶中,加入足量某酸溶液;①检查装置的气密性后加药物进行实验②测量一定时间内干燥管内物质增加的质量(见上边右图曲线); ③待锥形瓶中不再产生气泡时,打开活塞B ,从导管A 处缓缓鼓入空气;④再次称量干燥管内物质增加的质量;⑤重复③和④的操作,直至干燥管内物质质量不变。
讨论: 操作③中从导管A 处缓缓鼓入一定量空气的原因是____________,装置Ⅰ的作用是____________。
(3)计算说明此水垢的主要成分?7.某同学为探究混合物(只含Na 2CO 3和NaCl )的中Na 2CO 3的质量分数,先后进行了三次实验,实验数据如下表: 该混合物中Na 2CO 3的质量分数是多少?(3)据表计算所用盐酸的质量分数是多少?(保留一位小数)8.履带式推土机在松软和泥泞的作业环境下发挥着巨大的作用.图中为东方红品牌履带式推土机,右下表品牌东方红履带式推土机 型号 NT855-B280 长×宽×高6430×4035×3015mm 使用质量 20000kg 额定功率169kW 额定转速 2000rpm 履齿高度72mm 履带板宽度 900mm 履带接地长度 3300mm 爬坡能力 30第一次 第二次 第三次所取混合物的质量/g20 20 20 所加稀盐酸的质量/g100 120 80 生成二氧化碳的质量/g 6.6 6.6 6.6前进各档速度0-3.8-6.8-11.3km/h 后退各档速度0-4.9-8.2-13.6km/h)“履带”的主要作用是▲ 。
“履齿”的主要作用是▲ 。
(2)该推土机静止时对地面的压强(g取10N/kg).(3)假若该推土机以额定功率进行推土作业,在平直的场地上以1m/s的速度匀速行驶了5m,求推土机所受的阻力和推土机所做的功. (4)推土机给人们带来诸多方便,但也造成了一些负面影响,如能源消耗、尾气污染、噪声污染、交通阻塞等。
请你从可持续发展的角度,就我们生活中如何减小汽车的负面影响,提出一条合理化建议▲ .9.现在社会倡导建立“低碳”环境,很多能源都符合,如氢燃料。
2010年上海世博会使用200辆氢燃料电池四轮车,用于世博园区内各项服务。
该氢燃料车不算驾驶员和氢燃料,车的质量为120千克。
其最大的时速为80千米每小时。
每个轮余地面的接触面积约2分米2.为请你根据所学知识回答下列问题:⑴该氢燃料车的原理是:以氢气和氧气为原料,通过化学反应直接产生电能,运行时产生的温度一般不超过80℃,反应后的产物只有水。
氢燃料电池能量转换过程是将▲能转化为电能。
⑵该氢燃料电池新车停在仓库内的水平路面,对水平路面压强是多少。
⑶氢气是一种有巨大发展前景的绿色能源,有人设想用电解水的方法制取氢气开发能源。
回答下列问题:①已知在“220V、2A”的条件下,通电36 分钟可电解9.9克水,求电解这些水需要的电能是多少?②若每1千克氢气的完全燃烧放出的热量为1.43×108焦,则电解9.9g水产生的氢气完全燃烧放出的热量是多少?③根据以上计算,用电解水的方法开发氢能源是否可行?▲10.某科技活动小组为了探究可以测量物体重力的“浮力秤”的刻度是否是均匀的,进行了如下操作(装置如图所示):他们将作秤盘的空心圆柱体竖直漂浮在水面上,此时秤盘与水面相交处标为“0牛”,然后在秤盘上放10 牛的物体,在秤盘与水面相交处标上“10 牛”.小组同学对如何标记浮力秤上0~10牛的其他刻度有一番争论(如图)。
(1)分析表中数据,得出的结论是____ _______。
(2)当水面离“0牛”刻度线2.5 厘米时,秤盘上所放的物体重为___ ___牛。
(3)当水面处于秤盘“0 牛”刻度线位置时(如图甲),测得水面离秤盘底0.05 米,已知秤盘的底面积为300 厘米2.求秤盘受到的浮力多大?(g取10N/kg)10.现有一个电路元件X,对它进行测试,测得加在它两端的电压值和通过电流的数据如下表所示:U/V 0 0.3 0.5 1.0 1.5 2.0I/A 0 0 0 0.20 0.40 0.60(2)把元件X接入电源电压为3V的图示电路中,闭合开关后,电流表读数为0.5A,此时元件X消耗的电功率多大?电阻R0的阻值为多大? (3)若电源电压为3V并保持不变,元件X消耗的功率超过2W时将被烧坏。
电阻R0的阻值至少为____________Ω。
11、如图所示,小明同学利用滑轮甲、乙使重为600N的物体A沿水平方向向左做匀速直线运动,在40秒内物体A移动了8米,此时拉力F大小为160牛(不计绳重及滑轮的摩擦)。
根据题意完成以下问题:(1)小明利用甲滑轮的目的是为了▲;(2)求出拉力F的功率是多少瓦。
(3)当小明提供的拉力增大到200牛时,物体A在水平地面上受到的滑动摩擦力的大小为▲牛。
12、甲烷气体(CH4)无色、无臭,是沼气的主要成份.甲烷气体在空气中的浓度在一定范围内,遇到明火会发生爆炸.由此,某中学综合实践活动小组的小明同学就甲烷气体的浓度测量展开探究活动.小组同学通过上网查询,知道用二氧化锡制成的电阻阻值随空气中甲烷气体浓度(甲烷气体在空气中的体积分数)的增大而减小.他们从实验室借来一只二氧化锡电阻R x,并从产品说明书上获取相关参数,如下表所示.甲烷气体浓度/%O 20 40 60 80 100R x/Q 25 20 15 lO 7 5x13.同一型号的两个灯泡串联在电路中会一样亮吗,小军同学在进行电学实验时发现了有趣的实验现象。
