医疗器械产品技术要求(参考)
医疗器械技术要求

医疗器械技术要求一、引言医疗器械是医疗卫生行业中必不可少的一部分。
为了保证患者的安全和医疗质量,医疗器械必须符合一定的技术要求。
本文将介绍医疗器械的技术要求,包括性能、质量控制、设计要求等方面。
二、性能要求医疗器械的性能要求是指其在特定使用条件下所能执行的功能。
不同类型的医疗器械有着不同的性能要求。
例如,心电图机要求能够准确记录心电图结果,血压计要求能够准确测量血压值等等。
性能要求是医疗器械设计与制造的基础,必须严格符合相关标准和规范。
三、质量控制要求医疗器械的质量控制要求是指对医疗器械的制造过程和产品质量进行控制的要求。
包括原材料的选择、加工工艺的控制、产品检测的要求等。
医疗器械的质量控制是保证其安全性和可靠性的关键,必须按照相关标准和法规进行严格执行。
四、设计要求1. 结构设计医疗器械的结构设计是指其外观和内部结构的设计要求。
外观设计应美观大方,符合人体工程学,便于使用和操作。
内部结构设计应简洁明了,易于维护和检修。
结构设计必须考虑到不同用户群体的需求和使用习惯。
2. 安全设计医疗器械的安全设计是指在设计过程中考虑到使用过程中可能存在的危险因素并采取相应措施,保证患者和医护人员的安全。
例如,手术刀的设计应避免误伤,药物注射器的设计应避免漏气等。
安全设计是医疗器械设计中最重要的方面之一。
3. 可靠性设计医疗器械的可靠性设计是指在设计过程中考虑到使用寿命、故障率、维修和保养等因素,确保其长期稳定可靠地工作。
可靠性设计需要考虑到各种环境和使用条件下的适应性。
五、标志和标签医疗器械的标志和标签是指在产品上标明的相关信息,包括产品名称、型号、生产厂家、使用方法、注意事项等。
标志和标签的设计要求明确、易识别、易读,并符合相关法规和标准。
六、总结医疗器械的技术要求包括性能要求、质量控制要求、设计要求等方面。
通过严格执行这些要求,可以保证医疗器械的安全性和可靠性,提高医疗质量,保护患者的生命和健康。
医疗器械的技术要求是医疗卫生行业的重要基础,应得到广泛的关注和重视。
医疗器械产品技术要求(精美模板)

标题:医疗器械产品技术要求(精美模板)一、概述随着科技的不断发展,医疗器械产品在医疗领域发挥着越来越重要的作用。
为了确保医疗器械产品的质量和安全性,我国制定了严格的产品技术要求。
本文将详细介绍医疗器械产品技术要求的相关内容,以供广大医疗器械研发和生产单位参考。
二、医疗器械产品技术要求的主要内容1. 产品性能要求医疗器械产品性能要求包括产品功能、性能指标、使用寿命等方面的内容。
产品功能要求是指产品应具备的基本功能,如诊断、治疗、监测等;性能指标要求是指产品在各种工况下的性能表现,如准确度、稳定性、灵敏度等;使用寿命要求是指产品在正常使用条件下的预期使用寿命。
2. 产品安全要求医疗器械产品安全要求包括电气安全、生物相容性、机械强度等方面的内容。
电气安全要求是指产品在正常使用和单一故障条件下的电气安全性能;生物相容性要求是指产品与人体组织接触时,不产生有害作用的性能;机械强度要求是指产品在运输、使用过程中,不发生损坏的性能。
3. 产品适用范围医疗器械产品适用范围是指产品可以安全、有效地使用的具体疾病、症状、人群等。
产品适用范围应明确、具体,避免产生歧义。
4. 产品使用方法医疗器械产品使用方法包括产品安装、操作、维护、清洗、消毒等方面的内容。
产品使用方法应详细、明确,确保医务人员和患者能够正确、安全地使用产品。
5. 产品标签和说明书医疗器械产品标签和说明书是产品的重要组成部分,应包括产品名称、型号、规格、生产日期、有效期、生产企业、产品性能、使用方法、注意事项等内容。
标签和说明书应采用清晰、易懂的语言,方便医务人员和患者正确理解和使用产品。
三、医疗器械产品技术要求的编制和审查1. 编制要求医疗器械产品技术要求编制应遵循以下原则:(1)科学性:技术要求应基于充分的科学依据,确保产品性能和安全;(2)合理性:技术要求应考虑实际使用需求,确保产品在实际应用中的有效性;(3)明确性:技术要求应明确、具体,避免产生歧义;(4)可操作性:技术要求应具有可操作性,方便研发和生产单位进行产品设计和生产;(5)可追溯性:技术要求应具有可追溯性,方便监管部门进行产品监管。
一次性使用电子宫腔检查镜产品技术要求参考

医疗器械产品技术要求编号:一次性使用电子宫腔检查镜1. 产品型号/规格及其划分说明1.1 型号规格PGONE由手柄和插入部组成。
1.3 适用范围该产品需与XXXX公司生产的医用内窥镜图像处理器(pgtwo)配套用于宫腔的成像和检查。
2. 性能指标2.1溶解析出物要求与患者接触部分的聚合物材料的溶解析出物要求如下:a)pH:与同批空白对照液对照,其 pH 差应不大于 2.0。
b)可溶出的重金属总含量:溶出液中可溶出的重金属总含量不超过5.0μg/mL。
c)高锰酸钾还原性物质:与等体积的同批空白对照液的消耗量差应不大于2.0 mL。
2.2表面和边缘宫腔镜的各组成件应当设计成对人体不会造成任何意外伤害,其所有表面不得有细孔,裂纹和毛刺。
2.3光学性能2.3.1 视场角:120°,允差-5%~+15%。
2.3.2 视向角:22°,允差±5°。
2.3.3分辨率:在工作距离处(10mm),中心分辨率应不低于 9.36 lp/mm。
— 1 —2.3.4照度:在工作距离处(10mm),照度应大于 1500lx。
2.3.5可清晰观察范围:3~50mm。
2.3.6内窥镜成像应清晰,视场边缘应圆整,视场内不得有影响观察的划痕、麻点及附着物等疵病。
2.3.7通过内窥镜观察,在工作距离 10mm 处,照明光斑应充满视场。
2.3.8视场质量视场应无重影或鬼影、闪烁等效应,无可见杂质、气泡等缺陷。
2.3.9照明有效性2.3.9.1边缘均匀性在有效景深范围(3~50mm)内检查,照明光斑应充满视场的有效尺度,且在最大视场角的 90%视场处的照度应均匀,在该视场带上选择四个正交方位测试,其均匀度应满足 U L≤25%。
2.3.9.2照明镜体光效内窥镜在W p的90%视场处的照明镜体光效IL eR 的名义值为1.2,照明镜体光效IL eR 的测定值应不小于名义值。
2.3.10综合光效内窥镜在W p的90%视场处的综合镜体光效 SLeR 的名义值为 5.5,测定值应不小于名义值。
医疗器械技术要求

医疗器械产品技术要求医疗器械产品技术要求编号:雾化管1.产品规格型号及其划分说明1.1产品规格型号A型、B型1.2结构组成雾化管A型为雾化管含咬嘴,B型为雾化管不含咬嘴。
1.3材质雾化管和咬嘴采用符合YY/T0114-2008医用输液、输血、注射器具用聚乙烯专用料制成。
2.性能指标2.1外观2.1.1雾化管的管体和管端内表面应光滑过渡,洁净无污物。
2.1.2雾化管的外表面应柔软、光滑、规则,无明显的机械杂质和异物。
2.1.3咬嘴应无飞边、毛刺,洁净无污物。
2.2基本尺寸2.2.1雾化管实际长度应为标记长度±标记长度的10%。
2.2.2雾化管管壁厚应不小于0.4mm。
2.2.3雾化管接头和咬口接头应能与YY1040.1-2003规定的22mm或15mm圆锥接头相配合。
2.3雾化管2.3.1气流阻力在15L/min流量下对雾化管试验时,压力增量不应超过0.2kPa。
2.3.2泄漏雾化管泄漏速率应不超过10mL/min。
2.4咬口咬口口腔受力部分应能承受50N的压力30min无明显扁瘪。
2.5连接牢固度咬口和管路连接后,应能承受不小于15N的静拉力,持续15s而不脱落。
2.6微生物限度雾化管和咬口细菌菌落总数应≤200cfu,真菌菌落总数应≤100cfu,大肠菌群不得检出。
3.检验方法3.1外观以目力观察,应符合2.1的要求。
3.2基本尺寸以通用或专用量具测量,应符合2.2的要求。
3.3雾化管3.3.1气流阻力:按YY0461-2003中附录A试验时,应符合2.3.1的要求3.3.2泄漏:按YY0461-2003中附录D试验时,应符合2.3.2的要求。
3.4咬口用压力计在咬口中部施加50N的作用力并保持30min,应符合2.4的要求。
3.5连接牢固度在管路和咬口之间施加于15N的静拉力,持续15s,应符合2.5的要求。
3.6微生物限度按《中国药典》2015版第四部中1105非无菌产品微生物限度检查微生物计数法和1106非无菌产品微生物限度检查控制菌检查法中规定的方法进行检查,应符合2.6的要求。
医疗器械产品技术要求格式

医疗器械产品技术要求格式1. 引言本文档旨在规定医疗器械产品的技术要求,以确保产品的质量和安全性。
本文档适用于所有医疗器械产品的研发、制造和销售过程。
2. 术语和定义在本文档中,以下术语和定义适用:医疗器械:指任何设备、仪器、器具、材料或其他物品,用于预防、诊断、治疗、缓解或监测疾病、损伤或生理过程的目的。
技术要求:指医疗器械产品在设计、制造和使用中需要满足的技术要求和规范。
3. 技术要求详细说明3.1 设计要求医疗器械产品的设计应符合相关的技术标准、法规和行业规范。
设计应考虑产品的功能、性能、安全性、可靠性和易用性。
设计应满足用户的需求和期望,并具有良好的人机工程学特性。
3.2 材料要求所使用的材料应符合相关的法规和标准,且具有足够的生物相容性。
材料的选择应考虑产品的用途、工作环境和预期使用寿命。
3.3 制造要求制造过程应符合相关的质量管理体系和标准。
制造工艺应能够确保产品的质量和一致性。
制造过程中的关键参数应进行监控和记录。
3.4 标识和包装要求医疗器械产品应在产品上标示清晰的标识、标志和警示语。
包装应符合相关的标准和法规,以确保产品在运输和存储过程中的安全性和完整性。
4. 验证和验证要求验证和验证应符合相关的方法和标准,以确保产品的性能和安全性满足要求。
验证和验证应包括材料测试、功能测试和耐久性测试等方面。
5. 审核和记录要求设计、制造和验证过程应进行审核和记录。
相关记录应保留并随时可查。
6. 产品维护和售后服务要求医疗器械产品的维护和售后服务应提供相关的技术支持和培训。
产品的维修和更换应符合相关的规范和流程。
7. 附录本文档的附录中包含了相关的参考资料和标准,供参考和使用。
以上是医疗器械产品技术要求的文档格式。
请根据实际情况和要求进行适当的修改和补充。
(完整版)医疗器械产品技术要求

一次性使用微量泵连结收技术要求医疗器材产品技术要求编号:一次性使用微量泵连结收1.0 产品型号 / 规格及其区分说明:1.1 产品型号:3*150cm1.2 产品规格:管路公称内径为 1.4mm,长度为 1800mm。
1.3 合用范围:合用于 ICU、手术室需要使用麻醉药物进行手术的病人,本产品与多通道微量泵配合进履行用,用于多种药物近端混淆给药,减少了药物混淆时间,提升了麻醉功能,解决了临床上同时使用多根延伸管纷乱、易打结等临床问题,便于医护人员进行操作,检查。
1.4构造构成:一次性使用微量泵连结收(以下简称连结收)由管路、鲁尔接头、护帽、药液过滤器(可选配)、逆流阀(可选配)、止流夹(可选配)构成,产品典型构造表示图见图1。
1- 管路 2- 鲁尔接头3- 护帽 4- 药液过滤器 5- 逆流阀 6- 止流夹图 1 一次性使用微量泵连结收构造表示图。
1.5资料:各零零件均为高分子资料。
2.0 性能指标:2.1 物理指标2.1.1 外观:连结收表面应平坦、干净、无损坏,无杂质。
2.1.2 管路:由塑料制成的软管应柔嫩,透明,光洁,无杂质。
其透明度能看清气泡。
2.1.3 护帽:连结收两头及鲁尔接头应有护帽,护帽应牢靠,但要易于拆掉。
2.1.4 药液过滤器:应有一药液过滤器,过滤器对乳胶粒子得滤除率应不小于80%。
2.1.5 止流夹:在使用过程中不损害延伸管,在止流夹阻断状态下通入20kPa的液压 15s 应无液体经过。
2.1.6 接头:应切合 GB/T 1962.2 的要求。
2.1.7 密封性:应无气体泄露现象。
2.2 化学指标金属离子含量:钡、铬、铜、铅、锡总含量不超出1μg/ml 。
镉含量不超出0.1μg/ml 。
酸碱度:一次性使用微量泵连结收浸提液的PH 值与空白比较液之差不得超出1.0 。
易氧化物:一次性使用微量泵连结收浸提液与等体积的空白比较液对比,0.002mol/L 的高锰酸钾溶液耗费量之差应≤0.5mL。
医疗器械产品技术要求
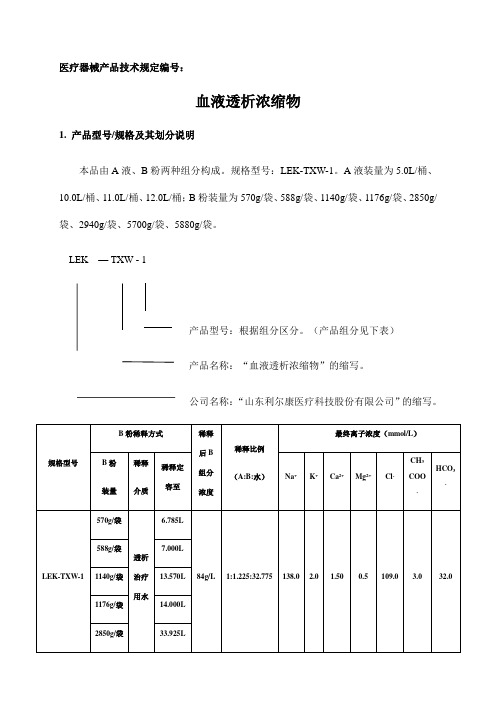
医疗器械产品技术规定编号:血液透析浓缩物1. 产品型号/规格及其划分说明本品由A液、B粉两种组分构成。
规格型号:LEK-TXW-1。
A液装量为5.0L/桶、10.0L/桶、11.0L/桶、12.0L/桶;B粉装量为570g/袋、588g/袋、1140g/袋、1176g/袋、2850g/袋、2940g/袋、5700g/袋、5880g/袋。
LEK — TXW - 1产品型号:根据组分区分。
(产品组分见下表)产品名称:“血液透析浓缩物”的缩写。
公司名称:“山东利尔康医疗科技股份有限公司”的缩写。
注:稀释用水为血液透析和相关治疗用水。
2. 结构组成本品A液由氯化钠、氯化钾、氯化镁、氯化钙、冰醋酸等原料组成;B粉由碳酸氢钠组成。
2.1 氯化钠别名:食盐化学式:NaCl 相对分子质量:58.44管制类型:不管制CAS号:7647-14-5 EINECS号:231-598-3本品为无色、透明的立方形结晶或白色结晶性粉末;无臭,味咸。
生产血液透析浓缩物所采购的医用级氯化钠的各项技术指标均符合《中华人民共和国药典》四部(2023年版)药用辅料氯化钠项下的各项技术指标规定。
2.2 氯化钾别名:- 化学式:KCl 相对分子质量:74.45管制类型:不管制CAS号:7447-40-7 EINECS号:231-211-8本品为无色长棱形、立方形结晶或白色结晶性粉末;无臭。
生产血液透析浓缩物所采购的医用级氯化钾的各项技术指标均符合《中华人民共和国药典》四部(2023年版)药用辅料氯化钾项下的各项技术指标规定。
2.3氯化钙别名:- 化学式:CaCl2·2H2O 相对分子质量:147.02管制类型:不管制CAS号:10043-52-4 EINECS号:233-140-8本品为白色、坚硬的碎块或颗粒;无臭;极易潮解。
生产血液透析浓缩物所采购的医用级氯化钙的各项技术指标均符合《中华人民共和国药典》四部(2023年版)药用辅料氯化钙项下的各项技术指标规定。
医疗器械产品技术要求参考

医疗器械产品技术要求(参考)医疗器械产品技术要求编号xxxxxxx电动手术台1.产品型号/规格及其划分说明1.1型号xx-x-x设计序号产品分类x 电动xx汉字拼音字头1.2组成手术台由多节式台面头板、背板、臀板、腿板、立柱、底座、液压传动系统、控制器和配套件组成。
配套件有搁臂板、肩托板、腿托架2.性能指标2.1工作条件a)环境温度-20℃~50℃;b)相对湿度30〜80; c )大气压力700 hPa〜1060hPa ;d )电源电压AC220V±22V;。
)频率50Hz±1Hz。
2.2外观2.2.1手术台的外观应平整光滑,表面不得有锋棱、毛刺、凹凸缺陷。
无露底、起泡、裂纹、流挂、脱落等现象。
2.2.2手术台的电镀件表面应光滑,色泽应均匀,不允许擦伤、烧痕、针孔、毛刺和可见的裂纹;2.2.3手动机构应灵活可靠。
手术台移动灵活,刹车制动可靠。
2.3基本参数详见表1。
表1项目说明备注台面规格mm全长XXX,宽度XXXX 台面高度mm最低<XXX最高>XXX台面动作参数头板可上折>XX°,下折>XX°,可拆卸背板上折>XX°, 下折>XX°台面前倾>XX°, 后倾>XX°台面左倾>XX°,右倾>XX°台面平移XXXXX腿板分叉式外折NXX°,下折NXX°,可拆卸2.4正常工作载荷135kg。
手术台面均载135Kg.,各功能动作应平稳。
2.5.渗漏手术台液压系统应无渗漏现象。
手术台台面按照3.2规定方法检验,液压系统历时5h (气压系统历时1h),手术台下降距离不得大于8mm。
2.6动作平稳性手术台各种动作变换应该平稳,不得产生抖动现象。
2.7台面摆动量空载下,台面呈现最高位置时,应保持水平,取下头板、搁臂板和所有配套件后,应符合下列要求纵向摆动量应不大于15mm;横向摆动量应不大于10mm;水平侧向摆动量应不大于18mm。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医疗器械产品技术要求编号:xxxxxxx电动手术台1.产品型号/规格及其划分说明1.1 型号xx-x-x设计序号产品分类x电动xx汉字拼音字头1.2 组成手术台由多节式台面(头板、背板、臀板、腿板) 、立柱、底座、液压传动系统、控制器和配套件组成。
配套件有搁臂板、肩托板、腿托架2.性能指标2.1 工作条件:a)环境温度 -20℃~+50℃;b)相对湿度 30%~80%;c)大气压力 700 hPa~1060hPa;d)电源电压 AC220V±22V;e)频率 50Hz±1Hz。
2.2 外观2.2.1 手术台的外观应平整光滑,表面不得有锋棱、毛刺、凹凸缺陷。
无露底、起泡、裂纹、流挂、脱落等现象。
2.2.2 手术台的电镀件表面应光滑,色泽应均匀,不允许擦伤、烧痕、针孔、毛刺和可见的裂纹;2.2.3 手动机构应灵活可靠。
手术台移动灵活,刹车制动可靠。
2.3 基本参数详见表1。
表12.4 正常工作载荷 135kg。
手术台面均载135Kg.,各功能动作应平稳。
2.5. 渗漏手术台液压系统应无渗漏现象。
手术台台面按照3.2规定方法检验,液压系统历时5h(气压系统历时1h),手术台下降距离不得大于8mm。
2.6 动作平稳性手术台各种动作变换应该平稳,不得产生抖动现象。
2.7 台面摆动量空载下,台面呈现最高位置时,应保持水平,取下头板、搁臂板和所有配套件后,应符合下列要求:纵向摆动量应不大于15mm;横向摆动量应不大于10mm;水平侧向摆动量应不大于18mm。
2.8 拆装头板、搁臂板,腿板和所有配套件装卸应方便、锁止应可靠。
2.9 材料台面和台垫应选用能透过X射线的材料制成,便于透视摄影。
2.10 噪声手术台在载有按全工作负荷时,其运动噪声在一米距离处,不得大于65dB(A)。
2.11 电磁兼容性应符合YY 0505—2012的要求和0570-2005中36.101的要求.2.12 电气安全要求手术台电气安全应符合GB9706.1-2007的要求,产品主要特征见附录A。
2.13 环境手术台应符合GB/T14710-2009中气候环境试验II组、机械环境II组的要求见附录B.3.检验方法3.1 外观用手感目力检查,其结果应符合2.2的规定。
3.2 基本参数用通用量具测量,其结果应符合2.3的规定。
3.3 安全工作载荷按YY0570-2005中图102所示安全工作载荷,应符合2.4的规定。
3.4 渗漏手术台在20℃±5℃的条件下,按照YY1106-2008中5.2的规定进行实验,其结果应符合4.3的规定。
3.5 动作平稳性手术床在变换动作时,以手触摸台面实验,其结果应符合2.6的规定3.6 台面摆动量按照YY1106-2008中5.4的规定进行实验,其结果应符合2.7的规定。
3.7 拆装通过实际操作进行验证其结果应符合2.8的规定3.8 材料台面及所选用的台垫,在X射线摄影(50KV)或X射线透视(70KV)的状态下目测应该无阴影,符合2.9的规定。
3.9 噪声按YY 0570-2005中图102所示安全工作载荷,在变换手术台状态时,用声级计测量离手术台1m处的噪声,应符合2.10的要求。
3.10 电磁兼容性按符合YY 0505-2012和YY 0570-2005中36.101的规定试验,应符合2.11的要求。
3.11 安全见附录A。
3.12 环境见附录B附录A安全A.1 产品特征A.1.1手术台为可移动式设备,由多节式台面、立柱、底座、液压传动系统、控制器和配套件组成。
A.1.2手术台按GB9706.1-2007对电击危险防护类型属Ⅰ类、B型应用部分的普通设备。
A.1.3 手术台没有信号输入、输出部分,有应用部分。
A.1.4输入电压为AC220V±22V,50Hz±1Hz输入功率为≤400VA。
A.1.5外壳防护等级为IPX4A.2 要求和试验方法A.2.1 外部标记至少应有下列“永久帖牢的”和“清楚易认的”标记:a)生产厂名称;b)产品名称和型号;c)电源:交流220V+22V、频率:50Hz±1Hz;d) 输入功率:400VAe) 设备安全分类:Ⅰ类、B型应用部分f) 熔断器型号及额定值:5A Φ6x30.A.2.2 部标记:不适用。
A.2.3 控制器件及仪表标记。
要求:a)电源开关用“l”,“0”表示通断。
b)功能键的标记用符号表示。
A.2.4 符号 A2.1~A2.3中用作标记的符号应符合GB9706.1-2007中附录D的规定。
试验方法:通过检查,予以验证。
A.2.5 导线绝缘颜色A.2.5.1 要求a)保护接地线的绝缘,全长为绿/黄色。
仪器部与保护接地端相连的导线上的绝缘体必须至少在导线终端为绿/黄色;b)电源线中导线绝缘的颜色,应符合GB9706.1-2007中6.5e)关于三心电缆颜色的要求,且与电源中性线相连的导线绝缘应为浅兰色。
A.2.5.2 试验方法:通过检查,予以验证。
A.2.6 气体识别,不适用。
A.2.7 气体连接点识别,不适用。
A.2.8 指示灯颜色要求:应符合GB9706.1-2007中的6.7a)的要求。
试验方法:通过检查,予以验证。
A.2.9 按钮颜色要求:按钮颜色应符合GB9706.1中的6.7 b)的要求。
试验方法:通过检查,予以验证。
A.2.10 随机文件齐全性使用说明书应符合GB9706.1中6.8.1的规定。
试验方法:通过检查,予以验证。
A.2.11 使用说明书A.2.11.1 要求:使用说明书应包含以下容:a)GB9706.1中6.8.2a)d)和6.8.3a)b)d)规定的容;b)YY0570-2005中6.8.3增补的容:c)本企业可按要求提供GB9706.1-2007中6.8.3c)所列文件的承诺。
A.2.11.2 试验方法:通过检查,予以验证。
A.2.12 技术说明书技术说明书与使用说明书合并。
A.2.13 输入功率≤400 VA试验方法:电源电压置242V,在手术台变化状态时用有效值交流安培表电压表测量,读出稳态电流和电压值,取其乘积。
A.2.14 环境试验运输和贮存a)环境温度围:-40℃~55℃b)相对湿度围:≤90%c)大气压力围:500~1060hPa运行a) 环境温度围:5℃~40℃b) 相对湿度围:30%~70%c) 大气压力围:500~1060hPad)电源:AC220±22V,50Hz±1HzA.2.15 安全类型Ⅰ类B型应用部分试验方法:通过检查和有关试验予以验证。
A.2.16 剩余电压应符合GB9706.1-2007中的15 b)的要求。
试验方法:按GB9706.1中15b)的规定,用剩余电压测试仪进行试验。
A.2.17 剩余能量:不适用A.2.18 外壳的封闭性应符合GB9706.1-2007中16 a)的要求。
试验方法:按GB9706.1-2007中16 a)的规定,用标准试验指、试验针、试验钩进行试验。
A.2.19 不用工具就可打开的罩、门的安全性:不适用。
A.2.20 灯泡安全性:不适用。
A.2.21 顶盖安全性:不适用。
A.2.22 控制器件的保护阻抗:不适用。
A.2.23 带电件防护:不适用。
A.2.24 整机外壳安全性,防止与带电部件接触的外壳必须仅用工具才能移开。
试验方法:通过检查,予以验证。
A.2.25 调节孔安全性:不适用。
A.2.26 隔离程度应符合GB9706.1中17a)4)的要求。
试验方法:查阅有关技术文件和相关试验验证。
A.2.27 应用部分的隔离应符合GB9706.1中17.c)的要求。
试验方法:查阅技术文件和相关试验验证。
A.2.28 软轴的隔离:不适用A.2.29 可触及部件隔离应符合GB9706.1中17g)1)、17g)4)的要求。
试验方法:查阅有关技术文件和相关试验验证。
A.2.30 电位均衡导线连接装置:不适用A.2.31 保护接地阻抗要求:电源输入插口中的保护接地点与保护接地的所有可触及金属部件之间的阻抗,不得超过0.1Ω。
试验方法:应符合GB9706.1中18f)的规定,使用医用电击防护参数测试仪进行实验。
A.2.32 功能接地端子:不适用A.2.33 功能接地线的标记:不适用A.2.34 正常工作温度下的连续漏电流要求:应不超过表A1所列容许值。
表A1 连续漏电流容许值单位为毫安防护参数测试仪进行试验。
A.2.35 正常工作温度下的患者辅助电流不适用。
A.2.36 正常工作温度下电介质强度A.2.36.1 要求:a) A-a1部位应能承受1500V、50HZ正弦波电压试验,历时1min无击穿或闪络现象。
b)A-a2部位应能承受4000V、50HZ正弦波电压试验,历时1min无击穿或闪络现象。
c) B-a部位应能承受4000V、50HZ正弦波电压试验,历时1min无击穿或闪络现象。
A.2.36.2 试验方法:按GB9706.1-2007中20.4的规定,使用医用电气设备电击防护参数测试仪进行试验。
A.2.37 潮湿预处理后的连续漏电流应不超过表1所列容许值。
试验方法:潮湿预处理可与环境试验中的湿热贮存试验一并进行。
潮湿预处理后连续漏电流试验,按GB9706.1-2007中19.4的规定,使用医用电气设备电压防护参数测试仪进行试验。
A.2.38 潮湿预处理后的患者辅助电流不适用。
A.2.39 潮湿预处理后的电介质强度A.2.39.1 要求:见A2.36.1A.2.39.2 试验方法:潮湿预处理与环境实验中的湿热贮存试验一并进行。
潮湿预处理后电介质强度试验,按GB9706.1-2007中20.4的规定,使用医用电气设备电击防护参数测试仪进行试验。
A.2.40 外壳及零部件刚度应符合GB9706.1-2007中21a)的要求。
试验方法:应符合GB9706.1-2007中21a)的规定,用加力计量装置试验。
A.2.41 外壳机零部件强度应符合GB9706.1-2007中21b)的要求。
试验方法:按GB9706.1-2007中21b)的规定,用弹簧冲击试验装置试验。
A.2.42 提拎装置承载能力不适用。
A.2.43 支撑件的承载能力安全工作载荷135kg。
试验方法:按YY 0570-2005中21.101的规定试验。
A.2.44 抗坠落性手控开关应能承受GB9706.1-2007中21.5规定的坠落试验。
试验方法:按GB9706.1-2007中21.5的规定。
A.2.45 抗搬运应力应符合GB9706.1-2007中21.6的要求。
试验方法:按GB9706.1-2007中21.6的规定进行试验。
A.2.46 运动部件的安全性不适用。
A.2.47 传动部件的安全性要求:牵引用绳带必须被限制不会脱离或跳出其引导装置。
