高考化学复习铝及铝合金
高考化学一轮复习:铝及其化合物知识点总结

高考化学一轮复习:铝及其化合物知识点总结(一)铝单质——Al(两性单质)1、物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高,有良好的导电、导热性和延展性。
2、用途:铝有良好的导电、导热性和延展性,主要用于导线、炊具等,铝的最大用途是制合金。
3、铝合金特点:①密度小①强度高①塑性好①制造工艺简单①成本低①抗腐蚀力强4、化学性质:铝是较活泼的金属,自然界中没有铝单质(1)与非金属:4Al + 3O2 == 2Al2O3生成致密的氧化膜起保护作用。
(2)与酸的反应:2Al + 6HCl == 2AlCl3+ 3H2↑ 2Al + 6H+ == 2Al3+ + 3H2↑钝化:在常温下,铝与浓硝酸、浓硫酸反应,在表面生成致密的氧化膜,阻止进一步反应,保护铝。
(3)与碱的反应:2Al + 2NaOH + 6H2O == 2Na[Al(OH)4] + 3H2↑ 2Al + 2OH− + 6H2O == 2[Al(OH)4]− +3H2↑ (4)与某些盐溶液反应:如能置换出CuSO4、AgNO3等溶液中的金属。
(5)铝热反应:高温下铝与某些金属氧化物的反应(如Fe、Cr、Mn、V的氧化物)2Al + Fe2O3Al2O3 + 2Fe。
Al和Fe2O3的混合物叫做铝热剂(混合物)。
可用于焊接钢轨、冶炼金属。
(二)氧化铝——Al2O3(两性氧化物)白色固体,熔点高(2054①),常作为耐火材料和冶炼金属铝的原料。
两性氧化物:既能与强酸反应又能与强碱反应生成盐和水的氧化物。
1、与酸的反应:Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O2、与碱的反应:Al2O3 + 2NaOH + 3H2O == 2Na[Al(OH)4] Al2O3 + 2OH− + 3H2O == 2[Al(OH)4]−3、电解熔融的氧化铝制备金属铝:(三)氢氧化铝——Al(OH)3(两性氢氧化物)白色难溶于水的胶状沉淀,是两性氢氧化物,加热易分解。
高考理综高三一轮高考化学复习 第3章 第2讲 铝及其重要化合物

第2讲 铝及其重要化合物[考纲要求] 了解铝及其重要化合物的主要性质和应用。
考点一 铝的性质及应用1.铝的结构和存在铝位于元素周期表第三周期ⅢA 族,原子结构示意图为。
铝元素在地壳中含量丰富,仅次于硅。
自然界中的铝全部以化合态存在。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
3.金属铝的化学性质写出图中有关反应的化学方程式或离子方程式: ①Al O 2⎪⎪⎪⎪――→ 常温形成致密的氧化膜――→ 点燃4Al +3O 2=====点燃2Al 2O 3②2Al+3Cl 2=====点燃2AlCl 3③Al 酸⎪⎪⎪⎪――→氧化性酸遇冷的浓硫酸或浓硝酸钝化――→非氧化性酸2Al +6HCl===2AlCl 3+3H 2↑④2Al+2NaOH +2H 2O===2NaAlO 2+3H 2↑ ⑤2Al+Fe 2O 3=====高温Al 2O 3+2Fe(铝热反应) 4.对比记忆镁的化学性质铝镁与非金属反能被Cl 2、O 2氧化2Mg +O 2=====点燃2MgO应3Mg +N 2=====点燃Mg 3N 2 与水反应 反应很困难 能与沸水反应Mg +2H 2O=====△Mg(OH)2+H 2↑与碱反应 能溶于强碱溶液 不反应与某些氧化物反应能与Fe 2O 3、MnO 2、Cr 2O 3等金属氧化物发生铝热反应能在CO 2中燃烧:2Mg +CO 2=====点燃2MgO +C5.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
深度思考1.铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较好的抗腐蚀性能? 答案 铝在常温下迅速被氧气氧化,形成一层致密的氧化膜,保护铝不再被氧化,因而铝制品通常具有较强的抗腐蚀性能。
2.金属铝是活泼的金属,能与酸反应,为什么能用铝槽储运浓H 2SO 4或浓HNO 3?答案 常温下浓H 2SO 4、浓HNO 3能使铝钝化(在表面形成一层致密的氧化膜),阻止反应继续进行。
高考知识点铝元素

高考知识点铝元素高考知识点:铝元素铝(Al)是一种广泛应用的金属元素,其化学符号为Al,原子序数为13,在元素周期表中属于第3周期、3族元素。
铝元素的发现和应用对于高考化学知识非常重要。
1. 铝元素的发现历史铝元素最早由丹麦化学家汉斯·克里斯蒂安·厄尔斯泰德(Hans Christian Ørsted)于1825年发现。
他通过电解氯化铝的方法成功分离出金属铝,得到了纯度较高的铝样品,并确定了其化学性质。
2. 铝元素的物理性质铝元素是一种轻质、耐腐蚀的金属。
它的密度为2.7 g/cm³,熔点为660.32摄氏度,沸点为约2467摄氏度。
铝具有良好的导热性和导电性,属于典型的热电导金属。
3. 铝元素的化学性质(1)反应性:在常温下,铝元素比较稳定,不易与空气中的氧气发生反应。
然而,当铝暴露在空气中时,其表面会形成一层氧化铝(Al2O3)的致密薄膜,这层薄膜能够有效地防止进一步氧化。
(2)与酸反应:铝可以和酸类物质发生反应,生成相应的盐和氢气。
例如,铝和硫酸反应可以产生硫酸铝和氢气的反应。
4. 铝元素的应用铝是一种广泛应用的金属,其应用领域包括但不限于以下几个方面:(1)建筑领域:铝具有较低的密度和良好的耐腐蚀性,因此常用于制作建筑材料和构件,如铝合金窗户、铝合金门、铝合金屋顶等。
(2)电子领域:铝具有良好的导电性和导热性,因此广泛应用于电子器件的导线、散热片等部件。
(3)包装领域:铝具有较好的气密性和韧性,常用于制作食品和药品的包装材料,如铝箔和铝罐。
(4)航空航天领域:铝具有轻质、高强度的特点,被广泛应用于航空航天器的制造,如飞机、火箭等。
5. 铝元素的环境问题铝的生产和应用过程可能会对环境造成一定的影响。
例如,铝的生产需要大量的电能,其主要原料为铝矾土,采矿过程可能对土地和水资源造成一定的损害。
此外,铝与某些物质的结合可能会产生有毒的废弃物,对环境和生态系统造成污染。
高考化学复习高中总复习:专题3第3讲从铝土矿到铝合金

第3讲从铝土矿到铝合金[考纲要求] 1.了解铝的主要性质及应用。
2.认识铝热反应及其应用。
3.了解铝的重要化合物的主要性质及应用。
考点一铝1.铝的结构和存在铝位于元素周期表______________,原子结构示意图为________________。
铝元素在地壳中含量丰富,仅次于____。
自然界中的铝全部以________态存在。
2.金属铝的物理性质________色有金属光泽的固体,有良好的____________、__________和传热性等,密度较小,质地柔软。
3.金属铝的化学性质根据下列转化关系,完成化学方程式。
①________________________________________________________________________;②________________________________________________________________________;③________________________________________________________________________;④________________________________________________________________________;⑤________________________________________________________________________;⑥________________________________________________________________________;⑦________________________________________________________________________。
1.金属铝是活泼的金属,能与酸反应,为什么能用铝槽储运浓H2SO4或浓HNO3?2.实验室能否用硫化物与铝盐溶液混合制取Al2S3?用离子方程式说明原因。
2024年高考化学一轮复习知识清单07 铝及其重要化合物
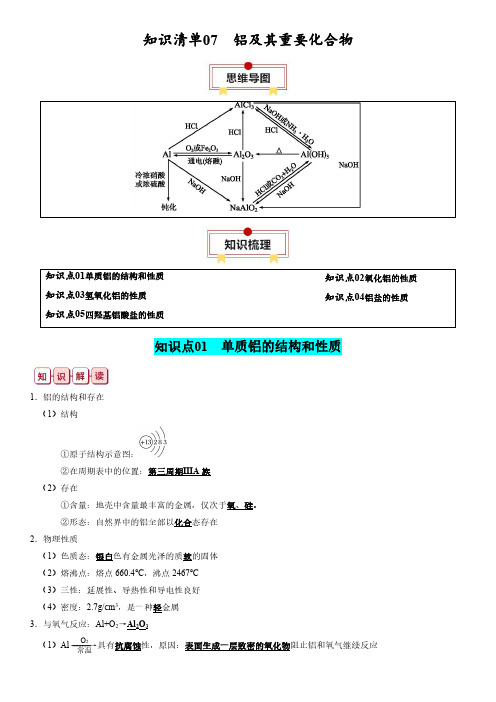
知识清单07铝及其重要化合物知识点01单质铝的结构和性质知识点03氢氧化铝的性质知识点05四羟基铝酸盐的性质知识点02氧化铝的性质知识点04铝盐的性质知识点01单质铝的结构和性质1.铝的结构和存在(1)结构①原子结构示意图:②在周期表中的位置:第三周期ⅢA 族(2)存在①含量:地壳中含量最丰富的金属,仅次于氧、硅。
②形态:自然界中的铝全部以化合态存在2.物理性质(1)色质态:银白色有金属光泽的质软的固体(2)熔沸点:熔点660.4℃,沸点2467℃(3)三性:延展性、导热性和导电性良好(4)密度:2.7g/cm 3,是一种轻金属3.与氧气反应:Al+O 2→Al 2O 3(1)Al -------→O 2常温具有抗腐蚀性,原因:表面生成一层致密的氧化物阻止铝和氧气继续反应(2)Al -------→O 2点燃放出大量的热,发出耀眼的白光4.铝热反应(1)实验装置(2)反应:2Al+Fe 2O 32Fe+Al 2O 3(3)本质:Al 和不活泼金属氧化物的置换反应(4)引发操作:加入少量KClO 3,插上Mg 条并点燃(5)特点:反应放出大量的热,得到熔融的金属(6)应用:冶炼V 、Cr 、Mn 等难熔金属;焊接钢轨①冶炼V :10Al+3V 2O 55Al 2O 3+6V ②冶炼Cr :2Al+Cr 2O 32Cr+Al 2O 3③冶炼Mn :4Al+3MnO 23Mn+2Al 2O 3④冶炼Cu :2Al+3Cu 2O6Cu+Al 2O 35.铝与酸的反应(1)氧化性酸①Al ---------------------→浓硝酸、浓硫酸常温钝化②Al ---------------------→浓硝酸、浓硫酸加热剧烈反应,分别放NO 2和SO 2气体③Al ----------→稀硝酸常温放NO 气体(2)非氧化性酸:Al ---------------------→稀盐酸、稀硫酸常温放H 2①关系式:2Al~6H +~3H 2↑②离子方程式:2Al+6H +2Al 3++3H 2↑6.铝与强碱溶液的反应(1)化学:2Al+2NaOH+6H 2O 2Na [Al (OH )4]+3H 2↑(2)离子:2Al+2OH -+6H 2O2[Al (OH )4]-+3H 2↑(3)铝和强碱溶液的反应过程①置换反应:2Al+6H2O2Al (OH )3+3H 2↑②中和反应:Al (OH )3+NaOH Na [Al (OH )4]③还原剂是Al ,氧化剂是H 2O7.铝与盐溶液的置换反应(1)CuSO 4-------→Al Cu ;AgNO 3-------→AlAg(2)FeCl 3-------→Al少量Fe 2+;FeCl 3-------→Al过量Fe易错点:铝的易错知识点(1)铝是活泼金属,但铝的抗腐蚀性强,因为铝的表面有一层致密的氧化物薄膜。
高考化学压轴题之铝及其化合物推断题(高考题型整理,突破提升)附答案解析

高考化学压轴题之铝及其化合物推断题(高考题型整理,突破提升)附答案解析一、铝及其化合物1.Ⅰ.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),工艺流程如图:i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为CrO42-。
ii.常温时,部分金属离子开始沉淀和完全沉淀时的pH值(1)步骤①提高酸溶速率的措施__(任填一条即可)。
固体A的成分是___。
(2)步骤③需加氢氧化钠溶液调节pH,调节pH范围为__,目的是__。
(3)写出④反应的离子方程式__。
(4)将溶液H经过__即得红矾钠粗晶体。
Ⅱ.经该工厂的工业废水中含1.00×10-3mol·L-1的Cr2O72-,其毒性较大。
该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:(5)第①步反应的离子方程式是__。
(6)常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据,则步骤②加入NaOH溶液调节溶液的pH至9时,溶液中Cr3+的浓度为___mol/L(101/2≈3.2)。
(7)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。
理论上需要加入FeSO4·7H2O的质量为__g(已知FeSO4·7H2O的摩尔质量为278g/mol)。
【答案】加热/搅拌/粉碎/适当提高稀硫酸的浓度(任写一条) SiO2 4.9≤pH<5.5 使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去 3NaBiO3 + 2Cr3+ +7OH- + H2O =2Cr2O72− + 3Bi(OH)3↓+3Na+蒸发浓缩、冷却结晶、过滤洗涤干燥 Cr2O72− + 6Fe2++14H+ = 2Cr3+ + 6Fe3++7H2O 6.4×10−14 2.78【解析】【分析】铬铁矿中的FeO 、Cr 2O 3和Al 2O 3均能溶于硫酸,SiO 2不溶,过滤,向滤液中加入双氧水,氧化亚铁离子,步骤③的目的是使Fe 3+、Al 3+沉淀,过滤,向滤液中加入NaBiO 3、NaOH ,能将Cr 3+转化为Cr 2O 72−,过滤,将滤液蒸发浓缩、冷却结晶、过滤洗涤干燥得到Na 2Cr 2O 7·2H 2O 。
高考化学一轮复习配套课件:从铝土矿到铝合金

合金只能是金属与金属的混合物吗? 提示:不是,合金可以是金属与金属熔合得到,也可以 由金属与非金属组成,如生铁就是铁、碳合金。
[自我诊断] 1.铝合金抗腐蚀性强是因为其硬度大。(×) 2.Al箔插入稀硝酸中,无现象,说明Al箔表面被
HNO3氧化,形成致密的氧化膜(×) 3.向AlCl3溶液中加足量氨水,离子方程式为 Al3++4NH3·H2O===AlO +4NH +2H2O。(×) 4.加入铝粉能产生H2的溶液中,可能存在大量的Na +、Ba2+、AlO 、NO (√) 5.MgO与铝粉可发生铝热反应。(×) 6.由Al2O3―→Al(OH)3可一步生成Al(OH)3。(×)
则Al与NaOH反应生成的H2为0.15 mol×2=0.3 mol 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 2×27 g 3 mol 5.4 g 0.3 mol 即投入的铝粉为5.4 g。 [答案] A
可能中药是咱们中国人自己的吧,我们总是会对这东
+ - - - - + - 发生水解相互促进的反应而不能大量共存;AlO- 与 H 、 HCO 2 3 以及弱
碱阳离子(如 Al3+、Fe3+等)不能大量共存。
(2)鉴别(利用相互滴加的顺序不同,现象不同) ①AlCl3溶液中滴加NaOH溶液现象为:先产生白色沉淀,后沉淀溶解。 ②NaOH溶液中滴加AlCl3溶液现象为:开始无明显现象,后产生白色 沉淀,沉淀不溶解。
银白 还原
(1)与非金属单质反应
致密
(2)与酸溶液反应
(3)与NaOH溶液反应的离子方程式为 。
(4)铝热反应:如Al与Fe3O4反应的化学方程式为
高考化学一轮复习 3.7考点强化 铝的主要性质与用途课

HNO3
•
氧化,形成致密的氧化膜
• B.工业上电解熔融状态的Al2O3制备Al • C.日用铝制品表面覆盖着氧化膜,对内部金属起保护
作
•
用
• D.铝制容器可盛装浓H2SO4
•
解析显/隐
解析 浓硝酸才能使Al钝化形成致密的氧化膜。
3.总结归纳
•
铝的两大特殊反应
• 1.与碱的反应
•
活泼金属与酸反应是金属的通性,而铝不但能与酸(H+)反应,还能够
• A.比纯铝熔点高 D • B.具有比较活泼的化学性质 • C.各种成分在自然界中含量丰富,容易获取 • D.质量轻,强度大,抗腐蚀能力比较强
•
•ห้องสมุดไป่ตู้
解析 A 项,铝合金的熔点比纯铝低,错误;B 项,作为制造
车厢的材料铝合金抗腐蚀能力应该较强,即化学性质应该较稳
定,错误;C 项,铝的含量丰富,但却不容易获取,制取金属
第三章 金属及其化合物
考点强化: 铝的主要性质与用途
1.考点精讲 2.典例剖析 3.总结归纳 4.变式训练 5.真题演练
1.考点精讲
一、铝
1.铝的原子结构和存在 铝位于元素周期表_第__3_周__期__Ⅲ__A_族__,原子结构示意图为_______。
铝元素在地壳中含量丰富,仅次于_硅__。自然界中的铝全部以 _化__合__态存在。 2.金属铝的物理性质
_银__白_色有金属光泽的固体,有良好的_延_展__性__、_导__电__性__和 传热性等,密度较小,质地柔软。
3.金属铝的化学性质
点燃
①_2_A_l_+__3_C_l_2 ________2_A__lC__l3_
②_2_A__l _+_6_H_C__l_=_=_=__2_A__lC__l3_+_3_H2↑ ③_2_A__l _+_3_S_________A_l_2_S_3___
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题3 从矿物到基础材料
新知初探自学导引
自主学习
铝及铝合金 1.物理性质:铝是__银__白___色金属,熔点660.4 ℃,密度2.7 g·cm-3,是电的___良__导__体____。 2.主要用途:常用于制造__轻__质__合__金___,用 于__飞__机____、汽车、____轮__船______部件;做 ____导__线_____、炊具、建筑装饰材料等。
栏目 导引
专题3 从矿物到基础材料
要点突破讲练互动
要点一 铝的性质
探究导引 铝既能与盐酸反应又能与强碱NaOH溶液反 应,能说铝具有两性吗?为什么?
栏目 导引
专题3 从矿物到基础材料
提示:不能说铝具有两性.铝是活泼的金属, 铝之所以能够与NaOH溶液反应,是因为 Al(OH)3具有两性,反应过程:Al先与H2O 反应生成Al(OH)3和H2,Al(OH)3 能够溶于 NaOH溶液中。
栏目 导引
专题3 从矿物到基础材料
自主体验
1.下列有关金属铝及其化合物的叙述不.正确 的是(双选)( ) A.铝在常温下不能与氧气反应 B.铝不能与氯气反应 C.铝既能溶于强酸,又能溶于强碱 D.氧化铝既能与酸反应,又能与碱反应
栏目 导引
专题3 从矿物到基础材料
解析:选AB。铝可与氧气在常温下发生反
应;铝也能与氯气发生反应,所以A、B两
项不正确。
2.除去镁粉中混有的少量铝粉,可选用的
试剂是( )
A.稀盐酸
B.稀硫酸
C.氢氧化钠溶液 D.氨水
栏目 导引
解析:选C。
专题3 从矿物到基础材料
3.下列物质中,属于合金的是( )
A.硬铝
B.铝箔
C.冰晶石
D.水银
栏目 导引
专题3 从矿物到基础材料
解析:选A。合金是由两种或两种以上的金 属(或金属与非金属)熔合在一起而形成的具 有金属特性的物质。硬铝是由Al、Cu、 Mg、Mn、Si等形成的合金,铝箔是Al,冰 晶石是一种化合物,水银是Hg。
栏目 导引
专题3 从矿物到基础材料
栏目 导引
专题3 从矿物到基础材料
要点归纳 氢氧化铝沉淀量的图像大致可分为如下图所 示的三类。图中纵坐标均为Al(OH)3沉淀的 物质的量,横坐标为加入试剂的物质的量。
栏目 导引
专题3 从矿物到基础材料
即时应用
1.两份铝屑,分别与足量的盐酸和氢氧化
钠反应,在相同状况下产生H2的体积比为 1∶2,则这两份铝的质量比是( )
A.1∶1
B.1∶2
C.1∶3
D.2∶1
栏目 导引
专题3 从矿物到基础材料
解析:选B。由于酸和碱足量,铝被完全消 耗,反应产生的氢气的量由铝的量决定。根 据铝和盐酸、氢氧化钠反应的方程式中铝和 氢气的化学计量数的关系可知,两份铝的质 量比为1∶2。
栏目 导引
专题3 从矿物到基础材料
要点二 有关Al(OH)3沉淀的图像
探究导引 向含1 mol AlCl3的溶液中通入氨气至过量, 问生成氢氧化铝的物质的量与氨气的物质的 量之间有何关系?能否用图像表示? 提示:当n(NH3)≤3 mol时,n(NH3) =3n[Al(OH)3]。 当n(NH3)>3 mol时,n[Al(OH)3]=1 mol。
栏目 导引
专题3 从矿物到基础材料
(3)与酸的反应(写出与盐酸反应的离子方程 式): ____2_A__l+__6_H__+_=_=_=__2_A_l_3+__+__3_H_2_↑_____。 4.化学特性 (1)与强碱溶液的反应(写出与NaOH溶液反 应的方程式): 2_A__l+__2_N__a_O_H__+__2_H__2O__=_=_=_2_N__a_A_l_O_2_+__3_H_2_↑_。 (2)常温下遇___浓__硝__酸__、__浓__硫__酸_____钝化。
栏目 导引
专题3 从矿物到基础材料
要点归纳 铝与酸、碱溶液反应的计算规律
(1)反应原理: 2Al+6HCl===2AlCl3+3H2↑
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
栏目 导引
专题3 从矿物到基础材料
(2)规律:
反应物量的关 系
Al
稀盐酸、 NaOH溶液
产生H2的物质 的量的关系
栏目 导引
专题3 从矿物到基础材料
(3)铝热反应(写出冶炼铁、铬的方程式): _____2_A_l_+__F_e_2_O_3_=_=高_=温_=_=_A_l_2O__3+ __2_F__e_______ ; _____2_A_l_+__C_r_2_O_3_=_=高_=温 _=_=_2_C_r_+__A__l2_O_3_______。 想一想 铝热反应为什么能发生?意义是什么? 提 示 : 原 因 : (1) 铝 的 还 原 性 强 , (2) 生 成 Al2O3时会放出大量热。意义:冶炼高熔点 金属。
栏目 导引
专题3 从矿物到基础材料
3.活泼金属单质的通性 (1)与非金属单质(氧气、氯气等)的反应(写 出化学方程式):__4_A_l_+__3O__2_=_=△_==_=__2A__l2_O__3 _; ___2_A__l+__3_C_l_2_=_=△_==_=_2_A__lC__l3__。 (2)与水的反应(高温条件且反应缓慢,写化 学方程式): ___2_A_l_+__6H__2_O_=_=高_=_温=_=_2_A_l_(_O_H__)3_+__3_H_2_↑____。
栏目 导引
专题3 从矿物到基础材料
5.铝合金 铝合金具有__密___度__小___、____强__度__高______、 ___塑__性__好___、__制__造__工__艺__简单、__成__本__低__、 __抗__腐__蚀__能__力____强、装饰效果好等特点,主 要用于__建__筑__业____、____交__通__运__输__业______以 及电子行业。
n(HCl)(H2)∶
n(NaOH)(H2)
消耗H+、 OH-的物质 的量的关系
等 量
均过量
1∶1
3∶1
足 量
等量
1∶3
1∶1
栏目 导引
专题3 从矿物到基础材料
特别提醒 一定量的铝分别和一定量的 H+、OH-反应时, 若产生氢气的体积比为13<VVOHH+-HH22 <1,则必 定是与酸反应时铝过量,与碱反应时铝不足。
