芦荟组织培养
金丽勇开题报告

植物细胞工程-开题报告学校:海南大学学院:农学院专业:08生物技术(2)班姓名:金丽勇学号:2008 0104B 075指导老师:莫廷辉2010年12月10日芦荟组织培养的研究一、项目研究的目的意义芦荟属(学名:Aloe)通称芦荟,原产于地中海、非洲,为独尾草科多年生草本植物,据考证的野生芦荟品种300多种,主要分布于非洲等地。
这种植物颇受大众喜爱,主要因其易于栽种,为花叶兼备的观赏植物。
可食用的品种只有六种,而当中具有药有价值的芦荟品种主要有:洋芦荟(又名巴巴多斯芦荟或翠叶芦荟Aloe Barbadensis/Aloe Vera)库拉索芦荟(分布于非洲北部、西印度群岛),好望角芦荟(分布于非洲南部),元江芦荟等。
芦荟是百合科芦荟属多年生常绿多肉质草本植物。
近年来,由于芦荟化学及药理学研究的深入,巳形成了一股世界性的芦荟保健热。
据科学研究,发现芦荟中有不少成分对人体皮肤有良好的营养滋润作用,且刺激性少,用后舒适,对皮肤粗糙、面部皱纹、疤痕、雀斑、痤疮等均有一定疗效[1]。
因此,其提取物可作为化妆品添加剂,配制成防晒霜、沐浴液等。
至于轻度的撞伤、挫伤、香港脚、冻伤、皮肤龟裂、疣子等,都可以使用芦荟来治疗,效果不错。
现代研究显示,其叶含芦荟大黄素、异芦荟大黄素及芦荟苦味素等,药理实验有泻下、抗癌作用。
芦荟花性寒,味苦涩,有清热、止咳、止血功效,可治疗咳嗽、吐血[2]。
芦荟的栽培产业也已开始在我国兴起,但由于芦荟不能自花授粉结实,因此,用种子繁殖非常困难。
目前的繁殖方法主要是分株和分蘖,但难以快速、大量地繁殖种苗,这也是当前芦荟种苗昂贵的重要原因之一[3]。
本文介绍一种对芦荟茎尖进行组织培养快速繁殖试管苗的技术,利用这项技术可在短期内繁殖上百万株的种苗,具有成本低,效益高的特点。
二、国内外技术发展概况及趋势(附主要参考文献及出处)很多学者对芦荟不同外植体进行比较试验,苏海等[4]认为,二年生的库拉索芦荟(A. barbadensis)茎尖比茎段更容易诱导出不定芽,而且芦荟快速繁殖宜通过茎尖诱导出不定芽而获得无菌苗,这样省去了诱导愈伤组织步骤,缩短了诱导时间,而且可以减少种苗变异率。
美国芦荟组织培养研究

1. .5继代 培养 。 2 将启动培养所获得 的嫩 芽剪下接种 于 增 殖 培 养 基 上 进 行 增 殖 培 养 。继 代 培 养 基 分 别 用
6 B . 、. , 1 m / 和 2 mg 与 N A 一A 0 m 5 1 mr . g 0  ̄、 5 L . / O L A
植物 不同品种芽的分化都有不 同程度 的影响 。 因此 , 以 MS为基本 培养基 ,采用 2因素 3 水平 方差试验设计 , 6B - A设 置 l g 、m /、r /3 水平 , A m/ 2 g 3 g 个 L L a L N A设 置为 00 m / 、. g 、. m / .5 g 01 / 01 g 3个水 平 。每种 培养 基接 L m L 5 L
较好地促 进美 国芦荟茎段 芽诱 导生长 。
表 1 不 同激素组合对启动 率的影响
保湿 1 , 周 并进行正 常的水分 管理 ,0 3d后统计 成活 率
可达 9 . 5 %。 3 3 结论
在 芦荟 的组织 培养过程 中 , MS为基本培 养基 , 以
在初代 培养 中添加 6 B m 和 N A0 5 g 一 A2 玑 A . m f 0 L能较 好 的促进茎 段芽诱导和提高启 动率 ;继代增殖 中添 加 6 B . gL和 N A 0 5 / 一 A1 m , 0 A . mg 0 L能较 好地 促进 芽苗 增 殖 ;在生根 培养 中用 I MS培养基添 加 N 05 g / 2 从 . m m 能较好促进 无根单 苗 生根 ,诱 导出的根 粗壮 而且 多 。
织培养 ,可在较短时间 内繁殖 出大量优质美国芦荟种 苗[1目前, 5。 . 4 有关美 国芦荟组织 培养方面的研究报道相
NAA浓度对中华芦荟叶片组织培养影响的研究

不同浓度NAA诱导芦荟叶片愈伤效果的研究王玉梅广东第二师范学院生物系09园艺技术广州510303摘要:采用浓度差的方法,考察了0mg/L、0.5mg/L、1mg/L、1.5mg/L四种浓度的NAA对中华芦荟叶片愈伤组织的诱导效果的影响。
结果表明:在MS+0.2mg/L6-NA基本培养基中,1mg/L的NAA对愈伤的诱导效果最好。
关键词:芦荟(Aloe)叶片愈伤组织诱导芦荟(Aloe)为百合科芦荟属植物,含有七十多种对人体有益物质,在医学、食用、美容等多方面都具有广泛的实用价值【1】。
芦荟的繁殖一般采用扦插和分株繁殖,然而这些方法受繁殖基数的限制,初期繁殖速度较慢,而且容易是病毒积累,影响植株生长,甚至退化【2】。
采用叶片经愈伤组织诱导再促进长芽、生根的培养方法,不仅可以为生产提供一条在短期内繁殖出大量种苗的途径,以加速新品种的推广,而且还可以解决大规模快速繁殖中材料不足的问题。
该试验以中华芦荟为材料,采用浓度差的方法,探究不同浓度NAA在MS+0.2mg/L6-BA基本培养基中对中华芦荟叶片愈伤组织诱导效果,以期获得最佳浓度。
1 材料与方法1.1 实验材料中华芦荟的幼嫩叶片采自广东第二师范学院生物楼6楼顶1.2 实验方法1.2.1 培养基的配置以MS为基本培养基,其中添加0.2mg/L的6-BA和4个不同浓度的NAA组合(见表1),蔗糖3%,琼脂1%,PH5.8,培养基经高温杀毒30min备用。
表1 培养基与激素组合组名瓶数培养基 6-BA(mg/L) NAA(mg/L)A 10 MS 0.2 0B 10 MS 0.2 0.5C 10 MS 0.2 1D 10 MS 0.2 1.51.2.2 材料灭菌处理取芦荟幼嫩叶片,用自来水洗干净再在流水下冲刷3h, 再用75%的酒精进行表面消毒30s,然后用0.1%的升汞液消毒9min,最后用无菌水冲洗7~8次,洗去植物表面的升汞残液,放人无菌培养皿中,用无菌滤纸吸干水分备用。
芦荟的组织培养

三、生根培养
• 芦荟增殖芽数长到一定高度就可以转入生 根培养基,生根培养基采用 KC+IBA0.5mg/L+蔗糖3%+琼脂0.7%+活性 炭0.3%比较适宜。
四、壮苗培养
• 为了使植株健壮,使之能够在移栽后保证 较高的成活率,当在生根培养基上形成了 完整植株后,就可以转接到 1/2MS+IBA2mg/L+AC0.3%+蔗糖3%+琼脂 0.7%的壮苗培养基上进行壮苗培养。此阶 段可将光照强度增至2000LX,经过20d左 右培养,平均每个试管植株长出四五条粗 壮的侧根,叶色浓绿。此时即可移栽。
培养基的配制: 在芦荟的初代培养及诱导侧芽分化的过程 中,采用MS为培养基,附加蔗糖3%、琼 脂0.7%以BA3mg/L 、NAA0.2mg/L, PH5.8的培养基效果最为理想。 接种40d,统计在该培养基上平均每个外植 体诱导侧芽数为4个,且侧芽粗壮浓绿。
二、继代培养
• 在初代培养基上培养了40D左右时,侧芽转 接到成分为MS+BA3mg/L+NAA0.2mg/L+ 蔗糖3%+琼脂0.7%的培养基上培养,25d 后,每个芽周围又可长出4~6个侧芽,形成 芽丛,此时即可切下来再进行继代培养。 以后每25天可以培养一次。在第一至第五 次继代培养繁殖过程中,随着继代数的的 增加,每个芽丛平均新增殖芽数也明显增 多。
谢 谢
主要步骤
• • • • • 初代培养 继代培养 生根培养 壮苗培养 移栽与管理
一、材料与培养基
• 材料:取盆芦荟植株的上端或新芽,将材 料中心部分(生长点及附近组织)切成拇 指大小,置于自来水下冲洗干净。然后用 90%酒精消毒1min,立即用0.15%升汞灭 菌10min;再用无菌水冲洗四五遍,沥干水 分后,用于接种。 • 芦荟试管快繁的整个过程中温度均可控制 在(26±3)℃;白天以日光灯照明11h左 右,光照1000~1500lx,晚间黑暗。
芦荟组培实验报告
1.2 培养基
愈伤组织诱导培养基(一)MS + ( 2. 5mg / 1) 6- BA+ ( 0. 15mg / 1) NAA, PH6. 2;
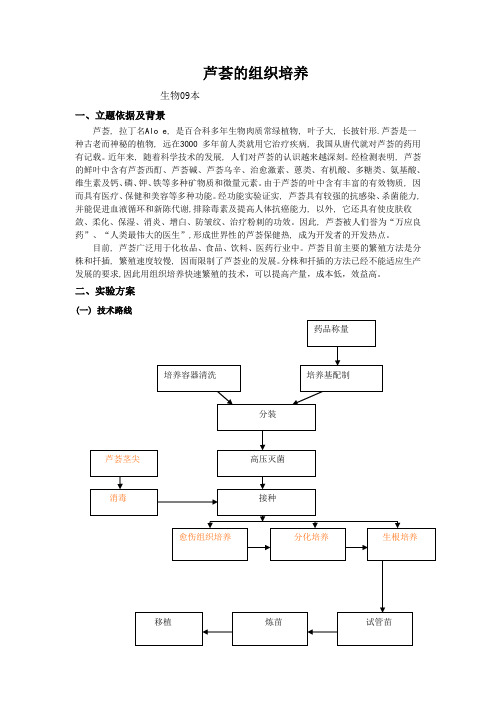
目前,芦荟广泛用于化妆品、食品、饮料、医药行业中。芦荟目前主要的繁殖方法是分株和扦插,繁殖速度较慢,因而限制了芦荟业的发展。分株和扦插的方法已经不能适应生产发展的要求,因此用组织培养快速繁殖的技术,可以提高产量,成本低,效益高。
二、实验方案
(一) 技术路线
(二) 材料、方法与手段
1 材料
1.1 样品来源
2.2愈伤组织
在无菌条件下,将灭菌好的芦荟的茎尖接种到愈伤组织诱导培养基上,培养条件:温度( 27±1)℃,每天光照10hr—12hr后,光强2001x ,约15天后,试管中的外植体就可膨大形成愈伤组织周后,可将愈伤组织转管进行继代培养或分化培养。两种各培养基接15瓶,每瓶接3块组织。
2.3分化培养
培养基(二):M S + BA 4.5mg/L + NAA 0.2mg/L +0.25%活性炭上
2.方法与手段
2.1外植体获得
将准备好的芦荟幼苗,用自来水冲洗好后,洗净外表泥土,切除根部大部分叶片,取茎尖部分,先用75%乙醇浸泡60S,然后再用0. 1%升汞消毒15min,最后用无菌水洗4次—5次。
3天
6天
9天
12天
15天
2.分化培养
分化培养基1
分化培养基2
接种数
分化数
分化百分比
小苗情况
原因分析
3.增值生根培养
《芦荟的组织培养》课件

组织培养的基本原理
介绍组织培养的基本原理和作用机制。
组织培养的步骤
详细说明进行芦荟组织培养时的步骤和 操作方法。
芦荟组织培养的应用
芦荟提取物 取物在医学和工业领域中的应用。
探讨芦荟在药物研究和治疗方面 的潜力。
工业领域的应用
讨论芦荟在工业生产中的用途和 应用领域。
芦荟的组织分化
通过培养芦荟的不同组织部 位,促进其分化和生长。
芦荟的快速繁殖
利用组织培养的技术,快速 繁殖大量芦荟植株。
芦荟的体细胞胚胎培养
通过体细胞胚胎培养技术, 培养出芦荟的胚胎组织。
芦荟的组织培养技术
1
组织培养所需的条件
2
讲解进行组织培养时所需的培养基和环
境条件。
3
组织培养注意事项
4
提醒注意进行组织培养时需要特别注意 的事项和技巧。
[参考文献列表]
鸣谢
感谢支持和协助本课件制作的各方。
《芦荟的组织培养》PPT 课件
编者:[您的姓名]
日期:[日期]
本PPT课件将全面介绍芦荟的组织培养,包括基本原理、方法、技术和应用领 域,以及未来的发展趋势和研究方向。
简介
芦荟是一种常见的多年生植物,其组织培养是一项重要的研究领域。本节将介绍芦荟的概述、组织培养的定义 以及芦荟组织培养的重要性。
芦荟的组织培养方法
研究展望
1 芦荟组织培养的发展趋势
展望芦荟组织培养研究的未来发展方向。
2 未来的研究方向
提出关于芦荟组织培养的未来研究方向和可 能的创新。
结束语
1 芦荟组织培养对于我们的意义
总结芦荟组织培养对于科学研究和实际应用 的重要意义。
2 芦荟组织培养的未来前景
芦荟、紫苏组织培养实验报告

芦荟、紫苏组织培养实验报告一、实验目的与实验要求1、学习MS培养基母液的配制方法。
2、学习用母液法配制培养基以及掌握培养基灭菌的方法。
3、初步掌握外植体芦荟、紫苏等植物材料消毒、接种的无菌操作技术以及外植体初代培养的方法。
4、认识植物组织培养技术在生产实践中起的作用,尤其在于保存珍贵物种和生产研究方面的应用。
5、体验开放式实验教学,培养生物实验意识,提高学习的主动性、获取实验知识的能力和撰写实验报告水平。
二、实验方案1、实验仪器冰箱,分析天平,烧杯(50mL,100mL,500mL,1000mL),量筒(1000mL,100mL,25mL),容量瓶(1000mL,500mL,100mL),磨口试剂瓶(500mL,1000mL),药勺、称量纸、精密pH试纸,滴管、玻璃棒、电炉,微波炉、移液管(10mL,5mL,2mL,1mL,0.5mL),吸耳球,滴瓶,锥形瓶、纱布,耐热橡皮筋,线绳,高压灭菌锅,标签纸,记号笔、解剖工具、托盘、棉花、超净工作台2、实验药品NH4NO3, KNO3, CaCl2•2H2O, MgSO4•7H2O, KH2PO4, KI, H2BO3,MnSO4•4H2O,ZnSO4•7H2O, Na2•MoO4•2H2O, CuSO4•5H2O, CoCl2•6H2O, Na2•EDTA•2H2O,FeSO4•7H2O,烟酸,甘氨酸, 维生素B1,维生素B6 ,肌醇, 蒸馏水, 琼脂,蔗糖,NAA,6-BA,1mol/LHCl,1mol/LNaOH, 升汞,吐温-803、实验原理(1)母液法配制培养基原理在实验中常用的培养基,可将其中的各种成分配成10倍、100倍的母液,放入冰箱中保存,用时可按比例稀释。
配制母液有2点好处:一是可减少每次配制称量药品的麻烦,二是减少极微量药品在每次称量时造成的误差。
母液可以配单一化合物母液,但一般都配成以下四种不同混合母液。
应注意以下几个方面:A.药品称量应准确,尤其微量元素化合物应精确到0.0001克,大量元素可精确到0.01克。
芦荟组培实验报告

一、实验简介实验名称:芦荟组织培养实验实验目的:了解芦荟组织培养的基本原理和方法,掌握植物组织培养技术,探索芦荟快速繁殖和优良品种选育的新途径。
实验时间:2023年X月X日至2023年X月X日实验地点:XX大学植物组织培养实验室二、实验材料与仪器1. 实验材料:- 芦荟植株:新鲜、无病虫害的健康芦荟植株- 诱导培养基:MS培养基(改良Skoog和Lisense培养基)- 细胞分裂素:6-苄基腺嘌呤(BAP)- 脱分化培养基:1/2MS培养基- 生根培养基:1/2MS培养基+IAA(吲哚乙酸)- 营养液:1/2MS培养基+植物激素- 灭菌剂:70%酒精、0.1%氯化汞2. 实验仪器:- 恒温培养箱- 离心机- 超净工作台- 剪刀、解剖刀、镊子、剪刀等三、实验方法1. 材料处理- 将芦荟植株洗净,用70%酒精消毒后,用0.1%氯化汞浸泡5分钟,再用无菌水冲洗3次。
- 将消毒后的芦荟植株切成小块,每块含有1-2个腋芽。
2. 芦荟组织培养- 将芦荟小块接种于诱导培养基上,置于恒温培养箱中,培养温度为25℃,光照时间为12小时/天。
- 在诱导培养基中,细胞分裂素浓度为0.5mg/L,培养7天后,观察愈伤组织的形成情况。
3. 愈伤组织分化- 将愈伤组织接种于脱分化培养基上,继续培养,观察愈伤组织分化成丛生芽的情况。
- 在脱分化培养基中,细胞分裂素浓度为0.1mg/L,生长素浓度为0.1mg/L,培养14天后,观察丛生芽的形成情况。
4. 丛生芽生根- 将丛生芽接种于生根培养基上,置于恒温培养箱中,培养温度为25℃,光照时间为12小时/天。
- 在生根培养基中,生长素浓度为0.5mg/L,培养10天后,观察生根情况。
5. 炼苗与移栽- 将生根后的芦荟幼苗移栽到土壤中,进行炼苗。
- 注意保持土壤湿润,适当遮荫,促进幼苗生长。
四、实验结果与分析1. 芦荟愈伤组织形成- 在诱导培养基中,芦荟愈伤组织形成较为良好,愈伤组织呈白色,质地柔软。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验十、芦荟的组织培养(自选实验)
前言:芦荟属(学名:Aloe)通称芦荟,原产于地中海、非洲,为独尾草科多年生草本植物,据考证的野生芦荟品种300多种,主要分布于非洲等地。
这种植物颇受大众喜爱,主要因其易于栽种,为花叶兼备的观赏植物。
因此芦荟具有积极重要的经济价值。
摘要:本实验以芦荟的芽为外植体进行组织培养,通过不定芽萌发途径再生植株。
诱导培养基:MS+ BA2.0mg/L+NAA0.2mg/L;(4)继代培养基:MS+ BA2.0mg/L+NAA0.2mg/L;生根培养基:1/2MS+NAA0.1mg/L;
关键词:芦荟茎段外植体诱导培养
1、实验目的
芦荟的常规繁殖同许多植物一样有有性繁殖和无性繁殖两种。
由于芦荟雌雄花开放时间不一致,授粉不亲和,故而结实少,并且种子细小,再加上芦荟有些品种只开花不结果,因而有性繁殖速度慢,因而无法满足芦荟种植业发展和开发芦荟资源对种苗的要求。
芦荟的组织培养不仅可在短期内繁殖大量规格一致、种性稳定的芦荟种苗,还具有可以保持芦荟资源的永续利用。
2、材料和步骤:
2.1材料
1、芦荟幼嫩茎段
2、诱导培养基:MS+ BA2.0mg/L+NAA0.2mg/L+30g/L白糖+8.5g/L卡拉胶
3、继代培养基:MS+ BA2.0mg/L+NAA0.2mg/L+30g/L白糖+8.5g/L卡拉胶
4、生根培养基:1/2MS+NAA0.1mg/L+30g/L白糖+8.5g/L卡拉胶
5、PH: 5.8-6
2.2步骤
2.2.1外植体消毒方法
用自来水冲洗芦荟茎段表面的泥土,用干净的手将幼嫩芦荟苗的叶片大部分摘除,只留下约1cm左右的叶段。
将芦荟茎段切成1cm长,用70%酒精消毒15-30 s,用灭菌水冲洗1次后,放入0.15%升汞消毒约10min,灭菌水冲洗3-4次,滤干水分,准备接种。
2.2.2诱导培养
将芦荟茎段放到无菌工作台的无菌纸上,用消毒刀剥去几层外裹的叶片,然后切成两半,按生长极性方向植入诱导培养基。
每瓶诱导分化培养基接种1小块,共接7瓶。
每周观察记录一次。
2.2.3培养条件:
在组培实验室的条件下培养,每个星期观察一次。
3、实验结果与分析:
3.1对芦荟茎段进行诱导时,污染率1
4.3%,诱导率为100%。
说明本实验中用的诱导培养基适宜,消毒时间合适。
此法可以对芦荟进行大规模的生产提供参照。
芦荟茎段诱导培养结果统计表
3.2由于自选材料时间有限,没有进行继代培养和生根培养。
3.3结果图片:
4、注意事项
1、配制培养基时,要严格精确地称取各种化学试剂。
2、实验时一定要注意无菌操作,万不可引入杂菌污染培养基。
3、观察记录时,要注意拿组培瓶的方式,手要握住组培瓶的下方而不要握住组培瓶的盖子。
4、观察记录时要仔细,认真描述并做好记录。
细胞工程自选试验开题报告:
芦荟组织培养
一、基本背景
芦荟属(学名:Aloe)通称芦荟,原产于地中海、非洲,为独尾草科多年生草本植物,据考证的野生芦荟品种300多种,主要分布于非洲等地。
这种植物颇受大众喜爱,主要因其易于栽种,为花叶兼备的观赏植物。
芦荟是百合科芦荟属多年生常绿多肉质草本植物。
据科学研究,发现芦荟中有不少成分对人体皮肤有良好的营养滋润作用,且刺激性少,用后舒适,对皮肤粗糙、面部皱纹、疤痕、雀斑、痤疮等均有一定疗效。
此外芦荟对轻度的撞伤、挫伤、香港脚、冻伤、皮肤龟裂、疣子等都有一定的疗效。
根据现代研究显示,其叶含芦荟大黄素、异芦荟大黄素及芦荟苦味素等,药理实验有泻下、抗癌作用。
芦荟花性寒,味苦涩,有清热、止咳、止血功效,可治疗咳嗽、吐血。
而且芦荟还有极高的营养价值,食用芦荟的发展把对芦荟的研究带入了一个新的研究阶段,尤其是对芦荟组织培养技术发展有了极大地推动作用。
二、实验设备和药品
1、所需设备
高压灭菌锅、超净工作台、培养瓶、称量仪器、移液管、锥形瓶、量筒、镊子、解剖刀、支架、酒精灯、牛皮纸、牛皮袋
2、药品
(1)大量元素、钙盐、微量元素、铁盐、有机元素、蒸馏水、BA、IBA、NAA 、蔗糖、卡拉胶(2)75%酒精、0.1%升汞(加吐温)、95%酒精
3、材料
幼嫩芦荟的芽
三、实验内容及方法
1.研究方法:
对芦荟茎尖、吸芽进行灭菌处理,然后接入无菌培养瓶进行组织培养,快速繁殖试管苗。
采集芦荟→截取根尖、吸芽→外植体消毒→在超净工作台接种→放入培养室培养→继代培养→生根培养
2.试验方法及步骤:
1 )愈伤组织培养将准备好的芦荟幼苗在清水中冲洗数次,剪去叶片和大部分茎段,取茎尖部分,再冲洗1-2次,淋干。
在超净台上,先用75%的乙醇将茎尖浸泡30-60s,再用升汞浸5-l0min,最后用无菌水冲洗数次。
用解剖刀取出包括茎尖生长点的组织切块,接种到愈伤组织诱导培养基上。
培养条件为:每天光照 10-12h,光照度为 1000一2000Lx,温度(25士)2℃。
大约15-25d后,试管中接种的外植体
就会长出新芽
3 )生根培养当培养瓶中的幼苗叶片长到3cm左右时,将幼苗在无菌条件下取出,放入装有生根培养基的培养瓶中培养,培养条件同分化培养。
大约半个月后,幼苗即可生根。
3.可行性分析:
外植体接种到诱导培养基上培养10天后,顶芽开始伸长生长,到25天左右在组织块的基部开始长出腋芽,并且在每个外植体的嫩茎组织基部长出多个小突起,45-50天后小突起和腋芽逐渐长成7-9个绿色单芽,此时芽约有2.0-2.5cm可进行下一步的培养。
将长至3厘米高以上的无根增殖苗由丛生芽块上单芽切下转到生根培养基上,7天后在苗的基部形成白色的突起,并逐渐伸长,至12天可形成明显的幼根,逐渐长成完整的小植株,小苗长至7cm以上时即可移栽。
四、可能出现的问题及解决方法:
1、要注意严格遵守灭菌操作程序,防止被环境中的微生物的污染,这是组织培养的关键。
2、在培养中,如果出现杂菌污染,应立即将该污染培养瓶中的培养物倒掉并将培养瓶洗净,烘干备用。
3、对于愈伤组织或试管苗长势良好,仅有局部杂菌污染的试管或培养瓶,也可在无菌条件下,将愈伤组织或试管苗取出,重新放入装有相应培养基的试管或培养瓶中,继续培养。
4、严格的把握外植体灭菌时间,消毒时间不能太短,也不能太长,一定要好好把。
五、预期结果
完成对芦荟的诱导培养以及分化培养,如果时间允许,最好可以获得芦荟的组培幼苗,对其进行炼苗移栽,获得完整的植株,如果时间允许,经过炼苗和移栽,获得自然条件的生长的植株。
