化学必修一第三章知识归纳
高中化学必修一(第三章)知识点全归纳

高中化学必修一(第三章)知识点全归纳第三章金属及其化合物第一节金属的化学性质1.金属的物理通性有哪些?(1)金属在常温下的状态除汞是液体外,其他在常温下是固体。
(2)金属的颜色、光泽绝大多数金属都是银白色,具有金属光泽,少数金属是特殊颜色如铜是紫红色,金是金黄色。
(3)良好的导电、导热性。
(4)延展性延性:拉成细丝的性质。
展性:压成薄片的性质。
2.化学通性有哪些?(1)化合态金属元素只有正化合价(2)金属单质易失电子,表现还原性(3)易与氧气反应,得到氧化物(4)活动性排在氢前的金属元素与酸反应得到盐和氢气(5)与盐反应,置换出活动性弱的金属单质3.金属钠的性质有哪些?(1)物理性质有哪些?钠银白色、质软、熔点低、密度比水的小但比煤油的大。
★(2)化学性质有哪些?①很活泼,常温下:4Na + O2=2Na2O★(新切开的钠放在空气中容易变暗)②加热条件下:2Na+O2 Na2O2★(先熔化成小球,后燃烧产生黄色火焰,生成淡黄色固体Na2O2。
)钠在空气中的变化过程:Na―→Na2O―→NaOH―→Na2CO3·10H2O(结晶)―→Na2CO3(风化),最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH易潮解),最终变成白色粉未(最终产物是Na2CO3)。
③钠与水的反应与H2O反应2Na+2H2O=2NaOH+H2↑★离子方程式:2Na++2H2O=2Na++2OH-+H2↑(注意配平)实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。
“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH遇酚酞变红”。
知识拓展:a:将钠放入硫酸铜溶液中,能否置换出铜单质?不能,2Na + 2H2O = 2NaOH + H2↑2NaOH+CuSO4=Cu(OH)2↓+Na2SO4实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应b:将钠放入盐酸中,钠将先和H2O反应,还是先和HCl反应?2Na+2HCl=2NaCl+H2↑钠与酸反应时,如酸过量则钠只与酸反应,如酸不足量则钠先与酸反应再与水反应。
高一化学必修一第三章知识点总结

高一化学必修一第三章知识点总结第三章是高一化学的重点,也是难点。
高一化学必修一第三章知识点总结之:物质的构成要素第三章内容物质的组成元素和化合物物质的基本单元——分子、原子、离子和粒子、分子结构与分子间作用力、元素周期律、核外电子排布规律、化学键、元素周期表等知识点物质的结构元素周期律和元素周期表、氧化还原反应及电子得失、离子共存问题、酸碱盐等性质与元素的原子结构的关系、共价键的形成与特征、离子化合物的特征、单质和化合物的主要区别和联系等知识点物质的构成分子、原子、离子和粒子是构成物质的微观粒子,其中分子是保持物质化学性质的最小微粒。
离子化合物是由带电荷的原子或原子团通过静电引力或电磁力结合在一起的化合物,如水和氯化钠等。
物质由分子构成,分子由原子(或原子团)构成,原子由带正电荷的原子核和带负电荷的电子构成。
分子和原子的区别是原子可以再分为更小的原子,但分子不能再分为更小的分子。
由原子直接构成物质的单质有单质分子(ClO2, Br2, H2O等),如Na, He等。
1.分子、原子、离子和粒子是构成物质的微观粒子,其中分子是保持物质化学性质的最小微粒。
2.1.分子、原子、离子和粒子是构成物质的微观粒子,其中分子是保持物质化学性质的最小微粒。
2.单质的基本属性是:均一性、稳定性、强相互作用、磁性、难溶性和易分解。
3.酸、碱、盐的定义为:能使酸碱指示剂变色的化合物。
4.共价化合物:共价键(化学键)。
(1)共价键的概念:在化学反应中,由两个或两个以上原子组成的原子团叫做共价单原子团。
共价单原子团中,相邻的两个原子形成的共用电子对叫做共用电子对。
共用电子对的偏移不影响共用电子对的数目。
(2)共价键的特征:共用电子对不能自由移动,成键原子的电子对全部偏向成键原子的空轨道,这样就形成了一对共用电子对,整个体系显电中性。
化学必修一第三章知识点

化学必修一第三章知识点化学必修一第三章知识点随着时代的发展,化学这门学科的科技含量越来越高,已经成为现代科技的重要支柱之一。
而作为化学学科的开端,化学必修一第三章是学习化学的基础,也是学习化学必不可少的一部分。
下面就为大家介绍化学必修一第三章知识点。
一、化学式和化合价1. 化学式:化学式是化学元素符号的组合,用来表示某一种化合物由哪些元素组成,每个元素有多少个原子。
2. 化合价:此处的化合价是指元素化合生成某种化合物时,元素形成价态的相对大小。
化合价的背后是共价键和离子键的生成。
在学习化合价的时候,有两个需要特别注意:1. 主族元素的化合价通常等于元素族数;2. 在氢氧化物和一些酸中,氢的化合价通常为+1。
二、化学键1. 非极性共价键:当共价键两侧的原子电负性相同时,原子的电子对在两个原子之间共享,这种化学键就是非极性共价键。
如氧气分子(O2)。
2. 极性共价键:当两个原子的电负性不同的时候,就会在更电负的原子侧形成一个部分负电荷,另一侧形成部分正电荷。
这种偏向一方的化学键就是极性共价键(偏极分子)。
如水(H2O)分子。
3. 离子键:当元素形成离子时,会通过形成离子键来保持离子之间的联系。
如NaCl。
4. 金属键:金属中的原子之间并非是共价键,而是通过金属键连接在一起。
三、简单的化合物1. 气体熔沸点低,分子间的相互作用力很小。
(包括分子分子引力,静电作用力和车壳力等)2. 水(液体)水的分子结构是极性分子,氢键是次级键,在纯水中没有振动状态的离子。
3. 固体它的力作用比气体和液体要大。
四、消解反应和双替代反应1. 消解反应:化合物在加热过程中分解成较简单的分子,通常释放气体。
例如:碳酸氢钠(NaHCO3)-- >碳酸钠(Na2CO3)+水+二氧化碳。
2. 双替代反应:一个化合物的中的阳离子和另一个化合物中的阴离子相互交换。
例如:钠氯化物(NaCl)和银亚硫酸钠(Ag2SO3)会发生反应:NaCl + Ag2SO3 --> Na2SO4 + 2AgCl。
高中化学必修一第三章知识点总结

高中化学必修一第三章知识点总结一、金属及其化合物(一)金属的化学性质1. 金属与非金属的反应- 钠与氧气反应- 常温下:4Na + O_{2}=2Na_{2}O,氧化钠为白色固体。
- 加热时:2Na+O_{2}{}{=!=!=}Na_{2}O_{2},过氧化钠为淡黄色固体。
- 铝与氧气反应- 在常温下,铝能与空气中的氧气反应,表面生成一层致密的氧化铝薄膜,4Al + 3O_{2}=2Al_{2}O_{3}。
这层薄膜可以阻止内部的铝进一步被氧化。
2. 金属与酸和水的反应- 钠与水反应- 化学方程式:2Na + 2H_{2}O = 2NaOH+H_{2}↑。
- 现象:“浮(钠的密度比水小)、熔(反应放热,钠的熔点低)、游(有气体生成)、响(反应剧烈)、红(溶液呈碱性,使酚酞变红)”。
- 铁与水蒸气反应- 化学方程式:3Fe + 4H_{2}O(g){高温}{=!=!=}Fe_{3}O_{4}+4H_{2}。
3. 铝与氢氧化钠溶液反应- 化学方程式:2Al+2NaOH + 2H_{2}O=2NaAlO_{2}+3H_{2}↑。
(二)几种重要的金属化合物1. 氧化物- 氧化钠和过氧化钠- 氧化钠(Na_{2}O)- 属于碱性氧化物,与水反应:Na_{2}O + H_{2}O = 2NaOH;与酸反应:Na_{2}O+2HCl = 2NaCl + H_{2}O。
- 过氧化钠(Na_{2}O_{2})- 与水反应:2Na_{2}O_{2}+2H_{2}O = 4NaOH+O_{2}↑。
- 与二氧化碳反应:2Na_{2}O_{2}+2CO_{2}=2Na_{2}CO_{3}+O_{2},因此过氧化钠可用于呼吸面具和潜水艇中作为氧气的来源。
- 氧化铝(Al_{2}O_{3})- 两性氧化物,既能与酸反应:Al_{2}O_{3}+6HCl = 2AlCl_{3}+3H_{2}O,又能与碱反应:Al_{2}O_{3}+2NaOH = 2NaAlO_{2}+H_{2}O。
高一化学必修一第三章章节总结

学习笔记与氢氧化钠现象:产生白色沉淀,快速变成灰绿色,最终变成红褐色。
FeCl2+2NaOH==F e(O H)2↓+2NaCl4F e(O H)2+O2+2H2O==4F e(O H)3现象:产生红褐色沉淀FeCl3+3NaOH==F e(O H)3↓+ 3NaCl与KSCN溶液无现象产生血红色Fe3++3SCN-==Fe(SCN)3氧化(还原性)主要表现:还原性,举例:2FeCl2+Cl2 ==2FeCl3表现:氧化性,举例:2FeCl3+Fe==3FeCl2相互转化FeCl2FeCl3:2FeCl2+Cl2 ==2FeCl3FeCl3 FeCl2:2FeCl3+Fe==3FeCl2名称氢氧化亚铁氢氧化铁化学式F e(O H)2F e(O H)3颜色、状态白色固体红褐色固体水溶性难溶于水难溶于水与酸反应F e(O H)2+2HCl==FeCl2+2H2OF e(O H)2+2H+==Fe2++2H2OF e(O H)3+3HCl==FeCl3+3H2OF e(O H)3+3H+==Fe3++3H2O氢氧化亚铁露置空气中4F e(O H)2+O2+2H2O ==4F e(O H)33、铁三角二、本章典型题剖析1、滴加依次不同,试验现象不同(1)稀Na2CO3溶液与稀盐酸间的反应向Na2CO3溶液中逐滴加入稀盐酸,起先时无气体产生,达到肯定量后才有气泡冒出,由少到多的过程中依次发生下列反应:是NaOH。
若将1克该样品放入含有HCl 3.65克的盐酸中使其完全反应后,残酸再用50克2%的NaOH溶液恰好中和反应,蒸干溶液,所得固体的质量是多少克?解:所得固体是NaCl ,是5.85克[小结]本题数据众多,反应物不纯,过程困难。
若按常规方法,一步步分析计算,不但费时还易出错,若仔细分析就会发觉,最终所得固体物质NaCl中全部的Cl全来自于HCl中的Cl1、有5.1gMg–Al合金,投入500mL 2mol/L HCl中,金属完全溶解后,又加4mol/LNaOH 溶液VmL,得最多沉淀8.6g,则V等于A. 425mLB. 560mLC. 250mLD. 500mL2、铝三角转化及铝的图像问题(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消逝方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH― ==AlO2―+H2O图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消逝方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀渐渐溶解。
高中化学必修一第三章铁金属材料知识点归纳超级精简版(带答案)

高中化学必修一第三章铁金属材料知识点归纳超级精简版单选题1、现有MgO、Al2O3.Fe2O3.CuO混合物,如果只用一种试剂把Al2O3分离出来,应选用试剂A.氨水B.浓NaOH溶液C.NaCl溶液D.稀H2SO4答案:BA.MgO、Al2O3.Fe2O3.CuO与氨水都不反应,故A不符合题意;B.Al2O3能与浓NaOH溶液反应溶解,MgO、Fe2O3.CuO与NaOH溶液都不反应,可以把Al2O3分离出来,故B符合题意;C.MgO、Al2O3.Fe2O3.CuO与NaCl溶液都不反应,故C不符合题意;D.MgO、Al2O3.Fe2O3.CuO与稀H2SO4都反应,故D不符合题意;故答案为B。
2、下列说法中,不正确...的是A.Al的摩尔质量是27g·mol−1B.标准状况下,22 .4LH2O的物质的量为1molC.1molCH4中含有的分子数约为6 .02×1023D.1L1mol·L−1KCl溶液中含有1molK+答案:BA.摩尔质量以g·mol−1做单位时,在数值上等于物质的式量,则Al的摩尔质量是27g·mol−1,A正确;B.标准状况下,水为非气态,不能用气体的摩尔体积进行计算,则无法计算22 .4 L H2O的物质的量,B错误;C.1mol CH4中含有的分子数约为1mol×6 .02×1023mol-1=6 .02×1023,C正确;D.1L 1mol·L−1 KCl溶液中含有K+的物质的量为1L×1mol·L−1 =1mol,D正确;故答案为B。
3、下列反应中不涉及铁元素价态变化的是A.用铁粉除去FeCl2溶液中的少许FeCl3杂质B.铁在氧气中燃烧C.氢氧化亚铁是白色固体,在空气中会迅速变成灰绿色,最终变成红褐色D.氢氧化铁受热分解答案:DA. 铁粉可将Fe3+还原为Fe2+,Fe元素价态发生了变化,A项不符合题意;B. Fe在氧气中燃烧,生成Fe3O4,Fe元素价态发生了变化,B项不符合题意;,Fe元素价态发生了变化,C项不C. Fe(OH)2具有还原性,在空气中发生反应4Fe(OH)2+O2+2H2O=4Fe(OH)3符合题意;D. Fe(OH)3受热分解:2Fe(OH)3≜Fe2O3+3H2O,Fe元素价态没有发生变化,D项符合题意;故选D。
化学必修一第三章钠及其化合物知识点

第三章金属及其化合物知识点3.1-钠及其化合物知识点☆(了解)一、钠单质的性质(1)钠的物理性质:钠是银白色金属,密度小(0.97g/cm3),熔点低(97°C),硬度小,质软,可用刀切割。
钠通常保存在煤油中。
是电和热的良导体。
(2)钠的化学性质:从原子结构可知钠是活泼的金属单质。
二、钠(Na )与非金属单质反应:★(掌握)①钠和空气和氧气的反应: 钠和空气的反应: 钠在空气中的变化:银白色的钠T 变暗(生成了氧化钠)T 变白(生成氢氧化钠)T 潮解变成白色固体(生成碳酸钠)。
钠和氧气的反应: 常温: 4Na+O==2NaO22加热:2Na+O==NaO;2Na+Cl==2NaCl;2Na+S==NaS 等22222反应实验:A 、实验过程: ①T ②T ③T ④T ⑤T ⑥T ⑦B 、反应原理: A2Na+0NaO,2NaO+2H0=4Na0H+0T2222222①玻璃管中装的钠不能太大,太大反应太剧烈,会将玻璃管炸裂. C 、注意事项:②反应开始时,即钠熔成小球后要稍稍倾斜玻璃管,但是角度不能太大,—e —/水平放彥①带火呈的木条以防止钠从玻璃管中脱出.并能保证空气疏通从而观察到明显现象. ③ 在取钠时要将其表面的氧化物用小刀除去,用纯钠进行实验.因为表面 被氧化的钠在受热熔化后,钠表面会有一层黑色而影响实验现象的观察. ④ 加热时间不能太长,否则钠与0迅速反应、燃烧起来,现象就不是很明2显了.⑤ 盛Na0的小试管要干燥.22D 、实验现象: 钠熔成小球,先变成白色后变成淡黄色固体,淡黄色固体遇水放出使带火星木条复燃的气体.E 、实验结论:钠熔点低,与0加热反应生成Na0,Na0遇水生成0.222222★(掌握)②钠与水反应:钠与水的反应:2Na+2H0==2NaOH+HT22反应实验:☆(了解)③钠和酸、盐溶液、氢气的反应 ☆(了解)钠与酸的反应:A 、反应原理:2Na+2H0==2Na0H+HT22B 、实验现象:① 钠与水剧烈反应 ② 钠熔化成小球③ 钠球在水面上不停地滚动 ④ 有气体生成,并发出嘶嘶声 ⑤ 因为生成强碱,使得酚酞溶液变红他的悄度比水小 反砲放热,钠的熔点低产生气体推动钠昧游动厘应剧韻 生氓了强诫M10H④工业制钠与钠的用途:★(掌握)工业制钠:(电解熔融NaCI)反应原理:2NaCI(熔融)二二2Na+ClT2☆(了解)钠的用途:①在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等;②钠钾合金是快中子反应堆的热交换剂;③钠蒸气可作高压钠灯,发出黄光,射程远,透雾能力强。
(完整)化学必修1第三章知识点总结,推荐文档
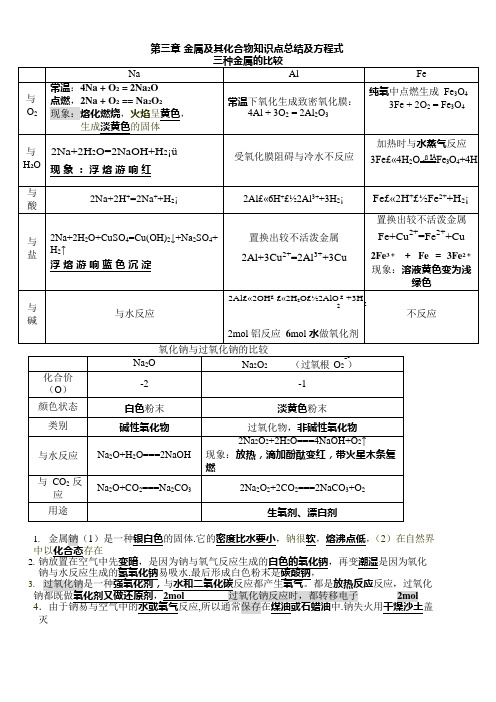
第三章金属及其化合物知识点总结及方程式1.金属钠(1)是一种银白色的固体.它的密度比水要小,钠很软,熔沸点低,(2)在自然界中以化合态存在2.钠放置在空气中先变暗,是因为钠与氧气反应生成的白色的氧化钠,再变潮湿是因为氧化钠与水反应生成的氢氧化钠最后形成白色粉末是碳酸钠,3.反应,过氧化2mol4钠失火用干燥沙土盖风化是化学变化区别碳酸钠与碳酸氢钠可用1.与CaCl2 反应有无沉淀2.与酸反应剧烈程度3 碱性强弱4 稳定性2.碳酸钠与盐酸互滴时现象不同,碳酸钠滴到盐酸中马上有气泡,盐酸滴到碳酸钠中刚开始无现象,后有气泡3 除杂:Na2CO3固体(NaHCO3)加热;Na2CO3溶液(NaHCO3)适量NaOHNaHCO3溶液(Na2CO3)足量CO22 2 1. Al 3+和 OH -互滴现象不同:OH -滴到 Al 3+中先沉淀后澄清;Al 3+到 OH -中先澄清后沉淀Al 3++3 OH -=Al(OH)3 ↓ Al(OH)3 + OH - = AlO -2+2 H 2OAl 3++4OH -= AlO - +2 H O 2. NaAlO 2 和盐酸-互滴现象不同:盐酸滴到 NaAlO2 中先沉淀后澄清; NaAlO 2 滴到盐酸中先澄清后沉淀AlO -+H ++H O=Al(OH) ↓ Al(OH) + 3H + = Al 3+ + 3H O .AlO -+4H + = Al 3+ + 2H O22332222. 实验室制取 Al(OH)3 碱须用氨水3. 铝,氧化铝,氢氧化铝与碱反应,碱必须是强碱4.明矾的化学式 KAl(SO 4)2·12 H 2O,可做净水剂原因是Al 3+ + 3 H 2O = Al(OH)3( 胶 体 )+ 3H +5. 焰色反应:是元素的性质,是物理变化;钠的焰色是黄色,钾的焰色是紫色(透过蓝色钴玻璃)实验中用盐酸洗铂丝;实验步骤:烧,蘸,烧,洗33△3 3点燃2422 23 31制备Fe(OH)2注意:亚铁盐溶液必须新制,保证无氧氛围2铁盐可做净水剂原因是Fe3与水反应形成Fe(OH)胶体:Fe3++3 H2O =Fe(OH)3(胶体)+3H+3.合金的硬度一般高于各成分金属,熔点一般低于各成分金属;铁合金可分为生铁和钢第三章化学反应归纳1、钠在空气中燃烧2Na +O2Na2O2钠块在空气中变暗4Na+O2=2Na2O2 、2Na +2H2O =2 NaOH +H2↑2Na +2H2O =2Na++2OH-+H2↑3 、2Na2O2+2H2O =4NaOH +O2↑2Na2O2+2H2O =4Na++4OH -+O2↑Na2O+H2O=2NaOH4、2Na2O2+2CO2=2Na2CO3+O25、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl +H2O+CO2↑CO 2-+2H+=H2O+CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO 2-+H+=HCO -NaHCO3+HCl=NaCl+H2O+CO2↑HCO -+H+=H2O +CO2↑6、2NaHCO3Na2CO3+H2O +CO2↑7 、NaHCO3+NaOH = Na2CO3+H2O HCO -+OH -=H2O +CO 2-8.Na2CO3+H2O+CO2 = 2NaHCO39.2NaHCO3+Ca(OH)2====CaCO3 + 2H2O+Na2CO3NaHCO3+Ca(OH)2====CaCO3+H2O+NaOH10.2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑1、铝箔在氧气中剧烈燃烧4Al +3O22Al2O32. 2Al +6HCl =2AlCl3+3H2↑2Al +6H+=2Al3++3H2↑3. 2Al+2NaOH +2H2O =2NaAlO2+3H2↑2Al +2OH -+2H2O =2AlO -+23H2↑4.Al2O3+2NaOH 2NaAlO2+H2O Al2O3+2OH -=2AlO -+H2O5.Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH +6.Al(OH)3+3HCl =AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O7.Al(OH)3+NaOH NaAlO2+2 H2O Al(OH)3+OH-=AlO -+2 H O8 2Al(OH)3=Al2O3+3H2O9.Al3++3 H2O =Al(OH)3( 胶体)+3H+11.Al3++3 OH-=Al(OH)3↓Al(OH)3+OH-=AlO -+2 H2OAl3++4OH-= AlO -+2 H O2 212.AlO2-+H++H2O=Al(OH)3↓Al(OH)3+3H+=Al3++3H2O.AlO2-+4H+ = Al3++2H2O13.2AlO2-+CO2+3H2O=2 Al(OH)3+ CO32-1. 高温下铁与水反应3Fe +高温4H2O(g) Fe3O4+4H22. 铁与盐酸反应Fe +2HCl =FeCl2+H2↑Fe +2H+=Fe2++H2↑3. 氧化铁溶于盐酸中Fe2O3+6HCl =2FeCl3+3H2O Fe2O3+6H+=2Fe3++3H2O4.Fe3O4+8H+=Fe2++2Fe3++4H2O5.Fe2O3+3CO=2Fe+3CO26.FeCl3+3NaOH =Fe(OH)3↓+3NaCl Fe3++3OH -=Fe(OH)3↓7.FeCl2+2NaOH =Fe(OH)2↓+2NaCl Fe2++2OH -=Fe(OH)2↓8.氢氧化亚铁在空气中被氧化4Fe (OH)2+O2+2H2O =4Fe (OH)39.Fe(OH)2+2HCl=FeCl2+2H2O10.Fe(OH)3+3HCl=FeCl3+3H2O11.氯化亚铁溶液中通入氯气2FeCl2+Cl2=2FeCl3 2 Fe2++Cl2=2 Fe3++2Cl-12.氯化铁溶液中加入铁粉2FeCl3+Fe =3FeCl22Fe3++Fe =3Fe2+13.2Fe3++Cu=2Fe2++ Cu2+14.3SCN- + Fe3+=Fe(SCN)3“”“”At the end, Xiao Bian gives you a passage. Minand once said, "people who learn to learn are very happy people.". In every wonderful life, learning is an eternal theme. As a professional clerical and teaching position, I understand the importance of continuous learning, "life is diligent, nothing can be gained", only continuous learning can achieve better self. Only by constantly learning and mastering the latest relevant knowledge, can employees from all walks of life keep up with the pace of enterprise development and innovate to meet the needs of the market. This document is also edited by my studio professionals, there may be errors in the document, if there are errors, please correct, thank you!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无
无
稳定性
稳定
稳定
稳定
用途
工业原料等
中和胃酸制糕点
净水剂等
印刷线路板等
金属离子检验
焰色反应呈黄色
遇KSCN不显血红色,加入溴水后显红色
遇KSCN显血红色
四、金属及其化合物之间的相互转化
1、钠及其重要化合物之间的转化关系,写出相应的化学反应方程式。
2、铝及其重要化合物之间的转化关系,写出相应的化学反应方程式。
三、金属化合物的性质
1、氧化物
氧化物
化学性质
Na2O
Na2O2
Al2O3
Fe2O3
颜色状态
白色粉末
淡黄色粉末
白色粉末
红棕色粉末
属性
碱性氧化物
过氧化物
两性氧化物
碱性氧化物
与酸反应
生成钠盐和水
生成盐
氧气和水
与碱反应
与水反应
与水反应
不反应
与水反应
不反应
不反应
2、氢氧化物
氢氧化物
化学性质
NaOH
Al(OH)3
3、铁及其重要化合物之间的转化关系,写出相应的化学反应方程式。
化学必修一第三章《金属及其化合物》的归纳与整理
金属
化学性质Βιβλιοθήκη NaAlFe与O2反应
常温下氧化成Na2O
点燃生成Na2O2,Na保存在煤油中
常温下氧化生成致密氧化膜,使得铝耐腐蚀,纯氧中可燃
潮湿空气中腐蚀,纯氧中点燃生成Fe3O4
与H2O反应
受氧化膜阻碍
与酸反应
与盐反应
与碱反应
与水反应
不反应
金属活泼性
金属活泼性逐渐减弱
Fe(OH)2
Fe(OH)3
属性
碱性氢氧化物
两性氢氧化物
碱性氢氧化物
碱性氢氧化物
与酸反应
与碱反应
不反应
不反应
不反应
热稳定性
稳定
受热分解
还原性
无还原性
无还原性
无还原性
制备
略
用途
化工原料
脱色净水中和胃酸
净水
净水
3、盐
盐
化学性质
Na2CO3
NaHCO3
FeCl2
FeCl3
与酸反应
不反应
不反应
与碱反应
不反应
