人教版高二化学选修4 -燃烧热 化学反应热的计算(1)-3学习任务单
高中化学兴趣小组活动计划

高中化学兴趣小组活动计划正文:高中化学兴趣小组活动计划高中化学兴趣小组活动计划高中化学兴趣小组活动计划1一、活动目的:1、促进中学生全面发展,培养自觉主动的学习兴趣,加强综合能力的培养;2、着眼于学生整个高中阶段的健康发展;3、为学生自身的化学学科倾向提供活动空间。
二、指导教师:王强、李丽三、确定组员:通过在高一年级学生中宣传、动员,自愿报名,确定小组成员。
四、活动计划⒈、召开全体组员座谈会,师生畅所欲言,谈自己的三年规划和近期打算,指导教师与组员共同探讨兴趣小组的`活动内容和形式;⒉、小组每周集中一次,指导教师布置活动内容,师生一起交流学习心得,讨论共同感兴趣的问题;3、邀请我校考入名校的同学到化学兴趣小组跟同学交流学习化学心得体会;4、研究高考,了解动态,摸清规律,使学习更有针对性和效率,努力取得优异成绩;5、学习评阅试卷,带动帮助其他同学学好化学。
6、对中学知识进一步加深后,为参加各级化学竞赛作一定准备。
具体安排:时间:每周一下午课外活动时间地点:化学实验准备室高中化学兴趣小组活动计划2为了积极响应学校及年级组的号召,深入开展生命教育活动,将生命教育渗透到教学工作的点点滴滴中。
同时,提高自己的教学水平和专业素质。
新学期伊始,我也走上了教学工作新的征程,本学期我担任的是高二18、20班的化学教育教学工作。
在宜中新课改的“以人为本”的办学理念下,要培养出具有德才兼备的优秀学子,本学期我打算从高考研究、课堂实效、习惯培养、提优补差四个方面出发提升自己的业务水平和学生的基本素质。
一、深入研究高考为了更加准确的把握高考考点,更好的落实每节课的重难点知识,同时提升自己的素质和业务水平我打算采取以下几个措施:①每周完成一套近年高考题,并对考点进行分析,找出与现在教学中知识点的联系,思考如何在课堂中渗透高考考点,引导学生如何找出题型的突破口;②向有经验的教师及时请教,对自己弄不清楚的知识点、或知识点间的相互联系要谦虚多问;③即时反思、总结,将自己的心得体会随时记录下来,过一段时间进行整理,形成一套自己的方法。
高二化学必修课程教学计划人教版模板(6篇)

高二化学必修课程教学计划人教版模板(6篇)一、指导思想:以新课程标准为指引,紧跟学校教学工作计划,以提高课堂教学效率和构建乐学课堂和高效课堂为中心,狠抓常规教学的落实,不断优化课堂教学策略。
学习北门中学教学模式和经验,变“教学”为“导学”,真正以学生为主体,以培养学生能力为主,努力提高四十五钟教学质量。
加强教学研究,进一步改进课堂教学方法,努力提高个人的整体教学水平和教学成绩。
二、现状分析1、学情分析:本学期教的高二(8)班、(14)班,其中14班均为理科普通班,大部分学生的化学学科基础相对较薄弱,尤其对化学原理的运用能力较弱,分析问题能力,综合能力欠缺。
但各班大多数学生能认真听讲,基本上能按时完成作业,有问题能及时提出,有较强的上进心。
大部分同学都能积极地学习。
8班为理科实验班,学生基础较为扎实,具备了一定的分析能力,培养学生的化学思维能力,分析综合性问题的方法,提高解题能力,寻求更简单的解法,才是教学重要任务。
2、教材分析:本学期的教学任务是完成选修五《有机化学基础》第三、四、五章的内容,选修三《物质结构与性质》的所有内容。
这两个选修模块是高考中的选考模块。
内容较为多,但是一部分是在必修2的基础上加以延长的,对学生要求对一些概念的理解应该更加深刻,而且本模块所增添延长知识较为多,难以理解,须要时光同时也须要学生多练。
三、教学目标做好高中化学新课程标准的实施工作,在实践中不断探索和研究,增强对新课标的理解和驾驭能力;设计好导学案,立足课堂开展教学研究,实现课堂教学的化。
根据学校工作计划,结合学科实际,落实各项教研和教学常规工作。
实现学生学习成绩的提高和学习能力的培养。
四、具体措施1、认真做好教学常规,确保教学有效开展精心准备导学案。
按课程标准的要求,积极认真地做好课前备课资料的搜集;认真上好每节课;积极实践新课程理念,把握好课堂,提高课堂教学实效性;精心构思每道题。
分层、合理布置学生作业,书面作业要求全批全改,及时反馈;对每一次测试认真分析总结,为学生确定合理的目标。
(完整版)初中英语各年级所学的主要内容
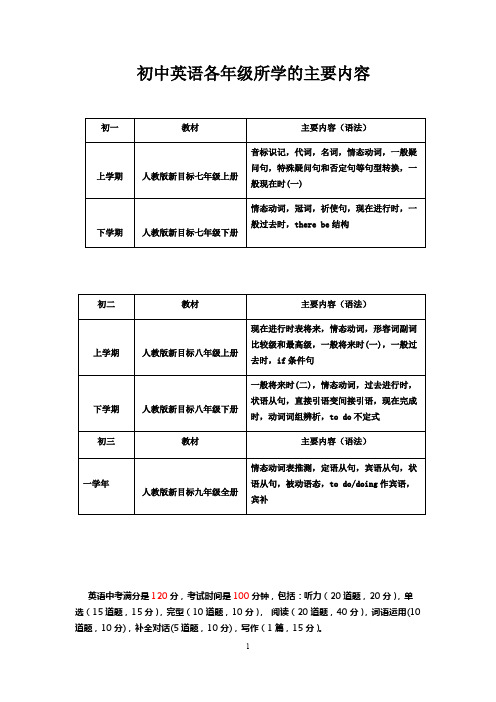
初中英语各年级所学的主要内容初一教材主要内容(语法)上学期人教版新目标七年级上册音标识记,代词,名词,情态动词,一般疑问句,特殊疑问句和否定句等句型转换,一般现在时(一)下学期人教版新目标七年级下册情态动词,冠词,祈使句,现在进行时,一般过去时,there be结构初二教材主要内容(语法)上学期人教版新目标八年级上册现在进行时表将来,情态动词,形容词副词比较级和最高级,一般将来时(一),一般过去时,if条件句下学期人教版新目标八年级下册一般将来时(二),情态动词,过去进行时,状语从句,直接引语变间接引语,现在完成时,动词词组辨析,to do不定式初三教材主要内容(语法)一学年人教版新目标九年级全册情态动词表推测,定语从句,宾语从句,状语从句,被动语态,to do/doing作宾语,宾补英语中考满分是120分,考试时间是100分钟,包括:听力(20道题,20分),单选(15道题,15分),完型(10道题,10分),阅读(20道题,40分),词语运用(10道题,10分),补全对话(5道题,10分),写作(1篇,15分)。
初中各年数学级所学的主要内容七年级上册七年级上册八年级上册第六章数据的分析平均数、众数、中位数众数、中位数、方差3方差第七章证明【一】平行线的性质与判定、平行线的性质与判定3三角形内角和八年级下册九年级上册6第二章一元二次方程解法及应用解一元二次方程,根的判别式,根与系数关系第三章概率表格法树状图求解概率概率的求解63第四章相似图形相似图形的性质与判定相似图形的性质与判定第五章视图与投影三视图三视图3求k值3第六章反比例函数函数图像性质,k的几何意义九年级上册育50,理化生实验30,共680分,数学120分。
初中物理之课本篇问题76:初中物理几本书?初中物理是人教版的课本,初二才有物理,初二上下册各一本,初三一本全一册。
问题77:中考物理考几道题?每道题的分值多少?中考物理共5大题,70分。
5黄埔基于SOLO分类理论探讨化学核心概念的学习进阶与教学衔接——以人教版“中和反应”为例

摘要:概述学习进阶理论在化学核心概念教学衔接研究中的应用价值,介绍了SOLO分类理论对划分化学核心概念认知 层级与进阶路径的指导意义。按照SOLO分类理论划分中和反应概念的学习阶段、进阶路径和发展目标,建构中和反应概念进 阶学习的认知模型,对中和反应的初高中跨学段教学衔接提出研究与实施建议。
关键词:学习进阶理论;SOLO分类理论;中和反应;初高中教学衔接;认知模型 文章编号:1005—6629(2016)11—0024—06
图2学生认识对象、角度、方式类别和水平的相互关系
学生 认 识 方 式 的 水 平
2基于跨学段学习的进阶路径建构“中和反 应”概念认知模型 中和反应是化学核心概念之・,因其重要性 列入中学化学学科100个关键词【l‘71,对学生化学 认知方式发展、化学概念的多重表征学习、化学
式,分别产生隐性知识、直觉知识、陈述性知识、
任务、认识角度、认知层级与认知对象4个维度。 3基于中和反应概念认知模型探讨初高中跨
学段的教学衔接
3.1初中阶段“中和反应”概念的进阶教学
化学教学 2016年第11期
万方数据
——————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————
数学极限思想在高中化学教学中的应用

教学篇誗方法展示数学极限思想在高中化学教学中的应用文|邝洪涛极限思想在近代数学中发挥着重要作用,可以为分析和解决问题提供支持。
在跨学科教学理念的基础上将数学极限思想应用在高中化学教学中有利于弥补化学教学的不足,因此利用文献资料法等方法对数学极限思想在高中化学教学中的应用进行了研究与探讨。
本文先分析了数学极限思想及其应用意义,之后探讨了极限思想在化学教学中的应用及优化策略,发现灵活应用极限思想有利于完善学生的知识框架并提高教学效率,所以需要将极限思想应用在知识建构与问题解决等环节中,并通过增强应用意识、明确应用方法等手段优化极限思想的应用效果,提高化学教学质量。
一、关于数学极限思想数学极限思想指的是利用极限概念分析问题、解决问题。
极限思想的历史十分悠久,即公元前庄子阐述了极限思维;公元后刘徽在割圆术中应用了原始的极限思想;古希腊人提出了蕴含着极限思想的穷竭法;16世纪时荷兰数学家对穷竭法进行了改进,充分发挥了极限思想在问题分析中的作用;牛顿与莱布尼茨以无穷小概念为基础构建了微积分,且意识到了极限概念的重要性,促进了极限思想的发展;18世纪时罗宾斯等人先后表示将极限当作微积分的基础概念且完善了极限的定义,促进了极限思想的完善。
[1]此外,极限思想揭示了变量与常量、无限与有限的对立统一关系,充分展现了唯物辩证法中的对立统一关系,具有较强的思维功能。
灵活应用极限思想可以从有限中认识无限、从量变认识质变、从近似认识精确。
二、在高中化学教学中应用数学极限思想的意义(一)有利于完善学生的知识框架高中化学涉及诸多知识点,如人教版化学教材中涉及了物质及其变化、海水中的重要元素———钠和氯、物质结构等知识点,加大了教学难度。
同时,这些知识点也具有复杂、分散等特点,导致部分学生无法形成完整的知识框架。
而灵活应用数学极限思想有利于剖析化学核心概念、深化学生对知识的理解,也有利于推导化学规律,使学生形成系统的认知,所以在化学教学中应用数学极限思想有利于帮助学生形成完善的知识框架。
高二数学上学期教学计划(新教材人教版)

高二数学上学期教学计划(新教材人教版)四、加强辅导工作。
对已经出现数学学习困难的学生,教师的下班辅导十分重要,所以每位老师必须重视搞好辅导工作。
教师教学中,要尽快掌握班上学生的数学学习情况,有针对性地进行辅导工作,既要注意照顾好班上优生层,更不能忽视班上的困难学生。
人教版数学第一册教案(新教材)学期计划人教版数学第一册教案(新教材)学期计划全册教学理念:让不同的孩子在数学上得到不同的发展。
全册教学内容:义务教育课程标准实验教科书小学数学第一册全册教材分析:本册教材一共分为十个单元:数一数、比一比、1----5的认识和加减法、认识物体和图形、分类、6-----10的认识和加减法、11-----20的认识、认识钟表、20以内的进位加法及总复习和二个数学活动:数学乐园和我们的校园。
本册的教学重点是20以内的进位加法和10以内的加减法,难点是进位加法,这两部分知识和20以内的退位减法是学生学习认数和计算的基础,同时它又是多位数计算的基础。
因此,一位数的加法和相应的减法是小学数学中最基础的内容,是学生终身学习与发展必备的基础知识和基本技能,必须让学生切实掌握。
本册教材是义务教育的实验教材,是在新课程标准的指导下进行的实验课本,本册教材主要是通过各种各样的活动对学生进行数感及观察能力、思维能力、口头表达能力、学习习惯、合作与交流的能力等方面的培养,让学生对数学产生浓厚的学习兴趣,同时鼓励学生用自己喜欢的方式去学习自己有用的知识,对学生进行有效地思想品德教育,初步了解一定的学习方法、思考方式。
全册教学目标:1、熟练地数出数量在20以内的物体的个数,会区分几个和第几个,掌握数的顺序和大小,掌握10以内各数的组成,会读、写0――20各数。
2、初步知道加、减法的含义和加减法算式中各部分部分名称,初步知道加法和减法的关系,比较熟练地计算一位数的加法和10以内的减法。
3、初步学会根据加、减法的含义和算法解决一些简单的实际问题。
初中英语各年级所学的主要内容

初中英语各年级所学的主要内容英语中考满分是120分,考试时间是100分钟,包括:听力(20道题,20分),单选(15道题,15分),完型(10道题,10分),阅读(20道题,40分),词语运用(10道题,10分),补全对话(5道题,10分),写作(1篇,15分).初中各年数学级所学的主要内容七年级上册七年级上册八年级上册八年级下册九年级上册九年级上册中考文化课满分600(语数英各120分,物理政治各70分,化学历史各50分),体育50,理化生实验30,共680分,数学120分。
初中物理之课本篇问题76:初中物理几本书?初中物理是人教版的课本,初二才有物理,初二上下册各一本,初三一本全一册。
问题77:中考物理考几道题?每道题的分值多少?中考物理共5大题,70分。
其中填空题7个,共14分;选择题8个,共15分;作图题2个,共4分;实验探究题3个,共19分;综合应用题2个,共17分。
问题78:新东方授课用什么教材?新东方授课的教材是新东方内部根据每周定期教研汇总整理的新东方内部讲义。
初中化学之课本篇问题79:初中化学几本书?初中化学是人教版的课本,初三才有化学,初三共上下册两本书。
问题80:中考化学考几道题?每道题的分值多少?中考化学四大题,共50分。
其中选择题12个共12分;填空题6个,共16分;简答题4个,共12分;综合应用题1个共10分。
高中英语所学的主要内容高三主要是对高中八本书的复习和总结,尤其是要逐步的学会用英语来思维。
在一模考试之前要完成对整个高中阶段的词汇的学习和语法框架的构建.英语高考满分是150分,考试时间是2个小时,包括:听力(20道题),阅读(20道题),完型(20道题),语法填空,改错,写作。
但是听力目前是不计算在内的。
高中数学所学重要的内容高考数学满分150分,共24道题.1—-—12选择题,每题5分,共计60分.13--—16填空题,每道5分,共计20分。
17-——21题是解答题,每题12分,共计60分,22--—24是三道选做题,三选一,共计10分(多做按第一题给分)。
2016年高考高三化学复习备考策略研究

理综
理综 理综 理综 理综 理综 理综
必修1、2、原理、有机、技术;无结构
必修1、2、原理、有机、生活;无结构 必修1、2、原理、有机、生活;无结构 必修1、2、原理、有机、结构 必修1、2,原理;技术、结构、有机3选1 必修1、2、原理;有机,结构 2选1
100分/300分
必修2-课本实验.doc 选修4-课本实验.doc
化学实验小专题
3.探究实验专题
4.定量实验专题 5.有机实验专题
探究实验(专题).ppt
探究实验专题学案.doc 定量实验(专题).ppt 定量实验专题学案.doc 有机实验(专题).ppt 有机实验专题学案.doc
常见无机物性质和应用小专题
1.物质的性质与框图推断 2.重要无机离子检验与推断 3.热重图像分析专题 4.工业流程专题 5.化学计算常用方法
化学科考试,为了有利于选拔具有学习 潜能和创新精神的考生,以能力测试为 主导,在测试考生进一步学习所必需的 知识、技能和方法的基础上,全面检测 考生的化学科学素养。 化学科命题注重测量自主学习的能力, 重视理论联系实际,关注与化学有关的 科学技术、社会经济和生态环境的协调 发展,以促进学生在知识和技能、过程 和方法、情感、态度和价值观等方面的 全面发展。
(2016.4.2——2016.5.15 )
4、调整阶段
(2016.5.16——2016.6.6)
1、系统复习阶段(第一轮)
(2015.8.1——2016.2.15 )
我认为至少应选2个模块,高考 第一轮复习中,把必修一、必修 二、选修四《化学反应原理》和 确定的选修内容,相接近的部分, 揉碎重新组合,一气呵成。
高考第一轮复习中,把必修一、必修 二、选修四《化学反应原理》选修五《有 机化学基础》选修三《物质结构与性质》 的内容,相接近的部分,揉碎重新组合, 一气呵成。 各备课组要有计划(统一行动) 认真研究高考题(统一认识)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《燃烧热化学反应热的计算(1)》学习任务单长郡中学史李东【学习目标】1.了解燃烧热的含义,学会应用燃烧热数据书写热化学方程式、计算燃料燃烧的热量变化以及选择合理的燃料;2.认识盖斯定律,从能量守恒的角度理解盖斯定律,了解盖斯定律在科学研究中的重要意义。
3.利用盖斯定律和热化学方程式进行有关反应热的简单计算。
【课前预习任务】阅读人教版选修4《化学反应原理》7-12页,思考:1.什么燃烧热?燃烧热与中和热、反应热的联系区别?2.如何利用盖斯定律和热化学方程式进行有关反应热的简单计算?【课上学习任务】任务1:复习巩固,家用天燃气燃烧的热化学方程式书写。
任务2:学习燃烧热的概念,认识概念的限定重点,与中和热、反应热的联系和区别。
任务3:燃烧热数据的应用实例分析。
任务4:盖斯定律的内涵,甲烷不完全燃烧时燃烧热的计算方法。
任务5:学以致用,运用盖斯定律和燃烧热计算石墨转化为金刚石的热效应。
【课后作业】一、选择题1.下列说法中正确的是( )A.物质燃烧放出的热量就是燃烧热B.1 mol C燃烧生成CO时放出就是C的热量的燃烧热C.1 mol CH4完全燃烧时放出的热量是CH4的燃烧热D.相同条件下,1 mol H2O(l)完全分解生成氢气和氧气吸收的热量与氢气和氧气化合生成1 mol H2O(l)放出的热量值相等2.25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5 kJ·mol-1、ΔH=-285.8 kJ·mol-1、ΔH=-890.31 kJ·mol-1、ΔH=-2 800 kJ·mol -1,则下列热化学方程式正确的是( )A.C(s)+12O2(g)===CO(g) ΔH=-393.5 kJ·mol-1B.2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1 C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.31 kJ·mol-1D. 12C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-3.已知氢气、乙烷、甲醇、甲烷的燃烧热分别为285.8 kJ·mol-1、1 559.8 kJ·mol -1、726.51 kJ·mol-1 、890.31 kJ·mol-1,相同质量的氢气、乙烷、甲醇、甲烷完全燃烧时,放出热量最多的是( )A.H2(g) B.C2H6(g) C.CH3OH(l) D.CH4(g)4.已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1CO(g)+12O2g)===CO2(g) ΔH=-282.9 kJ·mol-1某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为( )A.2∶1 B.1∶2 C.1∶1 D.2∶35.已知:① CH3OH(g)+1/2O2(g) === CO2(g)+2H2(g ΔH=-192.9 kJ·mol-1② H2(g)+ 1/2O2(g) === H2O(l) ΔH=-285.8kJ·mol-1则CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(l)的ΔH为()A.+478.7 kJ/mol B.-764.5 kJ/mol C.-478.7 kJ/mol D.+7645 kJ/mol6.已知胆矾溶于水时溶液温度降低。
胆矾分解的热化学方程式为CuSO4·5H2O(s)===CuSO4(s)+5H2O(l) ΔH=+Q1 kJ·mol-1,室温下,若将1 mol无水硫酸铜溶解为溶液时放热Q2 kJ,则( )A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.无法比较二填空题7.按要求填空:(1)已知在1.01×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ的热量,则该反应的热化学方程式为:。
(2)已知:H2(g)+12O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,若1 g水蒸气转化成液态水放热2.444 kJ,则反应H2(g)+12O2(g)==H2O(l)的ΔH=kJ·mol-1。
(3)已知:① 2O2(g)+N2(g)=N2O4(l) ΔH1② N2(g)+2H2(g)=N2H4(l) ΔH2③ O2(g)+2H2(g)=2H2O(g) ΔH3④ 2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH4=-1048.9kJ/mol上述反应热效应之间的关系式为ΔH4= ,联氨和N2O4可作为火箭推进剂的主要原因为。
8.研究NO x、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。
已知:① CO(g)+12O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1② S(s)+O2(g)===SO2(g) ΔH=-296.0 kJ·mol-1此反应的热化学方程式是。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)===NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)2CO(g)+2NO(g)===N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NO x也可以消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol -1 ①CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=?②若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=。
【课后作业参考答案】1.D解析:燃烧热是指在25 ℃、101 kPa 下,1 mol 纯物质完全燃烧生成稳定的氧化物时放出的热量,显然A 项错误;B 项中碳燃烧生成的稳定化合物应为CO2,错误;C 项中CH4燃烧时的条件及生成水的状态不确定,故不能确定CH4的燃烧热,错误;根据能量守恒定律可知D 项正确。
2.D解析:根据燃烧热的概念中生成稳定氧化物的含义可知,CO2(g)是C 的稳定氧化物,生成的H2O 应该为液态,故只有D 正确。
3.A 解析:比较285.82、1 559.830、726.5132、890.3116的大小可知相同质量的四种气体完全燃烧时,H2放出热量最多。
4.C解析:根据热化学方程式可知:H2的燃烧热为571.6 kJ ·mol -1÷2=285.8 kJ ·mol -1。
生成的n (H2O)= 3.6 g 18 g ·mol -1=0.2 mol ,参加反应的H2为0.2 mol ,故H2燃烧放出的热量为0.2 mol ×285.8 kJ ·mol -1=57.16 kJ 。
CO 燃烧放出的热量为113.74 kJ -57.16 kJ =56.58 kJ ,故n (CO)=Q 放|ΔH CO |=56.58 kJ 282.9 kJ ·mol -1=0.2 mol 。
则n (H2)∶n (CO)=1∶1。
5.B6.A解析:根据盖斯定律,可设计下列分步反应:依题意,胆矾溶于水时,溶液温度降低,说明该反应为吸热反应,ΔH 总>0。
ΔH =+Q 1,ΔH ′=-Q 2。
由盖斯定律ΔH 总=ΔH +ΔH ′=+Q 1+(-Q 2)>0,则Q1>Q2。
7.(1) H2(g)+12O2(g)===H2O(g) ΔH=-242 kJ·mol-1(2)-285.8(3)2ΔH3−2ΔH2−ΔH1 反应放热多、产生大量气体8.(1)2CO(g)+SO2(g)===S(s)+2CO2(g) ΔH=-270 kJ·mol-1(2)0.3 3(2a+b)/80(3)-1 160 kJ·mol-1【素材积累】1、成都,是一个微笑的城市,宁静而美丽。
几千年前的三星堆、金沙,是古蜀人智慧的结晶,难以忘怀的文明,静静地诉说着古人们的智慧……刘备,孟昶等,多少为成都制造机会,创造美丽的人啊!武侯祠中诸葛亮摘悄悄的感叹成都的美……杜甫草堂,有多少千古名句,虽然简陋却给了杜甫一个温暖的港湾。
2、早上,晴空万里,云雾满天。
太阳公公把一切都搞得有一层薄薄的金黄色。
一群小鸟,摘老松树的枝头上欢蹦乱跳,叽叽喳喳地唱歌,这些小淘气们一跳上去,那些晶莹的小露珠旧滴一声,跳到了地上,继续进行它们的旅行。
空气摘早上也是非常的清新,你深深地吸一口气,仿佛可以把自己所有的心烦事都忘得一干二净,这旧是我家乡的早晨。
