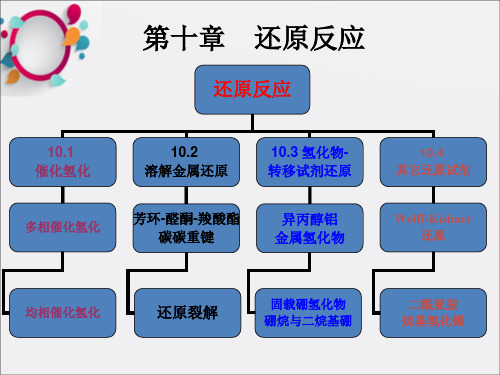
中国药科大学药物合成反应讲义还原反应
合集下载
《还原反应》PPT课件
CH2 CHCH2Ph + 2
PhCH=CHCO2H + 2
H Ph +2
Ph H
Pd 120h
Pd 64h
CH3CH2CH2Ph 85%
PhCH2CH2CO2H 90%
Pd 17h
PhCH2CH2Ph
100%
PhC CPh + 2
Pd 23h
PhCH2CH2Ph 100%
CH CO2H + 2 CH CO2H
PhCH=CHCHO H2/Raney Ni
PhCH2CH2CH2OH
酮羰基的氢化要比醛羰基的氢化困难。
CH3COCH3 PhCOCH3
H2/ R-Ni, 0.1~0.3MPa 25~30℃, 38min
CH3CH(OH)CH 3
100%
H2/ Ni-NaH,EtOH, 0.1MPa 25℃, 2.5h
多相催化氢化分为催化加氢、催化氢解、催化转移氢化三类。
① 催化加氢反应:碳—碳重键的加氢反应
◆ 碳—碳重键在钯、铂、镍的作用下催化加氢成为饱和键。
CHCO2H CHCO2H
+ H2
CH2CO2H CH2CO2H
亚油酸酯 CH3(CH2)4CH=CHCH2CH=CH(CH2)7CO2R
H2/Ni
CH3(CH2)7CH=CH(CH2)7CO2R + CH3(CH2)4CH=CH(CH2)10CO2R
OH OH
H H
OH
OH 86%
◆催化加氢反应是合成顺式取代乙烯衍生物的重要方法。使用Lindlar催化剂可 使叁键变为双键,不影响其它双键。
RC CR'
H2
Lindlar催化剂
药物合成反应第七章还原反应-PPT精选文档

一 炔、烯的还原 1 多相催化氢化 常用的氧化cat有:Ni(骨架)、Pd、Pt、 载体Pd/C 及Pt/C。
(1) 影响氢化反应速度和选择性的因素
a:毒剂(Poisons)和抑制剂(Inhibitors)
O H C H 2 P d / C a C O / H / 喹 啉 3 2 O H
2 0 1 k g / c m , 3 0 3 7 C
H + 2 2 ( a ) C 2 H H H + 2 2C 2
C H H ( b ) 2C 2
C H H + H 2 C 2
C H H c ) + 2 ( 2 C 3
C H H H 2 C 3+
C H H d ) + 2 ( 3 C 3
Bond历程:
D 2 + 2 2 ( a ) C H H D + 2C 2
第七章 还原反应
有机物分子中碳原子总的氧化态(Oxidation
Stete) 降低的反应为还原反应,即加上H或减少O。
多相催化氢化(Heterogeneous
Hydrogenation) 转移氢化(Trandfer Hydrogenation)
第一节 还原反应机理 一 非均相催化氢化反应 1 基本原理
PPh R h PPh e f
3
反应历程:
R R b H P h 3P R h C l P h 3P R c R
C l
3
P h 3P R h C l
ž
PPh
3
a
H
2
H
ž
P h 3P R h C l P h 3P H P h 3P R h C l P h 3P R R H R d R
(1) 影响氢化反应速度和选择性的因素
a:毒剂(Poisons)和抑制剂(Inhibitors)
O H C H 2 P d / C a C O / H / 喹 啉 3 2 O H
2 0 1 k g / c m , 3 0 3 7 C
H + 2 2 ( a ) C 2 H H H + 2 2C 2
C H H ( b ) 2C 2
C H H + H 2 C 2
C H H c ) + 2 ( 2 C 3
C H H H 2 C 3+
C H H d ) + 2 ( 3 C 3
Bond历程:
D 2 + 2 2 ( a ) C H H D + 2C 2
第七章 还原反应
有机物分子中碳原子总的氧化态(Oxidation
Stete) 降低的反应为还原反应,即加上H或减少O。
多相催化氢化(Heterogeneous
Hydrogenation) 转移氢化(Trandfer Hydrogenation)
第一节 还原反应机理 一 非均相催化氢化反应 1 基本原理
PPh R h PPh e f
3
反应历程:
R R b H P h 3P R h C l P h 3P R c R
C l
3
P h 3P R h C l
ž
PPh
3
a
H
2
H
ž
P h 3P R h C l P h 3P H P h 3P R h C l P h 3P R R H R d R
《药物合成反应》第七章还原反应-revised

7%
29
EtOH/KOH
35-50%
65~50%
转移氢化
❖ 有机物为供氢体
计划生育药安宫黄体酮(Medroxyprogesterone)的制备
O O CO CH3
+ O
CH3
Pd-C/EtO H , 5h O
O O CO CH3
CH3
30
转移氢化
❖ 二酰亚胺为氢转移试剂
HN NH +
CC
HH NN
酶催化法
4
一. 非均相催化氢化
❖ 催化剂自成一相(固相) ❖ 氢源:
➢ H2(多相催化氢化,Heterogeneous hydrogenation), ➢ 有机物(转移氢化,Transfer hydrogenation ).
❖ 溶剂
5
1. 多相催化氢化
P t/H 2
H 2 C C H 2
C H 3 C H 3
历程: ❖ 氢分子与催化剂活性中心化学吸附 ❖ 烯烃与催化剂活性中心化学吸附,双键被活化 ❖ 活化氢分步加成,得到半氢化中间产物 ❖ 氢順式加成得烷烃 ❖ 产物分子由催化剂表面解吸
6
影响因素
❖ 化学吸附
➢ 电性因素 催化剂金属最外层d轨道占有8~9个电子最合适; 空d轨道过少不易吸附,过多不易解吸; (Ni、 Cu、 Pt、Pd、Rh等)
1.金属氢化物为还原剂
❖ 本类还原剂是以K、Na、Li离子和B、Al等复氢负离子 形成的复盐,如LiAlH4 、LiBH4 、KBH4、NaBH4、 (CH3CH2CH(CH3)-)3BHLi 等。 硼氢负离子作为亲核基团,机理如下:
H
R
H B H+O C
R
药物合成反应课件 中国药科大学

醋酸去氢 表雄酮
炔雌醇合成 的第一步
卤素外 的基团 来自溶剂
注意 区域 选择 性?
N-卤代酰胺
Nu=H2O, ROH, DMSO, DMF
选择性???
Dalton 反应
a-溴酮
高选择性对
向加成产物
不影响其它官能团
不饱和烃的硼氢化-卤解反应
首先将烯烃进行硼氢化,然后用卤解反应转
化成卤代烃,具立体和区域选择性的。定位 属反马氏规则。 烯烃的硼氢化常用的试剂为二硼烷(B2H6), BH3/THF和BH3/Me2S(DMS)。 炔烃的硼氢化试剂常用儿茶酚硼烷。 属顺式硼氢化加成机理,硼原子优先处于位 阻较小的位置。 若硼原子连接的碳原子为手性中心,在置换 过程中发生构型反转现象。
3-羰基甾体
Py的作 用??
酮的选择性 ketoselectivity
减少双键加成
取代,快,可逆 加成,慢,不可逆
四溴环己二烯酮
特点:亲电活性大,无需催化剂,只得到单取代产物, 反应中不生成卤化氢,适用于对酸、碱敏感的酮。 区域选择性高,取代反应主要在烷基取代较多的α位。 对αβ不饱和酮也较好,还可用于醛的α-溴代反应。
还有什 么方 法??
与前页比较
芳环上有吸电子取代基时,卤取代反应一
般需用lewis酸催化,反应温度也较高。
含吸电 子基团
二溴异氰尿酸
98%
含多余π-电子的芳杂环:吡咯﹥呋喃﹥ 噻吩﹥>苯,且2位比3位活泼。
对于缺π-电子的芳杂环如吡啶,卤 取代反应相当困难,条件苛刻。
20~50℃
氟和碘取代反应
第二节 卤加成反应
一、不饱和烃的卤加成反应
卤素的活性次序为F>Cl>Br>I
药物合成导图-还原反应

对脂肪酮、醛或脂环酮的还原
对酸、热敏感底物的还原:条件需温和
Wolf-黄鸣龙反应
醛、酮在强碱性条件下和水合肼加热,还原成烃
反应通式
反应机理 影响因素 应用特点
水合肼向醛、酮羰基亲核进攻 介质对反应的影响:85%的水合肼、氢氧化钾反应 介质中含有水对反应的影响:腙在分解前应尽量去除水分 醛、酮还原为烃:弥补了clemmensen的不足,适用于对酸敏感的物质 腙还原为烃
酸性条件,用锌汞齐或锌粉将醛基、酮基为甲基和亚甲基
反应通式: 反应机理
应用特点
碳离子中间体历程 自由基中间体历程
应用范围:适用于所有芳香酮或者脂肪酮的还原
存在选择性:羧酸、酯、酰胺不受影响
对酮酸及其酯的还原:α位,羟基;β位,亚甲基
对不饱和酮的还原
与羰基共轭的双键同时被还原 与酯基共轭的双键被仅双键被还原
应用特点:分子中含有烯键、炔键、硝基、氰基及卤素均无影响
三、四
多想催化氢化还原
反应通式 应用特点
还原剂种类:Raney镍、铂、钯等过渡金属 脂肪族醛、酮的还原:Raney镍和铂 芳香醛、酮的还原:Raney镍和钯
均相催化氢化
反应通式 应用特点:Ru、Ir和有机磷形成络合物,有机磷-BINAP
还原胺化反应
羰基的还原胺化反应
反应通式 反应机理:亲核加成反应机理 影响因素:催化氢化活泼金属与酸、金属氢化物、甲酸及其衍生物等 应用特点:制备伯仲叔胺
LW和EC反应
LW反应:过量甲酸存在下,羰基化合物与氨、胺的还原胺化反应
EC反应:过量甲酸作用下,甲醛与伯胺、仲胺反应生成甲基化胺的反应
反应通式
影响因素
还原剂及介质:甲酸、甲酸铵或甲酰胺的反应 反应条件:一般不用溶剂,特殊情况去水即可
《药物合成反应》第七章 还原反应

2 Birch反应(伯奇还原)
芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁 醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
Birch
Li K Na( 液 NH3)
【北京大学】药学院《药物合成反应》精品课件
第三节 醛、酮的还原反应一 还原成烃的反应1 Clemmensen还原
钯C(Pd/C)
ndlar(林德拉)催化剂 Pd/BaSO4/喹啉 炔 Lindlar 烯
【北京大学】药学院《药物合成反应》精品课件
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
③铂(Pt)为催化剂
铂 Na2PtCl6 + 2HCl + 6NaOH Pt + 2HCOONa + 6NaCl + 4H2O H2PtCl6 + NaBH4 Pt
10036,U.S.A
【北京大学】药学院《药物合成反应》精品课件
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
多相氢化因素:
a 催化剂:活性高 稳定性 不易中毒,再生 用量 Ni 10%~15%被催化物质质量 Pd/C 1%~5%被催化物质质量 Pt 0.5%~1%被催化物质质量
载体:为增大催化剂的表面在催化剂制备中加入的多孔物质
【北京大学】药学院《药物合成反应》精品课件
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
b 氢压 收率 高 压 :400atm(磁 搅 拌 ) 低 压 : 4atm(磁 搅 拌 ) 常 压 : 1atm(摆 床 )
CC
H2/Pt 1kg/cm2
H2/Pt 2kg/cm2
CC CH2 CH2
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁 醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
Birch
Li K Na( 液 NH3)
【北京大学】药学院《药物合成反应》精品课件
第三节 醛、酮的还原反应一 还原成烃的反应1 Clemmensen还原
钯C(Pd/C)
ndlar(林德拉)催化剂 Pd/BaSO4/喹啉 炔 Lindlar 烯
【北京大学】药学院《药物合成反应》精品课件
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
③铂(Pt)为催化剂
铂 Na2PtCl6 + 2HCl + 6NaOH Pt + 2HCOONa + 6NaCl + 4H2O H2PtCl6 + NaBH4 Pt
10036,U.S.A
【北京大学】药学院《药物合成反应》精品课件
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
多相氢化因素:
a 催化剂:活性高 稳定性 不易中毒,再生 用量 Ni 10%~15%被催化物质质量 Pd/C 1%~5%被催化物质质量 Pt 0.5%~1%被催化物质质量
载体:为增大催化剂的表面在催化剂制备中加入的多孔物质
【北京大学】药学院《药物合成反应》精品课件
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
b 氢压 收率 高 压 :400atm(磁 搅 拌 ) 低 压 : 4atm(磁 搅 拌 ) 常 压 : 1atm(摆 床 )
CC
H2/Pt 1kg/cm2
H2/Pt 2kg/cm2
CC CH2 CH2
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
药物合成反应-还原反应

2014-7-29
2. 二酰亚胺还原
二酰亚胺(HN=NH)为选择性较好的还原试剂,可有效地还原非极性重键(如C=C, N=N等),而极性重键(如C=N, NO2等)不受影响;其也可以作为氢转移试剂。
(1)通式:
(2)机理:其反应机理为,不饱和键与二酰亚胺通过一个非极性环状过渡态,然后,氢转移 不饱和键并放出氮而完成还原反应,因而其加氢也为同向加氢。
钯C(Pd/C)
Lindlar(林德拉)催化剂 Pd/BaSO4/喹啉 炔 Lindlar 烯
2014-7-29
③铂(Pt)为催化剂
铂 Na2PtCl6 + 2HCl + 6NaOH H2PtCl6 + NaBH4 Pt PtO2 + 4NaCl + 2NH4Cl + 4NO2 + O2
亚当斯催化剂 (Adams) PtO2
1. NaBH4 2. H+, H 2 O R
OH
H 2NNH 2 HO-, Δ
R
H2 C
R
脱氧或加氢的反应称为还原
2014-7-29
O R H
H2 CrO4 R
O OH
an aldehyde OH R R an alcohol H2 CrO4 R O C
R
加氧或脱氢的反应称为氧化
2014-7-29
CH2CH2CH2COOH
羧基不被还原
2014-7-29
2 . 黄鸣龙还原(碱性条件下还原)
R R C O + H2N
R R C
B
NH2
△
R R
CH2 + N2
TEG or DEG(三 甘 醇 、 二 甘 醇 ) 120℃( 蒸 出 H2O)
药物合成反应还原反应1

第21页/共142页
Wilkinson cat.
• (Ph3P)RhCl-通常只还原位阻最小的双键; • 加入Ph3P不但能够促进催化剂在有机溶剂中的溶解度,而且使其更具空间效应。
第22页/共142页
• 2. 溶解金属还原 • 金属+酸: Clemmensen reduction
第23页/共142页
Blanc Reduction
• 溶解金属还原的一般过程:双电子化,双质子化。 第27页/共142页
伯奇还原
金属钠溶解在液氨中可得到一种蓝色的溶液,它 在醇的存在下,可将芳香化合物还原成1,4-环己二烯 化合物,该还原反应称为伯奇还原。
Na NH3(l) C2H5OH
1 K、Li能代替Na,乙胺能代替氨; 2 卤素、硝基、醛基、酮羰基等对反应有干扰。
第56页/共142页
Myers’ Aldehyde Syn.
第57页/共142页
第58页/共142页
(3) Zn-Hg
第59页/共142页
5(1. )ODitimhieder RReedudcutiocntion Methods
第60页/共142页
第61页/共142页
Formation (generation) of reagents (diimide)
第28页/共142页
反应机理:
Na + NH3
Na+ + (e-) NH3
溶剂化电子
金属钠溶解在液 氨中可得到一种 蓝色的溶液,这 是由钠与液氨作 用生成的溶剂化 电子引起的
(e-)NH3
CH3OH
-CH3O-
自由基负离子
(e-) NH3
CH3OH
负离子
Wilkinson cat.
• (Ph3P)RhCl-通常只还原位阻最小的双键; • 加入Ph3P不但能够促进催化剂在有机溶剂中的溶解度,而且使其更具空间效应。
第22页/共142页
• 2. 溶解金属还原 • 金属+酸: Clemmensen reduction
第23页/共142页
Blanc Reduction
• 溶解金属还原的一般过程:双电子化,双质子化。 第27页/共142页
伯奇还原
金属钠溶解在液氨中可得到一种蓝色的溶液,它 在醇的存在下,可将芳香化合物还原成1,4-环己二烯 化合物,该还原反应称为伯奇还原。
Na NH3(l) C2H5OH
1 K、Li能代替Na,乙胺能代替氨; 2 卤素、硝基、醛基、酮羰基等对反应有干扰。
第56页/共142页
Myers’ Aldehyde Syn.
第57页/共142页
第58页/共142页
(3) Zn-Hg
第59页/共142页
5(1. )ODitimhieder RReedudcutiocntion Methods
第60页/共142页
第61页/共142页
Formation (generation) of reagents (diimide)
第28页/共142页
反应机理:
Na + NH3
Na+ + (e-) NH3
溶剂化电子
金属钠溶解在液 氨中可得到一种 蓝色的溶液,这 是由钠与液氨作 用生成的溶剂化 电子引起的
(e-)NH3
CH3OH
-CH3O-
自由基负离子
(e-) NH3
CH3OH
负离子
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
18
Mechanism
氢解还原历程: 氢化还原历程:
19
20
不饱和烃的还原
1. 炔、烯烃的还原
(1). Heterogeneous Hydrogenation
Catalyst: Ni , Pd , Pt
① Ni催化剂 Raney Ni、载体Ni、还原Ni、硼化Ni
Raney Ni(活性Ni,多孔状骨架镍):中性或弱碱性,用于 炔,烯,NO2, CN,RCOR,Ar,C-X,C-S
第九章 还原反应
Chapter 9 Reduction Reaction
1
概述
定义:碳原子总氧化态降低(得电子或电子云密度增高)
增加氢,减少氧
分类:
Catalytic Hydrogenation
H2/(Pd, Pt, Ni)
Heterogeneous:
transfer:氢供体/Pd-C
Homogeneous (Rh, Ru, C-C不饱和键)
Chemical Hydrogenation
电子---质子转移还原
氢负离子转移还原:metal hydride ,
borane,alkoxy aluminium
Bio-reduction
2
一. Heterogeneous Hydrogenation
1. Catalytic Hydrogenation (催化氢化) : The reduction by addition of two hydrogen Atoms (通
29
炔、烯烃的非均相催化氢化法
Transfer hydrogenation: 简单易行,使用安全
O OCOCH3
+ O
CH3
Pd-C / EtOH ,5h
O OCOCH3
65%
O CH3
计划生育药 安宫黄体酮
30
催化转移氢化 Diimide donor 二酰亚胺 NHNH, syn-addition
4
Heterogeneous Hydrogenation
其立体化学特征是 —— Syn-addition
5
一. Heterogeneous Hydrogenation
• alkenes ( C=C ), alkynes ( C≡C )
• imines ( C=N ), nitriles ( C≡N )
COOH Na/NH3/EtOH
COOH
供电子基:1-取代-1,4-环己二烯
吸电子基: 1-取代-2,5-环己二烯
36
芳烃的还原反应
Mechanism:电子转移历程
37
芳烃的还原反应
18-甲基炔诺酮 Norgestrel中间体
苯甲醚、苯胺Brich 反应生成环己酮衍生物
38
醛、酮的还原反应
一. 还原成烃
抗凝血药
Clemmensen反应缺点: 1、反应需要使用大量的重金属汞; 2、反应在强酸条件下进行,底物范围受到严重的限制 3、反应条件苛刻
42
醛、酮的还原反应---还原成烃
2. Wolff-Кижер-黄鸣龙还原反应 (碱性条件下还原)
R
RCOOR, RCONHR,苄位结构氢解
钯 黑 PdCl2+H2
Pd↓+HCl+NaOH
Pd↓+HCOONa+NaCl+H2O
载 体 钯 : 加 入 载 体 ( 活 性 炭 、 CaCO3、 BaSO4、 硅 藻 土 、 Al2O3) 增大比表面,增大活性
注意:使用时先通氢气还原为铂黑,然后再投 底物加氢还原!! Pt/C: 5%~10%
铂较易中毒,不能用于有机硫化物和有 机胺类的还原!
24
炔、烯烃的非均相催化氢化法
影响因素: ①poisons(毒剂):P,S, As, I,有机硫或胺类: 占 据活性中心, 难活化 inhibitors(抑制剂):quinoline, 可活化再生, 提高选择性
Ph H CC
H Ph
NH2-NH2 / Cu2+
Ph
H
CH CH
H
Ph
88%
NHNH不稳定, 需新制, 选择性还原末端双键 及反式双键,不影响其他基团
CH2=CHCH2-S-S-CH2CH=CH2 NH2-NH2
CH3CH2CH2-S-S-CH2CH2C3H1 3
(2) 均相催化氢化反应:(Ph3P)3RhCl, TTC(氯化(三苯瞵)合铑)、
对酯基和酰胺无作用
酸性条件下活性降低,当pH<3,活性消失
不饱和烃的还原
Raney Ni:
活性影响因素:温度、碱的浓度及用量、反应 时间、洗涤条件
Raney Ni 活性: W6>W7>W3,W4,W5>W2>W1>W8 铝残留量少、分散度大、吸氢多活性高
22
炔、烯烃的非均相催化氢化法
钯(Pd)为催化剂:中性或酸性条件,应用范围广,可还原
26
炔、烯烃的非均相催化氢化法
选择性加氢及立体化学
H3CO
CH CHCOOH
Syn-addition
H2 / 5% /Pd-C NaH2PO2
H3CO
CH2CH2COOH 96%
CH3
PtO2/H2/AcOH
CH3
CH3 +
CH3
82%
CH3
CH3 18%
位阻小的一面同向加成(Syn-addition)
14
15
反应活性
16
2. 硼烷 B2H6
有毒气体,一般溶于四氢呋喃,二甲硫醚 机理:亲电性氢负离子转移,首先进攻富电子中心
17
四. 电子转移还原
• Reduction by addition of an electron, a proton —— Na, Li, K, Mg, Ca, Zn donate an electron to the compound and H2O (ROH, or acid) donates a proton. —— is called as a dissolving metal reduction —— addition of H to bond ——可被还原的化合物主要有炔烃、苯和羰基化 合物, RCN,NO2
3、还原不饱和酮:孤立双键不被还原; 与羰基共轭双键,易与羰基一起被还原; 与酯羰基共轭双键,仅双键被还原
41
醛、酮的还原反应---还原成烃
不适用于对酸和热敏感的羰基化合物:须在温和条件下(0oC)
O
Zn, (C2H5)2O
CHCOOH
CHCOOH 84%
CH2CH3
HCl
CH2CH3
O
O
Indobufen
Yes
• aldehydes or ketones ( C=O )
But, RCOOH, RCOOR’, and RCONHR’ No
6
Heterogeneous Hydrogenation Relative reactivity of the Functional Groups by Catalytic Hydrogenation(-不同功能团氢化难易顺序表)
(Ph3P)3RuCl
末端双键,环外双键易还原 单取代>双取代>三取代>四取代
优点: 烯键选择性好, 催化剂不易中毒,无副反应
CH3 O
(PPh3)3RhCl/H2
CH3 O
32
(3). 硼氢化反应
(1) 硼烷 BR3
BH3活性最好 硼原子主要加成取代较少的碳原子
X
CH=CH2 2BH3/O(CH2CH2OCH3)2 X
反应的必要条件:底物在催化剂表面发生化学吸附(底物 与催化剂之间的几何因素和电性因素决定)
电性因素:催化剂的d轨道有一定的电子占有程度 (d:8~9;Pt, Rh, Ni等)
Fe: 3d6,4s2 结合键能大,结合牢固吸附不易解吸,导致催化 剂不活泼 Cu: 3d10,4s1结合能弱,活化能小 Pd: 4d10→4d9,5s1
Ph3P PPh3 Rh
Cl PPh3
H Cl PPh3 Ru
Ph3P PPh3
3NC Cl CN
Co NC CN
催化剂呈配合分子状态溶解于反应介质中,选择性好,条件 温和,速度快、副反应少。
selective reduction for unsaturated bond 9
Mechanism
σ络合物
P-2能选择性还原炔键 和末端烯键
CH3
NiB(P-2)/H2 NH2CH2CH2NH2
CH3 95% HH
27
炔、烯烃的非均相催化氢化法
选择性加氢及立体化学 P-2型硼化Ni选择性还原炔键和末端烯键
产物以顺式加成为主 28
炔、烯烃的非均相催化氢化法
Raney Ni
R
R
H
H
位阻小一面同向加成 R, β位, H α位
O OCOCH3
+ O
CH3
Pd-C / EtOH ,5h
O OCOCH3
65%
O CH3
8
二. Homogeneous Hydrogenation
均相催化剂:
Metal: VIII( Ru, Rh, Co, Ir, Pt) Ligand: Cl, CN, H, Ph3P,CO,NO
M-ligand
1. NaBH4、LiAlH4
亲核试剂
机理: 负氢对羰基亲核加成
13
醛、酮 NaBH4 醇
不反应
NaBH4
酸、酯 酰胺
LiAlH4
醇、胺
Al-H bonds are more polar than B-H bonds, so LiAlH4 is a stronger reducing reagent than NaBH4
Mechanism
氢解还原历程: 氢化还原历程:
19
20
不饱和烃的还原
1. 炔、烯烃的还原
(1). Heterogeneous Hydrogenation
Catalyst: Ni , Pd , Pt
① Ni催化剂 Raney Ni、载体Ni、还原Ni、硼化Ni
Raney Ni(活性Ni,多孔状骨架镍):中性或弱碱性,用于 炔,烯,NO2, CN,RCOR,Ar,C-X,C-S
第九章 还原反应
Chapter 9 Reduction Reaction
1
概述
定义:碳原子总氧化态降低(得电子或电子云密度增高)
增加氢,减少氧
分类:
Catalytic Hydrogenation
H2/(Pd, Pt, Ni)
Heterogeneous:
transfer:氢供体/Pd-C
Homogeneous (Rh, Ru, C-C不饱和键)
Chemical Hydrogenation
电子---质子转移还原
氢负离子转移还原:metal hydride ,
borane,alkoxy aluminium
Bio-reduction
2
一. Heterogeneous Hydrogenation
1. Catalytic Hydrogenation (催化氢化) : The reduction by addition of two hydrogen Atoms (通
29
炔、烯烃的非均相催化氢化法
Transfer hydrogenation: 简单易行,使用安全
O OCOCH3
+ O
CH3
Pd-C / EtOH ,5h
O OCOCH3
65%
O CH3
计划生育药 安宫黄体酮
30
催化转移氢化 Diimide donor 二酰亚胺 NHNH, syn-addition
4
Heterogeneous Hydrogenation
其立体化学特征是 —— Syn-addition
5
一. Heterogeneous Hydrogenation
• alkenes ( C=C ), alkynes ( C≡C )
• imines ( C=N ), nitriles ( C≡N )
COOH Na/NH3/EtOH
COOH
供电子基:1-取代-1,4-环己二烯
吸电子基: 1-取代-2,5-环己二烯
36
芳烃的还原反应
Mechanism:电子转移历程
37
芳烃的还原反应
18-甲基炔诺酮 Norgestrel中间体
苯甲醚、苯胺Brich 反应生成环己酮衍生物
38
醛、酮的还原反应
一. 还原成烃
抗凝血药
Clemmensen反应缺点: 1、反应需要使用大量的重金属汞; 2、反应在强酸条件下进行,底物范围受到严重的限制 3、反应条件苛刻
42
醛、酮的还原反应---还原成烃
2. Wolff-Кижер-黄鸣龙还原反应 (碱性条件下还原)
R
RCOOR, RCONHR,苄位结构氢解
钯 黑 PdCl2+H2
Pd↓+HCl+NaOH
Pd↓+HCOONa+NaCl+H2O
载 体 钯 : 加 入 载 体 ( 活 性 炭 、 CaCO3、 BaSO4、 硅 藻 土 、 Al2O3) 增大比表面,增大活性
注意:使用时先通氢气还原为铂黑,然后再投 底物加氢还原!! Pt/C: 5%~10%
铂较易中毒,不能用于有机硫化物和有 机胺类的还原!
24
炔、烯烃的非均相催化氢化法
影响因素: ①poisons(毒剂):P,S, As, I,有机硫或胺类: 占 据活性中心, 难活化 inhibitors(抑制剂):quinoline, 可活化再生, 提高选择性
Ph H CC
H Ph
NH2-NH2 / Cu2+
Ph
H
CH CH
H
Ph
88%
NHNH不稳定, 需新制, 选择性还原末端双键 及反式双键,不影响其他基团
CH2=CHCH2-S-S-CH2CH=CH2 NH2-NH2
CH3CH2CH2-S-S-CH2CH2C3H1 3
(2) 均相催化氢化反应:(Ph3P)3RhCl, TTC(氯化(三苯瞵)合铑)、
对酯基和酰胺无作用
酸性条件下活性降低,当pH<3,活性消失
不饱和烃的还原
Raney Ni:
活性影响因素:温度、碱的浓度及用量、反应 时间、洗涤条件
Raney Ni 活性: W6>W7>W3,W4,W5>W2>W1>W8 铝残留量少、分散度大、吸氢多活性高
22
炔、烯烃的非均相催化氢化法
钯(Pd)为催化剂:中性或酸性条件,应用范围广,可还原
26
炔、烯烃的非均相催化氢化法
选择性加氢及立体化学
H3CO
CH CHCOOH
Syn-addition
H2 / 5% /Pd-C NaH2PO2
H3CO
CH2CH2COOH 96%
CH3
PtO2/H2/AcOH
CH3
CH3 +
CH3
82%
CH3
CH3 18%
位阻小的一面同向加成(Syn-addition)
14
15
反应活性
16
2. 硼烷 B2H6
有毒气体,一般溶于四氢呋喃,二甲硫醚 机理:亲电性氢负离子转移,首先进攻富电子中心
17
四. 电子转移还原
• Reduction by addition of an electron, a proton —— Na, Li, K, Mg, Ca, Zn donate an electron to the compound and H2O (ROH, or acid) donates a proton. —— is called as a dissolving metal reduction —— addition of H to bond ——可被还原的化合物主要有炔烃、苯和羰基化 合物, RCN,NO2
3、还原不饱和酮:孤立双键不被还原; 与羰基共轭双键,易与羰基一起被还原; 与酯羰基共轭双键,仅双键被还原
41
醛、酮的还原反应---还原成烃
不适用于对酸和热敏感的羰基化合物:须在温和条件下(0oC)
O
Zn, (C2H5)2O
CHCOOH
CHCOOH 84%
CH2CH3
HCl
CH2CH3
O
O
Indobufen
Yes
• aldehydes or ketones ( C=O )
But, RCOOH, RCOOR’, and RCONHR’ No
6
Heterogeneous Hydrogenation Relative reactivity of the Functional Groups by Catalytic Hydrogenation(-不同功能团氢化难易顺序表)
(Ph3P)3RuCl
末端双键,环外双键易还原 单取代>双取代>三取代>四取代
优点: 烯键选择性好, 催化剂不易中毒,无副反应
CH3 O
(PPh3)3RhCl/H2
CH3 O
32
(3). 硼氢化反应
(1) 硼烷 BR3
BH3活性最好 硼原子主要加成取代较少的碳原子
X
CH=CH2 2BH3/O(CH2CH2OCH3)2 X
反应的必要条件:底物在催化剂表面发生化学吸附(底物 与催化剂之间的几何因素和电性因素决定)
电性因素:催化剂的d轨道有一定的电子占有程度 (d:8~9;Pt, Rh, Ni等)
Fe: 3d6,4s2 结合键能大,结合牢固吸附不易解吸,导致催化 剂不活泼 Cu: 3d10,4s1结合能弱,活化能小 Pd: 4d10→4d9,5s1
Ph3P PPh3 Rh
Cl PPh3
H Cl PPh3 Ru
Ph3P PPh3
3NC Cl CN
Co NC CN
催化剂呈配合分子状态溶解于反应介质中,选择性好,条件 温和,速度快、副反应少。
selective reduction for unsaturated bond 9
Mechanism
σ络合物
P-2能选择性还原炔键 和末端烯键
CH3
NiB(P-2)/H2 NH2CH2CH2NH2
CH3 95% HH
27
炔、烯烃的非均相催化氢化法
选择性加氢及立体化学 P-2型硼化Ni选择性还原炔键和末端烯键
产物以顺式加成为主 28
炔、烯烃的非均相催化氢化法
Raney Ni
R
R
H
H
位阻小一面同向加成 R, β位, H α位
O OCOCH3
+ O
CH3
Pd-C / EtOH ,5h
O OCOCH3
65%
O CH3
8
二. Homogeneous Hydrogenation
均相催化剂:
Metal: VIII( Ru, Rh, Co, Ir, Pt) Ligand: Cl, CN, H, Ph3P,CO,NO
M-ligand
1. NaBH4、LiAlH4
亲核试剂
机理: 负氢对羰基亲核加成
13
醛、酮 NaBH4 醇
不反应
NaBH4
酸、酯 酰胺
LiAlH4
醇、胺
Al-H bonds are more polar than B-H bonds, so LiAlH4 is a stronger reducing reagent than NaBH4
