第七章_电泳胶片分析
凝胶电泳实验分析报告模板

凝胶电泳实验报告模板————————————————————————————————作者:————————————————————————————————日期:重庆大学研究生专业实验教学实验报告书重庆大学研究生院制实验课程名称: 凝胶电泳实验实验指导教师: 学 院:专业及类别: 生物学学 号: 姓 名: 实验日期: 成 绩:一、实验目的1.理解凝胶电泳的分类及琼脂糖和聚丙烯酰胺凝胶电泳实验的基本原理。
2.熟练琼脂糖凝胶电泳实验的基本操作。
3.通过实验了解凝胶电泳实验的注意事项并在以后的实验中尽量避免。
4.利用琼脂糖凝胶电泳检测DNA纯度、浓度和分子量以及分离大小不同的DNA 片段。
5.了解聚丙烯酰胺凝胶电泳测定DNA和蛋白分子量大小的方法。
二、实验材料、用具及试剂1.材料:菌落PCR产物(待检测DNA片段);2.用具:①琼脂糖凝胶电泳:电泳仪,水平板型电泳槽,电子天平,微量移液器(10µl),枪头,三角瓶,点样板,梳子,微波炉,凝胶成像仪;②聚丙烯酰胺凝胶电泳:垂直板电泳槽,稳压稳流电泳仪,梳子;3.试剂:琼脂糖,1×TAE缓冲液,载样缓冲液(Loading buffer),goldviwe染料,DL5,000 DNA Marker (Takara)。
三、实验原理核酸凝胶电泳是分子克隆核心技术之一,用于分离、鉴定和纯化DNA或RNA 片段,具有以下优点:便于分离、便于检测和便于回收。
其工作原理相对而言比较简单、主要用到了物理学的电荷理论。
当一种分子被放置在电场当中时,它们就会以一定的速度移向适当的电极,这种电泳分子在电场作用下的迁移速度,叫做电泳的迁移率。
它同电场的强度和电泳分子本身所携带的净电荷数成正比。
也就是说,电场强度越大、电泳分子所携带的净电荷数量越多,其迁移的速度也就越快,反之则较慢。
由于在电泳中使用了一种无反应活性的稳定的支持介质,如琼脂糖凝胶和聚丙烯酰胺胶等,从而降低了对流运动,故电泳的迁移率又是同分子的摩擦系数成反比的。
第七章_电泳胶片分析
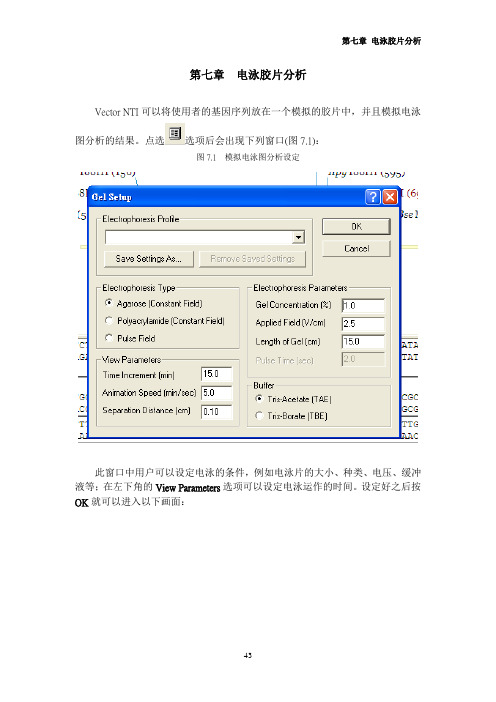
第七章 电泳胶片分析 Vector NTI可以将使用者的基因序列放在一个模拟的胶片中,并且模拟电泳图分析的结果。
点选选项后会出现下列窗口(图7.1):图7.1 模拟电泳图分析设定此窗口中用户可以设定电泳的条件,例如电泳片的大小、种类、电压、缓冲液等;在左下角的View Parameters选项可以设定电泳运作的时间。
设定好之后按OK就可以进入以下画面:图7.2 设定完电泳条件,会得到左边窗口的样子 右边的窗口是用户的电泳胶片,左边的窗口会有详细的文字叙述。
使用者点选选项就可以选择Marker(图7.3):图7.3 选择所要制作的胶片按下OK后marker就可以加入右边的胶片中(图7.4):图7.4 加入胶片之后的结果,呈现在右边窗口 接着加入使用者的样品,只要点选选项即可:图7.5 加入使用者样品此设定窗口(图7.5)和上一章所提到的RFLP设定完全相同,用户只要选取数据库中的基因序列及限制酶后,再按下Add to Gel就可以加入胶片中了:图7.6 加入斑马鱼海大基因胶片 此窗口(图7.6)样品和限制酶一样可以复选,使用者可以针对不同的需求进行调整,要放入胶中的分析物只要按下Add to Gel,选取完所有的样品后关闭此窗口就可以进行电泳分析,把光标移至电泳片上方:图7.7 加入样品后的结果,电泳分析的结果 使用者可以见到上方有一个时间轴的按钮,只要点最右边的按钮就可以进行分析,时间旁边的两个按钮可以手动控制电泳分析的时间:图7.8 控制电泳分析时间,分析不同的时间点 若要停止电泳分析只要在胶片上面在点一下鼠标左键就可以了。
电泳分析的结果的储存方式和主程序的储存方式相同。
使用者打开左边的文件夹后,会见到电泳分析的结果;右手边胶片数字编号的部分,按下鼠标右键后也可以见到电泳分析的结果(图7.9):图7.9 打开左窗口的档案,于右窗口得到电泳分析结果 使用者还可以计算被限制酶剪切的片段在胶片上分离的时间,只要用鼠标选取欲分析之片段,再按下就可以了(图7.10):图7.10 剪切限制酶的片段,进行片段的电泳分析 电泳图的颜色和线条可以进行编辑,用户只要在左边窗口(图7.11、7.12)中的文件夹按下鼠标右键或是点选选项进行编辑:图7.11 在文件夹按鼠标右键,以编辑电泳图的颜色或线条图7.12 设定电泳图的线条若内建数据库中没有用户欲分析的Marker,使用者可以在Local Database里面设定使用者自己的Marker(图7.13):图7.13 选取自己数据库的Marker 用户在Local Database的窗口(图7.14)中点选Gel Markers选项,就可以自行加入新的Marker档案,用户将Marker的数据设定好之后按下确定即可。
凝胶电泳及其应用ppt课件

按下式计算相对迁移率:
影响电泳速度的因素:
样品本身:带电量,分子大小,形状 电场强度:电压 缓冲液:成分, pH ,离子强度 支持介质:电渗作用,吸附作用 温度
SUCCESS
THANK YOU
2019/5/6
ddH2O 30%Acr Buffer
10%SDS 10%Ap TEMED
配胶
分离胶(10% 10ml) 浓缩胶(5% 10ml)
4.05ml
6.8ml
3.3ml
1.5mol/L pH=8.8 Tris-HCl 2.5ml
100µl
1.7ml
0.5mol/L pH=6.8 Tris-HCl 1.25ml
凝胶电泳及其应用
主要内容
1
凝胶电泳相关概念
2
凝胶电泳的原理
3
凝胶电泳的应用
4
聚丙烯酰胺凝胶电泳
2
凝胶电泳相关概念
凝胶:凝胶是胶体体系的一种存在形式,它是由胶体体系中分散相颗 粒相互联结,搭成具有三维结构的骨架后形成的,具有空间网状结构 体系,胶体体系中原有的分散介质(液体)充填在网状结构的空隙之 中。
凝胶电泳原理图
电泳过程中分子迁移的规律,小分子走在前头,大分子滞后。
凝胶电泳装置图
垂直式电泳装置
水平式电泳装置
影响凝胶电泳的因素
影响电泳速度的因素:
样品本身:带电量,分子大小,形状 电场强度:电压 缓冲液:成分, pH ,离子强度 支持介质:电渗作用,吸附作用 温度
电泳技术(共21张PPT)

优点:分辨率高,区带清晰、窄,加样部位自由,重现性好,可测定P或多肽的等电点。
蛋白:溴酚兰、氨黑10B、偶氮胭脂红B 根据要分离物质的相对分子质量选择合适的单体浓度。
机械强度好,透明有弹性,稳定,无吸附作用和电渗作用,可制成不同孔径的凝胶。
第4页,共21页。
2 滤纸的选择与处理 层析用滤纸,纸宽2~3cm/样品组分,长短影响电场强度。
3 点样
分1 电离泳胶::带小电孔粒径点子,在p圆H电8场.点中向(着与量其本少身电)荷相、反的点电极条移动状的过(程。一般),点中间(未知样品)、 点一边(已知样品) 点圆点(量少)、点条状(一般),点中间(未知样品)、点一边(已知样品)
凝胶(如聚丙烯酰胺凝胶) 4 操作要点
pH梯度支持介质的制备
聚焦电泳 检测 两性电解质载体的除去
第20页,共21页。
电泳技术思考题
1名词解释
电泳、电泳分离技术、泳动度、电渗、区带电泳、 相对迁移率、不连续凝胶电泳
2 影响泳动度的主要因素有哪些?
3 区带电泳的操作步骤一般有哪些?
4 如何制备聚丙烯酰胺凝胶?
CH2(NH2)COOH → (样品胶、浓缩胶pH6.7~6.8) →
CH2(NH2)COO-(0.1%~1.0%)泳动速度最慢(慢离子) 蛋白质(P)泳动速度介于快慢离子之间 电泳时, Cl -超过P走在最前面,其后形成一个离子浓度较
低的低电导区→较高电位梯度→P和慢离子加速移动→P 压缩成层
Aa:茚三酮、靛红
干法、湿法 分类:垂直管型盘状电泳、垂直板型电泳;
1 电泳:带电粒子在电场中向着与其本身电荷相反的电极移动的过程。
凝胶电泳中的胶片发黄的原因

凝胶电泳中的胶片发黄的原因我在实验室捣鼓凝胶电泳的时候,有一次就碰到了胶片发黄这烦心事。
那胶片本应该是透明的,就像清澈的小玻璃片一样,结果却变得黄不拉几的,像被太阳晒了很久的旧照片。
我就开始琢磨,这到底是咋回事呢?我想起之前有一次做化学实验,把一块白布放在有某些化学物质的环境里,过了一阵子,白布就变黄了。
我想这凝胶电泳胶片发黄会不会也是类似的情况呢?首先可能是缓冲液的问题。
缓冲液就像胶片的“洗澡水”,如果这“洗澡水”不干净或者成分不对,胶片就可能出问题。
我有一次可能是配缓冲液的时候,药品称量得不太准确,就像厨师做菜时盐放多了或少了一样。
这缓冲液里的某些成分一旦失衡,就可能和胶片发生一些奇怪的反应,导致胶片发黄。
就像两个人跳舞,如果舞步不协调,就会乱了套。
还有就是电泳的时间和电压。
这就好比是给胶片做“运动训练”。
有一回我着急看结果,把电压调得太高,电泳时间也过长,就像让一个运动员过度训练,累得气喘吁吁还受了伤。
胶片在过高的电压和过长时间的作用下,可能会因为发热或者受到一些异常的电刺激,从而发生变化,颜色就变黄了。
我当时看着那发黄的胶片,就像看到一个原本活力满满的小伙伴突然变得无精打采,心里别提多沮丧了。
另外,存放胶片的环境也很关键。
我把一些胶片放在一个靠近窗户的地方,阳光有时候会直接照到上面。
这阳光就像个调皮的小坏蛋,里面的紫外线等成分可能会对胶片进行“攻击”,慢慢地让胶片变色。
就像我们的皮肤在太阳下晒久了会变黑一样,胶片在不合适的光照环境下就会发黄。
我曾经有个塑料玩具,放在窗台太久,颜色就变得很奇怪,胶片也是这个道理。
而且,胶片本身的质量也不能忽视。
就像我们买东西,质量好的东西用起来就省心。
如果胶片在生产过程中就存在一些缺陷或者杂质,那在电泳过程中或者后续存放时,就更容易出现发黄的情况。
我有一批新到的胶片,一开始用就发现有几张发黄得厉害,后来才怀疑是不是这批胶片本身就有“先天不足”。
所以啊,凝胶电泳胶片发黄是多种因素共同作用的结果,就像一场小闹剧里有好几个演员在捣乱。
SDS_PAGE电泳技术分析蛋白质的研究

还要根据被分离样品的相对分子质量大小设计相 应的浓度的胶 ; PG - PAGE是按照凝胶孔径从上 至下不断减小的体系中 ,在电场力的推动下而移 动的不同大小的蛋白质分子会在不同位置明显受 阻而形成极窄的区带 ,从而提高分辨率 。
电泳是一种分离蛋白质和其他物质如核酸 、 嘌呤 、嘧啶 、一些有机化合物甚至无机离子的主要 方法或技术 。目前的电泳大多是在固定化的介质 中将样品放入流动相中进行分离 ,而不采用完全 自由态的溶液进行分离 。固体支持物的种类很 多 ,如纸 、乙酸纤维素 、硅胶 、氧化铝 、琼脂糖 、淀粉 及聚丙烯酰胺凝胶等 。特别是聚丙酰胺凝胶电 泳 ,由于它是一种多孔胶 ,其凝胶孔径与蛋白质分 子大小接近 ,提高了对蛋白质的分辨能力 。而且 聚丙烯酰胺凝胶质胶方便 ,代价低 ,机械强度 、化 学稳定性好 ,重复性强 ,对 pH 和温度变化稳定 , 非特异吸附和电渗多很小 ,凝胶透明 ,易于显色并 观察 。除此之外 ,聚丙烯酰胺凝胶电泳与下一步 的蛋白质提纯和蛋白质鉴定方法如免疫印迹 、质 谱鉴定等兼容性较好 ,因而使得聚丙烯酰胺凝胶 成为首选的蛋白质分离介质 [ 1 ] 。
按照待分离的蛋白质的分子质量不同 ,可选 择不同浓度的分离胶 。凝胶浓度与被分离蛋白质 分子量大小关系如表 1。
表 1 凝胶浓度的选择
适用凝胶 浓度 / %
20 ~30 15 ~20 10 ~15
样品分子质量 范围 /Da
生物化学技术__电泳_PPT教案
固定和谱带检测
固定:7%乙酸或12.5%三氯乙酸 谱带检测
染色法 荧光探针法 特殊试剂染色法
根据支持介质形状不同,可分为: •薄层电泳 •板电泳 •柱电泳
• 据用途不同,可分为: •分析电泳 •制备电泳 •定量电泳 •免疫电泳
第一节 电泳的基本原理
▪ 电泳是在电场作用下产生的物质运动。
在一定的电场强度下,带电颗粒(分子)在电 场中的迁移方式主要依据分子大小和形状、分 子所带电荷或分子的生物学与化学特性。
核黄素经光照后再被痕量氧氧产生自由基, 引发聚合反应。
丙烯酰胺聚合时常用的催化系统
引发剂
过硫酸铵 (AP)
加速剂 N,N,N′,N′-四甲基乙二胺 (TEMED)
3-二甲胺丙腈
3-二甲胺丙腈亚硫酸盐
应用范围 AP
酸性系统
核黄素
TEMED
碱性系统 (光聚合)
化学聚合与光聚合的比较
加样需注意
制备样品时,离子浓度不宜太高 蔗糖浓度小于20% 样品液中的沉淀和混浊需除去 阴离子系统用溴酚蓝作指示剂,负极在上;
阳离子系统用甲基绿或次甲基绿作指示剂, 正级在上。
一般操作
步骤:
摆好玻璃管 制备分离胶 预电泳:除去AP、未聚合丙烯酰胺、杂质 制备浓缩胶 加样 电泳:先低电流,样品进胶后,调至所需电流 取胶 固定和谱带检测 迁移率测定 谱带保存
微量TEMED的加入,可使过硫酸铵形成自由基,这些 自由基的产生可引发丙烯酰胺与甲叉双丙烯酰胺的聚合、 交联反应,形成有一定平均孔径的聚丙烯酰胺凝胶。
化学催化——酸性系统
引发剂:过硫酸铵(AP) 过氧化氢
加速剂:硫酸亚铁-抗坏血酸(Vc)
光聚合催化系统
引发剂:核黄素 加速剂:TEMED可以加速聚合
胶体电泳实验报告高中(3篇)
第1篇实验名称:胶体电泳实验目的:1. 理解胶体粒子在电场作用下的电泳现象。
2. 掌握电泳实验的基本操作步骤。
3. 加深对胶体电学性质的理解。
实验原理:胶体粒子由于表面吸附了带电的离子或分子,因此带电。
在外加电场的作用下,带电的胶体粒子会向着与其电荷相反的电极移动,这种现象称为电泳。
通过观察胶体粒子在电场中的移动,可以分析胶体的电学性质。
实验器材及药品:1. 实验器材:U形管、烧杯、玻璃棒、滴管、直流电源、电极、铁架台、Fe(OH)3胶体、NaCl溶液。
2. 药品:FeCl3饱和溶液、NaOH溶液。
实验步骤:1. 将FeCl3饱和溶液滴加到沸水中,继续煮沸至溶液呈红褐色,得到Fe(OH)3胶体。
2. 将Fe(OH)3胶体倒入U形管中,固定在铁架台上。
3. 在U形管两端分别插入电极,并连接直流电源。
4. 向U形管两端沿壁慢慢滴加NaCl溶液,使溶液在U形管中分层,形成清晰的液面。
5. 打开电源,观察胶体粒子在电场中的移动情况,并记录时间。
实验现象:1. 在外加电场的作用下,Fe(OH)3胶体粒子向阴极方向移动,使阴极附近的液面颜色逐渐变深。
2. 阳极附近的液面颜色逐渐变浅,甚至消失。
实验分析:1. Fe(OH)3胶体粒子带正电荷,在外加电场的作用下,向阴极方向移动。
2. NaCl溶液中的Na+和Cl-离子在电场作用下向相反方向移动,使胶体粒子周围的离子浓度发生变化。
3. 阴极附近的液面颜色变深,说明胶体粒子在阴极附近聚集。
4. 阳极附近的液面颜色变浅,甚至消失,说明胶体粒子在阳极附近聚集。
实验结论:1. 胶体粒子在外加电场的作用下会发生电泳现象。
2. 通过观察胶体粒子在电场中的移动,可以分析胶体的电学性质。
注意事项:1. 实验过程中,注意保持实验环境的清洁,避免污染胶体。
2. 实验过程中,注意观察胶体粒子的移动情况,及时记录实验数据。
3. 实验结束后,关闭电源,清洗实验器材。
讨论:1. 本实验通过观察Fe(OH)3胶体粒子的电泳现象,验证了胶体粒子带电的性质。
实验七血清脂蛋白琼脂糖凝胶电泳
实验七血清脂蛋白琼脂糖凝胶电泳实验七血清脂蛋白琼脂糖凝胶电泳一、实验目的1、进一步掌握电泳的基本原理及凝胶电泳的原理。
2、熟悉琼脂糖凝胶电泳的特点和操作要点。
3、掌握正常人血浆脂蛋白的分类。
二、实验原理琼脂糖凝胶是由交替排列组成的直链多糖。
固体支持物的影响较少,故电泳速度快、区带整齐。
而且由于琼脂糖不含带电荷的基团,电渗影响很小,是一种良好的电泳材料,分离效果较好。
血清中脂类物质均与载脂蛋白结合成水溶性脂蛋白形式存在,各种脂蛋白所含载脂蛋白的种类及数量不同,相差很大。
因此,以琼脂糖凝胶为支持物,在电场中可使各种脂蛋白颗粒分开。
将血清脂蛋白用脂类染料苏丹黑(或油红)进行预染。
再将预染过的血清置于琼脂糖凝胶板上进行分离,分成三条区带,从负极到正极依次为(最浅)及α脂蛋白(比前此法应用于高脂蛋白血症的分型。
三、器材和试剂1、器材:电泳仪、电泳槽、离心机、水浴锅、染色盘、微量注射D-半乳糖和3,6电泳时,因为凝胶中含水量大β脂蛋白略深) L-半乳糖的残基通过氢键因而不同脂蛋白颗粒大小可以看到脂蛋白被98%-99%β脂蛋白脱水(),通电后,β脂蛋白(最深)、前,在原点处应无乳糜微粒。
器、滤纸、镊子剪刀、2cm*8cm玻璃片 2、试剂⑴巴比妥缓冲液(PH8.6):称取巴比妥钠15.4g、巴比妥2.76g及 EDTA0.29g,加水溶解后,再加蒸馏水定容至1000ml(PH为8.6,离子强度0.075),作为电极缓冲液。
⑵苏丹黑染色液:将苏丹黑⑶凝胶缓冲液:称取三羟甲基甲烷(Nacl5.85g,用蒸馏水溶解后,稀释至⑷琼脂糖凝胶:称取琼脂糖50ml,在水浴中加热至沸,待琼脂糖完全溶解后,立即停止加热。
⑸新鲜血清(无溶血现象)四、操作步骤1、预染血清血清合后置于37℃水浴染色2、制备琼脂糖凝胶板波炉)中加热融化,用上,静置约半小时后凝固3、点加预染血清打孔器(在小玻璃片的两面固定两片小胶片)出,然后用胶片剥出长方小条凝胶。
电泳分析
♥ 电场作用下,毛细管柱中出现:
电泳现象和电渗流现象。
分离过程
♥ 带电粒子的迁移速度=电泳+电渗
流;两种速度的矢量和。
♥ 正离子:两种效应的运动方向一
致,在负极最先流出;
♥ 中性粒子无电泳现象,受电渗流
影响,在阳离子后流出;
♥ 阴离子:两种效应的运动方向相
反。
毛细管电泳的特点:
• 1.仪器简单、易自动化
他用丌同ph的溶液在u形管中测定了转化酶和过氧化氢酶的电1937年瑞典uppsala大学的tiselius对电泳仪器作了改迚创造了tiselius电泳仪建立了研究蛋白质的秱动界面电泳方法幵首次证明了血清是由白蛋白及球蛋白组成的由于tiselius在电泳技术方面做出的开拓性贡献而获得了1948年的诺贝尔化学奖
电源、毛细管、检测器、溶液瓶
• 2.分析速度快、分离效率高
在3.1min内分离36种无机及有机阴离子,4.1min内分离 了24种阳离子;分离柱效:105~107/m理论塔板数;
• 3.操作方便、消耗少
进样量极少,水介质中进行;
• 4.应用范围极广
有机物、无机物、生物、中性分子;生物大分子等; 分子生物学、医学、药学、化学、环境保护、材料等;
③聚丙烯酰胺凝胶电泳
聚丙烯酰胺凝胶电泳简称为PAGR( Pilyacrylamide gel eletrophoresis),是以聚丙烯酰胺凝胶作为支 持介质。聚丙烯酰胺凝胶是由单体的丙烯酰胺和甲叉 双丙烯酰胺聚合而成,这一聚合过程需要有自由基催 化完成。这种电泳方法成了分离蛋白质和核酸等大分 子物质的重要工具之一,目前已在科研、教学及生产 等方面广泛应用。
• 1937年瑞典Uppsala大学的Tiselius对电泳仪器作了改 进,创造了Tiselius电泳仪,建立了研究蛋白质的移动 界面电泳方法,并首次证明了血清是由白蛋白及球蛋 白组成的,由于Tiselius在电泳技术方面做出的开拓性 贡献而获得了1948年的诺贝尔化学奖。 • 1948年Wieland和Fischer重新发展了以滤纸作为支持 介质的电泳方法,对氨基酸的分离进行过研究。从本 世纪50年代起,特别是1950年Durrum用纸电泳进行 了各种蛋白质的分离以后,开创了利用各种固体物质 作为支持介质的区带电泳方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章 電泳膠片分析
Vector NTI可以將使用者的基因序列放在一個模擬的膠片中,並且模擬電泳
圖分析的結果。
點選選項後會出現下列視窗(圖7.1):
圖7.1 模擬電泳圖分析設定
此視窗中使用者可以設定電泳的條件,例如電泳片的大小、種類、電壓、緩衝液等;在左下角的View Parameters選項可以設定電泳運作的時間。
設定好之後按OK就可以進入以下畫面:
圖7.2 設定完電泳條件,會得到左邊視窗的樣子
右邊的視窗是使用者的電泳膠片,左邊的視窗會有詳細的文字敘述。
使用者
點選選項就可以選擇Marker(圖7.3):
圖7.3 選擇所要製作的膠片
按下OK後marker就可以加入右邊的膠片中(圖7.4):
圖7.4 加入膠片之後的結果,呈現在右邊視窗
接著加入使用者的樣品,只要點選選項即可:
圖7.5 加入使用者樣品
此設定視窗(圖7.5)和上一章所提到的RFLP設定完全相同,使用者只要選取資料庫中的基因序列及限制酶後,再按下Add to Gel就可以加入膠片中了:
圖7.6 加入斑馬魚海大基因膠片
此視窗(圖7.6)樣品和限制酶一樣可以複選,使用者可以針對不同的需求進行調整,要放入膠中的分析物只要按下Add to Gel,選取完所有的樣品後關閉此視窗就可以進行電泳分析,把游標移至電泳片上方:
圖7.7 加入樣品後的結果,電泳分析的結果
使用者可以見到上方有一個時間軸的按鈕,只要點最
右邊的按鈕就可以進行分析,時間旁邊的兩個按鈕可以手動控制電泳分析的時間:
圖7.8 控制電泳分析時間,分析不同的時間點
若要停止電泳分析只要在膠片上面在點一下滑鼠左鍵就可以了。
電泳分析的結果的儲存方式和主程式的儲存方式相同。
使用者打開左邊的資料夾後,會見到電泳分析的結果;右手邊膠片數字編號的部分,按下滑鼠右鍵後也可以見到電泳分析的結果(圖7.9):
圖7.9 打開左視窗的檔案,於右視窗得到電泳分析結果
使用者還可以計算被限制酶剪切的片段在膠片上分離的時間,只要用滑鼠選
取欲分析之片段,再按下就可以了(圖7.10):
圖7.10 剪切限制酶的片段,進行片段的電泳分析
電泳圖的顏色和線條可以進行編輯,使用者只要在左邊視窗(圖7.11、7.12)
中的資料夾按下滑鼠右鍵或是點選選項進行編輯:
圖7.11 在資料夾按滑鼠右鍵,以編輯電泳圖的顏色或線條
圖7.12 設定電泳圖的線條
若內建資料庫中沒有使用者欲分析的Marker,使用者可以在Local Database 裡面設定使用者自己的Marker(圖7.13):
圖7.13 選取自己資料庫的Marker
使用者在Local Database的視窗(圖7.14)中點選Gel Markers選項,就可以自行加入新的Marker檔案,使用者將Marker的資料設定好之後按下確定即可。
圖7.14 加入新的Marker檔案
如此一來就可以在電泳分析的功能中加入使用者自己的Marker。
除此之外,
使用者還可以利用內建的序列和限制酶建立屬於自己的Marker。
點選選項之
後如圖7.15所示:
圖7.15 使用內建的序列和限制酶,建立屬於自己的Marker
選擇序列資料和限制酶之後點選Save as Gel Marker即可儲存在Local Database中。
Add to Gel Sample List:這一項功能可以將使用者欲分析的電泳片段存取在一個程式內建的資料視窗,使用者可以利用此視窗進行快速存取,介面十分友
善。
使用者可以利用滑鼠選取欲分析之序列後,點選選項,接著在電泳的操
作視窗按下,結果如圖7.16:
圖7.16 使用Add to Gel Sample List,來進行快速存取
選取使用者欲加入電泳片的sample,再點選選項就可以加入膠片中(畫面(圖7.17)上膠片為選取第7個樣品):
圖7.17 選擇觀看電泳片中的某些樣品
使用者可以善用Add to Gel Sample List指令收集欲分析的sample後,再將資料匯入電泳片進行分析,如果不要此筆資料,按下就可以刪除;如
果想要把此資料當作Marker的話只要按下就會把該筆資料設定成為Marker(圖7.18)。
(和自己建立Marker的作法相同):
圖7.18 將選取的資料當作Marker
RFLP:上一章提到RFLP時,有個Create Gel的指令(圖7.19),點選後就會變成膠片電泳分析的操作畫面:
圖7.19 使用Create Gel,進行膠片電泳分析
藉由此操作模式,可以直接觀看電泳分析的結果,對於要經常分析RFLP 的使用者來說,是非常實用的功能。
