难溶电解质的溶解平衡知识点
第四节 难溶电解质的溶解平衡

解析:AgCl(s) Ag+(aq)+Cl-(aq),由于 c(Ag+)· -)=Ksp,溶液中c(Cl-)或c(Ag+)越 c(Cl 大,越能抑制AgCl的溶解,AgCl的溶解度就越小。 注意AgCl的溶解度大小只与溶液中Ag+或Cl-的 浓度有关,而与溶液体积无关。 ①c(Cl-)=0.01 mol· -1 ②c(Cl-)=0.04 mol· L L -1 ③c(Cl-)=0.03 mol· -1 L ④c(Cl-)=0 c(Ag+)=0 ⑤c(Ag+)=0.05 mol· -1 L Ag+或Cl-浓度由小到大的顺序为④<①<③<②< ⑤,故AgCl的溶解度由大到小的排列顺序为④> ①>③>②>⑤。 答案:B
PbS 3.4× 10-28
HgS 6.4× 10-33
ZnS 1.6× 10-24
6.3× 2.5× 10-18 10-13
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+ 杂质,最适宜向此工业废水中加入过量的( ) A.NaOH B.FeS C.Na2S
(1)pH=3时溶液中铜元素的主要存在形式是 ________。 (2)若要除去CuCl2溶液中的少量Fe3+,应该控制 溶液的pH( ) A.<1 B.4左右 C.>6 (3)在Ni(NO3)2溶液中含有少量的Co2+杂质, ________(填“能”或“不能”)通过调节溶液pH 的方法来除去,理由是__________________ (4)要使氢氧化铜沉淀溶解,除了加入酸之外,还 可以加入氨水生成[Cu(NH3)4]2+,写出反应的离 子方程式:_____________________________。 (5)已知一些难溶物的溶度积常数如下表。
第四节
难溶电解质的溶解平衡

难溶电解质的溶解平衡【知识要点】一、溶解平衡1. 不同电解质在中的溶解度差别很大。
在20℃时电解质的溶解性与溶解度的关系如下:2. 生成沉淀的离子反应之所以能发生,是因为_____________________ 。
3. 溶解平衡的建立:从固体溶解的角度来看,AgCl在水中存在两个过程:①在水分子的作用下,少量Ag+与Cl—脱离AgCl表面溶入水中,②溶液中的Ag+与Cl—受AgCl表面正、负离子的吸引,回到AgCl 表面析出沉淀。
在一定温度下,当沉淀溶液和生成的速率相等时,得到AgCl的饱和溶液,即建立下列平衡:AgCl(s)Ag+(aq)+ Cl—(aq)正是这种平衡的存在,决定了Ag+与Cl—的反应不能进行到底。
(1)定义:在一定条件下,难溶强电解质溶于水,当沉淀溶解的速率和沉淀生成的速率相等时,形成溶质的饱和溶液,达到平衡状态,这种平衡称为沉淀溶解平衡。
思考1. 将一块形状不规则的NaCl固体放入NaCl饱和溶液中,一昼夜后观察发现,固体变为规则的立方体,而质量却未发生变化,为什么?(2)特征:(与化学平衡相比较)①:可逆过程②:v(溶解)=v(沉淀)③:动态平衡,v(溶解)=v(沉淀)≠ 0④:达到平衡时,溶液中各离子浓度保持不变⑤:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
(3)生成难溶电解质的离子反应的限度化学上通常认为残留在溶液中的离子浓度小于,沉淀就达完全。
(4)影响沉淀溶解平衡的因素①内因:②外因:遵循原理浓度:加水,平衡向方向移动。
温度:绝大数难溶盐的溶解是吸热过程,升高温度,多数平衡向方向移动。
少数平衡向生成沉淀的方向移动,如Ca(OH)2的溶解平衡。
同离子效应:向平衡体系中加入相同的离子,使平衡向的方向移动。
例1. 将足量BaCO3分别加入:① 30mL 水②10mL 0.2mol/LNa2CO3溶液③50mL 0.01mol/L 氯化钡溶液④100mL 0.01mol/L盐酸中溶解至溶液饱和。
难溶电解质的溶解平衡

由 Ksp(Ag2CrO4) = c (Ag )· c(CrO ) , 得 c(Ag ) = -12 1.9 × 10 KspAg2CrO4 -1 -5 -1 = mol· L =4.36×10 mol· L , 2- 0.001 cCrO4 生成 AgCl 沉淀需 c(Ag+)小于生成 Ag2CrO4 沉淀时所需 c(Ag+),故 Cl-先沉淀。刚开始生成 Ag2CrO4 沉淀时,c(Cl-) -10 KspAgCl 1.8×10 = = L-1=4.13×10-6 mol· L-1。 + -5 mol· cAg 4.36×10
难溶电解质溶解平衡
知识点一、沉淀溶解平衡 1.概念 在 一定温度 下,当难溶强电解质溶于水形 成 饱和溶液时, 沉淀溶解 速率和 沉淀生成 速率
相等的状态。
2.沉淀溶解平衡常数——溶度积
(1)溶度积(Ksp):
在一定温度下,难溶电解质的饱和溶液中,离子 浓度 幂的乘积 。 (2)表达式: MmNn(s) 对于沉淀溶解平衡: mMn+(aq)+nNm-(aq),
⑥给溶液加热,溶液的 pH 升高 ⑦向溶液中加入 Na2CO3 溶液,其中固体质量增加 ⑧向溶液中加入少量 NaOH 固体,Ca(OH)2 固体质量不变 A.①⑦ B.①②⑦⑧ C.③④⑤⑦ D.①③⑦⑧
5、溶度积与溶解度的关系: Ksp(AgCl)=1.77×10-10 Ksp(AgBr)=5.35×10-13 Ksp(AgI)=8.51×10-17 溶解度(mol/L):AgCl>AgBr>AgI 结论:同类型的盐若Ksp越小,溶解度越小 不同类型的盐的Ksp不能直接作为溶解度大 小的比较依据。 Ksp(Ag2CO3)=8.45×10-12 溶解度:AgCl<Ag2CO3
难溶电解质的沉淀溶解平衡
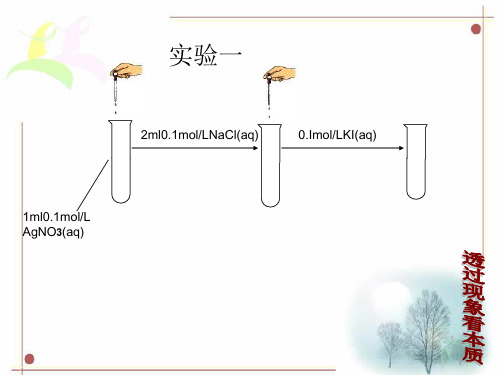
2ml0.1mol/LNaCl(aq)
0.Imol/LKI(aq)
1ml0.1mol/L AgNO3(aq)
一、 难溶电解质的溶解平衡
1、概念: 在一定条件下,当难溶电解质 v(溶解)= v (沉淀)时, 此时溶液中存在的溶解和沉淀间的动态平衡,称为沉 淀溶解平衡. 溶解平衡时的溶液是饱和溶液。
滴加0.5mol/L
Na2SO4(aq)
2C5a℃CO溶3解:1.度5 :×10-3g CaSO4:2.1 ×10-1g
注意:观察对比生成沉淀时Na2CO3(aq) 和Na2SO4(aq)的用量及实验现象。
水垢的主要成分:CaCO3、CaSO4、Mg(OH)2 如何除去水垢?
沉淀的溶解
实验三
CaCO3(S)
• 1、为什么医学上做胃部造影所服用的“钡餐”是 BaSO4而不是BaCO3?
• 2、为什么钙片的成分是CaCO3而不是CaSO4?
• 3、菠菜和豆腐为什么不宜同食?
• 4、如何预防肾结石[CaC2O4和Ca3(PO4)2]呢?
硬水的成分:是指含有较多Ca 、Mg 的水
——硬水的危害
1、全棉衣服或毛巾板结僵硬,多次洗涤后 颜色黯淡 。
2、洗澡后皮肤干燥、粗糙、发痒 。 3、热水器、增湿器、洗衣机等设备管路阻
塞、流量减小、寿命缩短 。
二、沉淀平衡的应用
沉淀的生成
实验二
滴加0.5mol/L
Na2CO3(aq)
CaCl2(aq) 0.5mol/L各1ml
①绝对不溶的电解质是没有的。
②同是难溶电解质,溶解度差别也很大。
b、外因:遵循平衡移动原理
①浓度: 加水,平衡向溶解的方向移动。 加入相同离子,平衡向沉淀方向移动。
难溶电解质的溶解平衡

难溶电解质的溶解平衡1.沉淀溶解平衡(1)概念在一定温度下,当难溶电解质溶于水形成饱和溶液时,沉淀溶解速率和沉淀生成速率相等的状态。
(2)溶解平衡的建立固体溶质溶解沉淀溶液中的溶质⎩⎪⎨⎪⎧v溶解大于v沉淀,固体溶解v溶解等于v沉淀,溶解平衡v溶解小于v沉淀,析出晶体(3)特点(4)表示AgCl在水溶液中的电离方程式为AgCl===Ag++Cl-。
AgCl的溶解平衡方程式为AgCl(s)Ag+(aq)+Cl-(aq)。
2.沉淀溶解平衡的影响因素(1)内因难溶电解质本身的性质。
溶度积(K sp)反映难溶电解质在水中的溶解能力。
对同类型的电解质而言,K sp数值越大,电解质在水中溶解度越大;K sp数值越小,难溶电解质的溶解度也越小。
(2)外因①浓度(K sp不变)a.加水稀释,平衡向溶解的方向移动;b.向平衡体系中加入难溶物相应的离子,平衡逆向移动;c.向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向溶解的方向移动。
②温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向溶解的方向移动,K sp 增大。
(3)实例 以AgCl (s )Ag +(aq )+Cl -(aq ) ΔH >0为例20 ℃时电解质在水中的溶解度与溶解性存在如下关系: (1)沉淀的生成 ①调节pH 法如除去CuCl 2溶液中的杂质FeCl 3,可以向溶液中加入CuO ,调节溶液的pH ,使Fe 3+形成Fe(OH)3沉淀而除去。
离子方程式为Fe 3++3H 2OFe(OH)3+3H +,CuO +2H+===Cu 2++H 2O 。
②沉淀剂法如用H 2S 沉淀Hg 2+的离子方程式为Hg 2++H 2S===HgS ↓+2H +。
(2)沉淀的溶解①酸溶解法:如CaCO 3溶于盐酸,离子方程式为CaCO 3+2H +===Ca 2++CO 2↑+H 2O 。
②盐溶解法:如Mg(OH)2溶于NH 4Cl 溶液,离子方程式为Mg(OH)2+2NH +4===Mg 2++2NH 3·H 2O 。
第四节 难溶电解质

(3)影响因素:KSP只与难溶电解质的 性质和温度有关
(4)应用:判断有无沉淀——溶度积规则 Q(离子积)= [c(Mn+)]m·[c(Am-)]n
Q>KSP时,溶液中有沉淀析出 Q=KSP时,沉淀与溶解处于平衡状态
Q<KSP时,溶液中无沉淀析出
二、沉淀溶解平衡的应用
(一)沉淀的生成
方法:1、调节pH法:
例:Ag2S(s) 2Ag+(aq)+S2-(aq) Ksp=c2(Ag+)·c(S2-)
(2)意义:
对于同类型(阴、阳离子个数相同)的难溶电解质, 在相同温度下,Ksp越大→S(溶解度)越大
例:Ksp(AgCl)=1.8×10-10 Ksp(AgBr)=6.3×10-15 说明S(AgCl)> S(AgBr)
除去NH4Cl中的FeCl3 溶于水,加NH3 H2O调节pH值在7-8
Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ 2、加沉淀法:
以Na2S、H2S做沉淀剂除去Cu2+和Hg2+
Cu2 S 2 CuS
Hg
2
S 2
HgS
Cu2 H2S CuS 2H Hg 2 H2S HgS 2H
(3)如果生成各种沉淀所需试剂离子的浓度相差较大, 就能实现分步沉淀,从而达到提纯、分离的目的。
3、常见转化:常用银盐溶解度的大小顺序
Ag2CrO4 ↓(砖红色)Cl AgCl↓(白) Br AgBr↓(浅黄色)
I AgI↓(黄色) S2 Ag2S↓(黑色)
4、应用:
(1)锅炉除水垢:CaSO4
注:(1)生成沉淀的离子反应不能进行到底(即离子浓度≠0), 一般情况下,当溶液中剩余离子的浓度小于1×10-5mol/L时,化学 上通常认为生成沉淀的反应就进行完全了
第四节难溶电解质的溶解平衡
C.c(Mg2+)为0.120 mol/L的溶液中要产生Mg(OH)2 沉淀,溶液的pH要控制在9以上
D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl) 变大
解 析 : A 选 项 , c(Ag + )·c(Ac - ) = 0.2/2×0.2/2 = 0.01>Ksp(CH3COOAg),所以一定能生成沉淀;B选项,由 Ksp(AgCl) 和 Ksp(Ag2CrO4) 可 知 , 溶 解 度 S(AgCl)<S(Ag2CrO4),应该先产生AgCl沉淀.C选项中, 根据Ksp[Mg(OH)2]=1.2×10-11 mol3·L-3=c(Mg2+)c2(OH- 1)=0.120×c2(OH-)可算出c(OH-)应大于10-5mol·L-1, 所以溶解的pH要控制在9以上.D选项,Ksp(AgCl)只与温 度有关.
答案:B
1.沉淀的生成 (1)条件:离子积(Qc)大于溶度积(Ksp). (2)应用 ① 分 离 离 子 : 同 一 类 型 的 难 溶 电 解 质 , 如 AgCl 、 AgBr、AgI,溶度积小的物质先析出,溶度积大的物质后 析出.
② 控 制 溶 液 的 pH 来 分 离 物 质 . 如 除 去 CuCl2 中 的 FeCl3 就 可 向 溶 液 中 加 入 CuO 或 Cu(OH)2 等 物 质 , 将 Fe3 + 转化为Fe(OH)3而除去.
(4)溶解平衡方程式的书写
①难溶电解质后标“ s ”,离子后标“ aq ”;
②不用“ === ”,用“
”.
3.溶度积常数
(1)定义:在一定条件下的难溶电解质饱和溶液中,存 在沉淀溶解平衡,其 平衡常数 即为溶度积常数或溶度
积,符号 Ksp .
(2)表达式:对于沉淀溶解平衡MmAn(s)
第十章第4节 难溶电解质的溶解平衡(共59张PPT)

(1)浓度:(Ksp不变) ①加水稀释,平衡向溶解的方向移动; ②向平衡体系中加入难溶物相应的离子,平衡 逆向移动; ③向平衡体系中加入可与体系中某些离子反应 生成更难溶或更难电离或气体的离子时,平衡 向溶解的方向移动。 (2)温度:绝大多数难溶盐的溶解是吸热过程, 升高温度,平衡向溶解的方向移动,Ksp增大。
1g
10g <S< S>
10 g
[特别提醒]
(1)沉淀溶解平衡是化学平衡的一种,沉淀溶解
平衡移动分析时也同样遵循勒夏特列原理。 (2)AgCl(s) 解平衡。 Ag+(aq)+Cl-(aq)表示 AgCl 在水溶液中的溶
[固本自测] 1. 有关AgCl沉淀的溶解平衡的说法中,不正确 的是( ) A.AgCl沉淀生成和沉淀溶解不断进行,但速 率相等 B.AgCl难溶于水,溶液中没有Ag+和Cl- C.升高温度,AgCl沉淀的溶解度增大 D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的 溶解度降低 答案:B 解析:所谓难溶于水,是指在水中溶解度很小,
[特别提醒] 复分解反应总是向着某些离子浓 度减小的方向进行,若生成难溶电解质,则向 着生成溶度积较小的难溶电解质的方向进行。
[固本自测] 2. 下列说法正确的是( ) A. 溶度积Ksp不仅与温度有关,还与溶液中相关 离子的浓度大小有关 B. 难溶电解质的溶度积Ksp越小,则它的溶解度 越小 C. 温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时, 此溶液为AgCl的饱和溶液 D. 将AgCl固体放入较浓的KI溶液中,AgCl不能 转化成AgI 答案:C
4.溶度积规则 某难溶电解质的溶液中任一情况下有关离子浓 度幂的乘积称为离子积,用Qc表示。 ①当Qc < Ksp时,溶液不饱和,无沉淀析出,需 加入该难溶电解质直至饱和; ②当Qc= Ksp时,溶液达饱和,沉淀与溶解处于 平衡状态; ③当Qc > Ksp时,溶液过饱和,有沉淀析出,直 至溶液饱和,达到新的平衡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
难溶电解质的溶解平衡一.固体物质的溶解度1.溶解度:在一定温度下,某固体物质在100g 溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
符号:S ,单位:g ,公式:S=(m 溶质/m 溶剂 )×100g2.不同物质在水中溶解度差别很大,从溶解度角度,可将物质进行如下分类:3.解度随温度的升高而减小。
二?沉淀溶解平衡 1.溶解平衡的建立讲固态物质溶于水中时,一方面,在水分子的作用下,分子或离子脱离固体表面进入水中,这一过程叫溶解过程;另一方面,溶液中的分子或离子又在未溶解的固体表面聚集成晶体,这一过程叫结晶过程。
当这两个相反过程速率相等时,物质的溶解达到最大限度,形成饱和溶液,达到溶解平衡状态。
溶质溶解的过程是一个可逆过程:⎪⎩⎪⎨⎧→<→=→>⇒⎭⎬⎫→→晶体析出溶解平衡固体溶解结晶溶液中的溶质溶解固体溶质结晶溶解结晶溶解结晶溶解v v v v v v2.沉淀溶解平衡绝对不溶解的物质是不存在的,任何难溶物质的溶解度都不为零。
以AgCl 为例:在一定温度下,当沉淀溶解和生成的速率相等时,便得到饱和溶液,即建立下列动态平衡:AgCl(s)Ag +(aq)+Cl -(aq)3.溶解平衡的特征1)动:动态平衡2)等:溶解和沉淀速率相等3)定:达到平衡,溶液中离子浓度保持不变4)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
三.沉淀溶解平衡常数——溶度积1)定义:在一定温度下,难溶性物质的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫溶度积常数。
2)表达式:即:AmBn(s)mA n+(aq)+nB m -(aq) Ksp =[A n+]m·[B m -]n例如:常温下沉淀溶解平衡:AgCl(s)Ag +(aq)+Cl -(aq),Ksp(AgCl)=[Ag +][Cl -] =×10-10常温下沉淀溶解平衡:Ag 2CrO 4(s)2Ag +(aq)+CrO 42-(aq),Ksp(Ag 2CrO 4)=[Ag +]2[CrO2- 4] =×10-123)意义:反应了物质在水中的溶解能力。
对于阴阳离子个数比相同的电解质,Ksp 数值越大,电解质在溶解 沉淀水中的溶解能力越强。
4)影响因素:与难溶电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关。
四.影响沉淀溶解平衡的因素1)内因:难溶电解质本身的性质2)外因:①浓度:加水稀释,沉淀溶解平衡向溶解的方向移动②温度:多数难溶性电解质溶解于水是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动。
③同离子效应:向沉淀溶解平衡体系中,加入相同的离子,使平衡向沉淀方向移动。
④其他:向体系中加入可与体系中某些离子反应生成更难溶或气体的离子,使平衡向溶解方向移动。
五.溶度积规则1、通过比较溶度积Ksp与溶液中有关离子的离子积Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解?对AgCl而言,其Qc=c(Ag+)·c(Cl-),该计算式中的离子浓度不一定是平衡浓度,而Ksp 计算式中的离子浓度一定是平衡浓度?1)若Qc>Ksp,则溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡?2)若Qc=Ksp,则溶液饱和,沉淀与溶解处于平衡状态?3)若Qc<Ksp,则溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和?2、溶度积K SP的性质(1)溶度积K SP的大小和平衡常数一样,它与难溶电解质的性质和温度有关,与浓度无关,离子浓度的改变可使溶解平衡发生移动,而不能改变溶度积K SP的大小。
(2)溶度积K SP反映了难溶电解质在水中的溶解能力的大小。
相同类型的难溶电解质的Ksp越小,溶解度越小,越难溶于水;反之Ksp越大,溶解度越大。
如:Ksp(AgCl)= ×10-10 ;Ksp(AgBr) = ×10-13;Ksp(AgI) = ×10-17.因为:Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI),所以溶解度:AgCl) > Ksp (AgBr) > Ksp (AgI)。
不同类型的难溶电解质,不能简单地根据Ksp大小,判断难溶电解质溶解度的大小。
3、、溶度积的应用①通过比较溶度积与溶液中有关离子浓度幂的乘积——浓度积(Q c)的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解。
Q c>K sp,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡;Q c=K sp,溶液饱和,沉淀与溶解处于平衡状态;Q c<K sp,溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。
②难溶电解质的组成类型相同时,K sp越大,其溶解能力越大,反之,越小。
以上规则称为溶度积规则。
沉淀的生成和溶解这两个相反的过程它们相互转化的条件是离子浓度的大小,控制离子浓度的大小,可以使反应向所需要的方向转化。
六、沉淀反应的应用1、沉淀的生成方法:(1)调节pH法:如工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可使Fe3+转变为Fe(OH)3沉淀而除去。
反应如下:Fe3++3NH3·H2O===Fe(OH)3↓+3NH+4。
(2)加沉淀剂法:如以Na2S、H2S等作沉淀剂,使某些金属离子如Cu2+、Hg2+等生成极难溶的硫化物CuS、HgS等沉淀,也是分离、除去杂质常用的方法。
反应如下:Cu2++S2-===CuS↓。
Cu2++H2S===CuS↓+2H+。
Hg2++S2-===HgS↓。
Hg2++H2S===HgS↓+2H+。
应用:提纯、废水处理等,目的是利用沉淀去除或者分离某种离子2.沉淀的溶解(1)沉淀溶解的原理根据平衡移动,对于在水中难溶的电解质,如果能设法不断地移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。
(2)溶解沉淀的化学方法Ⅰ.酸碱溶解法注意:用酸溶解含金属离子的难溶物时,所选用酸的酸根与金属离子不反应?如:使CaCO3沉淀溶解,可以加入盐酸降低 CO32-的浓度,使平衡向溶解的方向移动?Ⅱ.氧化还原溶解法原理是通过氧化还原反应使难溶物的离子浓度降低,使平衡向右移动而溶解?此法适用于具有明显氧化性或还原性的难溶物,如不溶于盐酸的硫化物Ag2S溶于HNO3就是一个例子:3Ag2S+8HNO3 ===6AgNO3+3S↓+2NO↑+4H2OⅢ.配位溶解法生成络合物使沉淀溶解法,如溶解AgCl可以加入氨水以生成Ag(NH3)2+而使其溶解?Ⅳ.沉淀转化溶解法本法是将难溶物转化为能用上述两种方法之一溶解的沉淀,然后再溶解?例如BaSO4中加入饱和Na2CO3溶液使BaSO4转化为BaCO3,再将BaCO3溶于盐酸?3、沉淀的转化沉淀转化的实质是溶解平衡的移动,一般来说,溶解度小的沉淀转化成溶解度更小的沉淀比较容易(转化成更难溶的物质)。
这两种难溶物的溶解能力差别越大,这种转化的趋势就越大?如:在ZnS的溶解平衡体系中加入CuSO4溶液,可以使其转化为更难溶的CuS沉淀,这说明溶解度ZnS>CuS?转化的方程式可以表示为ZnS(s)+Cu2+(aq)===CuS(s)+Zn2+(aq)?对于一些用酸或其他方法不能溶解的沉淀,可以将其转化成另一种用酸或其它方法能溶解的沉淀,然后出去。
例如锅炉除水垢例、许多在水溶液中的反应,往往有易溶物转化为难溶物或难溶物转化为更难溶物的现象?下表为相同(1)若在有氯化银固体的水中加入硫化钠溶液,可能观察到的现象是______白色固体消失,同时会生成黑色固体__________________________?(2)生成硫酸铵化肥的方法之一是把石膏粉(CaSO4)悬浮于水中,不断通入氨气并通入二氧化碳,充分反应后立即过滤,滤液经蒸发而得到硫酸铵晶体,写出该反应的化学方程式:CaSO4+CO2+H2O+2NH3===CaCO3↓+(NH4)2SO4_?一.考查沉淀溶解平衡中溶质浓度的计算例3:已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =×10-10Ksp(Ag2CrO4)=[Ag+]2[CrO2- 4] =×10-12试求:(1)此温度下AgCl 饱和溶液和Ag 2CrO 4饱和溶液的物质的量浓度,并比较两者的大小。
(2)此温度下,在·L -1的AgNO 3溶液中,AgCl 与Ag 2CrO 4分别能达到的最大物质的量浓度,并比较两者的大小。
解析①AgCl(s)Ag +(aq)+Cl -(aq)1510sp L mol 103.1108.1)AgCl (K )AgCl (c ---⋅⨯=⨯==Ag 2CrO 4(s)2Ag +(aq)+CrO 42-(aq)2x x(2x)2·x=Ksp1531234242105.64101.14)()(---⋅⨯=⨯==L mol CrO Ag K CrO Ag c sp∴ c(AgCl)<c(Ag2CrO4)②在 mol ·L -1 AgNO 3溶液中,c(Ag+)= mol ·L -1AgCl(s) Ag +(aq) + Cl -(aq) 溶解平衡时: +x x+x)·x =×10-10∵ x 很小,∴ +x ≈x =×10-8(mol ·L -1)c(AgCl)= ×10-8(mol ·L -1)Ag 2CrO 4(s) 2Ag +(aq) + CrO2-4(aq) 溶解平衡时: +x x+2x)2·x =×10-12∵ x 很小,∴ +2x ≈x =×10-8(mol ·L -1) ∴ c(Ag 2CrO 4)=×10-8 (mol ·L -1) ∴ c(AgCl)>c(Ag 2CrO 4)二. 考查沉淀溶解平衡中的溶度积规则例4.将等体积的4×10-3mo1·L -1的AgNO 3和4×10-3mo1·L –1K 2CrO 4混合,有无Ag 2CrO 4沉淀产生 已知K SP(Ag 2CrO 4)=×10-12。
解:等体积混合后,浓度为原来的一半。
c(Ag +)=2×10-3mol·L -1;c(CrO 4 2-)=2×10-3mol ·L -1Q i =c 2(Ag +)·c(CrO 4 2 -)=(2×l0-3 )2×2×l0-3=8×l0-9>K ?SP (CrO 4-2) 所以有沉淀析出【练习】在LKCl 溶液中,加入LAgNO 3溶液,下列说法正确的是 (AgCl 的Ksp =×10-10) ( )A .有AgCl 沉淀析出B .无AgCl 沉淀C .无法确定D .有沉淀,但不是AgCl三. 考查沉淀溶解平衡中的同离子效应例5.将足量BaCO 3分别加入:① 30mL 水 ②10mL LNa 2CO 3溶液 ③50mL L 氯化钡溶液 ④100mL L 盐酸中溶解至溶液饱和。
