实验二+蛋白质及氨基酸的显色反应
《生物化学》实验讲义

实验一蛋白质及氨基酸的颜色反应一、目的意义1、学习几种鉴定氨基酸与蛋白质的一般方法及其原理。
2、学习和了解一些鉴定蛋白质的特殊颜色反应及其原理。
二、实验原理1、双缩脲反应当尿素加热到180℃左右时,2分子尿素发生缩合放出1分子氨而形成双缩脲.双缩脲在碱性溶液中与铜离子结合生成复杂的紫红色化合物,这一呈色反应称为双缩脲反应。
蛋白质分子中含有多个与双缩脲相似的键,因此也具有双缩脲的颜色反应.借此可以鉴定蛋白质的存在或测定其含量。
应当指出,双缩脲反应并非蛋白质的特异颜色反应,因为凡含有肽键的物质并不都是蛋白质.2、茚三酮反应蛋白质与茚三酮共热,产生蓝紫色化合物,此反应为一切蛋白质及α-氨基酸(除脯氨酸和羟脯氨酸)所共有。
含有氨基酸的其他化合物也呈此反应.该反应十分灵敏,1:1500000浓度的氨基酸水溶液就能呈现反应。
因此,此反应广泛用于氨基酸的定量测定.3、黄色反应含有苯环侧链的(特别是含酪氨酸)蛋白质溶液与硝酸共热时,呈黄色(硝基化合物),再加碱则变为橙黄色,此反应也称为黄蛋白反应。
OH+HNO3HO NO2+H2OHO NO2+O NOH三、仪器与试剂1、试剂(1) 蛋白质溶液:取10mL鸡蛋清,用蒸馏水稀释至100mL,搅拌均匀后用纱布过滤得上清液。
(2) 0。
3%色氨酸溶液、0。
3%酪氨酸溶液、0。
3%脯氨酸溶液、0。
5%甘氨酸溶液、0.5%苯酚溶液。
(3) 0.1%茚三酮-乙醇溶液:称取0。
1g茚三酮,溶于100mL 95%乙醇。
(4) 10%NaOH溶液、1%硫酸铜溶液、尿素、浓硝酸.2、仪器:试管及试管夹、酒精灯。
四、操作方法1、双缩脲反应(1) 取一支干燥试管,加入少量尿素,用微火加热使之熔化,待熔化的尿素开始变硬时停止加热。
此时,尿素已缩合为双缩脲并放出氨气(可由气味辨别).待试管冷却,加入约1mL10%NaOH溶液,振荡使其溶解,再加入1滴1%硫酸铜溶液。
混匀后观察出现的粉红色. (2)另取1支试管,加入1mL蛋白质溶液,再加入2mL 10%NaOH溶液摇匀,然后再加入2滴1%的硫酸铜溶液。
生物化学实验指导实验一蛋白质的性质实验(一)(呈色反应)一、目的1
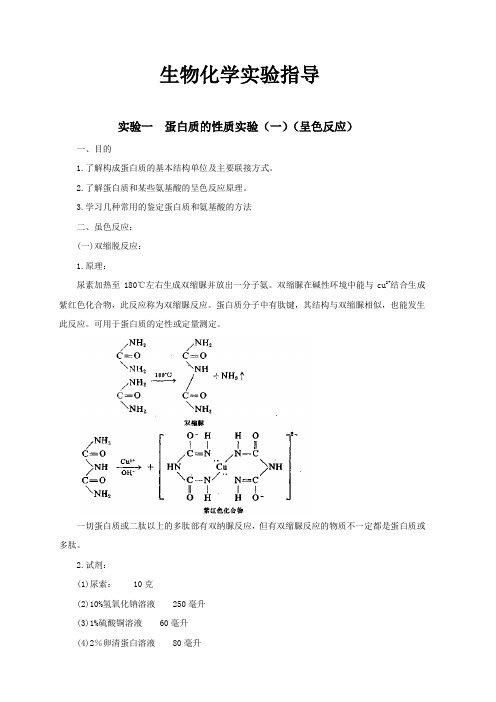
生物化学实验指导实验一蛋白质的性质实验(一)(呈色反应)一、目的1.了解构成蛋白质的基本结构单位及主要联接方式。
2.了解蛋白质和某些氨基酸的呈色反应原理。
3.学习几种常用的鉴定蛋白质和氨基酸的方法二、虽色反应:(一)双缩脱反应:1.原理:尿素加热至180℃左右生成双缩脲并放出一分子氨。
双缩脲在碱性环境中能与cu2+结合生成紫红色化合物,此反应称为双缩脲反应。
蛋白质分子中有肽键,其结构与双缩脲相似,也能发生此反应。
可用于蛋白质的定性或定量测定。
一切蛋白质或二肽以上的多肽部有双纳脲反应,但有双缩脲反应的物质不一定都是蛋白质或多肽。
2.试剂:(1)尿索: 10克(2)10%氢氧化钠溶液 250毫升(3)1%硫酸铜溶液 60毫升(4)2%卵清蛋白溶液 80毫升3.操作方法:取少量尿素结晶,放在干燥试管中。
用微火加热使尿素熔化。
熔化的尿素开始硬化时,停止加热,尿素放出氨,形成双缩脲。
冷后,加10%氢氧化钠溶液约1毫升,振荡混匀,再加1%硫酸铜溶液1滴,再振荡。
观察出现的粉红颜色。
避免添加过量硫酸铜,否则,生成的蓝色氢氧化铜能掩盖粉红色。
向另一试管加卵清蛋白溶液约l毫升和10%氢氧化钠溶液约2毫升,摇匀,再加1%硫酸铜溶液2滴,随加随摇,观察紫玫色的出现。
(二)茚三酮反应1.原理:除脯氨酸、羟脯氨酸和茚三酮反应产生黄色物质外,所有α—氨基酸及一切蛋白质都能和茚三酮反应生成蓝紫色物质。
该反应十分灵敏,1:1 500 000浓度的氨基酸水溶液即能给出反应,是一种常用的氨基酸定量测定方法。
茚三酮反应分为两步,第一步是氨基酸被氧化形成CO2、NH3和醛,水合茚三酮被还原成还原型茚三酮;第二步是所形成的还原型茚三酮同另一个水合茚三酮分于和氨缩合生成有色物质。
反应机理如下:此反应的适宜pH为5—7,同一浓度的蛋白质或氨基酸在不同pH条件下的颜色深浅不同,酸度过大时甚至不显色。
2.试剂:(1)蛋白质溶液 100毫升2%卵清蛋白或新鲜鸡蛋清溶液(蛋清:水=1:9)(2)0.5%甘氨酸溶液 80毫升(3)0.1%茚三酮水溶液 50毫升(4)0.1%茚三酮—乙醇溶液 20毫升3.操作方法:(1)取2支试管分别加入蛋白质溶液和甘氨酸溶液1毫升,再各加0.5毫升0.1%茚三酮水溶液,混匀,在沸水浴中加热1—2分钟,观察颜色由粉色变紫红色再变蓝。
大学生物化学实验

生物化学实验安排实验一蛋白质及氨基酸的呈色反应一、实验目的1、了解构成蛋白质的基本结构单位及主要联接方式2、了解蛋白质和某些氨基酸的呈色反应原理3、学习几种常用的鉴定蛋白质和氨基酸的方法二、实验原理1. 双缩脲反应(biuret reaction)蛋白质和多肽分子中肽键在稀碱溶液中与硫酸铜共热,呈现紫色或红色,此反应称为双缩脲反应,双缩脲反应可用来检测蛋白质水解程度。
2. 茚三酮反应(ninhydrin reaction)蛋白质经水解后产生的氨基酸也可发生茚三酮反应。
3.苯环的黄色反应Tyr+ 浓硝酸黄色TrpPhe+少量浓硫酸+浓硝酸黄色4. 乙醛酸的反应:检测Trp或含Trp蛋白质的反应。
当Trp与乙醛酸和浓硫酸在试管中滴加时,产生分层现象,界面出现紫色环。
主要是由于蛋白质中的吲哚环作用。
5. 偶氮反应偶氮化合物都含有-N=N-这样结构,通常作为染料。
6. 醋酸铅反应()↓--→+--+Pb COO NH Pb COOH N H 2222Pr Pr三、实验步骤1. 双缩脲反应(biuret reaction)取1支试管,加乳蛋白溶液(蛋清:水= 1:9)约1ml 和10%NaOH 约2ml ,摇匀,再加1%CuSO4溶液2滴,随加随摇。
观察现象,记录。
2. 茚三酮反应(ninhydrin reaction)(1)取2支试管分别加入蛋白质溶液(蛋清:水= 1:9)和甘氨酸溶液1ml ,再各加0.5ml0.1%茚三酮,混匀,沸水浴中加热1-2分钟,观察颜色是否由粉红色变紫红色再变蓝色。
(2)在一块小滤纸上滴1滴0.5%的甘氨酸溶液,风干后再在原处滴1滴0.1%茚三酮乙醇溶液,在微火旁烘干显色,观察是否有紫红色斑点的出现。
3. 苯环的黄色反应向6个试管中按下表加试剂,观察现象并记录。
鸡蛋清溶液(蛋清:水= 1:9)4. 乙醛酸的反应:向3个试管中按下表加试剂,观察现象并记录。
蛋白质溶液(蛋清:水= 1:20)5. 偶氮反应向3个试管中按下表加试剂,观察现象并记录。
氨基酸显色反应茚三酮反应.ppt

氨基酸显色反应---茚三酮反应
茚三酮ቤተ መጻሕፍቲ ባይዱ应
实验原理
除脯氨酸、羟脯氨酸和茚三酮反应产生黄色物质外,所有α—氨基酸及一切蛋白质 都能和茚三酮反应生成蓝紫色物质。 该反应十分灵敏,1:1 500 000浓度的氨基酸水溶液即能给出反应,是一种常用 的氨基酸定量测定方法。 茚三酮反应分为两步,第一步是氨基酸被氧化形成CO2、NH3和醛,水合茚三酮 被还原成还原型茚三酮;第二步是所形成的还原型茚三酮同另一个水合茚三酮分 于和氨缩合生成有色物质。
实验器材及试剂
器材: 试管、酒精灯、试管夹、试管架 试剂: (1)蛋白质溶液:2%卵清蛋白或新鲜鸡蛋清溶液(蛋清:水=1:9) (2)0.5%甘氨酸溶液 (3)0.1%茚三酮水溶液 (4)0.1%茚三酮—乙醇溶液
实验步骤
(1)取2支试管分别加入蛋白质溶液和甘氨酸溶液1毫升,再各加0.5毫升0.1%茚 三酮水溶液,混匀,在沸水浴中加热1—2分钟,观察颜色由粉色变紫红色再变蓝。 (2)在一小块滤纸上滴一滴0.5%的甘氨酸溶液,风干后,再在原处滴上一滴0.1% 的茚三酮乙醇溶液在微火旁烘干显色,观察紫红色斑点的出现。
生物化学实验

本科生实验报告实验课程学院名称专业名称学生姓名学生学号指导教师实验地点实验成绩二〇一五年月二〇一五年月实验一氨基酸的分离鉴定----纸层析法一、实验目的通过氨基酸的分离,学习纸层析法的基本原理及实验方法。
二、实验原理纸层析法是用滤纸作为惰性支持物的分配层析法。
滤纸纤维上的羟基具有亲水性,因此吸附一层水作为固定相,而通常把有机溶剂作为流动相。
纸层析法是根据不同氨基酸在两相间的分配比不同而进行分离的:在固定相分配的比例大的氨基酸,随流动相移动的速度慢,而在流动相分配的比例大的则随流动相流动的速度快。
层析溶剂由有机溶剂和谁组成。
物质被分离后用比移值(Rf值)来衡量各组分的分离情况,如图所示。
根据图得到:Rf=a\b其中:a为原点到层析点中心的距离(cm),b为原点到溶剂前沿的距离(cm)。
在一定的条件下某种物质的Rf值是常数。
Rf值最大等于1,即该组分随溶剂一起上升,Rf值最小等于0,即该组分基本上留在原点不动。
Rf值的大小与物质的结构、性质、溶剂系统、层析滤纸的质量和温度等因素有关。
本实验利用纸层析法分离氨基酸。
三、实验药品、实验器材1.扩展剂:将20mL正丁醇和5mL冰醋酸放入分液漏斗中,与15mL水混合,充分震荡,静置数分层后,放出下层水相。
取分液漏斗内的扩展剂约5mL置于小烧杯中作为平衡溶剂,其余的倒入杯中备用。
2.氨基酸溶液:赖氨酸、脯氨酸、缬氨酸、苯丙氨酸、亮氨酸溶液及它们的混合液(各组分浓度均为0.5%),各5mL。
3.显色剂:0.1%水合茚三酮正丁醇溶液。
4.层析缸:毛细管,喷雾剂,培养皿,层析滤纸,分液漏斗,针,线。
四、实验方法1.将盛有平衡溶剂的小烧杯置于密闭的层析缸中,使展开剂达到饱和。
2.取层析滤纸(长22cm,宽14cm)一张。
在纸的一端距边缘2cm处用铅笔画一条直线,在此直线上每间隔2cm作一记号。
3.点样:用毛细管将氨基酸样品分别点在这6个位置上,吹干后再点一次。
注意没点再纸上扩散的直径最大不超过3mm。
最新实验一 蛋白质及氨基酸的显色反应(验证)

操作步骤:
一、取一支试管加4滴0.5%苯酚溶液,再加浓 硝酸2滴,观察黄色出现,冷却后逐滴加入10% 氢氧化钠溶液,观察颜色转变为橙色。
紫红色铜双缩脲复合物分子结构为:
蛋白质和多肽都有双缩脲反应,但有双缩 脲反应的物质不一定都是蛋白质或多肽。此反 应所产生颜色的深浅与蛋白质的浓度成正比, 而与蛋白质分子量及氨基酸成分无关。
操作步骤
一、取少量尿素结晶,放入干燥试管中,用微火 加热使尿素熔化。熔化的尿素开始硬化时,停 止加热,尿素放出氨,形成双缩脲。冷却后, 加10%NaOH溶液约1mL,振荡混匀,再加入 1%CuSO4溶液1滴,振荡之。观察出现的粉红颜 色。避免添加过量硫酸铜,生成的蓝色氢氧化 铜能掩盖粉红色。
二、在一小片滤纸上滴上一滴0.5%的甘氨酸 溶液,风干后,再在原处滴0.1%的茚三酮 乙醇溶液一滴,在微火旁烘干显色,观察 紫红色斑点的出现。
Ⅲ、黄色反应 (Xanthoproteic reaction)
原理
凡是含有苯环的化合物都能与浓硝酸作用 产生黄色的硝基苯衍生物。该化合物在碱性 溶液中进一步转化成深橙色的硝醌酸钠。
管号
1
0
0.3% 蛋白质 20% α -萘 NaClO 现象
精氨 溶液 NaOH 酚
记录
酸
0
5
5
3
6
2
0
5
0
5
3
6
3
5
0
0
5
3
6
Ⅴ、乙醛酸反应 (AdamkiewicaHopkins-Cole reaction)
生物化学实验

2008—2009 学年度第 一 学期
开课单位 课程名称 授课班级 任课教师
水产学院 生物化学实验 养殖 0713 韩芳
试验一蛋白质显色反应和氨基酸纸层析
(一) 蛋白质的显色反应
一、 目的要求: 1、 理解蛋白质具有双缩脲反应。 2、 理解蛋白质和α--氨基酸均能与茚三酮作用产生有色化合物。 3、 了解氨基酸、蛋白质的某些侧链功能基团能发生黄色反应、米伦氏反应
二、教学方法和教学学时: 1、教学方法:学生操作实验,教师指导。 2、教学学时:4 学时。
三、实验内容: 以桔络、作实验样品,用 10 倍量的 1%盐酸抽提(研磨),制得 50ml 抽
提液;用 1%盐酸作空白液。脉动和鲜橙多饮料,离心后的6—二氯酚靛酚滴定法测定该抽提液或样品液中 VC 的含量。
六、思考题
1.常用蛋白质的提取方法有哪些?各有何优缺点?
2.考马斯亮蓝 G-250 法测定蛋白质含量的原理是什么?还有哪些蛋白质定
量法?
3.如何正确使用分光光度计?
七、作业:完成实验报告。
实验四 还原糖和总糖含量的测定(3,5-二硝基水杨酸比色法)
一、目的要求:
1、掌握用硝基水杨酸比色法测定样品中总糖和还原糖含量。
(1)标准曲线的制作
取 6 支具塞试管,编号后,按下表加入试剂。
管号
12345 6
蛋白质标准液(ml)
0 0.2 0.4 0.6 0.8 1.0
蒸馏水(ml)
1.0 0.8 0.6 0.4 0.2 0
考马斯亮蓝 G-250 试剂(ml)
55555 5
蛋白质含量(μg)
0 20 40 60 80 100
(二) 氨基酸的纸层析法分离
生物化学实验一蛋白质和氨基酸的呈色反应

实验一 蛋白质和氨基酸的呈色反应一、目的要求验证蛋白质特性;学习和掌握蛋白质呈色反应的原理和方法;学习几种常用的鉴定蛋白质和氨基酸的方法。
二、实验原理蛋白质中的某些化学键或氨基酸残基中的某些化学基团可以与某些特殊试剂形成特定的有色物质。
这些反应称为蛋白质的呈色反应。
各种蛋白质的氨基酸残基不完全相同。
因此,呈色反应产物的颜色也不完全一样。
呈色反应不是蛋白质所特有,一些非蛋白物质也能呈现类似的呈色反应。
因此,不能仅以呈色反应结果来判别被测物质是否为蛋白质。
三、呈色反应双缩脲反应1.原理两分子尿素经加热至180°C 后可以缩合成一分子双缩脲,并放出一分子氨。
双缩脲在碱性溶液中与铜离子结合生成紫红色络合物,此反应称为双缩脲反应。
多肽及所有蛋白质均具有肽键,与双缩脲分子中亚酰胺键结构相同,也能发生此反应,因此,蛋白质在碱性溶液中与铜离子也能呈现出类似于双缩脲的颜色反应。
2.器材与试剂1)器材试管、药匙、电炉、试管夹、滴管。
2)试剂〈1〉蛋白质溶液(10%卵清蛋白溶液):吸取鸡蛋清溶液10ml ,加蒸馏水稀释,定容至100ml 。
〈2〉10%氢氧化钠溶液。
〈3〉1%硫酸铜(CuSO4)溶液。
〈4〉0.1%甘氨酸(Gly)溶液:称0.1g 甘氨酸溶于蒸馏水中,稀释至100ml 。
〈5〉结晶尿素。
3.实验步骤双缩脲反应实验1234尿素+加热后的尿素+蛋白质溶液/滴30.1%Gly/滴310%NaOH/滴55551%CuSO 4/滴1111显色现象试管试剂/滴(1)制备双缩脲:取结晶尿素少许(约火柴头大小),放入干燥的小试管中。
微火加热至尿素熔解至硬化,刚硬化时立即停止加热,尿素放出氨,此时双缩脲即已形成。
冷却后作为双缩脲样品(1号管)。
(2)另取3支试管,与1号管一起按表加样,混匀,观察各管颜色变化,记录结果并解释现象。
茚三酮反应1.原理蛋白质或氨基酸在弱碱性条件下,其上的氨基与茚三酮共热可产生蓝紫色缩合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7.浓硝酸和浓硫酸(A.R.) 8.0.1%茚三酮水溶液 9.0.3%精氨酸、0.3%组氨酸、0.5%甘氨酸 10.纯鸡蛋清 11.1%α-萘酚乙醇溶液,临用时配制 12.冰乙酸 13.次氯酸钠溶液 14.Ehrlich氏重氮试剂: 溶液 A:溶解5g亚硝酸钠于1 000mL水中。 溶液 B:溶解5g对氨基苯磺酸于1 000mL水中。 溶解后,再加入5mL浓硫酸。 A、B溶液分别保存于密闭瓶内。需用时,以1:1 的比例混合。
偶氮反应
试剂 (滴) 管号 0.3% % 组氨酸 (滴) 鸡蛋清 (滴) 偶氮试 剂 20% % NaOH溶 溶 液 现象记 录
1
4
8
2
2
4
8
2
反应名称 1、双缩脲反应 、
反应基团 肽键
反应产物及现 象 Cu–Cu—双缩 双缩 脲络合物( 脲络合物(兰 紫色) 紫色) 兰紫色 黄色硝醌酸生 成 玫瑰红色产物 生成 中间生成兰紫 色环 有橙色和鲜红 色产物生成
2
0
5
0
5
3
6
3
5
0
0
5
3
6
Ⅴ、乙醛酸反应 (Adamkiewica-HopkinsCole reaction)
原理 在浓硫酸存在下,色氨酸与乙醛酸反应生 成紫色物质,色氨酸在浓硫酸中与一些醛类 反应也形成有色物质。很多人用含有少量醛 杂质的冰醋酸或芳香醛等进行此反应。硝酸 根、亚硝酸根、氯酸根及过多的氯离子均能 妨碍此反应,有微量硫酸铜或 Fe3+ 离子存 在时,可以加强色氨酸的阳性反应。
Ⅲ、黄色反应 (Xanthoproteic reaction)
原理 凡是含有苯环的化合物都能与浓硝酸作用产 生黄色的硝基苯衍生物。该化合物在碱性溶液 中进一步转化成深橙色的硝醌酸钠。 在蛋白质分子中酪氨酸和色氨酸残基易发生 上述反应,而苯丙氨酸不易硝化,需加少量浓 硫酸催化才能呈明显的正反应。皮肤、指甲、 头发等遇浓硝酸变黄即为这一反应的结果。
Ⅳ、坂口反应 (Sakaguchi reaction)
生成的氨被次溴酸钠或次氯酸钠氧化生成氮。 该反应中过量的次溴酸钠或次氯酸钠是不利的,因 其能进一步缓慢氧化,使产物破裂分解,引起颜色 消失。但加入适量尿素可破坏过量的次溴酸钠。酪 氨酸、色氨酸和组氨酸也能降低产生颜色的强度。 甚至会阻止颜色的生成。 该反应灵敏度达 1:250 000。因此常用于定量 测定精氨酸的含量和定性鉴定含有精氨酸的蛋白质。
α-氨基酸 氨基酸 苯环、Trp、 苯环、 、 Tyr 胍基 吲哚环 酚核、 酚核、咪唑基
试剂和器材
一、试剂 1.蛋白质溶液:取5mL蛋清,用蒸馏水稀释至 100mL,搅拌均匀后,用纱布过滤。 2.0.1%茚三酮乙醇溶液:称取0.1g茚三酮,溶于 2.0.1% 0.1g 100mL95%乙醇。临用前配制。 3.尿素粉末 4.1%硫酸铜溶液 5.10%氢氧化钠溶液和20%氢氧化钠溶液 6.0.5%苯酚溶液
黄色反应
管号 材料 量 ( 滴) 浓硝酸(滴) 浓硝酸( 现象 加入NaOH后 加入NaOH后 NaOH 现象变化 1 2 0.5% 0.5%苯酚 鸡蛋清液 4 4 4 2 3 指甲 少许 20 4 头发 少许 20
Ⅳ、坂口反应 (Sakaguchi reaction)
原理
在次溴酸钠或次氯酸钠存在的条件下,许 多含有胍基的化合物 (如胍乙酸、甲胍、胍基 丁胺等)能与α-萘酚发生反应生成红色物质。 在20种氨基酸中唯有精氨酸含有胍基,所以 只有它呈正反应。
二、器材 1.试管及试管架 2.水浴锅 3.酒精灯 4.滤纸片 5.烘箱 6.量筒(10ml)
实验注意事项: 实验注意事项:
1、本次实验内容繁多,请做好实验报告, 并严格按步骤操作。 2、本次实验是定性实验,各种实验的 现象都可能发生,要细心观察。 3、本次实验有的试剂具强腐蚀性和刺 激性,操作时要多加小心。
实验二、 蛋白质及氨基酸 的显色反应
Department of life science
实验二、蛋白质及氨基酸的显色反应
目的和要求 1.学习和了解常用的几种鉴定蛋白质与氨基 酸的方法。 2.进一步认识氨基酸是蛋白质的基本组成 单位。
Ⅰ 、双缩脲反应 (Biurea reaction)
原理: 双缩脲反应:在碱性条件下,双缩脲与二价铜离 子作用,生成紫红色配合物的反应。当加热至 180℃左右时,两分子尿素缩合脱去一分子氨, 生成双缩脲。在肽和蛋白质分子中具有肽键,其 结构与双缩脲类似,也能发生此反应,生成蓝紫 色或紫红色的配合物。该反应常用于蛋白质的定 性或定量测定。此反应所产生颜色的深浅与蛋白 质的浓度成正比,而与蛋白质分子量及氨基酸成 分无关。
用途 测蛋白质含量 鉴定蛋白质水 解 是否完全 测AA含量检验 含量检验 AA及蛋白质 及蛋白质 鉴定Trp、Tyr 、 鉴定 鉴定Arg 鉴定 测定Arg含量 测定 含量 鉴定Trp 鉴定 鉴定His、Tyr 、 鉴定
2、茚三酮反应 、 3、黄色反应 、 4、坂口反应 、 5、乙醛酸反应 、 6、偶氮反应 、
操作步骤 取2支试管,分别加入1mL 0.3%精氨酸 溶液和蛋白溶液,各加20%氢氧化钠溶液5 滴,1%α-萘酚酒精溶液2滴,次氯酸钠溶 液6滴,摇匀,放置片刻,观察出现的颜色。
坂口反应
试 剂 (滴) 管号 1 0 0 5 5 3 6 H2O 0.3% 蛋白质 20% % % NaOH 精氨 溶液 酸 α -萘 NaClO 现象 酚 记录
Ⅱ 、茚三酮反应 (Ninhydrin reaction)
原理: 除脯氨酸、羟脯氨酸和茚三酮反应生成黄色物 质外,所有的α-氨基酸及一切蛋白质都能和茚三 酮反应生成蓝紫色物质。该反应分两步进行,首 先是氨基酸被氧化,产生 CO 2 、NH 3 和醛,而 水合茚三酮被还原成还原型茚三酮;第二步是所 生成之还原型茚三酮与另一个水合茚三酮分子和 氨缩合生成有色物质。
思考题
1.如果蛋白质水解作用一直进行到双缩脲 反应呈阴性结果,此时可对水解程度作出 什么结论? 2.能否用茚三酮反应可靠地鉴定蛋白质的 存在? 3.白明胶对乙醛酸反应呈阴性,为什么?
操作步骤
向试管中加数滴蛋白质溶液,再加冰醋酸 (常含有少量乙醛酸或醛类)约1mL并混匀倾 斜试管,谨慎地沿着管壁加浓硫酸(AR)约 1mL,使其重迭,且勿摇匀。静置后,观察 在两液界面上出现的红紫色环,于水浴中 微热,可加快色环形成。
乙醛酸反应
试剂 (滴) 管号 白明胶 0.3% % 色氨酸 (滴) 蛋白质 溶液 (滴) 冰醋酸 (ml) ) 浓硫酸 (ml) ) 现象记 录
1
5
1
1
2
5
1
1
3
5
1
1
Ⅵ、偶氮反应 (Azo reaction)
原理 偶氮化合物 (Ehrlich氏偶氮试剂)与酚核或咪 唑环结合产生有色物质。它与酪氨酸和组氨 酸反应的产物分别为红色和樱桃红色.含有酪 氨酸和组氨酸的蛋白质也有此反应。
操作步骤
取 2支试管,分别加入0.3%组氨酸溶液和纯 鸡蛋清各4滴,再各加入新配制的重氮试剂8 滴摇匀,加入2滴20%氢氧化钠溶液,再摇匀。 过几分钟,观察颜色的形成,一般出现樱桃 红色。
Ⅱ 、茚三酮反应 (Ninhydrin reaction)
此反应的适宜pH为5-7,同一浓度的蛋白质或 氨基酸在不同pH条件下的颜色深浅不同,酸度过 大时甚至不显色。该反应十分灵敏,1:1 500 000浓度的氨基酸水溶液即能显示反应,因此是一 种常用的氨基酸定量方法。
操作步骤 一、取 2支试管分别加入蛋白质溶液和0.5% 甘氨酸溶液1mL,再加0.5mL 0.1%茚三酮 水溶液混匀,在沸水浴中加热1~2min,观 察颜色由粉色变成紫红色再变蓝。 二、在一小片滤纸上滴上一滴 0.5%的甘氨酸 溶液,风干后,再在原处滴0.1%的茚三酮 乙醇溶液一滴,在微火旁烘干显色,观一支试管加 4滴0.5%苯酚溶液,再加浓 硝酸2滴,观察黄色出现,冷却后逐滴加入 10%氢氧化钠溶液,观察颜色转变为橙。 二、取一支试管加蛋白质溶液4滴及浓硝酸2滴, 由于强酸的作用,开始蛋白质形成白色沉淀, 小火加热,则沉淀变为黄色,冷却之,逐滴加 入10%氢氧化钠溶液,颜色由黄色转变成深橙 黄色。 三、剪少许指甲或头发放入试管中,加入数滴 浓硝酸,观察颜色变化。
紫红色铜双缩脲复合物分子结构为: 紫红色铜双缩脲复合物分子结构为:
操作步骤
一、取少量尿素结晶,放入干燥试管中,用微火加 热使尿素熔化。熔化的尿素开始硬化时,停止加 热,尿素放出氨,形成双缩脲。冷却后,加 10%NaOH溶液约1mL,振荡混匀,再加入 1%CuSO4 溶液1滴,振荡之。观察出现的粉红颜 色。(避免添加过量硫酸铜,生成的蓝色氢氧化 铜能掩盖粉红色)。 二、取另一支试管,加 1mL蛋白质溶液和10%氢氧 化钠溶液2mL,摇匀,再加1%硫酸铜溶液两滴, 随加随摇,观察紫玫瑰色的出现。
