《络合滴定法》PPT课件
合集下载
[课件]第五章 络合滴定法PPT
![[课件]第五章 络合滴定法PPT](https://img.taocdn.com/s3/m/3c3a770b4b73f242336c5f6f.png)
2018/12/2 3
:
N H C H 2
+
C H 2
N H
+
:
· ·
· ·
EDTA
H6 Y2+ =H+ + H5 Y+
[H+][H5Y] Ka1= [H Y] = 10-0.90 6
H5Y+ =H+ + H4Y H4Y =H+ + H3YH3Y- =H+ + H2Y2-
Ka2=
[H+][H4Y] [H5Y]
[MLn] n=K1K2 · · · Kn= [M][L]n
表示络.2.2 溶液中各级络合物的分布
M + L = ML ML + L = ML2
● ● ●
[ML] = 1 [M] [L] [ML2] = 2 [M] [L]2
● ● ●
MLn-1 + L = MLn
最佳配位型体 5
M-EDTA螯合物的立体构型
O C H 2C N H 2C C O O O C O
2018/12/2 6
O
H2 C
CH2 N CH2 C CH2 O
EDTA 通常 与金属离子 形成1:1的螯 合物
Ca O
多个五元环
某些金属离子与EDTA的形成常数 lgK
Na+ 1.7
lgK
Mg2+ 8.7 Ca2+ 10.7 Fe2+ Al3+ Zn2+ Cd2+ Pb2+ Cu2+
第五章 络合 滴定法
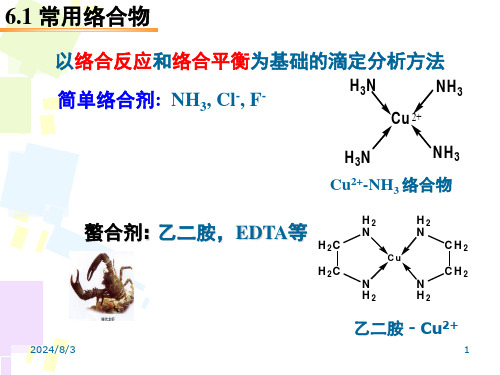
5.1 常用络合物
以络合反应和络合平衡为基础的滴定分析方法
滴定条件:定量、完全、迅速、且有指示终点的方法
:
N H C H 2
+
C H 2
N H
+
:
· ·
· ·
EDTA
H6 Y2+ =H+ + H5 Y+
[H+][H5Y] Ka1= [H Y] = 10-0.90 6
H5Y+ =H+ + H4Y H4Y =H+ + H3YH3Y- =H+ + H2Y2-
Ka2=
[H+][H4Y] [H5Y]
[MLn] n=K1K2 · · · Kn= [M][L]n
表示络.2.2 溶液中各级络合物的分布
M + L = ML ML + L = ML2
● ● ●
[ML] = 1 [M] [L] [ML2] = 2 [M] [L]2
● ● ●
MLn-1 + L = MLn
最佳配位型体 5
M-EDTA螯合物的立体构型
O C H 2C N H 2C C O O O C O
2018/12/2 6
O
H2 C
CH2 N CH2 C CH2 O
EDTA 通常 与金属离子 形成1:1的螯 合物
Ca O
多个五元环
某些金属离子与EDTA的形成常数 lgK
Na+ 1.7
lgK
Mg2+ 8.7 Ca2+ 10.7 Fe2+ Al3+ Zn2+ Cd2+ Pb2+ Cu2+
第五章 络合 滴定法
5.1 常用络合物
以络合反应和络合平衡为基础的滴定分析方法
滴定条件:定量、完全、迅速、且有指示终点的方法
第三章络合滴定法课件

MY
H+
OH -
MHY
M(OH)Y
MLn 辅助配 位效应
2024/8/2
M(OH)n H6Y
羟基配 酸效应 位效应
干扰离 子效应
混合配位效应
25
配合物MY的副反应及副反应系数MY
主反应:
M
+
Y
MY
副反应: L
OH - H +
N
H+
OH -
ML
MOH HY
NY
ML2
M(OH)2? H2Y
MHY
M(OH)Y
主反应和副反应
H6Y
羟基配位效应 辅助配位效应 酸效应 共存离子效应
混合配位效应
M(OH)
数
2024/8/2
M(L)
Y(H)
Y(N)
MY(H) MY(OH) 副反应系
20
主反应:
M
+
Y
副反应:
L
OH - H +
N
ML
MOH HY
NY
ML2
M(OH)2? H2Y
MY
H+
OH -
MHY
M(OH)Y
MLn
MLn
辅助配 位效应
M(OH)n H6Y
羟基配 酸效应 位效应
干扰离 子效应
2024/8/2
混合配位效应
26
EDTA的酸效应Y(H):由于H+存在使
EDTA与金属离子配位反应能力降低的现
象。
M+Y
MY
主反应
H+ HY
H+
H+
H2Y
《络合滴定法》课件

《络合滴定法》PPT 课件
目录
• 络合滴定法概述 • 络合滴定法的基本概念 • 络合滴定法的实验技术 • 络合滴定法的应用实例 • 络合滴定法的注意事项与展望
01
络合滴定法概述
定义与原理
定义
络合滴定法是一种通过络合反应来滴定溶液中金属离子浓度的分析方法。
原理
络合反应是可逆的,通过加入过量的络合剂与待测金属离子形成稳定的络合物 ,再利用滴定剂滴定剩余的络合剂,从而计算出金属离子的浓度。
络合滴定法的实验设备与试剂
实验设备
滴定管、容量瓶、烧杯、搅拌器等。
实验试剂
络合剂、指示剂、标准溶液、待测样品等。
络合滴定法的实验步骤与操作
实验步骤
准备实验设备与试剂、配制标准溶液、进行滴定操作、记录 实验数据。
操作要点
准确称量样品、控制滴定速度、选择合适的指示剂、观察颜 色变化等。
络合滴定法的实验数据处理与分析
络合滴定法的应用领域
环境保护
用于测定水体、土壤等 环境样品中的重金属离
子浓度。
食品检测
用于检测食品中的微量 元素,确保食品安全。
医药分析
用于药物成分分析,以 及生物样品中金属离子
的测定。
地质勘探
用于分析矿石和岩石中 的金属元素。
络合滴定法与其他滴定法的比较
与酸碱滴定法相比,络合滴定法具有 更高的选择性,能够测定一些酸碱滴 定法难以测定的金属离子。
01
误差控制
02
选择合适的络合剂和指示剂,确保反应速 度适中且变色点与化学计量点一致。
03
严格控制溶液的酸度、温度等条件,以减 小副反应的发生。
04
采用标准曲线法、内标法等手段进行校正 ,提高测量的准确性。
目录
• 络合滴定法概述 • 络合滴定法的基本概念 • 络合滴定法的实验技术 • 络合滴定法的应用实例 • 络合滴定法的注意事项与展望
01
络合滴定法概述
定义与原理
定义
络合滴定法是一种通过络合反应来滴定溶液中金属离子浓度的分析方法。
原理
络合反应是可逆的,通过加入过量的络合剂与待测金属离子形成稳定的络合物 ,再利用滴定剂滴定剩余的络合剂,从而计算出金属离子的浓度。
络合滴定法的实验设备与试剂
实验设备
滴定管、容量瓶、烧杯、搅拌器等。
实验试剂
络合剂、指示剂、标准溶液、待测样品等。
络合滴定法的实验步骤与操作
实验步骤
准备实验设备与试剂、配制标准溶液、进行滴定操作、记录 实验数据。
操作要点
准确称量样品、控制滴定速度、选择合适的指示剂、观察颜 色变化等。
络合滴定法的实验数据处理与分析
络合滴定法的应用领域
环境保护
用于测定水体、土壤等 环境样品中的重金属离
子浓度。
食品检测
用于检测食品中的微量 元素,确保食品安全。
医药分析
用于药物成分分析,以 及生物样品中金属离子
的测定。
地质勘探
用于分析矿石和岩石中 的金属元素。
络合滴定法与其他滴定法的比较
与酸碱滴定法相比,络合滴定法具有 更高的选择性,能够测定一些酸碱滴 定法难以测定的金属离子。
01
误差控制
02
选择合适的络合剂和指示剂,确保反应速 度适中且变色点与化学计量点一致。
03
严格控制溶液的酸度、温度等条件,以减 小副反应的发生。
04
采用标准曲线法、内标法等手段进行校正 ,提高测量的准确性。
第六章络合滴定法ppt课件
2024/8/3
3
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
EDTA: δ -pH图
δ
1.0
0.8
H6Y2+
H2Y2-
HY3-
0.6 0.4
H5Y+
H3Y-0.2来自H4Y0.00 2 4 6 8 10
(2)共存离子效应系数
Y(N)
[Y]
[Y]+[NY]
Y(N)= [Y] =
[Y]
= 1+ KNY[N]
多种共存离子
Y(N)= [Y] = [Y]+[N1Y]+[N2Y]+…+[NnY]
[Y]
[Y]
= 1+KN1Y[N1]+KN2Y[N2]+…+KNnY[Nn]
=Y(N1)+Y(N2)+…+Y(Nn)-(n-1)
Ka1=
[H+][H5Y]
[H6Y]
Ka2=
[H+][H4Y] [H5Y]
= 10-0.90 = 10-1.60
Ka3=
[H+][H3Y] [H4Y]
= 10-2.00
Ka4=
[H+][H2Y] [H3Y]
Ka5= Ka6=
[H+][HY] [H2Y]
[H+][Y] [HY]
= 10-2.67 = 10-6.16 = 10-10.26
2024/8/3
8
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
第6章络合滴定法PPT课件
4
第4页/共32页
自学要求: 了解 ①螯合剂主要有那些类型?②它们各与那类
物质反应形成螯合物?(参考书:武大第五版教材 P167~P168 )
5
第5页/共32页
6.1.2 氨羧络合剂 Complexan
是一类含有氨基二乙酸基团的螯合剂
CH3COOH
N
CH3COOH
:N
易与Co2+,Ni2+,Cd2+,Cu2+,Zn2+, Hg2+等金属离子络合。
15
第15页/共32页
2、MLn型(多元络合物)
M + L ⇌ ML
K1
[ML] [M][L
]
累积稳定常数
β1
[ML] [M][L]
k1
ML + L ⇌ ML2
K
2
[ ML2 [ M L] [
] L]
2
[ML2 ] [M][L] 2
k1k2
… … …
MLn-1 + L ⇌ MLn
K
n
[
[ MLn ] MLn-1] [
[H2Y] [Y][H]2
K1HK
H 2
1 K K a5 a6
… …
H5Y+H
H6Y
β6
[ H6 Y ] [ Y ] [ H ]6
K1H
K
H 2
K
H 6
[ Hi Y] βi[ Y] [ H ]i
1 Ka1 Ka2 ...Ka6
18
第18页/共32页
δ M L
n
[MLn]
CM
β n[ L ]n
]
k
1k
络合滴定法PPT课件

• 酸效应系数(L(H)): H+引起副反应时的副反应系数。对于EDTA, 用 Y(H)
Y
[Y ' ] [Y ]
未与M络合的总浓度 Y的平衡浓度
2021/5/31
19
第19页/共44页
酸效应系数 Y(H)
Y
[Y '] [Y ]
1 Y
[Y][HY][H2Y][H3Y][H4Y][H5Y][H6Y] [Y]
14
第14页/共44页
4.3 络合物的平衡常数
(Equilibrium constant)
• 4.3.1配合物的稳定常数
M+Y
MY
MY
稳定常数 K MY M Y
➢ 讨论:KMY↑大,配合物稳定性↑高,配合
反应完全
2021/5/31
15
第15页/共44页
2021/5/31
某些金属离子与EDTA的形成常
紫红
CuY2-
蓝
NiY2-
蓝绿
2021/5/31
13
第13页/共44页
4. EDTA配合物特点:
1) 广泛配位性→五元环螯合物→稳定、完全、迅速 2) 具6个配位原子,与金属离子多形成1:1配合物 3) 与无色金属离子形成的配合物无色,利于指示终点与有色金属离子形
成的配合物颜色更深
2021/5/31
1
MY
lg K 'MY lg KMY lgM lgY
• 在许多情况下, MY的副反应可以忽略
lg K 'MY lg K MY lg M lg Y
26
第26页/共44页
• 计算pH=5.00时,0.10mol/LAlY溶液中,游离F-的浓度为0.010mol/L时 AlY的条件稳定常数。
Y
[Y ' ] [Y ]
未与M络合的总浓度 Y的平衡浓度
2021/5/31
19
第19页/共44页
酸效应系数 Y(H)
Y
[Y '] [Y ]
1 Y
[Y][HY][H2Y][H3Y][H4Y][H5Y][H6Y] [Y]
14
第14页/共44页
4.3 络合物的平衡常数
(Equilibrium constant)
• 4.3.1配合物的稳定常数
M+Y
MY
MY
稳定常数 K MY M Y
➢ 讨论:KMY↑大,配合物稳定性↑高,配合
反应完全
2021/5/31
15
第15页/共44页
2021/5/31
某些金属离子与EDTA的形成常
紫红
CuY2-
蓝
NiY2-
蓝绿
2021/5/31
13
第13页/共44页
4. EDTA配合物特点:
1) 广泛配位性→五元环螯合物→稳定、完全、迅速 2) 具6个配位原子,与金属离子多形成1:1配合物 3) 与无色金属离子形成的配合物无色,利于指示终点与有色金属离子形
成的配合物颜色更深
2021/5/31
1
MY
lg K 'MY lg KMY lgM lgY
• 在许多情况下, MY的副反应可以忽略
lg K 'MY lg K MY lg M lg Y
26
第26页/共44页
• 计算pH=5.00时,0.10mol/LAlY溶液中,游离F-的浓度为0.010mol/L时 AlY的条件稳定常数。
第三章-络合滴定法PPT课件

§3.1 分析化学中的络合物 §3.2 络合物的平衡常数
第三章 §3.3 副反应系数和条件稳定常数 络合滴定法 §3.4 金属离子指示剂
§3.5 络合滴定法的基本原理
§3.6 提高络合滴定选择性的途径 §3.7 络合滴定方式及应用示例
8/2/2024
.
1
§3.1 分析化学中的络合物
一、简单络合物:由中心离子和单基配位体组成
1 β2[L]2
βn [L]n
δML
···
[ML] cM
1
β1[L]
β1[L] β2[L]2
β1[L]n
δMLn
8/2/2024
[MLn ] cM
1
β1[L]
β1[L] n β. 2[L] 2
β1[L]n
8
例2 使100mL 0.010mol·L-1Zn2+降至10-9mol·L-1,问应加入多
逐级稳定常数
Cu2+ + NH3 [Cu(NH3)]2+ + NH3 [Cu(NH3)]22+ + NH3
[Cu(NH3)]32+ + NH3
[Cu(NH3)]2+ [Cu(NH3)]22+ [Cu(NH3)]3 2+
[Cu(NH3)]4 2+
lgK1 =4.31 lgK2 =3.67 lgK3 =3.04 lgK4 =2.30
一、络合物的稳定常数:
M+ L ML + L
ML2
+L
···
MLn-1 + L
ML K1 ML2 K2 M···L3 K3 MLn Kn
M+ L M + 2L M + 3L
第三章 §3.3 副反应系数和条件稳定常数 络合滴定法 §3.4 金属离子指示剂
§3.5 络合滴定法的基本原理
§3.6 提高络合滴定选择性的途径 §3.7 络合滴定方式及应用示例
8/2/2024
.
1
§3.1 分析化学中的络合物
一、简单络合物:由中心离子和单基配位体组成
1 β2[L]2
βn [L]n
δML
···
[ML] cM
1
β1[L]
β1[L] β2[L]2
β1[L]n
δMLn
8/2/2024
[MLn ] cM
1
β1[L]
β1[L] n β. 2[L] 2
β1[L]n
8
例2 使100mL 0.010mol·L-1Zn2+降至10-9mol·L-1,问应加入多
逐级稳定常数
Cu2+ + NH3 [Cu(NH3)]2+ + NH3 [Cu(NH3)]22+ + NH3
[Cu(NH3)]32+ + NH3
[Cu(NH3)]2+ [Cu(NH3)]22+ [Cu(NH3)]3 2+
[Cu(NH3)]4 2+
lgK1 =4.31 lgK2 =3.67 lgK3 =3.04 lgK4 =2.30
一、络合物的稳定常数:
M+ L ML + L
ML2
+L
···
MLn-1 + L
ML K1 ML2 K2 M···L3 K3 MLn Kn
M+ L M + 2L M + 3L
络合滴定法的原理及应用(ppt 79页)

水解 络合 酸效应 共存离子 混合络合
19
二、副反应系数 (side reaction coefficient)
Y4-
x
1.0
0.8 H6Y2+ H2Y2-
0.6
H5Y+
0.4
0.2
H3Y-
0.0
H4Y
0246
HY3-
8 10
pH
Y4-
12 14
20
1. EDTA(Y)的副反应系数
●.酸效应
由于体系中PH值发生变化,就可能产生各种 离子。使EDTA对金属离子的络合能力降 低—酸效应
为了便于记忆,用H4Y表示其分子式:
(两个羧基上的H+转移到N原子上,形成双偶极离子)
5
其它氨羧络合剂
CDTA (环己二胺四乙酸)
H2C
CH2 CH NH+
CH2COOCH2COOH
H2C
CH NH+ CCHH22CCOOOO-H
CH2
HEDTA(2-羟乙基乙二胺三乙酸)
H2C
NH+
CH2COOCH2COOH
M (L)[[M M ']][M ][M]L [[M M ]2] L ...[Mn]L
αM(L)大,表示副反应越严重。如果M没有副反 应,则αM(L)=1。
M (L ) 1 1 [L ]2 [L ]2 . ..n [L ]n
29
M的总副反应系数αM
同样道理,M的总副反应系数αM
lK g M ' Y lK g M Y lg M lg Y32
四、配位滴定中适宜PH条件的控制
1.副反应系数尤其是酸效应系数对 配位滴定反应的影响有多大呢?
19
二、副反应系数 (side reaction coefficient)
Y4-
x
1.0
0.8 H6Y2+ H2Y2-
0.6
H5Y+
0.4
0.2
H3Y-
0.0
H4Y
0246
HY3-
8 10
pH
Y4-
12 14
20
1. EDTA(Y)的副反应系数
●.酸效应
由于体系中PH值发生变化,就可能产生各种 离子。使EDTA对金属离子的络合能力降 低—酸效应
为了便于记忆,用H4Y表示其分子式:
(两个羧基上的H+转移到N原子上,形成双偶极离子)
5
其它氨羧络合剂
CDTA (环己二胺四乙酸)
H2C
CH2 CH NH+
CH2COOCH2COOH
H2C
CH NH+ CCHH22CCOOOO-H
CH2
HEDTA(2-羟乙基乙二胺三乙酸)
H2C
NH+
CH2COOCH2COOH
M (L)[[M M ']][M ][M]L [[M M ]2] L ...[Mn]L
αM(L)大,表示副反应越严重。如果M没有副反 应,则αM(L)=1。
M (L ) 1 1 [L ]2 [L ]2 . ..n [L ]n
29
M的总副反应系数αM
同样道理,M的总副反应系数αM
lK g M ' Y lK g M Y lg M lg Y32
四、配位滴定中适宜PH条件的控制
1.副反应系数尤其是酸效应系数对 配位滴定反应的影响有多大呢?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
双偶极分子
分子式:
H4Y
ethylenediamine
EDTA性质
酸性 配位性质 溶解度
EDTA的性质
酸性 H6Y2+
HOOCH2C -OOCH2C
H N CH2 CH2 +
+ N
H
CH2COOCH2COOH
1.p0Ka1=0.9
pKa2=1.6
pKa3=2.07
分布系数
H分6Y20+.8
H6Y 2H+ 5Y+H2Y 2-
EDTA络合物的特点
广泛,EDTA几乎能与所有的金属离子形成络合物; 稳定,lgK > 15; 络合比简单, 一般为1︰1; 络合反应速度快,水溶性好; EDTA与无色的金属离子形成无色的络合物,与有色的金属离子形成颜
色更深的络合物。
6.2 络合物的平衡常数
6.2.1 络合物的稳定常数
H N CH2 CH2 +
+ N
H
CH2COOCH2COOH
O
.. 2个氨氮配位原子 N
4个羧氧配位原子
O ..
CO
C H2C O CH2
H2C N OC
CH2
O
Ca N
CH2
O
OC
C CH2 O
溶解度
型体
O
溶解度 (22 ºC)
H4Y Na2H2Y
0.2 g / L 111 g / L, 0.3 mol /L
Analytical Chemistry
第六章
络合滴定法
6-1 分析化学中的络合化合物 6-2 络合物的离解平衡 6-3 副反应系数和条件稳定常数 6-4 络合滴定法基本原理 6-5 准确滴定和分别滴定判别式 6-6 络合滴定中酸度的控制 6-7 提高络合滴定选择性的途径 6-8 络合滴定方式及其应用
i1
MLi-1 L MLi
Ki
[MLi ] [M Li -1 ][L]
K ( ni 1)
1 Ki
i
i K j
j 1
i
i
Kj
j 1
K1K2...Ki
[ML] [ML2 ] ... [MLi ] [M][L] [ML][L] [MLi1][L]
[L]i
i
[MLi ] [M][L]i
[MLi ] i[M][L]i
H4Y
HY 3-
Y 4- H3Y-
布
分 0.6
数pKa4=2.75
0.4
H5Y +
H2Y2-
pKa5=6.24 pKa6=10.34
HY3-
Y4-
H3Y -
0.2
H4Y
0.0
0 2 4 6 8 10 12 14
EDTA 各种型体分布图
pH
配位性质
EDTA 有 6 个配位基
HOOCH2C -OOCH2C
重要公式
6.2.2 溶液中各级络合物的分布
ML 1 M L
ML2 2 M L2 MLn n M Ln
若溶液中金属离子M的分析浓度为cM 则由MBE:
cM = [M] + [ML] + ……+ [MLn]
= [M](1 +β1[L] + β2[L]2 +……+ βn[L]n)
M
M
CM
有机络合剂 螯合物 ①稳定(环状)②组成简单恒定 ③选择性好
EDTA及其络合物
EDTA 乙二胺四乙酸
ethylenediaminetetraacetic acid
HOOCH 2C H
+
-OOCH 2C
N C H2 C H2 +
N H
乙二胺
N CH2 CH2 N
C H2C OOC H2C OOH
存在形式:
[M]+ β1[M][L] + β2[M][L]2 +... + βn[M][L]n
简简单单配配体体络络合合物物
螯合物
多多核核络络合合物物
Cu(NH 33)2424
O
C H2C O CH2Байду номын сангаас
H2C N OC
CH2
O
Ca N
CH2
O
OC
C CH2 O
O
OOHH
[[((HH22OO))44FFee
FFee((HH22OO))44]]44++
OOHH
无机络合剂 简单配位络合物 ①不够稳定②逐级络合③多组分共存
显色剂
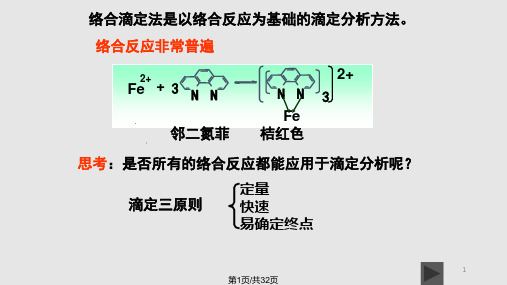
例如,邻二氮菲显色分光光度法测定铁:
Fe2+ + 3
NN
3 邻二氮菲
2+
NN 3 Fe
桔红色 max
滴定剂
例如:EDTA 络合滴定法测定水 的硬度所形成的Ca2+-EDTA络合物。
O
C H2C O CH2
H2C N OC
CH2
O
Ca N
CH2
O
OC
C CH2 O
O
分分析析化化学学中中的的络络合合物物
EDTA络合物:
稳定常数
离解常数
累积稳定常数
M Y MY
K1
[MY] [M][Y]
K1
1 K1
1 K1
多元络合物:
逐级形成络合物
M nL MLn Stepwise complex formation
逐级络合
稳定常数
离解常数 累积稳定常数
M L ML
……
K1
[ML] [M][L]
Kn
1 K1
MLi MLlCM
δ均仅仅是[L]的函数
以lg[L](p[L])为横坐标,δ为纵坐标作图,则得到 分布曲线p175图6-4、6-5
6.2.3 平均配位数
平均配位数 n ——金属离子络合配体的平均数,又称
为生成函数。
cL _ [L]
cM:金属离子总浓度 cL:配体总浓度
n=
[L]:配体平衡浓度
1
11+nβ1[LL]i+
β2[L]2
1 +……+
βn[L]n
ML
........
ML
CM
i1 1
L
11+βn 1[LL]+i
β1[L] β2[L]2 +……+
βn[L]n
i 1
MLn
MLn
CM
n Ln
n
11 +β1[LL]i +
βn[L]n β2[L]2 +……+
βn[L]n
i 1
1 K1
i
…… MLi-1 L MLi
Ki
[MLi ] [M Li -1 ][L]
K ( ni 1)
1 Ki
i
Kj
j 1
MLn-1
L
MLn
Kn
[MLn ] [M Ln-1 ][L]
K 1
1 Kn
n
n Ki
i1
累积稳定常数与平衡浓度的关系
多元络合物
M nL MLn
n
lg n lg Ki
cM
([L]+[ML]+2[ML2]+...+n[MLn]) _ [L]
=
[M]+[ML]+[ML2]+...[MLn]
= [ML]+2[ML2]+...+n[MLn] [M]+[ML]+[ML2]+...[MLn]
β1[M][L] +2 β2 [M][L]2 +... +n β n[M][L]n =
6.1 分析化学中的络合物
分析化学中广泛使用 各种类型的络合物
沉淀剂
例如,8-羟基喹啉与镁离子生成螯合物沉淀:
H O
H
Mg(H2O)62+ + 2
N OH
N
O
Mg
O
N
H
O H
+ 2 H+ + 4 H2O
掩蔽剂
例如,用 KCN 掩蔽Zn2+,消除其对 EDTA 滴定 Pb2+的干扰。
Zn2 4CN Zn(CN)24
分子式:
H4Y
ethylenediamine
EDTA性质
酸性 配位性质 溶解度
EDTA的性质
酸性 H6Y2+
HOOCH2C -OOCH2C
H N CH2 CH2 +
+ N
H
CH2COOCH2COOH
1.p0Ka1=0.9
pKa2=1.6
pKa3=2.07
分布系数
H分6Y20+.8
H6Y 2H+ 5Y+H2Y 2-
EDTA络合物的特点
广泛,EDTA几乎能与所有的金属离子形成络合物; 稳定,lgK > 15; 络合比简单, 一般为1︰1; 络合反应速度快,水溶性好; EDTA与无色的金属离子形成无色的络合物,与有色的金属离子形成颜
色更深的络合物。
6.2 络合物的平衡常数
6.2.1 络合物的稳定常数
H N CH2 CH2 +
+ N
H
CH2COOCH2COOH
O
.. 2个氨氮配位原子 N
4个羧氧配位原子
O ..
CO
C H2C O CH2
H2C N OC
CH2
O
Ca N
CH2
O
OC
C CH2 O
溶解度
型体
O
溶解度 (22 ºC)
H4Y Na2H2Y
0.2 g / L 111 g / L, 0.3 mol /L
Analytical Chemistry
第六章
络合滴定法
6-1 分析化学中的络合化合物 6-2 络合物的离解平衡 6-3 副反应系数和条件稳定常数 6-4 络合滴定法基本原理 6-5 准确滴定和分别滴定判别式 6-6 络合滴定中酸度的控制 6-7 提高络合滴定选择性的途径 6-8 络合滴定方式及其应用
i1
MLi-1 L MLi
Ki
[MLi ] [M Li -1 ][L]
K ( ni 1)
1 Ki
i
i K j
j 1
i
i
Kj
j 1
K1K2...Ki
[ML] [ML2 ] ... [MLi ] [M][L] [ML][L] [MLi1][L]
[L]i
i
[MLi ] [M][L]i
[MLi ] i[M][L]i
H4Y
HY 3-
Y 4- H3Y-
布
分 0.6
数pKa4=2.75
0.4
H5Y +
H2Y2-
pKa5=6.24 pKa6=10.34
HY3-
Y4-
H3Y -
0.2
H4Y
0.0
0 2 4 6 8 10 12 14
EDTA 各种型体分布图
pH
配位性质
EDTA 有 6 个配位基
HOOCH2C -OOCH2C
重要公式
6.2.2 溶液中各级络合物的分布
ML 1 M L
ML2 2 M L2 MLn n M Ln
若溶液中金属离子M的分析浓度为cM 则由MBE:
cM = [M] + [ML] + ……+ [MLn]
= [M](1 +β1[L] + β2[L]2 +……+ βn[L]n)
M
M
CM
有机络合剂 螯合物 ①稳定(环状)②组成简单恒定 ③选择性好
EDTA及其络合物
EDTA 乙二胺四乙酸
ethylenediaminetetraacetic acid
HOOCH 2C H
+
-OOCH 2C
N C H2 C H2 +
N H
乙二胺
N CH2 CH2 N
C H2C OOC H2C OOH
存在形式:
[M]+ β1[M][L] + β2[M][L]2 +... + βn[M][L]n
简简单单配配体体络络合合物物
螯合物
多多核核络络合合物物
Cu(NH 33)2424
O
C H2C O CH2Байду номын сангаас
H2C N OC
CH2
O
Ca N
CH2
O
OC
C CH2 O
O
OOHH
[[((HH22OO))44FFee
FFee((HH22OO))44]]44++
OOHH
无机络合剂 简单配位络合物 ①不够稳定②逐级络合③多组分共存
显色剂
例如,邻二氮菲显色分光光度法测定铁:
Fe2+ + 3
NN
3 邻二氮菲
2+
NN 3 Fe
桔红色 max
滴定剂
例如:EDTA 络合滴定法测定水 的硬度所形成的Ca2+-EDTA络合物。
O
C H2C O CH2
H2C N OC
CH2
O
Ca N
CH2
O
OC
C CH2 O
O
分分析析化化学学中中的的络络合合物物
EDTA络合物:
稳定常数
离解常数
累积稳定常数
M Y MY
K1
[MY] [M][Y]
K1
1 K1
1 K1
多元络合物:
逐级形成络合物
M nL MLn Stepwise complex formation
逐级络合
稳定常数
离解常数 累积稳定常数
M L ML
……
K1
[ML] [M][L]
Kn
1 K1
MLi MLlCM
δ均仅仅是[L]的函数
以lg[L](p[L])为横坐标,δ为纵坐标作图,则得到 分布曲线p175图6-4、6-5
6.2.3 平均配位数
平均配位数 n ——金属离子络合配体的平均数,又称
为生成函数。
cL _ [L]
cM:金属离子总浓度 cL:配体总浓度
n=
[L]:配体平衡浓度
1
11+nβ1[LL]i+
β2[L]2
1 +……+
βn[L]n
ML
........
ML
CM
i1 1
L
11+βn 1[LL]+i
β1[L] β2[L]2 +……+
βn[L]n
i 1
MLn
MLn
CM
n Ln
n
11 +β1[LL]i +
βn[L]n β2[L]2 +……+
βn[L]n
i 1
1 K1
i
…… MLi-1 L MLi
Ki
[MLi ] [M Li -1 ][L]
K ( ni 1)
1 Ki
i
Kj
j 1
MLn-1
L
MLn
Kn
[MLn ] [M Ln-1 ][L]
K 1
1 Kn
n
n Ki
i1
累积稳定常数与平衡浓度的关系
多元络合物
M nL MLn
n
lg n lg Ki
cM
([L]+[ML]+2[ML2]+...+n[MLn]) _ [L]
=
[M]+[ML]+[ML2]+...[MLn]
= [ML]+2[ML2]+...+n[MLn] [M]+[ML]+[ML2]+...[MLn]
β1[M][L] +2 β2 [M][L]2 +... +n β n[M][L]n =
6.1 分析化学中的络合物
分析化学中广泛使用 各种类型的络合物
沉淀剂
例如,8-羟基喹啉与镁离子生成螯合物沉淀:
H O
H
Mg(H2O)62+ + 2
N OH
N
O
Mg
O
N
H
O H
+ 2 H+ + 4 H2O
掩蔽剂
例如,用 KCN 掩蔽Zn2+,消除其对 EDTA 滴定 Pb2+的干扰。
Zn2 4CN Zn(CN)24
