抑菌圈直径和MIC解释标准
最低抑菌浓度的名词解释

最低抑菌浓度的名词解释1. 介绍最低抑菌浓度(Minimum Inhibitory Concentration,MIC),是指在体外实验条件下,抗生素或其他抑菌药物能够完全抑制病原微生物(如细菌、真菌等)生长的最低浓度。
MIC是一种衡量抗生素抑菌效果的指标,它可以用于评估药物的抗菌活性、确定临床有效的药物浓度范围,并为个体化药物治疗提供参考。
2. 测定方法测定MIC的常用方法包括四倍稀释法(Broth Dilution Method)和纸片扩散法(Disk Diffusion Method)。
2.1 四倍稀释法四倍稀释法是一种定量测定MIC的方法。
该方法将抗生素或其他抑菌药物通过连续四倍稀释的方式加入含有病原微生物的培养基中,然后观察最低能完全抑制菌落生长的药物浓度。
操作步骤: 1. 准备含有多种不同浓度抗生素的培养基。
2. 用含菌培养基分别接种到含有不同浓度抗生素的试管中。
3. 培养试管并观察菌落生长情况。
4. 确定最低能完全抑制菌落生长的浓度即为MIC。
2.2 纸片扩散法纸片扩散法是一种半定量测定MIC的方法。
该方法将抗生素或其他抑菌药物通过纸片扩散的方式施加到含有病原微生物的琼脂平板上,然后观察形成的抑菌圈直径,进而推算出MIC。
操作步骤: 1. 在琼脂平板上均匀涂抹含有病原微生物的悬浮液。
2. 将含有不同浓度抗生素的纸片放置在琼脂平板表面。
3. 孵育琼脂平板并观察抑菌圈直径。
4. 根据抑菌圈直径的大小推算出MIC。
3. 临床意义MIC在临床抗生素使用中具有重要的意义。
3.1 抗生素选择和疗效评估通过测定细菌对抗生素的MIC可以确定药物的抗菌活性,指导临床合理使用抗生素。
- 当病原菌对某种抗生素的MIC低于规定的临床断点时,该抗生素对该菌株是敏感的,可以选择该抗生素进行治疗。
- 当病原菌对某种抗生素的MIC高于规定的临床断点时,该抗生素对该菌株是耐药的,不应选择该抗生素进行治疗。
不同抑菌药物抑菌圈大小的标准

不同抑菌药物抑菌圈大小的标准下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help yousolve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts,other materials and so on, want to know different data formats and writing methods, please pay attention!不同抑菌药物抑菌圈大小的标准是判断药物在体外对微生物的抑菌能力的重要指标。
抑菌圈直径和MIC解释标准

抑菌圈直径和MIC解释标准铜绿假单胞菌抑菌圈直径和MIC解释标准试验条件培养基:纸片扩散法:MHA肉汤稀释法:CAMHB琼脂稀释法:MHA接种物:生长法或直接菌落悬液法,相当于麦氏标准孵育:35 2 °C;空气环境纸片扩散法:16 -18 h稀释法:16 - 20 h(1)对于纸片扩散法,直径150mm平板最大放置12只,直径100mm平板放置5只进行试验(见M02第节)测量抑菌圈直径(用肉眼判读),包括纸片直径。
保持平板在反射光照明的、非反射黑的背景上方几英寸,肉眼观察无明显生长的地区作为抑菌圈边缘。
在抑菌圈边缘借助放大镜才能观察到的微小菌落生长可忽略不计。
(2)用纸片扩散法和稀释法能可靠地测定分离于囊性纤维化病人的铜绿假单胞菌的敏感性,但在作为敏感结果报告前,应将孵育时间延长至24小时。
(3)所有抗菌药物在延长治疗期间可致铜绿假单胞菌发生耐药。
因此,初次分离的敏感菌株在开始治疗后3〜4不动杆菌属抑菌圈直径和MIC解释标准试验条件培养基:纸片扩散法:MHA肉汤稀释法:CAMHB琼脂稀释法:MHA接种物:生长法或直接菌落悬液法,相当于麦氏标准孵育:35 2° C;空气环境;20-24h,所有方法由于培养基中可能存在拮抗剂,甲氧苄啶和磺胺类药物抑菌圈内可允许出现菌株轻微生长;因此,在测量抑菌圈直径时可忽视轻微生长(20%或较少的菌苔)而测量较明显抑制的边缘。
(2)对四环素敏感的菌株被认为对多西环素和米诺环素也敏感。
然而,某些对四环素中介或耐药的菌株可以对多西环素或米诺环素或二者敏感。
洋葱伯克霍尔德菌抑菌圈直径和MIC解释标准试验条件培养基:纸片扩散法:MHA肉汤稀释法:CAMHB琼脂稀释法:MHA接种物:生长法或直接菌落悬液法,相当于麦氏标准孵育:35 2° C;空气环境;所有方法,20-24h嗜麦芽窄食单胞菌抑菌圈直径和MIC解释标准试验条件培养基:纸片扩散法:MHA肉汤稀释法:CAMHB琼脂稀释法:MHA接种物:生长法或直接菌落悬液法,相当于麦氏标准孵育:35 2° C;空气环境,所有方法,20-24 h由于培养基中可能存在拮抗剂,甲氧苄啶和磺胺类药物抑菌圈内可允许出现菌株轻微生长;因此,在测量抑菌圈直径时可忽视轻微生长(20%或较少的菌苔)而测量较明显抑制的边缘。
eucast mic和抑菌圈直径解释折点表

eucast mic和抑菌圈直径解释折点表标题:eucast mic与抑菌圈直径解释折点表:深入探讨抗生素敏感性测试的意义与应用导语:抗生素是当今医疗领域中不可或缺的药物,它们通过干预和杀死病原微生物来治疗感染性疾病。
然而,由于细菌的耐药性逐渐增强,适当的抗生素选择变得愈发关键。
为了准确评估细菌对抗生素的敏感性,使用Eucast MIC和抑菌圈直径解释折点表已成为临床实验室中常见的方法。
本文将以从简到繁、由浅入深的方式,对这一主题进行全面评估,帮助读者更好地理解这一关键概念。
第一部分:Eucast MIC的介绍与解释1. 什么是Eucast MIC?- Eucast(European Committee on Antimicrobial Susceptibility Testing,欧洲抗菌药物敏感性(MIC)测试委员会)是一个专门负责规范和指导抗菌药物敏感性测试的组织。
- MIC(Minimum Inhibitory Concentration,最低抑制浓度)是指能够抑制细菌生长的最小抗生素浓度。
2. 为什么使用Eucast MIC?- Eucast MIC提供了一种客观、量化的方式来评估细菌对抗生素的敏感性。
- 通过测定MIC值,可以确定一个细菌株是否对某种抗生素具有抗药性。
3. Eucast MIC折点表的应用- 折点(breakpoints)是指将MIC值与临床疗效关联起来的关键值。
- 通过将MIC与折点进行比较,可以根据细菌对抗生素的敏感性划分其抗菌药物类别:敏感、中级敏感和耐药。
第二部分:抑菌圈直径解释折点表的介绍与应用1. 什么是抑菌圈直径解释折点表?- 抑菌圈直径解释折点表是另一种常用的抗生素敏感性测试方法。
- 它通过测量抗生素在琼脂平板上形成的抑菌圈直径,来评估细菌对抗生素的敏感性。
2. 护菌圈直径解释折点表的意义与用途- 抑菌圈直径是细菌在抗生素作用下无法生长的区域。
- 通过比较抑菌圈直径与解释折点表中的标准值,可以评估细菌对抗生素的敏感性。
eucast mic和抑菌圈直径解释折点表

Eucast MIC和抑菌圈直径解释折点表1. 引言在临床微生物学中,抗生素敏感性测试是评估细菌对抗生素的敏感性的关键步骤。
其中,最常用的方法之一是测定最低抑菌浓度(MIC)和抑菌圈直径(ZOI)。
这两种方法通常使用折点表来解释结果。
本文将详细解释Eucast MIC和抑菌圈直径解释折点表的含义、用途和解读方法,并提供一些实际案例进行说明。
2. Eucast MIC折点表Eucast(欧洲临床微生物学与传染病学协会)是一个负责制定临床微生物学相关指南和标准的组织。
Eucast MIC折点表是根据大量实验数据和临床研究结果制定的,用于解释MIC测试结果的参考标准。
Eucast MIC折点表通常由两列组成:抗生素名称和对应的MIC折点。
抗生素名称列列出了常见的抗生素药物,而MIC折点列则给出了对应抗生素的敏感性分类。
MIC折点是指在体外实验条件下,细菌对抗生素的最低抑菌浓度。
通常,MIC折点表将抗生素的敏感性分类为以下几类:•敏感(S):细菌对抗生素敏感,建议使用该抗生素进行治疗。
•中间(I):细菌对抗生素的敏感性较低,需要根据具体情况进行判断是否使用该抗生素。
•耐药(R):细菌对抗生素耐药,不推荐使用该抗生素进行治疗。
根据MIC折点表的结果,临床医生可以选择最适合的抗生素进行治疗,以提高治疗效果。
3. 抑菌圈直径解释折点表除了MIC折点表外,抑菌圈直径解释折点表也是常用的抗生素敏感性测试结果解释标准之一。
抑菌圈直径是指在培养基上,细菌在抗生素作用下形成的抑菌圈的直径。
抑菌圈直径解释折点表通常由两列组成:抗生素名称和对应的抑菌圈直径解释。
抗生素名称列列出了常见的抗生素药物,而抑菌圈直径解释列则给出了对应抗生素的敏感性分类。
抑菌圈直径解释折点表将抗生素的敏感性分类为以下几类:•敏感(S):抑菌圈直径大于或等于折点值,细菌对抗生素敏感。
•中间(I):抑菌圈直径在敏感和耐药之间,需要根据具体情况进行判断是否使用该抗生素。
各种属细菌药敏试验解释标准
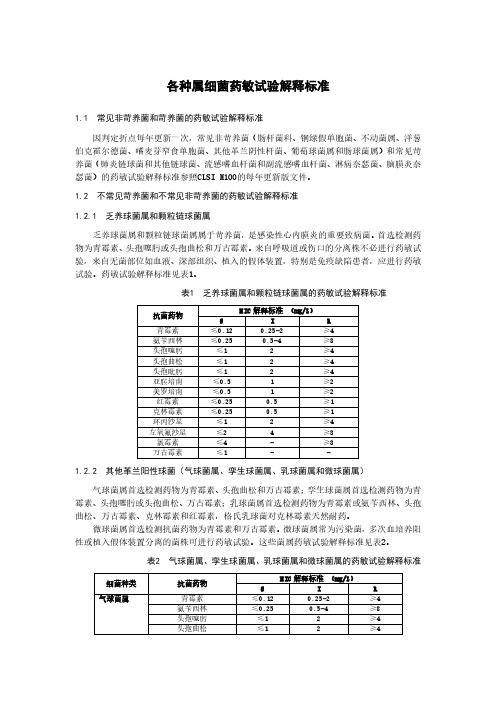
各种属细菌药敏试验解释标准1.1 常见非苛养菌和苛养菌的药敏试验解释标准因判定折点每年更新一次,常见非苛养菌(肠杆菌科、铜绿假单胞菌、不动菌属、洋葱伯克霍尔德菌、嗜麦芽窄食单胞菌、其他革兰阴性杆菌、葡萄球菌属和肠球菌属)和常见苛养菌(肺炎链球菌和其他链球菌、流感嗜血杆菌和副流感嗜血杆菌、淋病奈瑟菌、脑膜炎奈瑟菌)的药敏试验解释标准参照CLSI M100的每年更新版文件。
1.2 不常见苛养菌和不常见非苛养菌的药敏试验解释标准1.2.1 乏养球菌属和颗粒链球菌属乏养球菌属和颗粒链球菌属属于苛养菌,是感染性心内膜炎的重要致病菌。
首选检测药物为青霉素、头孢噻肟或头孢曲松和万古霉素。
来自呼吸道或伤口的分离株不必进行药敏试验,来自无菌部位如血液、深部组织、植入的假体装置,特别是免疫缺陷患者,应进行药敏试验。
药敏试验解释标准见表1。
表1 乏养球菌属和颗粒链球菌属的药敏试验解释标准1.2.2 其他革兰阳性球菌(气球菌属、孪生球菌属、乳球菌属和微球菌属)气球菌属首选检测药物为青霉素、头孢曲松和万古霉素;孪生球菌属首选检测药物为青霉素、头孢噻肟或头孢曲松、万古霉素;乳球菌属首选检测药物为青霉素或氨苄西林、头孢曲松、万古霉素、克林霉素和红霉素,格氏乳球菌对克林霉素天然耐药。
微球菌属首选检测抗菌药物为青霉素和万古霉素。
微球菌属常为污染菌,多次血培养阳性或植入假体装置分离的菌株可进行药敏试验。
这些菌属药敏试验解释标准见表2。
表2 气球菌属、孪生球菌属、乳球菌属和微球菌属的药敏试验解释标准1.2.3 对糖肽类药物天然耐药的革兰阳性菌(无色藻菌属、明串珠菌属、片球菌属、猪红斑丹毒丝菌和乳杆菌属)无色藻菌属、明串珠菌属和片球菌属无色藻菌属、片球菌属和明串珠菌属为苛养菌,对万古霉素天然耐药。
首选检测抗菌药物为青霉素或氨苄西林。
分离自无菌部位如血培养、深部组织的菌株,尤其是免疫缺陷患者无菌部位分离的菌株可进行药敏试验。
药敏结果解释标准见表3。
MIC(最小抑菌浓度英文缩写)—搜狗百科

MIC(最小抑菌浓度英文缩写)—搜狗百科 最小抑菌浓度是指(Minimum inhibitory concentration)或(Minimal inhibition concentration)的缩写, 测定抗菌药物抗菌活性大小的一个指标,指在体外培养细菌18~24小时后能抑制培养基内病原菌生长的最低药物浓度,该实验通过在Nuns96孔板上进行抗菌培养实验得到测试化合物的抗菌能力大小。
几种测定抗菌药物最低抑菌浓度(MIC)方法 1.1.常量肉汤稀释法1.1.1.抗菌药物贮存液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
抗菌药物直接购自厂商或相关机构。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表5。
配制好的抗菌药物贮存液应贮存于-60℃以下环境,保存期不超过6个月。
1.1.2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.1.3. 培养基 NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
实验七体外抑菌实验

03 实验结果
抑菌圈测量
抑菌圈大小
根据实验结果,测量并记 录各菌株对应的抑菌圈直 径,以评估抗菌物质的抑 菌效果。
抑菌圈对比
将不同菌株的抑菌圈进行 对比,分析抗菌物质对不 同菌株的抑制作用差异。
抑菌圈标准化
为确保实验结果的可靠性, 将抑菌圈直径标准化,以 消除实验操作和设备差异 对结果的影响。
数据记录与分析
数据整理
将实验过程中测量的数据整理成表格, 便于后续分析和对比。
数据分析
显著性检验
采用统计学方法对实验数据进行显著 性检验,以确定抗菌物质对各菌株的 抑制效果是否具有统计学上的显著差 异。
根据抑菌圈大小和其他相关指标,分 析抗菌物质对不同菌株的抑制作用。
结果展示
图表展示
利用图表(如柱状图、折线图等)直观展示实验结果,便于观察和分析。
实验操作步骤
1. 菌悬液制备
将实验菌种接种于适宜的培养基中, 培养至对数生长期,制备成一定浓度 的菌悬液。
2. 抗菌药物稀释
将抗菌药物用生理盐水或无菌水稀释 至所需浓度。
3. 抗菌活性测试
将菌悬液与稀释后的抗菌药物混合, 观察抗菌药物的抑菌效果。
4. ቤተ መጻሕፍቲ ባይዱ果记录
记录抑菌圈的大小、透明度等指标, 分析抗菌药物的抑菌效果。
结论总结
根据实验结果和数据分析,总结抗菌物质对各菌株的抑制作用,并给出相应的 结论和建议。
04 结论
结果总结
实验结果显示,不同浓度的抗菌剂对不同细菌的抑菌 效果存在差异。在一定浓度范围内,随着抗菌剂浓度
的增加,抑菌效果逐渐增强。
实验中使用的抗菌剂对革兰氏阳性菌和革兰氏阴性菌 的抑菌效果不同,表明不同细菌对抗菌剂的敏感性存
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
抑菌圈直径和MIC解释标准缩写: ATCC,美国模式菌种保藏所;CAMHB,调节过阳离子的Mueller-Hinton肉汤;FDA,美国食品和药品管理局;MHA, Mueller-Hinton琼脂;MIC,最低抑菌浓度;MRS,耐甲氧西林葡萄球菌;MRSA,耐甲氧西林金黄色葡萄球菌;MOD-SA,修饰的金黄色葡萄球菌;PBP,青霉素结合蛋白;PCR,聚合酶链反应;QC,质量控制;VRSA,耐万古霉素金黄色葡萄球菌;vanA,万古霉素耐药基因。
BHI,脑心浸液;AST,抗菌药物敏感性试验; ATCC,美国模式菌种保藏所;BSC,生物安全柜; BSL-2,二级生物安全水平;BSL-3,三级生物安全水平;CAMHB,调节过阳离子的 MuellerHinton 肉汤;CDC,疾病预防控制中心;CFU,菌落形成单位;LHB,溶解马血; MHA,Mueller-Hinton琼脂; MIC,最低抑菌浓度;QC,质量控制。
抑菌圈直径和MIC解释标准铜绿假单胞菌抑菌圈直径和MIC解释标准试验条件培养基: 纸片扩散法:MHA肉汤稀释法:CAMHB琼脂稀释法: MHA接种物: 生长法或直接菌落悬液法,相当于 0.5麦氏标准孵育: 35, 2 ?C;空气环境纸片扩散法:16 -18 h稀释法:16 - 20 h(1)对于纸片扩散法,直径150mm平板最大放置12只,直径100mm平板放置5只进行试验(见M02第9.2节)。
测量抑菌圈直径(用肉眼判读),包括纸片直径。
保持平板在反射光照明的、非反射黑的背景上方几英寸,肉眼观察无明显生长的地区作为抑菌圈边缘。
在抑菌圈边缘借助放大镜才能观察到的微小菌落生长可忽略不计。
(2)用纸片扩散法和稀释法能可靠地测定分离于囊性纤维化病人的铜绿假单胞菌的敏感性,但在作为敏感结果报告前,应将孵育时间延长至24小时。
(3)所有抗菌药物在延长治疗期间可致铜绿假单胞菌发生耐药。
因此,初次分离的敏感菌株在开始治疗后3~4不动杆菌属抑菌圈直径和MIC解释标准试验条件培养基:纸片扩散法: MHA肉汤稀释法: CAMHB琼脂稀释法: MHA接种物:生长法或直接菌落悬液法,相当于0.5麦氏标准孵育: 35,2?C;空气环境;20-24h,所有方法由于培养基中可能存在拮抗剂,甲氧苄啶和磺胺类药物抑菌圈内可允许出现菌株轻微生长;因此,在测量抑菌圈直径时可忽视轻微生长(20%或较少的菌苔)而测量较明显抑制的边缘。
(2)对四环素敏感的菌株被认为对多西环素和米诺环素也敏感。
然而,某些对四环素中介或耐药的菌株可以对多西环素或米诺环素或二者敏感。
洋葱伯克霍尔德菌抑菌圈直径和MIC解释标准试验条件培养基:纸片扩散法: MHA肉汤稀释法:CAMHB琼脂稀释法: MHA接种物:生长法或直接菌落悬液法,相当于0.5麦氏标准孵育: 35,2?C;空气环境;所有方法,20-24h嗜麦芽窄食单胞菌抑菌圈直径和MIC解释标准试验条件培养基:纸片扩散法: MHA肉汤稀释法: CAMHB琼脂稀释法: MHA接种物:生长法或直接菌落悬液法,相当于0.5麦氏标准孵育: 35,2?C;空气环境,所有方法,20-24 h由于培养基中可能存在拮抗剂,甲氧苄啶和磺胺类药物抑菌圈内可允许出现菌株轻微生长;因此,在测量抑菌圈直径时可忽视轻微生长(20%或较少的菌苔)而测量较明显抑制的边缘。
氯霉素:分离于泌尿道菌株不常规报告。
其他非- 肠杆菌科细菌MIC解释标准(,g/mL)葡萄球菌属抑菌圈直径和MIC解释标准试验条件纸片扩散法:MHA 培养基:肉汤稀释法:CAMHB; CAMHB+2% NaCl用于苯唑西林、甲氧西林和奈夫西林; CAMHB补充50 µg/mL钙用于达托霉素琼脂稀释法:MHA; MHA+2% NaCl用于苯唑西林、甲氧西林和奈夫西林;琼脂稀释测试达托霉素还未被批准接种物:直接菌落悬液法,相当于 0.5麦氏标准孵育: 35,2?C;空气环境纸片扩散法:16-18 h; 24 h (凝固酶阴性葡萄球菌与头孢西丁)稀释法: 16-20 h所有方法:苯唑西林、甲氧西林、奈夫西林和万古霉素需24h试验温度超过35?C可能检测不出MRS(1)对于纸片扩散法,直径150mm平板最大放置12只纸片,直径100mm平板放置5只进行试验(见M02第9.2节)。
测量抑菌环直径(用肉眼判读),包括纸片直径。
保持平板在反射光照明的、非反射黑的背景上方几英寸,除外利奈唑胺、苯唑西林、万古霉素应用透射光阅读(平板正对光源)。
肉眼观察无明显生长的地区作为抑菌圈边缘。
在抑菌圈边缘借助放大镜才能观察到的微小菌落生长可忽略不计。
由于培养基中可能存在拮抗剂,甲氧苄啶和磺胺类药物抑菌环内可允许出现菌株轻微生长;因此,在测量抑菌环直径时可忽视轻微生长(20%或较少的菌苔)而测量较明显抑制的边缘。
在抑菌环内任何可辨别的菌落生长提示苯唑西林、利奈唑胺或万古霉素耐药。
(2)过去,将对青霉素酶稳定的青霉素类(见术语表 I)耐药称为“耐甲氧西林”或“耐苯唑西林”, MRSAs是指表达mecA或具有另一种甲氧西林耐药机制,如青霉素结合蛋白与苯唑西林的亲和力改变 (修饰的金黄色葡萄球菌[MOD-SA]菌株)的金黄色葡萄球菌。
(3)对于耐苯唑西林金黄色葡萄球菌和凝固酶阴性葡萄球菌 (MRS),被认为对其它,- 内酰胺类药物,即,青霉素类、,- 内酰胺/,- 内酰胺酶抑制剂复合物,头孢类(新的“具有抗-MRSA活性的头孢菌素”例外)和碳青霉烯类等是耐药。
这是因为大多数文献报道了MRS(4)在大部分葡萄球菌中,苯唑西林耐药是由mecA基因介导,此基因编码青霉素结合蛋白2a (PBP 2a,也称为PBP2')。
测试分离菌株mecA或PBP 2a阳性应报告苯唑西林耐药。
通过苯唑西林MIC、头孢西丁MIC或头孢西丁纸片法测试分离菌株为耐药,应报告苯唑西林耐药。
非mecA介导的耐药机制较罕见,包括新的mecA同系物mecC 1 。
具有mecC菌株的头孢西丁和/或苯唑西林MICs典型地落在耐药范围;通过直接检测mecA或PBP 2a不能检测出mecC介导的药。
、无并发症的泌尿道感染的抗菌药物(如,呋喃妥因、甲氧苄啶?磺胺甲恶唑或一(5)由于对常规用于治疗急性种氟喹诺酮)在尿液中可达到浓度的治疗反应是敏感的,因此,不建议对尿液中分离的腐生葡萄球菌进行常规试验。
(6)对于某些细菌/抗菌药物组合,尚不存在或罕见耐药菌株,因此,除了“敏感”以外没有标明任何其他药敏类型。
如果菌株的结果提示“非敏感”,应确证菌株鉴定和抗菌药物敏感性试验结果。
(见附录 A)。
(7)β- 内酰胺酶、苯唑西林耐药性、使用头孢西丁检测mecA-介导的苯唑西林耐药性、万古霉素敏感性减低、诱导型克林霉素耐药和高水平莫匹罗星耐药(仅金黄色葡萄球菌)等筛选试验,金黄色葡萄球菌查阅表2C补充表1和2,凝固酶阴性葡萄球菌查阅表2C补充表3。
另外,使用头孢西丁预报me介导的cA苯唑西林耐药性的进一步解释参见M07-A9第12青霉素酶不稳定青霉素类(8)青霉素敏感葡萄球菌也对葡萄球菌感染有临床疗效的其他β- 内酰胺类药物敏感。
青霉素耐药葡萄球菌对青霉素酶不稳定青霉素耐药,包括氨苄西林、阿莫西林、阿洛西林、羧苄西林、美洛西林、哌拉西林和替卡西林。
葡萄球菌产生,- 内酰胺酶。
当(9)青霉素可被用于测试葡萄球菌对所有青霉素酶不稳定青霉素类的敏感性。
青霉素耐药青霉素对葡萄球菌分离株MICs?0.12µg/mL或抑菌圈直径?29mm,在报告青霉素结果为敏感前,应对葡萄球菌执行β- 内酰胺酶试验。
罕见葡萄球菌含,- 内酰胺酶基因而,- 内酰胺酶试验结果为阴性。
因此,对需青霉素治疗的严重感染,从相同患者随后分离的所有菌株,实验室应测定青霉素MIC和执行诱导β- 内酰胺酶试验。
也可考虑用PCR测试分离菌株bla Z,- 内酰胺酶基因。
见表2C后的表2C补充表1和 3(10)苯唑西林耐药葡萄球菌应报告对青霉素耐药或不报告。
青霉素酶稳定青霉素类(11)苯唑西林(或头孢西丁)结果可应用于其他青霉素酶稳定青霉素类 (邻氯西林、双氯西林、氟氯西林、甲氧西林和萘夫西林)。
具有确切临床疗效的抗菌药物,考虑感染部位和适当的剂量,苯唑西林 (头孢西丁)敏感葡萄球菌可考虑对下列抗菌药物也敏感:,,- 内酰胺/,- 内酰胺酶抑制剂复合物 (阿莫西林- 克拉维酸、氨苄西林- 舒巴坦、哌拉西林- 他唑巴坦、替卡西林- 克拉维酸);, 口服头孢烯类 (头孢克罗、头孢地尼、头孢泊肟、头孢丙烯、头孢呋辛、氯碳头孢);, 注射用头孢烯类包括I、 II、 III和 IV代头孢菌素(头孢孟多、头孢唑啉、头孢吡肟、头孢美唑、头孢尼西、头孢哌酮、头孢噻肟、头孢替坦、头孢唑肟、头孢曲松、头孢呋辛、头孢噻吩、头孢洛林、拉氧头孢);和碳青霉烯 (多利培南、厄他培南、亚胺培南、美罗培南)。
除了新的具有抗MRSA活性的头孢菌素外,耐苯唑西林葡萄球菌对目前所有,- 内酰胺类药物耐药。
因此,对各种,- 内酰胺类抗菌药物敏感或耐药结果,可以通过只检测青霉素和头孢西丁或苯唑西林而推测得到。
除不建议常规测试其他,- 内酰胺类药物,具有抗-MRSA活性药物除外。
见注释 (4)。
苯唑西林用于金黄色葡萄球菌和路登葡萄球菌(12)苯唑西林纸片试验不可靠,当使用头孢西丁作为替代试验报告苯唑西林纸片试验结果时见头孢西丁和注释(13)。
(13)头孢西丁可被用作苯唑西林的替代品;r 根据头孢西丁结果来报告苯唑西林敏感或耐药。
(14)如果用头孢西丁和苯唑西林测试金黄色葡萄球菌或路登葡萄球菌,二种药物中有任一结果为耐药,则应报告受试菌株对苯唑西林耐药。
苯唑西林用于除路登葡萄球菌外的凝固酶阴性葡萄球菌(CoNS)(15)对于某些 CoNS,由于某些非表皮葡萄球菌苯唑西林MIC为0.5~2μg/ml,而缺乏mecA基因,因此,苯唑西林MIC解释标准可能高估了耐药性。
除表皮葡萄球菌外,对于苯唑西林MIC为0.5~2μg/mlCoNS引起的严重感染,适合于测试分离菌株mecA基因或PBP2a或头孢西丁纸片扩散法敏感性。
.万古霉素用于金黄色葡萄球菌。
(18)测定所有葡萄球菌分离株对万古霉素敏感性应执行MIC试验。
纸片扩散法既不能区别万古霉素敏感与中介金黄色葡萄球菌,也不能区分万古霉素敏感、中介和耐药凝固酶阴性葡萄球菌,对所有分离菌株给出相似大小抑菌圈。
(19)除了下述情况外,葡萄球菌纸片扩散法抑菌圈直径大小与万古霉素MIC不存在相关性。
30µg万古霉素纸片试验可检测含vanA基因的万古霉素耐药金黄色葡萄球菌(VRSA)。
上述菌株在纸片周围表现无抑菌圈 (直径 = 6 mm)。
