无机推断题解题技巧
无机推断题的解题思路与技巧

突破无机推断题一、无机推断题得特点1.它集元素化合物知识、基本概念与基本理论知识为一体。
具有考查知识面广、综合性强、思考容量大得特点。
这种题型不但综合性考查学生在中学阶段所学得元素及其化合物知识以及物质结构、元素周期律、电解质溶液、化学平衡、氧化还原反应、化学用语等知识,而且更重要得就是它能突出考查学生得综合分析判断能力、逻辑推理能力。
且结构紧凑、文字表述少,包含信息多,思维能力要求高。
2.无机推断题与双基知识、有机、实验、计算均可联系,出题比较容易。
在少题量得情况下,可考多个知识点,多方面得能力,从而更好地突出学科内综合,这就受到了理综卷得青睐。
3.无机推断题层次明显,区分度高,有一步推错,整题失分得可能,很容易拉分。
具有很高得区分度与很好得选拔功能。
尽管它考得内容广,能力全面,层次高,但它还就是离不开大纲与考纲。
知识点必须就是高中阶段强调掌握得基础知识与主干知识。
例题1 已知A、B、C、D为气体,E、F为固体,G就是氯化钙,它们之间得转换关系如下图所示:⑴ D得化学式(分子式)就是 ,E得化学式(分子式)就是。
⑵ A与B反应生成C得化学方程式就是。
⑶ E与F反应生成D、H与G得化学方程式就是。
解析:由E(固)+F(固) → D(气) + H + G(CaCl2),容易联系到实验室用NH4Cl与Ca(OH)2制NH3得反应,这样可推断出D为NH3,H为H2O,E与F一个为NH4Cl、一个为Ca(OH)2。
由D(NH3)+C(气)→E,可确定E 为NH4Cl,C为HCl,则A、B一个为H2、一个为Cl2。
A与B生成C得化学方程式为H2+Cl2===2HCl。
E与F生成D、H与G得化学方程式为2NH4Cl+Ca(OH)2NH3↑+2H2O+CaCl2。
二、无机推断题得解题思路与技巧1.基础知识得梳理(1)元素周期表、元素周期律与物质结构熟悉元素周期表与元素周期律(电子排布与周期表得关系,化合价与最外层电子数、元素所在得族序数得关系(包括数得奇偶性),微粒得半径大小与元素周期表得关系,非金属氢化物得稳定性、酸性与元素周期表得关系)。
论述无机化学推断题的解题技巧

论述无机化学推断题的解题技巧无机化学推断题是考察学生对无机化学知识掌握和思维能力的重要手段。
在这类题目中,要求学生通过有限的信息和一定的推理能力推断出未知物质的性质或反应过程。
本文将从简单到复杂、由浅入深地介绍无机化学推断题的解题技巧,并分享个人的观点和理解。
一、正确理解题干和给出的信息解题的第一步是准确理解题干和给出的信息。
在解题过程中,仔细阅读题目,并将题干和给出的信息进行整理和分类。
对于无机化学推断题来说,给出的信息可能包括反应方程式、实验现象、实验条件以及所用试剂等。
二、运用基础知识和常识进行推理在理解题目和给出的信息后,接下来要运用已经掌握的基础知识和常识进行推理。
要对反应类型和常见的无机与无机反应进行熟悉。
酸和碱反应产生盐和水,金属与非金属氧化物反应产生相应的氧化物。
三、辅助信息的利用在解题过程中,如果途中出现不确定或缺少的信息,可以使用辅助信息进行推断。
常见的辅助信息有元素周期表、离子半径、溶解度规律等。
通过对辅助信息的利用,可以增加对未知物质性质的判断和推断。
四、化学方程式的平衡和饱和度的考虑解题时,要考虑化学方程式的平衡和饱和度。
化学方程式需要满足质量守恒和电荷守恒的原则。
在无机化学推断题中,要根据给出的反应方程式和已知物质的物质量来推断未知物质的量。
五、合理推断未知物质的性质或反应过程在前面的步骤中,通过理解题干、整理信息、运用基础知识和常识、辅助信息的利用,以及考虑化学方程式的平衡和饱和度,我们已经对未知物质的性质或反应过程有了初步的了解。
接下来,需要进一步分析推断未知物质的性质或反应过程。
这可以通过比较已知物质和未知物质的性质、考虑氧化还原反应的可能性、以及酸碱中和反应的判断等方面来实现。
六、个人观点和理解无机化学推断题既考察了对基础知识的掌握,也考察了逻辑推理和思维能力。
解题过程既需要运用已经学到的知识,也需要灵活的思维和判断能力。
我认为,通过大量的练习和实践,可以提高解题的准确性和速度。
无机推断题的解题思路与技巧

突破无机推断题一、无机推断题的特点1•它集元素化合物知识、基本概念和基本理论知识为一体。
具有考查知识面广、综合性强、思考容量大的特点。
这种题型不但综合性考查学生在中学阶段所学的元素及其化合物知识以及物质结构、元素周期律、电解质溶液、化学平衡、氧化还原反应、化学用语等知识,而且更重要的是它能突出考查学生的综合分析判断能力、逻辑推理能力。
且结构紧凑、文字表述少,包含信息多,思维能力要求高。
2•无机推断题与双基知识、有机、实验、计算均可联系,出题比较容易。
在少题量的情况下,可考多个知识点,多方面的能力,从而更好地突出学科内综合,这就受到了理综卷的青睐。
3•无机推断题层次明显,区分度高,有一步推错,整题失分的可能,很容易拉分。
具有很高的区分度和很好的选拔功能。
尽管它考的内容广,能力全面,层次高,但它还是离不开大纲和考纲。
知识点必须是高中阶段强调掌握的基础知识和主干知识。
例题1已知A、B、C、D为气体,E F为固体,G是氯化钙,它们之间的转换关系如⑴D的化学式(分子式)是_________ , E的化学式(分子式)是⑵A和B反应生成C的化学方程式是_____________⑶E和F反应生成D、H和G的化学方程式是解析:由E(固)+F(固)T D (气)+ H + G(CaCI』,容易联系到实验室用NHCI与C&0H2制NH的反应,这样可推断出D为NH, H为HO E和F —个为NHCI、一个为C&OH2。
由D(NH)+q气)T E,可确定E为NHCI , C为HCI,贝U A B 一个为f、一个为CI2。
A和B生成C的化学方程式为H2+ Cl 2=== 2HCI。
E和F生成D H和G的化学方程式为2NHCI+Ca (OH2亠NH f +2fO+CaCI2。
二、无机推断题的解题思路与技巧1.基础知识的梳理(1)元素周期表、元素周期律和物质结构熟悉元素周期表和元素周期律(电子排布和周期表的关系,化合价和最外层电子数、元素所在的族序数的关系(包括数的奇偶性),微粒的半径大小和元素周期表的关系,非金属氢化物的稳定性、酸性和元素周期表的关系)。
浅析无机框图推断题的解题方法和思路

浅析无机框图推断题的解题方法和思路 宜昌市夷陵区小溪塔高中 程瑞生 443100无机框图推断题是高考中的常规题型,分值大约15分;可以考查基本概念、基本理论、元素及其化合物等知识,几乎覆盖了大纲要求的全部知识点。
同时也考查了学生的知识应用能力,对学生的要求是比较高的。
一、解题技巧:寻找到突破点:即在解题过程中选择有特征的物质、发生的特殊反应、反应所需的特殊条件、反应所产生的特殊现象等作为突破点。
二、推断方法:审题→挖掘、筛选信息→联系已学知识→寻找突破点→推理判断→得出结论→正向求证。
推理判断的方法可以是:顺逆推断、猜想推断、综合推断等思维方法。
审题,就是阅读题目的过程。
先阅读全题形成一个整体印象,再仔细领会题意,反复推敲、认真辨析,注意题目所给的限制性语句,把条件找准、找全。
已知条件找出来以后,经过与大脑中储存的知识信息相比较,对信息、条件进行加工、筛选,目的是找出解决问题的突破点。
突破点可以是物质的特殊性质、反应所需的特殊条件、反应所产生的特殊现象等。
找到突破点后再联系已学过的知识,进行推断,推断时既可正向推断,又可逆向推断,通过筛选、论证,然后得出结论。
最后按正向顺序代入推断结果进行检验以确保答案的准确性。
三、典例分析找准突破点是解无机推断题的关键,也是解无机推断题的基本方法。
根据“突破点”的类型不同,可分为以下几种:1. 以特殊现象为突破点例1. 下图每一方框中的字母代表一种反应物或生成物。
产物J 是含A 金属元素的胶状白色沉淀,I 为NaCl 溶液,D 是淡黄色固体单质。
试填写下列空白:(1)L 的化学式为__________________(2)F 的化学式为__________________(3)J 受热分解反应的化学方程式为__________________(4)H 和G 之间反应的化学方程式为__________________解析:此题的突破点是:D 是淡黄色固体单质,且能够在空气中燃烧,则D 应是单质硫,G 《高中化学元化知 识课堂教学有效 性研究》课题应是SO2,H应是H2S,L应是H2O。
无机推断的思路与技巧(附练习与答案)
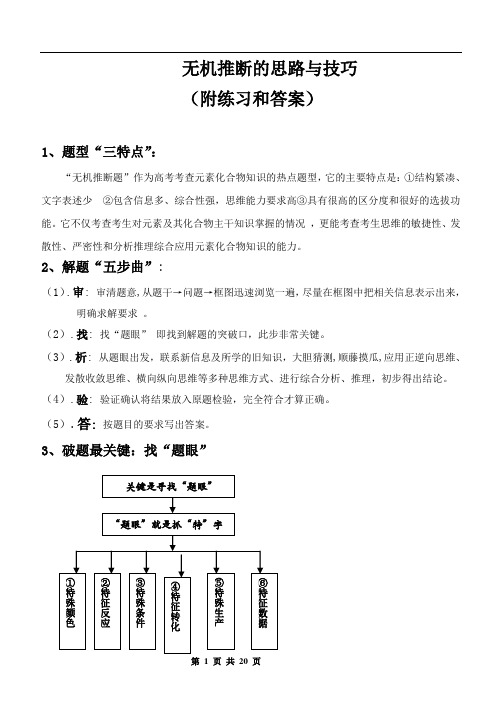
无机推断的思路与技巧(附练习和答案)1、题型“三特点”:“无机推断题”作为高考考查元素化合物知识的热点题型,它的主要特点是:①结构紧凑、文字表述少②包含信息多、综合性强,思维能力要求高③具有很高的区分度和很好的选拔功能。
它不仅考查考生对元素及其化合物主干知识掌握的情况,更能考查考生思维的敏捷性、发散性、严密性和分析推理综合应用元素化合物知识的能力。
2、解题“五步曲”:(1).审: 审清题意,从题干→问题→框图迅速浏览一遍,尽量在框图中把相关信息表示出来,明确求解要求。
(2).找: 找“题眼”即找到解题的突破口,此步非常关键。
(3).析: 从题眼出发,联系新信息及所学的旧知识,大胆猜测,顺藤摸瓜,应用正逆向思维、发散收敛思维、横向纵向思维等多种思维方式、进行综合分析、推理,初步得出结论。
(4).验: 验证确认将结果放入原题检验,完全符合才算正确。
(5).答:按题目的要求写出答案。
3、破题最关键:找“题眼”4.常见“题眼”归类解析方法一:根据物质的特殊颜色推断知识准备:物质颜色(1)有色固体:红色:Cu 、Cu 2O 、Fe 2O 3; 褐色:Fe(OH)3; 黄色:AgI 、Ag 3PO 4;浅黄色:S 或Na 2O 2或AgBr ; 蓝色:Cu(OH)2; 紫黑色:KMnO 4 I 2 黑色:炭粉、CuO 、FeO 、FeS 、CuS 、Ag 2S 、PbS ; 白色:Fe(OH)2、CaCO 3、BaSO 4、AgCl 、BaSO 3;(2) 有色溶液:Fe 2+(浅绿色)、Fe 3+(黄色)、Cu 2+(蓝色)、MnO 4-(紫红色)、[]±y x SCN Fe )((x=1~6)(红色)(3).有色气体:Cl 2(黄绿色)、Br 2(g)(红棕色)、NO 2、(红棕色)、I 2(紫色)O 3(淡蓝色)例1、下图表示各物质之间的转化关系。
已知:A 、D 、F 、H 均为单质,X 常温下为无色液体,B 为淡黄色固体,J 溶于酸得到黄色溶液。
高考化学 无机推断试题无机框图题解题方法素材 人教版

无机推断试题无机框图题解题方法一、无机推断题的形式:推物质、判性质、写用语。
题目中给出的条件一般是物质的物理性质和化学性质,物质类别以及无机物间的相互关系,也可能有结构、周期表位置,以及计算、实验等条件,但以前者为主。
用语主要是化学方程式和离子方程式。
二、无机推断题的解题方法:(1)逻辑推理法:以抓住特征条件找出特征物质为突破口,顺藤摸瓜,依次找出各物质,求解问题。
(2)直觉思维法:通观全题,由跳到脑海中的可能物质进行试探,看是否符合题意来解答问题。
解题中要用元素周期表知识来统率,以物质类别、无机物的相互关系图为依据。
三、解题思路和步骤:无机推断题解题思路和步骤:阅读题目→挖掘信息→筛选信息→寻找突破口→推断整理→得出结论→规X书写★阅读题目:注意限制性语句,尤其隐含的条件,找准找全。
★筛选信息:将试题信息与大脑或教材知识相比较,进行加工、筛选,找出有用信息。
★寻找突破口:突破口这是解题的关键。
突破口可以是反应条件、反应现象、也可能是特殊性质〔如气体的生成、沉淀的生成、颜色的变化、溶解度、特殊反应等〕,甚至有时在后面的提问中。
★规X书写的内容:物质的名称、化学式、结构式、结构简式、电子式、表示物质形成过程的电子表达式、化学方程式、离子方程式、电离方程式。
无机框图题的一般解题思路是:迅速游览产生印象寻找突破口注意联系大胆设想全面分析〔正推和逆推〕验证确认。
解题的关键是:依物质的特征或变化特征来确定“突破口〞,顺藤摸瓜,进而完成全部未知物的推断。
因此应熟练掌握以Na 、Al、Fe等金属为代表,非金属以S、Cl、N、C等为代表的元素及化合物相互转化的基础知识。
四、寻找突破口需巩固的知识1、物质的特征现象:〔1〕物质的颜色:有色气体单质:F2、Cl2、O3其他有色单质:Br2(深红色液体,蒸气为红棕色)、I2〔紫黑色固体〕、S〔淡黄色固体〕、Cu〔紫红色固体〕、P〔白磷是白色固体,红磷是暗红色固体〕、Si〔灰黑色晶体〕、C〔黑色粉未〕无色气体单质:N2、O2、H2有色气体化合物:NO2〔红棕色〕黄色固体:S、Na2O2、AgBr〔浅黄〕、AgI、Ag3PO4〔黄色〕黑色固体:FeO、Fe3O4、MnO2、C、CuS、PbS、Ag2S、CuO红色固体:Fe(OH)3(红褐色)、Fe2O3〔红棕色〕、Cu2O〔红色〕、Cu〔红色〕、红磷〔暗红〕蓝色固体:五水合硫酸铜〔胆矾或蓝矾〕CuSO4·5H2O、Cu(OH)2;绿色固体:七水合硫酸亚铁〔绿矾〕FeSO4·7H2O;紫黑色固体:KMnO4、碘单质。
无机推断题的解题思路与技巧

无机推断题的解题思路与技巧突破无机推断题一、无机推断题的特点1•它集元素化合物知识、基本概念和基本理论知识为一体。
具有考查知识面广、综合性强、思考容量大的特点。
这种题型不但综合性考查学生在中学阶段所学的元素及其化合物知识以及物质结构、元素周期律、电解质溶液、化学平衡、氧化还原反应、化学用语等知识,而且更重要的是它能突出考查学生的综合分析判断能力、逻辑推理能力。
且结构紧凑、文字表述少,包含信息多,思维能力要求高。
2•无机推断题与双基知识、有机、实验、计算均可联系,出题比较容易。
在少题量的情况下,可考多个知识点,多方面的能力,从而更好地突出学科内综合,这就受到了理综卷的青睐。
3•无机推断题层次明显,区分度高,有一步推错,整题失分的可能,很容易拉分。
具有很高的区分度和很好的选拔功能。
尽管它考的内容广,能力全面,层次高,但它还是离不开大纲和考纲。
知识点必须是高中阶段强调掌握的基础知识和主干知识。
例题1已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:□II⑴D的化学式(分子式)是 ______________ ,E的化学式(分子式)是,⑵A和B反应生成C的化学方程式是________________________________⑶E和F反应生成DH和G的化学方程式是 __________________________解析:由E(固)+F(固)-D(气)+ H + G(CaCl2),容易联系到实验室用NHCI与C&0H2制NH的反应,这样可推断出D 为NH, H 为H20, E和F —个为NHCI、一个为C&0H2。
由D(NH3)+C(气)—E,可确定E为NHCI,C为HCI,贝U A、B一个为H2、一个为Cl20A和B生成C的化学方程式为H2+Cl2===2HCI o E和F生成D H和G的化学方程式为2NH4CI+C&OH2 亠NHH +2H2O+CaCI2o二、无机推断题的解题思路与技巧1.基础知识的梳理(1)元素周期表、元素周期律和物质结构熟悉元素周期表和元素周期律(电子排布和周期表的关系,化合价和最外层电子数、元素所在的族序数的关系(包括数的奇偶性),微粒的半径大小和元素周期表的关系,非金属氢化物的稳定性、酸性和元素周期表的关系)。
化学无机推断题技巧(一)

化学无机推断题技巧(一)化学无机推断题技巧引言在化学课上,无机化学推断题不仅是考试重点,也是学生最为头疼的部分。
本文将聚焦于无机化学推断题技巧,帮助学生更好地应对化学课上的考试。
技巧一:准确描述化学反应在推断题中,正确描述化学反应是获得分数的关键。
建议学生记清楚常见化学反应方程式,简要描述化学物质间的相互作用以及形成的物质。
技巧二:注意化学反应间的量比关系化学反应中,物质的量比关系是影响推断过程的重要因素。
学生需要根据所给物质的量推断不同物质数量和性质。
在推断过程中需要注意比例关系,合理运用化学方程式求出未知物质的量。
技巧三:根据性质排查可能的物质推断过程中,根据化学物质的性质可以推断可能的物质种类。
例如,对某种金属离子进行检测时,根据是否有气体产生和具体产生的气体情况,可以排查出可能含有的金属离子种类。
技巧四:有序推断整个过程在推断过程中,学生需要有序地进行推断,一步步确定未知物质的种类和性质。
需要注重每一步推断过程的准确性和逻辑性,确保每一步推断没有遗漏或错误。
结论以上是化学无机推断题的相关技巧,希望大家在备考时能够重视这些技巧,提高自己的化学无机推断题能力。
只有掌握正确的方法,才能赢得优异的成绩!补充技巧:掌握常见离子的性质在无机化学推断中,掌握常见的离子的性质是非常重要的。
比如,硫化氢气体可以用于检测金属离子,铵盐可以用于检测氨基酸等等。
因此,学习化学无机推断,需要搞清楚各种离子的特性,熟悉它们的化学反应和检测方法。
补充技巧二:练习解析技能想要在化学无机推断题中获得更高的分数,需要掌握解析技能。
平时多做习题,了解各种答题技巧,例如分类讨论、化合物判断等等,可以帮助提高解析和推断的能力。
同时,也可以加强注记与解析的能力,更快更好地推断出未知物质的性质。
结论以上的补充技巧同样对于学习和应对化学无机推断题非常有帮助。
在学习过程中,掌握各种离子的性质和解析技巧是非常重要的。
希望大家能够在这些技巧的帮助下更好地学习和应对化学无机推断的考试。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[题型一]解题突破口是
物质性质特征
• 对有关物质的物理性质特征:如(浅
)黄色的固体(粉末)、黑色的粉末( 固体)、有刺激性气味的气体、易溶于 水的气体、有颜色的气体、白色沉淀、 有颜色的沉淀、有颜色的溶液、焰色反 应的颜色等应进行总结。
• 绝大多数金属在粉末状态时呈黑色或 灰黑色。
9.白色:
• 常见白色固体物质如下(呈白色或无色的固体 、晶体很多):
• AgCl; Ag2CO3;Ag2SO4; Ag2SO3;BaSO4; BaSO3;BaCO3; Ba3(PO4)2;BaHPO4;
• CaO;Ca(OH)2;CaCO3; • MgO;Mg(OH)2;MgCO3; • Fe(OH)2;AgOH; • PCl5;SO3; • 三溴苯酚 CuSO4 • 铵盐(白色固体或无色晶体);
• Co2O3(蓝色);
O2(液态——淡蓝色);
• C溶u液(O中H)2(溶绛于蓝多色羟)基;化合物(如甘油、葡萄糖等)的水
• O色3()气。态——淡蓝色;液态——深蓝色;固态——紫黑
• 8.黑色:
• FeO; Fe3O4;FeS; CuO;CuS; Cu2S; MnO2;C粉; Ag2S; PbS; AgCl、AgBr、AgI、AgNO3光照分解 均变黑;
无机推断题
——框图题的解题思路和技巧
洞庭沐渔
例题1:根据下图所示的关系,确定A、B、 C、D、E、F的化学式,并写有关方程式。
C
A
黑色晶体B H2SO4
D
O2 红褐色固体F
(1)A__F_e__; BF_e_3_O_4_; C_F_e_S_O_;4 D___F_e_2(_S_O_;4)3 E_F_e_(_O_H__)_2 ; F_F__e(_O_.H)3
加热后不恢复红色)、在空气中变成红棕色的气体是____.
• 20、能使淀粉变蓝的是 __________
• 21、与碱溶液反应生成白色沉淀且放置空气中变灰绿 色最终变红褐色的离子是_________
• 22、滴入_____ 溶液显血红色以及遇苯酚显紫色的离子 是 _______
• 23、投入水中生成气体和难溶物或微溶物的物质是 ___________
例题2:A、B、C、D、四种元素原子核电荷依次 增大(均小于20),其单质及相应的化合物能
发生如下反应关系:
A E
白色胶状沉淀G NaOH溶液 无色溶液J
C
混合后加水
臭鸡蛋气味气体H
B
白色沉淀K
F
无色溶液I
AgNO3
D
稀HNO3
焰色反应:紫色
••
1、写出B、D形成化合物电子式K_+_[_∶__•S•_∶] 2— K +
2.紫色:
• 石蕊在中性溶液中(紫色); • Fe3+与苯酚反应产物(紫色); • I2(有金属光泽紫黑色固体) • KMnO4固体(紫黑色) • MnO4—(紫红色溶液) • 钾的焰色反应(紫色) • I2蒸气、I2在非极性溶剂中(紫色)
3.橙色:
溴水(橙色) K2Cr2O7溶液(橙色)
4.黄色:
• 工业浓盐酸(黄色)(含有Fe3+);
• Fe3+的水溶液(黄色);
• 硝基苯中溶有浓硝酸分解的NO2时(黄色) • 久置的浓硝酸(黄色)(溶有分解生成的NO2); • 浓硝酸粘到皮肤上(天然蛋白质)(显黄色);
5.绿色:
• Cu2(OH)2CO3(绿色固体); • Fe2+的水溶液(浅绿色); • FeSO4·7H2O(绿矾); • K2MnO4(绿色); • Cl2、氯水(黄绿色); • F2(淡黄绿色); • CuCl2的浓溶液(蓝绿色);
物质颜色助你突破无机推断
• 1.红色:
Fe(SCN)3(红色溶液); Cu2O(红色固体);
Fe2O3(红棕色固体); 红磷(暗红色固体);
液溴(深红棕色);
Fe(OH)3(红褐色固体);
Cu(紫红色固体); 溴蒸气、NO2(红棕色)
品红溶液(红色); 在空气中久置的苯酚(粉红)
石蕊遇酸性溶液(红色); 酚酞遇碱性溶液(红色)。
2、写出下列有关物质化学式:E __A_lC__l3_ J _N_a_A_l_O_2 3、写出C单质与H水溶液反应的离子方程式___________
Cl2+H2S=S↓+2H++2Cl-
[题型二]解题突破口是
反应现象特征
• 1末1(、M镁g条O)在,空产气生中_燃__烧烟产;生刺眼__光,在CO2中燃烧生成__色粉 • 12、铁丝在Cl2中燃烧,产生___的烟; • 13、____雕蚀玻璃:4HF + SiO2 = SiF4 + 2H2O • 14、Fe(OH)2在空气中被氧化:由__变为__最后变为___色; • 15、在常温下:Fe、Al 在浓___和浓____中钝化; • 1酚6遇、空向气盛变有_苯__酚色溶。液的试管中滴入FeCl3溶液,溶液呈__色;苯 • 17、蛋白质遇浓HNO3变___,被灼烧时有_____气味; • 1淡烧8蓝有、色明在火亮空焰的气_中、__燃C色O烧火有:焰蓝S有。色微火弱焰的、_C_H_色4有火__焰_色H2的有火__焰__、色S火在焰O2H中2S燃有 • 19、使品红溶液褪色的气体:____(加热后又恢复红色)、__(
6.棕色:
FeCl3固体(棕黄色); CuCl2固体(棕色) Ag2O(棕黑色)
7.蓝色:
• C蕊u遇(O碱H)2性、溶Cu液SO(4·蓝5H色2O)、;Cu2+在水溶液中(蓝色); 石
• 硫、氢气、甲烷、乙醇在空气中燃烧(淡蓝色火焰) ;
• 一氧化碳在空气中燃烧(蓝色火焰);
• 淀粉遇I2变蓝色;
• 24、既能跟酸反应又能跟碱反应且生成气体的物质一 般是 _____
• 25、能使湿润的红色石蕊试纸变蓝的气体是_____
• AgI(黄色固体);
AgBr(淡黄色固体);
• Ag3PO4(黄色固体); FeS2(黄色固体); • Na2O2(淡黄色固体);S(黄色固体); • Au(金属光泽黄色); I2的水溶液(黄色); • 碘Na酒的(焰黄色褐反色应)(;黄久色置)的;KIT溶NT液((淡黄黄色色)针(状被)氧;化为I2);
