大学无机化学第六章试题
无机化学第四版第六章思考题与习题答案

第六章分子的结构与性质思考题1.根据元素在周期表中的位置,试推测哪些元素之间易形成离子键,哪些元素之间易形成共价键。
答:ⅠA、ⅡA族与ⅥA、ⅦA元素之间由于电负性相差较大,易形成离子键,而处于周期表中部的主族元素原子之间由于电负性相差不大,易形成共价键。
2.下列说法中哪些是不正确的,并说明理由。
(1)键能越大,键越牢固,分子也越稳定。
不一定,对双原子分子是正确的。
(2)共价键的键长等于成键原子共价半径之和。
不一定,对双原子分子是正确的。
(3)sp2杂化轨道是由某个原子的1s轨道和2p轨道混合形成的。
×由一个ns轨道和两个np轨道杂化而成。
(4)中心原子中的几个原子轨道杂化时,必形成数目相同的杂化轨道。
√(5)在CCl4、CHCl3和CH2Cl2分子中,碳原子都采用sp2杂化,因此这些分子都呈四面体形。
×sp3,CCl4呈正四面体形;CHCl2和CH2Cl2呈变形四面体形。
(6)原子在基态时没有未成对电子,就一定不能形成共价键。
×成对的电子可以被激发成单电子而参与成键。
(7)杂化轨道的几何构型决定了分子的几何构型。
×不等性的杂化轨道的几何构型与分子的几何构型不一致。
3.试指出下列分子中那些含有极性键?Br2CO2H2O H2S CH44.BF3分子具有平面三角形构型,而NF3分子却是三角锥构型,试用杂化轨道理论加以解释。
BF3中的B原子采取SP2杂化,NF3分子的N原子采取不等性的SP3杂化。
5.CH4,H2O,NH3分子中键角最大的是哪个分子? 键角最小的是哪个分子? 为什么?CH4键角最大(109028,),C采取等性的SP3杂化,NH3(107018,), H2O分子中的N、O采用不等性的SP3杂化,H2O分子中的O原子具有2对孤电子对,其键角最小(104045,)。
6.解释下列各组物质分子中键角的变化(括号内为键角数值)。
(1) PF3(97.8°),PCl3(100.3°),PBr3(101.5°)中心原子相同,配体原子F、Cl、Br的电负性逐渐减小,键电子对的斥力逐渐增加,所以键角逐渐增加(2) H2O(104°45'),H2S(92°16'),H2Se(91°)配位原子相同,中心原子的电负性逐渐减小,键电子对的斥力逐渐减小,所以键角逐渐减小7.试用分子轨道法写出下列分子或粒子的分子轨道表示式,并指出其中有哪几种键?是顺磁性、还是反磁性的物质? O 2 O 22- N 2 N 22-O 2和N 2见教材,O 22-和N 22-的分子轨道分别为: O 22-()()()()()()()()()222222222112222222x y z y z s s s s p p p p p σσσσσππππ****⎡⎤⎢⎥⎣⎦具有1个双电子的σ键,是反磁性物质。
无机化学答案

第六章化学平衡常数6-1 写出下列各反应的标准平衡常数表达式。
(1)2SO2(g) + O2(g) = 2SO3(g)(2)NH4HCO3(s) = NH3(g) + CO2(g) + H2O(g)(3)CaCO3(s) = CO2(g) + CaO(s)(4)Ag2O = 2Ag(s) + 1/2 O2(g)(5)CO2(g) = CO2(aq)(6)Cl2(g) + H2O(l) = H+(aq) + Cl-(aq) + HClO(aq)(7)HCN(aq) = H+(aq) + CN-(aq)(8)Ag2CrO4(s) = 2Ag+(aq) + CrO42-(aq)(9)BaSO4(s) + CO32-(aq) = BaCO3(s) + SO42-(aq)(10)Fe2+(aq) + 1/2 O2(g) + 2H+(aq) = Fe3+(aq) + H2O(l)6-2已知反应ICl(g) = 1/2 I2(g) + 1/2 Cl2(g) 在25℃时的平衡常数为Kθ= ×10-3,试计算下列反应的平衡常数:(1)ICl(g) = I2(g) + Cl2(g)(2)1/2 I2(g) + 1/2 Cl2(g) = ICl(g)6-3 下列反应的Kp 和Kc之间存在什么关系?(1)4H2(g) + Fe3O4(s) = 3Fe(s) + 4H2O(g)(2)N2(g) + 3H2(g) = 2NH3(g)(3)N2O4(g) = 2NO2(g)6-4实验测得合成氨反应在500℃的平衡浓度分别为:[H2]=L ,[N2]=L ,[NH3]=L ,求标准平衡常数K θ、浓度平衡常数Kc以及分别用Pa 为气体的压力单位和用bar为气体的压力单位的平衡常数Kp。
6-5已知HCN = H+ + CN- K1θ= ×10-10NH3 + H2O = NH4+ + OH- K2θ= ×10-5H2O = H+ + OH-K3θ= ×10-14求反应NH3 + HCN = NH4+ + CN-的平衡常数Kθ。
2016届无机化学第六章试题答案
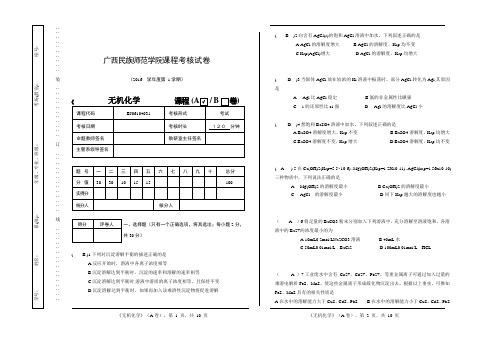
∶∶∶∶∶∶∶∶∶∶装∶∶∶∶∶∶∶∶∶∶∶订∶∶∶∶∶∶∶∶∶∶∶∶∶线∶∶∶∶∶∶∶∶∶∶∶∶∶∶∶∶广西民族师范学院课程考核试卷(2016 学年度第1学期)一、选择题(只有一个正确选项,将其选出;每小题2分,共30分)( B )1.下列对沉淀溶解平衡的描述正确的是A.反应开始时,溶液中各离子浓度相等B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变D.沉淀溶解达到平衡时,如果再加入该难溶性沉淀物将促进溶解( B )2.向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是A.AgCl的溶解度增大B.AgCl的溶解度、Ksp均不变C.Ksp(AgCl)增大D.AgCl的溶解度、Ksp均增大( D )3.当固体AgCl放在较浓的Kl溶液中振荡时,部分AgCl转化为Agl,其原因是A. Agl比AgCl稳定B.氯的非金属性比碘强C. l-的还原性比cl-强D. Agl的溶解度比AgCl小( D )4.想饱和BaSO4溶液中加水,下列叙述正确的是A.BaSO4溶解度增大、Ksp不变B.BaSO4溶解度、Ksp均增大C.BaSO4溶解度不变、Ksp增大D.BaSO4溶解度、Ksp均不变( A ) 5.在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2X10-11)、AgCl(ksp=1.56x10-10)三种物质中,下列说法正确的是A .Mg(OH)2的溶解度最小 B.Ca(OH)2的溶解度最小C. AgCl 的溶解度最小D.同下Ksp越大的溶解度也越小( A )6.将足量的BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。
各溶液中的Ba2+的浓度最小的为A.10mL0.2mol/LNa2CO3溶液B.40mL水C.50mL0.01mol/L BaCl2D.100mL0.01mol/L HCL( A )7.工业废水中含有Cu2+、Cd2+、Pb2+、等重金属离子可通过加入过量的难溶电解质FeS、MnS,使这些金属离子形成硫化物沉淀出去。
无机化学答案

第六章氧化还原平衡及氧化还原滴定法习题1.下列物质中元素的氧化数;1CrO42-中的Cr 2MnO42-中的Mn3Na2O2 中的O 4H2C2O4·2H2O中的C解答:1Cr:+6;2Mn:+6;3O:-1;4C:+32. 下列反应中,哪些元素的氧化数发生了变化并标出氧化数的变化情况;1Cl2+H2O=HClO+HCl2Cl2+H2O2=2HCl+O23Cu+2H2SO4浓=CuSO4+SO2+2H2O4K2Cr2O7+6KI+14HCl=2CrCl3+3I2+7H2O+8KCl 解答:1Cl:from 0 to+1and-12Cl:from 0to -1;O:from -1 to 03Cu:from 0 to +2;S:from +6 to +44Cr:from +6 to +3;I:from -1 to 03. 用离子电子法配平下列在碱性介质中的反应式;1Br2+OH-→BrO3-+Br-2Zn +ClO-→ZnOH42-+Cl-3MnO4-+SO32-→MnO42-+SO42-4 H2O2+CrOH4-→CrO42-+H2O解答:1 Br2+12OH-=2BrO3-+6H2O+10e2e+Br2=2Br-×56Br2+12OH-=2BrO3-+6H2O+10 Br-(2)Zn +4OH-=ZnOH42-+2eH2O+ClO-+2e=2OH-+Cl-Zn +H2O+2OH-+ClO-=ZnOH42-+Cl-3MnO4-+e=MnO42-×22OH-+SO32-=H2O+SO42-+2e2MnO4-+2OH-+SO32-=2MnO42-+H2O+SO42-4 H2O2+2e=2OH-×34OH-+CrOH4-=CrO42-+4 H2O+3e×23 H2O2+2OH-+2CrOH4-=2CrO42-+8 H2O4. 用离子电子法配平下列在酸性介质中的反应式;1 S2O82-+Mn2+→MnO4-+SO42-2 PbO2+HCl →PbCl2 +Cl2 +H2O3 Cr2O72-+Fe2+→Cr3++Fe3+4 I2+H2S→I-+S解答:1 S2O82-+2e=2SO42-×54H2O+Mn2+=MnO4-+8H++5e×25 S2O82-+8H2O+2 Mn2+=2MnO4-+16H++10SO42-2 PbO2+4H++2e=Pb2++2H2O2Cl-=Cl2 +2ePbO2+4HCl =PbCl2 +Cl2 +2H2O3 Cr2O72-+14H++6e =2Cr3++7H2OFe2+=Fe3++e×6Cr2O72-+14H++6 Fe2+=2Cr3++7H2O+6 Fe3+4 I2+2e=2I-H2S=S+2H++2eI2+H2S=2I-+S +2H+5.Diagram galvanic cells that have the following net reactions.1 Fe + Cu2+ = Fe2+ + Cu2 Ni + Pb2+ = Ni2+ + Pb3 Cu + 2Ag+ = Cu2+ + 2Ag4 Sn + 2H+ = Sn2+ + H2解答:1. -Fe| Fe2+c1‖Cu2+c2 |Cu+2. -Ni| Ni2+c1‖Pb2+c2 |Pb+3. -Cu| Cu2+c1‖Ag+c2 |Ag+4. -Sn| Sn2+c1‖H+c2 |H2,Pt+6. 下列物质在一定条件下都可以作为氧化剂:KMnO4、K2Cr2O7、CuCl2、FeCl3、H2O2、I2、Br2、F2、PbO2试根据标准电极电势的数据,把它们按氧化能力的大小排列成顺序,并写出它们在酸性介质中的还原产物;解答:氧化能力由大到小排列如下:解答:1F 2、2H 2O 2、3KMnO 4 、4PbO 2、 5K 2Cr 2O 7 、6Br 2 、7FeCl 3、8I 2、9CuCl 2 在酸性介质中的还原产物依次如下:F -、H 2O 、Mn 2+、Pb 2+、Cr 3+、Br -、Fe 2+、I -、Cu7..Calculate the potential of a cell made with a standard bromine electrode as the anode and a standard chlorine electrode as the cathode.解答:已知φ Cl 2/Cl -=; φ Br 2l/Br -=则电动势E =φ+-φ-=-=V8. Calculate the potential of a cell based on the following reactions at standard conditions.1 2H 2S +H 2SO 3 → 3S +3H 2O 22Br -+2Fe 3+→Br 2 +2Fe 2+3Zn +Fe 2+→Fe +Zn 2+42MnO 4-+5H 2O 2+6HCl →2MnCl 2 +2KCl +8H 2O +5O 2 解答:1 2- 3 49. 已知 MnO 4-+8H ++5e = Mn 2++4H 2O = Fe 3++e =Fe 2+= 1判断下列反应的方向MnO 4-+5Fe 2++8H +→ Mn 2++4H 2O +5Fe 3+2将这两个半电池组成原电池,用电池符号表示该原电池的组成,标明电池的正、负极,并计算其标准电动势;3当氢离子浓度为10mol ·L -1,其它各离子浓度均为1mol ·L -1时,计算该电池的电动势;解答:1MnO 4-+5Fe 2++8H +→ Mn 2++4H 2O +5Fe 3+正向进行2 -Pt| Fe 2+c 1,Fe 3+c 2‖MnO 4-c 3,Mn 2+c 4 | Pt +E =-= 3 E =+5lg108-=-=10. 已知下列电池Zn| Zn 2+x mol ·L -1‖Ag +mol ·L -1|Ag 的电动势E = 求Zn 2+离子的浓度;解答:E = +- -= Ag+/Ag ++- Zn2+/Zn +20592.0lg c Zn2+=·L + -+20592.0lg c Zn2+=·L ∴ cZn 2+= mol ·L -111.当HAc 浓度为 mol ·L -1,pH 2=100kPa,测得 HAc/ H 2=.求溶液中H +的浓度和HAc 的解离常数K a解:由题意得,HAc/H 2= H +/H 2+2lgH +2/pH 2/p= lgH +=可得H +=×10-3 mol ·L -1 HAc 的解离常数K a = H +2/c- H + =×10-512.在标准状态下,MnO 2和HCl 反应能否制得Cl 2如果改用12 mol ·L -1的浓盐酸呢设其他物质仍处于标准态解:由题意得,正极反应:MnO 2+2e+4H +→Mn 2++2H 2O 负极反应:4HCl 浓→Cl 2+2Cl -+4H ++2e 标准状况下E= E MnO 2/ Mn 2+-E Cl 2/ Cl -=故此时不能制得Cl 2; 改用12 mol ·L-1的浓盐酸时,E=E MnO 2/ Mn 2+-2lg1/ H +4-ECl 2/ Cl --2lg H +4Cl -2 =+×4×2-说明改用12 mol ·L-1的浓盐酸时能制得氢气13. 为了测定PbSO 4的溶度积,设计了下列原电池- Pb| PbSO 4| SO 42-mol ·L -1‖Sn 2+mol ·L -1|Sn + 在25C 时测得电池电动势E =,求PbSO 4 溶度积常数K sp ; 解答:∵正=- =-负 ∴负=- ∵Pb 2+SO 42-=K sp ∴-=-+20592.0lgPb 2+=+20592.0lg 1K θsp∴K sp =⨯-814.利用下述电池可以测定溶液中Cl -的浓度,当用这种方法测定某地下水Cl -含量时,测得电池的电动势为,求某地下水中Cl-的含量- Hgs| Hg 2Cl 2l | KCl 饱和 ‖Cl -c | AgCls |Ags +解:由题意得:EAgCls /Ags = E AgCls /Ags+Cl -= lgCl - 查表得EHgs/ Hg 2Cl 2l / KCl 饱和 =故电池的电动势为E = E +-E - = lgCl - =lgCl - = 故Cl -=×10-6 mol·L -115. 根据标准电极电势计算298K 时下列电池的电动势及电池反应的平衡常数 1 - Pbs| Pb 2+mol ·L -1‖Cu 2+mol ·L -1|Cus + 2 - Sns| Sn 2+mol ·L -1‖H +mol ·L -1|H 2105Pa,Pts +3 -Pt,H 2105Pa|H +1 mol ·L -1‖Sn 4+mol ·L -1,Sn 2+mol ·L -1 |Pt + 4 -Pt,H 2105Pa|H +mol ·L -1‖H +mol ·L -1|H 2105Pa,Pt +解答:1 负=-+20592.0=- 正=+20592.0=E =--= E =+= lgK =0592.0463.02⨯ ∴K =×10152正=0负=-+20592.0= ∴E = lgK =0592.0136.02⨯ ∴K =×1043 负=0 正=+20592.0lg 1.05.0= ∴E = lgK =0592.0151.02⨯ ∴K =×1054正=0负=0+20592.0lg 1)01.0(2=-∴E = K =1 16.下列三个反应:1A +B +=A ++B2A +B 2+=A 2++B 3A +B 3+=A 3++B 的平衡常数值相同,判断下述那一种说法正确 a 反应1的值最大而反应3的值最小; b 反应3的值最大;c 不明确A 和B 性质的条件下无法比较值的大小;d 三个反应的值相同; 答:C17.试根据下列元素电势图:A/V回答Cu +、Ag +、Au +、Fe 2+等离子哪些能发生歧化反应; 解答:Cu +、Au +能发生歧化; 18.计算在1 mol ·L-1溶液中用Fe 3+滴定Sn 2+的电势突跃范围;在此滴定中应选用什么指示剂若用所选指示剂,滴定终点是否和化学计量点符合 解答: Sn 4+/ Sn 2+= Fe 3+/ Fe 2+=突跃范围:+3×20592.0= V ~—3×10592.0 = V 选次甲基蓝;符合,sp =3154.02771.01⨯+⨯=19.将含有BaCl 2的试样溶解后加入K 2CrO 4使之生成BaCrO 4沉淀,过滤洗涤后将沉淀溶于HCl 再加入过量的KI 并用Na 2S 2O 3溶液滴定析出的I 2,若试样为0.4392g,滴定时耗去 mol ·L-标准溶液,计算试样中BaCl 2的质量分数;解答: Ba 2++CrO 42-=BaCrO 4 2CrO 42-+6I -+16H +=2Cr 3++8H 2O +3I 2I 2+2 Na 2S 2O 3=Na 2S 4O 6+2NaI∴Ba 2+~ CrO 42-~3/2 I 2~3 S 2O 32-nBa 2+=1/3n S 2O 32-BaCl 2%=4392.03.208311061.291007.03⨯⨯⨯⨯-=%20. 用KMnO 4法测定硅酸盐样品中的Ca 2+含量,称取试样0.5863g,在一定条件下,将钙沉淀为CaC 2O 4,过滤、洗涤沉淀,将洗净的CaC 2O 4溶解于稀H 2SO 4中,用 mol ·L -1 KMnO 4的标准溶液滴定,消耗,计算硅酸盐中Ca 的质量分数; 解答:5Ca 2+~5C 2O 42-~2MnO 4-nCa 2+=52nMnO 4- ∴ nCa 2+= molCa 2+ %=%14.221005863.0100008.4005052.064.2525=⨯⨯⨯⨯ 21. 大桥钢梁的衬漆用红丹Pb 3O 4作填料,称取0.1000g 红丹加HCl 处理成溶液后再加入K 2CrO 4,使定量沉淀为PbCrO 4:Pb 2+ + CrO 4 2- == PbCrO 4将沉淀过滤、洗涤后溶于酸并加入过量的KI,析出I 2以淀粉作指示剂用 mol ·L -1Na 2S 2O 3溶液滴定用去,求试样中Pb 3O 4的质量分数; 解答: 2 CrO 42-+6I -+16H +=2Cr 3++8H 2O+3I 2I 2 +2Na 2S 2O 3= Na 2S 4O 6+2NaIPb 3O 4~3 PbCrO 4~3 CrO 4 2-~9/2 I 2~9Na 2S 2O 3nPb 3O 4=1/9nNa 2S 2O 3∴ Pb 3O 4%=41.911001000.06.6851000.121000.0913=⨯⨯⨯⨯⨯-%22. 抗坏血酸摩尔质量为176.1g ·mol -1是一个还原剂,它的半反应为: C 6H 6O 6 + 2H + + 2e === C 6H 8O 6它能被I 2氧化;如果柠檬水果汁样品用HAC 酸化,并加入 mol ·L -1I 2溶液,待反应完全后,过量的I 2用 mol ·L -1Na 2S 2O 3滴定,计算每毫升柠檬水果汁中抗坏血酸的质量; 解答:C 6H 6O 6 ~I 2~2 Na 2S 2O 3 nC 6H 6O 6 = nI 2 =1/2 ×nNa 2S 2O 3∴W =ml g /007924.000.1010001.176)01000.000.102102500.000.20(=⨯⨯⨯-⨯ 23. 已知 Hg 2Cl 2s +2e =2Hgl +2Cl -= Hg 22++2e =2Hgl = 求: KspHg 2Cl 2 提示: Hg 2Cl 2s =Hg 22++2Cl -解答:Hg 2Cl 2s +2e =2Hgl +2Cl -Hg 22++2e =2Hgl 将上述两方程式相减得:Hg 2Cl 2s =Hg 22++2Cl -E =-此反应的平衡常数K,即是的Hg2Cl2s K sp,因此:lgK=lgK sp=0592.0)52.0(2-⨯=-K=10-KspHg2Cl2= K=10-=×10-1824. 已知下列标准电极电势Cu2++2e =Cu =Cu2++e =Cu+=1.计算反应Cu+Cu2+=2Cu+的平衡常数;2 已知KspCuCl=×10-6,试计算下面反应的平衡常数;Cu+Cu2++2Cl-== 2CuCl↓解答:1 Cu2++2e =CuCu2++e =Cu+Cu2+Cu+Cu21158.0⨯= ∴=lgK=0592.01 )522.0158.0(⨯-∴K=×10-7 2对负极:CuCl+e=Cu+Cl-Ksp=Cu+Cl-CuCl/Cu =+10592.0lgCu+=+lg][-ClKsp因为Cl-=1mol/LCuCl/Cu=+=对正极:Cu2++e+Cl-== CuCl↓Cu2+/Cucl=Cu2+/Cu=Cu2+/Cucl+lgCu2+/Cu+=+ lg1/ KspCuCl=+ lg1/×10-6=∴lgK=0592.01 )171.0504.0(⨯-=∴K=×10525. 吸取含有的IO3-和IO4-试液,用硼砂调溶液pH,并用过量KI处理,使IO4-转变为IO3-,同时形成的I 2用去 mol ·L -1Na 2S 2O 3溶液;另取试液,用强酸酸化后,加入过量KI,需同浓度的Na 2S 2O 3溶液完成滴定,用去;计算试液中IO 3-和IO 4-的浓度;.解答:IO 4-+ 2 I -+2H +=IO 3-+I 2+H 2O , IO 4-~I 2~2 Na 2S 2O 3 , nIO 4-=1/2nNa 2S 2O 3CIO 4-=00.501000.040.1821⨯⨯ = L强酸酸化以后:7 I -+8H +=4I 2+4H 2O , IO 4-~4I 2~8 Na 2S 2O 3 , nIO 4-=1/8nNa 2S 2O 3 IO 3-+5 I -+6 H +=3 I 2+3 H 2O , IO 3-~3 I 2~6 Na 2S 2O 3 , nIO 3-=1/6nNa 2S 2O 3 I 2+2 Na 2S 2O 3= Na 2S 4O 6+NaI ,设滴定IO 4-所消耗的Na 2S 2O 3的体积数为V 1ml,滴定IO 3-为V 2ml则×10 = 1/8× V 1 = V 2 = = ×C IO 4-= 1/6×× ∴CIO 4- = mol/L26.测定铜含量的分析方法为间接碘量法:2Cu 2++4H +=2CuI+I 2 I 2+2S 2O 32-=2I -+S 4O 62-用此法分析铜矿样中的铜的含量,为了使 mol·L -1Na 2S 2O 3标准溶液能准确滴定﹪的Cu,应称取铜矿样多少克解:由题意得:Cu 2+~ S 2O 32-nCu 2+= nS 2O 32-= mol·L -1××10-3L=×10-4 mol 故mCu 2+= nCu 2+×MCu 2+=×10-4 mol×63.55 g·mol -1= ×10-3 g故应称取铜矿样:mCu 2+/﹪=0.6673 g27. Calculate the standard free energy change at 25℃ for the reaction Cds +Pb 2+aq → Cd 2+aq +Pbs.解答:Cds +Pb 2+aq → Cd 2+aq +Pbs Cd2+/ Cd =- pb2+/ pb =-∴E =---=ΔG =-nF E =2×96500× =-53461 J ·mol =- KJ · mol28. Calculate the potential at 25℃ for the cellCd ∣Cd 2+·L ‖Pb 2+·L ∣PbThe cell reaction and standard state potential of the cell were determined in exercise 7-25.解答:正=-+20592.0=- 负=-+20592.0=-∴E =---=。
大学无机化学第六章试题及答案

第六章化学键理论本章总目标:1:掌握离子键、共价键和金属键的基本特征以及它们的区别;2:了解物质的性质与分子结构和键参数的关系;3:重点掌握路易斯理论、价电子对互斥理论、杂化轨道理论以及分子轨道理论。
4:熟悉几种分子间作用力。
各小节目标:第一节:离子键理论1:掌握离子键的形成、性质和强度,学会从离子的电荷、电子构型和半径三个方面案例讨论离子的特征。
2:了解离子晶体的特征及几种简单离子晶体的晶体结构,初步学习从离子的电荷、电子构象和半径三个方面来分析离子晶体的空间构型。
第二节:共价键理论1;掌握路易斯理论。
2:理解共价键的形成和本质。
掌握价键理论的三个基本要点和共价键的类型。
3:理解并掌握价层电子对互斥理论要点并学会用此理论来判断共价分子的结构,并会用杂化轨道理论和分子轨道理论来解释分子的构型。
实用文档第三节:金属键理论了解金属键的能带理论和三种常见的金属晶格。
第四节:分子间作用力1:了解分子极性的判断和分子间作用力(范德华力)以及氢键这种次级键的形成原因。
2;初步掌握离子极化作用及其强度影响因素以及此作用对化合物结构及性质的影响。
习题一选择题1.下列化合物含有极性共价键的是()(《无机化学例题与习题》吉大版)A.KClO3B.Na2O2C. Na2OD.KI2.下列分子或离子中键能最大的是()实用文档A. O2B.O2-C. O22+D. O22-3. 下列化合物共价性最强的是()(《无机化学例题与习题》吉大版)A.LiIB.CsIC. BeI2D.MgI24.极化能力最强的离子应具有的特性是()A.离子电荷高,离子半径大B.离子电荷高,离子半径小C.离子电荷低,离子半径小D.离子电荷低,离子半径大5. 下列化合物中,键的极性最弱的是()(《无机化学例题与习题》吉大版)A.FeCl3B.AlCl3C. SiCl4D.PCl56.对下列各组稳定性大小判断正确的是()A.O2+>O22-B. O2->O2C. NO+>NOD. OF->OF7. 下列化合物中,含有非极性共价键的离子化合物是()(《无机化学例题与习题》吉大版)A.H2O2B.NaCO3C. Na2O2D.KO38.下列各对物质中,是等电子体的为()实用文档A.O22-和O3B. C和B+C. He和LiD. N2和CO9. 中心原子采取sp2杂化的分子是()(《无机化学例题与习题》吉大版)A.NH3B.BCl3C. PCl3D.H2O10.下列分子中含有两个不同键长的是()A .CO2 B.SO3 C. SF4 D.XeF411. 下列分子或离子中,不含有孤电子对的是()(《无机化学例题与习题》吉大版)A. H2OB. H3O+C. NH3D. NH4+12.氨比甲烷易溶于水,其原因是()A.相对分子质量的差别B.密度的差别C. 氢键D.熔点的差别13. 下列分子属于极性分子的是()(《无机化学例题与习题》吉大版)A. CCl4B.CH3OCH3C. BCl3D. PCl514.下列哪一种物质只需克服色散力就能使之沸腾( )A.HClB.CH3Cll4D.NH3实用文档15. 下列分子中,中心原子采取等性杂化的是()(《无机化学例题与习题》吉大版)实用文档A. NCl3B.SF4C. CH Cl3D.H2O16.下列哪一种物质既有离子键又有共价键( )A.NaOHB.H2OC.CH3ClD.SiO217. 下列离子中,中心原子采取不等性杂化的是()(《无机化学例题与习题》吉大版)A. H3O+B. NH4+C. PCl6-D.BI4-18.下列哪一种分子的偶极矩最大( )A.HFB.HClC.HBrD.HI19. 下列分子中,属于非极性分子的是()(《无机化学例题与习题》吉大版)A.SO2B.CO2C. NO2D.ClO220.下列分子或离子中,中心原子的杂化轨道与NH3分子的中心原子轨道最相似的是()(《无机化学例题与习题》吉大版)A. H2OB. H3O+C. NH4+D. BCl321.下列分子或离子中,构型不为直线形的是()(《无机化学例题与习实用文档题》吉大版)A. I3+B. I3-C. CS2D. BeCl222. 下列分子不存在Ⅱ键的是()(《无机化学例题与习题》吉大版)A. COCl2B. O3C.SOCl2D. SO323. 下列分子中含有不同长度共价键的是()(《无机化学例题与习题》吉大版)A. NH3B. SO3C. KI3D. SF424. 下列化合物肯定不存在的是()(《无机化学例题与习题》吉大版)A. BNB. N2H4C. C2H5OHD. HCHO二填空题1.比较大小(《无机化学例题与习题》吉大版)(1)晶格能AlF3AlCl3NaCl KCl(2)溶解度CuF2CuCl2Ca(HCO3) NaHCO32.NO+、NO2、NO2-的几何构型分别是、、、其中键角最小的是。
无机化学试题(含答案)

无机化学试题第一章气体填空题:1、某广场上空有一气球,假定气压在一日内基本不变,早晨气温15℃时,气球体积为25.0L;中午气温为30℃,则其体积为 26.3 L;若下午的气温为25℃,气球体积为 25.9 L。
2、某真空集气瓶的质量为134.567g。
将一温度为31℃,压力为98.0 kPa的气体充入其中,然后再称其质量为137.456g,则该气体的质量m= 2.889g。
如果集气瓶中装满31℃的水,其总质量为1067.9g(该温度下水的密度为0.997g·mL-1),集气瓶的容积为0.936 L;该气体的密度ρ= 3.09 g.·L-1,摩尔质量M=79.6g·moI-1。
3、恒定温度下,将1.0L 204kPa的氮气与2.0L 303kPa的氧气充入容积为3.0L的真空容器中,则p(N2)= 68 kPa; p(O2)= 202 kPa; 容器内的总压力p=270 kPa。
4、在温度T时,在容积为c L的真空容器中充入氮气和氩气。
容器内压力为a kPa,若p(N2)=b kPa, 则p(Ar)= a-b kPa; N2和Ar的分体积分别为 bc/aL和 (a-b)c/a L; n(N2)= bc/RT mol,n(Ar)= (a-b)c/RT mol。
5、在相同温度、压力、体积下,两种气体的摩尔质量分别为M1和M2(M1>M2)。
试比较:n1 = n2, m1> m2; Ēk,1= Ēk,2; v1< v2; ρ1>ρ2。
若体积增大,温度、压力保持不变,则ρ1, ρ2都不变。
选择题:1、一定温度下,某容器中含有相同质量的H2,O2,N2与He的混合气体,其中分压最小的组分是………………………………………………………………( B )(A)N2 (B)O2(C)H2(D)He2、某温度下,一容器中含有2.0mol O2,3.0mol N2及1.0mol Ar。
无机化学第六章 练习答案

第六章 练习 一、选择题1. 从含有0.10 mol·L -1 Ag +的溶液中除去90%的Ag +,平衡时[24CrO -]等于( D )。
[K sp (Ag 2CrO 4)=2×10-12](A)2×10-12 (B)2×10-l1 (C)2×10-10 (D)2×10-82. 已知K sp :AgCl(1× 10-10),Ag 2CrO 4 (9 × l0-12),Ag 2C 2O 4 (3×l0-11)和AgBr(5×10-13)。
在下列难溶盐的饱和溶液中,Ag +浓度最大的是( C )。
(A)AgCl (B) Ag 2CrO 4 (C) Ag 2C 2O 4 (D) AgBr3. 下列有关分步沉淀的叙述正确的是( B )。
(A) 溶度积小者一定先沉淀出来 (B) 沉淀时所需沉淀试剂小者先沉淀出来 (C) 溶解度小的物质先沉淀 (D) 被沉淀离子浓度大的先沉淀4.在下列试剂中溶解度最大的是( A )。
(A) 0.10 mol·L -1 HAc (B) 0.10mol·L -1Sr(NO 3)3 (C) 纯水 (D) 1.0mol·L -1 Na 2CO 35. 欲使CaCO 3在水溶液中溶解度增大,可以采用的方法是( D )。
(A) 加入1.0 mol·L -1 Na 2CO 3 (B) 加入1.0 mol·L -1NaOH (C) 加入0.10mol·L -1CaCl 2 (D) 降低溶液的pH6. 向饱和AgCl 溶液中加水,下列叙述中正确的是( B )。
(A) AgCl 的溶解度增大 (B) AgCl 的溶解度,均不变 (C) AgCl 的增大 (D)AgCl 的溶解度,增大7. 欲使,转化为必使( D )。
(A) (B)(C) (D)二、填空题3SrCO sp K θspK θspK θ()12238.310SP Ag CO K θ-=⨯()12224 5.310SP Ag C O K θ-=⨯()()22_2430.64c C O c CO -<()()22_2431.6c C O c CO ->()()22_2431.6c C O c CO -<()()22_2430.64c C O c CO ->1. 某难溶强电解质M 2A ,在纯水中它的溶解度S =__________。
无机化学(华东理工大学)智慧树知到答案章节测试2023年

第一章测试1.等温等压下,气体A和B的体积分别为VA和VB,将它们混合,保持温度不变,则它们的分压比为 pA:pB = VB:VA。
A:错B:对答案:A2.分压定律适用于真实气体混合物的条件,除在所处的温度区间内气体间不发生化学反应外,这些气体所处的状态是:A:高温,高压;B:低温,低压;C:低温,高压。
D:高温,低压;答案:D3.混合气体中,某组分的分压是指:A:同一容器中,该组分气体在273.15K时所产生的压力;B:该组分气体在273.15K时所产生的压力;C:同温度时,该组分气体单独占据与混合气体相同体积时所产生的压力。
D:相同温度时,该组分气体在容积为1.0L的容器中所产生的压力;答案:C4.混合等物质的量的N2与O2,则混合气体的平均相对分子质量是:A:31。
B:32;C:62;D:30;答案:D5.在等温等压下,使5.0 m3的空气与过量碳反应,全部生成CO,则反应后比反应前气体体积增加的分数为:A:21%;B:36%。
C:100%;D:42%;答案:A6.实验室用排水集气法制取氢气。
在23oC、100.5 kPa下,收集了480.0 mL气体,已知23 oC 时水的饱和蒸气压为2.81 kPa,试计算氢气的物质的量:A:1.91´ 10-2mol;B:1.91´ 10-1mol;C:1.91mol。
D:1.91´ 10-3mol答案:A7.硼和氯的相对原子质量分别为10.81和35.5。
现有含硼、氯的质量分数分别为23%、77% 的固体硼氯化物试样0.0516g,在69℃完全蒸发,蒸气在2.96 kPa时占有体积268 mL。
则该化合物的化学式:A:BCl3;B:B2Cl4;C:B3Cl3;D:B4Cl4答案:D8.已知在25oC时苯的蒸气压为12.3 kPa。
当0.100mol苯的蒸气体积为10.2L和30.0L时,苯气体的压力分别是:A:12.3,8.24;B:12.3,12.3;C: 8.24,12.3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第六章化学键理论本章总目标:1:掌握离子键、共价键和金属键的基本特征以及它们的区别;2:了解物质的性质与分子结构和键参数的关系;3:重点掌握路易斯理论、价电子对互斥理论、杂化轨道理论以及分子轨道理论。
4:熟悉几种分子间作用力。
各小节目标:第一节:离子键理论1:掌握离子键的形成、性质和强度,学会从离子的电荷、电子构型和半径三个方面案例讨论离子的特征。
2:了解离子晶体的特征及几种简单离子晶体的晶体结构,初步学习从离子的电荷、电子构象和半径三个方面来分析离子晶体的空间构型。
第二节:共价键理论1;掌握路易斯理论。
2:理解共价键的形成和本质。
掌握价键理论的三个基本要点和共价键的类型。
3:理解并掌握价层电子对互斥理论要点并学会用此理论来判断共价分子的结构,并会用杂化轨道理论和分子轨道理论来解释分子的构型。
第三节:金属键理论了解金属键的能带理论和三种常见的金属晶格。
第四节:分子间作用力1:了解分子极性的判断和分子间作用力(范德华力)以及氢键这种次级键的形成原因。
2;初步掌握离子极化作用及其强度影响因素以及此作用对化合物结构及性质的影响。
习题一选择题1.下列化合物含有极性共价键的是()(《无机化学例题与习题》吉大版)A.KClO3B.Na2O2C. Na2OD.KI2.下列分子或离子中键能最大的是()A. O2B.O2-C. O22+D. O22-3. 下列化合物共价性最强的是()(《无机化学例题与习题》吉大版)A.LiIB.CsIC. BeI2D.MgI24.极化能力最强的离子应具有的特性是()A.离子电荷高,离子半径大B.离子电荷高,离子半径小C.离子电荷低,离子半径小D.离子电荷低,离子半径大5. 下列化合物中,键的极性最弱的是()(《无机化学例题与习题》吉大版)A.FeCl3B.AlCl3C. SiCl4D.PCl56.对下列各组稳定性大小判断正确的是()A.O2+>O22-B. O2->O2C. NO+>NOD. OF->OF7. 下列化合物中,含有非极性共价键的离子化合物是()(《无机化学例题与习题》吉大版)A.H2O2B.NaCO3C. Na2O2D.KO38.下列各对物质中,是等电子体的为()A.O22-和O3B. C和B+C. He和LiD. N2和CO9. 中心原子采取sp2杂化的分子是()(《无机化学例题与习题》吉大版)A.NH3B.BCl3C. PCl3D.H2O10.下列分子中含有两个不同键长的是()A .CO2 B.SO3 C. SF4 D.XeF411. 下列分子或离子中,不含有孤电子对的是()(《无机化学例题与习题》吉大版)A. H2OB. H3O+C. NH3D. NH4+12.氨比甲烷易溶于水,其原因是()A.相对分子质量的差别B.密度的差别C. 氢键D.熔点的差别13.下列分子属于极性分子的是()(《无机化学例题与习题》吉大版)A. CCl4B.CH3OCH3C. BCl3D. PCl514.下列哪一种物质只需克服色散力就能使之沸腾( )A.HClB.CH3Cl l4D.NH315.下列分子中,中心原子采取等性杂化的是()(《无机化学例题与习题》吉大版)A. NCl3B.SF4C. CH Cl3D.H2O16.下列哪一种物质既有离子键又有共价键( )A.NaOHB.H2O C.CH3Cl D.SiO217.下列离子中,中心原子采取不等性杂化的是()(《无机化学例题与习题》吉大版)A. H3O+B. NH4+C. PCl6-D.BI4-18.下列哪一种分子的偶极矩最大( )A.HFB.HClC.HBrD.HI19.下列分子中,属于非极性分子的是()(《无机化学例题与习题》吉大版)A.SO2B.CO2C. NO2D.ClO220.下列分子或离子中,中心原子的杂化轨道与NH3分子的中心原子轨道最相似的是()(《无机化学例题与习题》吉大版)A. H2OB. H3O+C. NH4+D. BCl321.下列分子或离子中,构型不为直线形的是()(《无机化学例题与习题》吉大版)A. I3+B. I3-C. CS2D. BeCl222. 下列分子不存在Ⅱ键的是()(《无机化学例题与习题》吉大版)A. COCl2B. O3C.SOCl2D. SO323. 下列分子中含有不同长度共价键的是()(《无机化学例题与习题》吉大版)A. NH3B. SO3C. KI3D. SF424. 下列化合物肯定不存在的是()(《无机化学例题与习题》吉大版)A. BNB. N2H4C. C2H5OHD. HCHO二填空题1.比较大小(《无机化学例题与习题》吉大版)(1)晶格能AlF3AlCl3NaCl KCl(2)溶解度CuF2CuCl2Ca(HCO3) NaHCO32.NO+、NO2、NO2-的几何构型分别是、、、其中键角最小的是。
3. 给出晶宝包中离子总数:立方ZnS ;NaCl ;CsCl 。
(《无机化学例题与习题》吉大版)4.CO2是分子;SO2是分子;BF3是分子;NF3是分子;PF5是分子。
5.下列各物质中,是CO的等电子体的有。
NO, O2, N2, HF, CN-。
(《无机化学例题与习题》吉大版)6.惰性气体由于存在,可在高压、温度极低时液化,而且随着增加,其沸点升高。
7.下列分子或离子中键角有大到小排列的顺序是。
(《无机化学例题与习题》吉大版)①B Cl3 ②NH3③H2O④PCl4+ ⑤HgCl28.CS2分子空间构型是直线形,C原子以2个sp杂化轨道分别和2个硫原子形成共价键。
CS2分子是分子;Cl2O分子的空间构型是V形,O原子以2个杂化轨道分别和2个Cl原子形成共价键。
Cl2O分子是分子。
9.离子极化的发生使键型由向过渡,通常表现出化合物的熔、沸点。
10.离子相互极化使Hg2+与S2-结合生成的化合物的键型有向转化,化合物的晶型有向转化,通常表现出化合物的熔沸点,颜色,溶解度。
(《无机化学例题与习题》吉大版)三问答题1.用VB法和MO法分别说明为什么H2能稳定存在,而He2不能稳定存在?2.下列情况要克服哪种类型的吸引力(除了色散力)?a 冰融化b NaCl溶于水c MgCO3分解为MgOd I2溶于CCl4中3.下列分子中,哪些是极性的?哪些是非极性的?为什么?(《无机化学例题与习题》吉大版)CH4、CHCl3、CO2、BCl3、H2S4.画出下列物质的结构图。
指出化学键的类型。
哪些分子中 有键?键是否有极性?分子是否有极性?H2、HCl、H2O、CS2、NH3、NaF、C2H4、Cu5.试用分子轨道能级图写出N2和O2的形成过程,并比较两分子的键级、稳定性大小。
6.说明卤素单质的熔、沸点随原子序数增加而递增的原因。
F2、Cl2、Br2、I27.氟化硼分子是否有极性,为什么?氟化硼、氯化硼、溴化硼是路易士酸还是路易士碱?8.判断下列分子或离子的中心原子杂化类型:A. PCl6-B. XeF2C. SO2D. SCl2E. OF29.应用价电子对互斥理论画出下列化合物的空间构型,确定杂化类型、化学键数,并标出孤电子对的位置。
A. XeOF4B. ClO2-C. IO65-D. PCl3E. I3-10.根据价电子对互斥理论画出下列分子(离子)的空间构型并写出中心原子的杂化轨道类型,标出孤电子对和 键。
①COCl2②ICl4-③NO3-④SO2⑤SF411.判断下列各组分子之间存在何种形式的反正间作用力。
(《无机化学例题与习题》吉大版)(1)CS2和CCl4(2)H2O和N2(3)CH3Cl (4)H2O与NH312.在H2、CH4、CH3Cl 和H2O中,分别存在何种类型的分子间作用力?四计算题1.锂的升华焓为519KJ/mol,氟化锂固体的生成热为-612KJ/mol。
求氟化锂的晶格能是多少?将所的值与氯化钠的相应值比较,并解释两者之差别。
2.利用下列数据求碘化钾的生成热△H0(KJ/mol)K(s)=K(g) +89.96K(g)=K+(g)+e +418.401/2I2(g)=I(g) +213.38I(g)+e=I-(g) -310.45I-(g)+ K+(g)=KI(s) -631.781/2I2(g)= 1/2I2(s) +31.13参考答案一选择题1. A2. C3. C4. B5. D6. C7. C8. D9.B10. B 11. D12. C 13.B 14.C 15.C 16.A 17.A 18.A 19.B 20.B 21.A 22.C 23.B 24.C 二 填空题1. (1)>,>;(2)<,<。
2. 直线型,角型,角型;NO 2-3. 8,8,24. 极性;非极性;极性;非极性5. N 2,CN -6. 色散力,色散力7.5>1>4>2>38. 直线型或非极性,sp 3不等性,极性或角型9. 离子键,共价键,降低10.离子键,共价键,离子晶体,分子晶体,降低,加深,减小三 问答题1.答:氢的电子层结构为1s 1,氦的为1s 2。
价键理论认为:He 的电子层结构为,所有电子都已互相成对,当两个氦原子相互接近时,不能在相互配对, 因为氦原子没有未成对电子,所以不能形成He 2, 在1s 轨道上有一个成单电子,当两个氢原子相互接近时,两个成单电子相互配对而形成稳定的化学键,故H 2能稳定存在。
分子轨道理论认为:如氦能形成He 2,则该分子的分子轨道排布为:2*121)()(s s σσ,其键极为(2-2)/2=0,说明不会形成He 2,因为进入成键和反键轨道的电子数目一样多,总能量互相抵消。
而对于H 2来说,其分子轨道排布为:21)(s σ 键极为(2-0)/2=1,存在一个稳定的化学键,故H 2能稳定存在。
2.答:a 情况要克服氢键,诱导力、取向力;b 情况要克服离子键;c 情况要克服共价键;d 情况要克服色散力。
3.答:CH 4、CO 2和BCl 3是非极性分子,CHCl 3是极性分子。
虽然上述5种分子它们的中心键均为极性键,但CH 4、CO 2、BCl 3的分子空间构型是完全对称的,所以为非极性分子。
而CHCl 3和H 2S 的分子空间构型不对称,所以为极性分子。
4.答:H 2:H :H ,非极性键,非极性分子HCl :H :Cl ,极性键,极性分子H 2O ::O:HH 104.50极性键,极性分子CS 2: S____C____S 极性键,非极性分子,有π键NH 3: NHHH 极性键,极性分子NaF : Na +F - 离子键(极性键),气态是极性分子,固态是离子晶体C 2H 4: C____CHH HH,极性键,非极性分子,有π键 Cu : 金属键,固态是金属晶体5.答:N 2:2242*2222*121)())(()()()(p p s s s s σπσσσσ 键极=(10-4)/2=3两个N 间形成一个σ键,两个π键O 2: 121222222222222121*)(*)()()()(*)()(*)()(pz py pz py p s s s s ππππσσσσσ 键极=(10-6)/2=2,形成一个σ键,两个三电子π键 可见,稳定性:N 2>O 26.答:卤素单质分子都是非极性分子,分子间的作用力是色散力,而色散力随着分子中电子数目的增加而增加,原子序数增加,色散力增大,分子变形性增加,所以熔点、沸点升高。
