大学无机化学第六章试题及答案
无机化学(周祖新)习题解答 第六章

第六章原子结构和元素周期律习题解答思考题1.氢原子为什么是线状光谱?谱线波长与能层间的能量差有什么关系?1.因为氢原子(也包括其他原子)核外电子按不同能量分层排布,这些能量间是不连续的。
跃迁到高能量轨道的电子回到低能量轨道时放出的能量以光的形式放出。
任一原子轨道间的能量差个数是有限的,故放出的光谱是有限的几条,所以是线状光谱。
根据hγ=△E,谱线波长λ=hc/△E。
2.原子中电子的运动有什么特点?2.原子中电子的运动有什么特点与其他微观粒子一样,具有波粒两象性。
量子力学用几率波来描述电子的运动。
3.量子力学的轨道概念与波尔原子模型的轨道有什么区别和联系?3.波尔原子模型的轨道把原子核作为球心,电子在原子核为球心的同心圆上围绕原子核旋转,也称“星系模型”。
量子力学的轨道概念是电子作为几率波,在原子核和其他电子形成的电场中运动。
用波动方程描述电子的运动,由于是微分方程,要有合理解,要确定一系列量子数,每一组量子数确定的波动方程即为一轨道。
4.比较原子轨道角度分布图与电子云角度分布图的异同。
4.原子轨道有正负之分,且原子轨道比较“胖”;电子云是原子轨道的平方,无正负之分,比原子轨道“瘦”。
5.氢原子的电子在核外出现的概率最大的地方在离核52.9pm的球壳上(正好等于波尔半径),所以电子云的界面图的半径也是52.9pm。
这句话对吗?5.不对。
电子云的界面图指包括电子运动概率很大(例如90%或99%)的等密度面的界面。
6.说明四个量子数的物理意义和取值范围。
哪些量子数决定了原子中电子的能量?6.主量子数是决定电子与原子核平均距离的参数。
其取值范围n为1、2、3、4……∞的自然数。
角量子数是电子运动角动量的参数,其取值范围l为0、1、2、3、……(n-1)的自然数。
磁量子数是具有相同角动量的电子在空间不同伸展方向的参数,其取值范围m为0、±1、±2、……±l。
自旋量子数是表示电子自旋的参数,根据电子自旋只有顺时针和逆时针两种情况,自旋量子数m s的取值范围取+1/2和-1/2。
无机化学第四版第六章思考题与习题答案

第六章分子的结构与性质思考题1.根据元素在周期表中的位置,试推测哪些元素之间易形成离子键,哪些元素之间易形成共价键。
答:ⅠA、ⅡA族与ⅥA、ⅦA元素之间由于电负性相差较大,易形成离子键,而处于周期表中部的主族元素原子之间由于电负性相差不大,易形成共价键。
2.下列说法中哪些是不正确的,并说明理由。
(1)键能越大,键越牢固,分子也越稳定。
不一定,对双原子分子是正确的。
(2)共价键的键长等于成键原子共价半径之和。
不一定,对双原子分子是正确的。
(3)sp2杂化轨道是由某个原子的1s轨道和2p轨道混合形成的。
×由一个ns轨道和两个np轨道杂化而成。
(4)中心原子中的几个原子轨道杂化时,必形成数目相同的杂化轨道。
√(5)在CCl4、CHCl3和CH2Cl2分子中,碳原子都采用sp2杂化,因此这些分子都呈四面体形。
×sp3,CCl4呈正四面体形;CHCl2和CH2Cl2呈变形四面体形。
(6)原子在基态时没有未成对电子,就一定不能形成共价键。
×成对的电子可以被激发成单电子而参与成键。
(7)杂化轨道的几何构型决定了分子的几何构型。
×不等性的杂化轨道的几何构型与分子的几何构型不一致。
3.试指出下列分子中那些含有极性键?Br2CO2H2O H2S CH44.BF3分子具有平面三角形构型,而NF3分子却是三角锥构型,试用杂化轨道理论加以解释。
BF3中的B原子采取SP2杂化,NF3分子的N原子采取不等性的SP3杂化。
5.CH4,H2O,NH3分子中键角最大的是哪个分子? 键角最小的是哪个分子? 为什么?CH4键角最大(109028,),C采取等性的SP3杂化,NH3(107018,), H2O分子中的N、O采用不等性的SP3杂化,H2O分子中的O原子具有2对孤电子对,其键角最小(104045,)。
6.解释下列各组物质分子中键角的变化(括号内为键角数值)。
(1) PF3(97.8°),PCl3(100.3°),PBr3(101.5°)中心原子相同,配体原子F、Cl、Br的电负性逐渐减小,键电子对的斥力逐渐增加,所以键角逐渐增加(2) H2O(104°45'),H2S(92°16'),H2Se(91°)配位原子相同,中心原子的电负性逐渐减小,键电子对的斥力逐渐减小,所以键角逐渐减小7.试用分子轨道法写出下列分子或粒子的分子轨道表示式,并指出其中有哪几种键?是顺磁性、还是反磁性的物质? O 2 O 22- N 2 N 22-O 2和N 2见教材,O 22-和N 22-的分子轨道分别为: O 22-()()()()()()()()()222222222112222222x y z y z s s s s p p p p p σσσσσππππ****⎡⎤⎢⎥⎣⎦具有1个双电子的σ键,是反磁性物质。
无机化学答案

第六章化学平衡常数6-1 写出下列各反应的标准平衡常数表达式。
(1)2SO2(g) + O2(g) = 2SO3(g)(2)NH4HCO3(s) = NH3(g) + CO2(g) + H2O(g)(3)CaCO3(s) = CO2(g) + CaO(s)(4)Ag2O = 2Ag(s) + 1/2 O2(g)(5)CO2(g) = CO2(aq)(6)Cl2(g) + H2O(l) = H+(aq) + Cl-(aq) + HClO(aq)(7)HCN(aq) = H+(aq) + CN-(aq)(8)Ag2CrO4(s) = 2Ag+(aq) + CrO42-(aq)(9)BaSO4(s) + CO32-(aq) = BaCO3(s) + SO42-(aq)(10)Fe2+(aq) + 1/2 O2(g) + 2H+(aq) = Fe3+(aq) + H2O(l)6-2已知反应ICl(g) = 1/2 I2(g) + 1/2 Cl2(g) 在25℃时的平衡常数为Kθ= ×10-3,试计算下列反应的平衡常数:(1)ICl(g) = I2(g) + Cl2(g)(2)1/2 I2(g) + 1/2 Cl2(g) = ICl(g)6-3 下列反应的Kp 和Kc之间存在什么关系?(1)4H2(g) + Fe3O4(s) = 3Fe(s) + 4H2O(g)(2)N2(g) + 3H2(g) = 2NH3(g)(3)N2O4(g) = 2NO2(g)6-4实验测得合成氨反应在500℃的平衡浓度分别为:[H2]=L ,[N2]=L ,[NH3]=L ,求标准平衡常数K θ、浓度平衡常数Kc以及分别用Pa 为气体的压力单位和用bar为气体的压力单位的平衡常数Kp。
6-5已知HCN = H+ + CN- K1θ= ×10-10NH3 + H2O = NH4+ + OH- K2θ= ×10-5H2O = H+ + OH-K3θ= ×10-14求反应NH3 + HCN = NH4+ + CN-的平衡常数Kθ。
无机化学练习题(含答案)第六章化学平衡常数

第六章化学平衡常数6-1 : 写出下列各反应的标准平衡常数表达式(1)2SO2(g) + O 2(g) = 2SO 3(g)(2)NH4HCO3(s) = NH 3(g) + CO 2(g) + H 2O(g)(3)CaCO3(s) = CO 2(g) + CaO(s)(4)Ag 2O = 2Ag(s) + 1/2 O 2(g)(5)CO2(g) = CO 2(aq)(6)Cl 2(g) + H 2O(l) = H +(aq) + Cl -(aq) + HClO(aq)(7)HCN(aq) = H +(aq) + CN - (aq)(8)Ag 2CrO4(s) = 2Ag +(aq) + CrO 42- (aq)(9)BaSO4(s) + CO 32-(aq) = BaCO 3(s) + SO 42-(aq)2+ + 3+(10)Fe 2+(aq) + 1/2 O 2(g) + 2H +(aq) = Fe 3+(aq) + H 2O(l)6-2: 已知反应 ICl(g) = 1/2 I 2(g) + 1/2 Cl 2(g) 在 25℃ 时的平衡常数为 K θ = 2.2 × 10-3,试计算下列反应的平衡常数:(1)ICl(g) = I 2(g) + Cl 2(g)(2)1/2 I 2(g) + 1/2 Cl 2(g) = ICl(g)6-3: 下列反应的 Kp 和 Kc 之间存在什么关系?(1)4H 2(g) + Fe 3O4(s) = 3Fe(s) + 4H 2O(g)(2)N 2(g) + 3H 2(g) = 2NH 3(g)(3) N 2O 4(g) = 2NO 2(g)6-6: 反应 CO (g ) + H 2O (g ) = CO 2 + H 2(g ) 在 749K 时的平衡常数 K θ=2.6 。
设 (1)反应起始时 CO 和 H 2O 的浓度都为 1mol/L (没有生产物,下同);(2)起 始时 CO 和 H 2O 的摩尔比为 1比3,求 CO 的平衡转化率。
大连理工大学《无机化学》教材习题全部答案及详解第六章

mL
= 0畅 010
m ol· L - 1
c0 ( N H3 · H2 O)
=
0畅 15 mol· L - 1 × 5畅 0 m L (10畅 0 + 5畅 0) m L
=
0畅 050
m ol· L - 1
溶液中的 O H - 主要来自 N H3 ·H2 O 的解离反应 :
N H3 · H2 O(aq)
学习资料分享
[公司地址]
116
第六章 沉淀 溶解平衡
其平衡常数为
K譟 sp
①
,M yers 借用 了
R畅 M畅 Smith[4] 的 相关 数据 。 如 果 再写 出下
列两个离子平衡方程式 :
H+ + OH-
H2 O
K譟
=
1/
K譟 w
(2)
H+ + HS-
H2 S
K譟
=
1/
K譟 a1
(
H2
0畅 15 mol· L - 1 N H3 (aq) , 是否能生成 M n( O H)2 沉淀 ?
(2) 若 在 上 述 10畅 0 m L 0畅 015 mol · L - 1 M nSO4 溶 液 中 先 加 入 0畅 495 g
( N H4 )2 SO4 晶 体 ,然 后 再 加 入 5畅 0 m L 0畅 15 m ol · L - 1 N H3 ( aq ) , 是 否 有
淀 。 滤液 的 放 射 性 计 数 为 44畅 4 s - 1 · m L - 1 , 原 A g N O3 溶 液 的 放 射 性 计 数
① 以 往 教材 中 M S(s)
M2+
+ S2- 的标准平衡常数为
K
譟 sp
2016届无机化学第六章试题答案
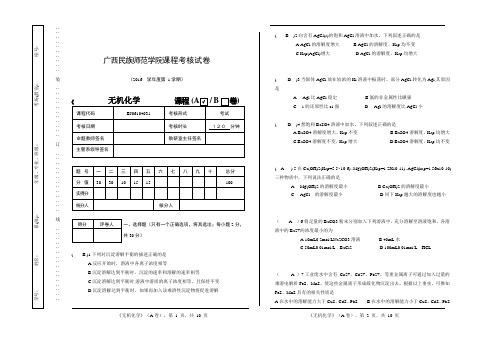
∶∶∶∶∶∶∶∶∶∶装∶∶∶∶∶∶∶∶∶∶∶订∶∶∶∶∶∶∶∶∶∶∶∶∶线∶∶∶∶∶∶∶∶∶∶∶∶∶∶∶∶广西民族师范学院课程考核试卷(2016 学年度第1学期)一、选择题(只有一个正确选项,将其选出;每小题2分,共30分)( B )1.下列对沉淀溶解平衡的描述正确的是A.反应开始时,溶液中各离子浓度相等B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变D.沉淀溶解达到平衡时,如果再加入该难溶性沉淀物将促进溶解( B )2.向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是A.AgCl的溶解度增大B.AgCl的溶解度、Ksp均不变C.Ksp(AgCl)增大D.AgCl的溶解度、Ksp均增大( D )3.当固体AgCl放在较浓的Kl溶液中振荡时,部分AgCl转化为Agl,其原因是A. Agl比AgCl稳定B.氯的非金属性比碘强C. l-的还原性比cl-强D. Agl的溶解度比AgCl小( D )4.想饱和BaSO4溶液中加水,下列叙述正确的是A.BaSO4溶解度增大、Ksp不变B.BaSO4溶解度、Ksp均增大C.BaSO4溶解度不变、Ksp增大D.BaSO4溶解度、Ksp均不变( A ) 5.在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2X10-11)、AgCl(ksp=1.56x10-10)三种物质中,下列说法正确的是A .Mg(OH)2的溶解度最小 B.Ca(OH)2的溶解度最小C. AgCl 的溶解度最小D.同下Ksp越大的溶解度也越小( A )6.将足量的BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。
各溶液中的Ba2+的浓度最小的为A.10mL0.2mol/LNa2CO3溶液B.40mL水C.50mL0.01mol/L BaCl2D.100mL0.01mol/L HCL( A )7.工业废水中含有Cu2+、Cd2+、Pb2+、等重金属离子可通过加入过量的难溶电解质FeS、MnS,使这些金属离子形成硫化物沉淀出去。
无机及分析化学第六章答案
无机及分析化学第六章答案无机及分析化学是化学学科中的两个重要分支,它们对研究物质的性质和应用具有重要推动作用。
其中第六章是无机及分析化学研究中的一个重要章节,它主要论述了离子反应和化学平衡的理论基础和应用方法。
在这篇文章中,我们将会讨论第六章的考试内容及相应的答案,希望能够对大家的学习和考试有所帮助。
第一部分:离子反应离子反应是无机化学中最基本的重要反应类型之一,其主要涉及离子的相互作用和转化。
在第六章的考试中,离子反应涵盖了离子的配位化学,氧化还原反应和过渡金属化合物的化学性质等内容。
Q1:什么是配位化学?A1:配位化学研究的是离子之间的相互作用和转化。
其中配位物是指能够以可逆或不可逆的方式向中心金属离子上提供一个或多个电子对的化合物。
金属离子则是被配位化合物所包围,在其中心位置上形成一个化学键。
在配位化学中,配体选择、离子半径、电子结构、环境因素等都会影响金属离子的性质和化学反应。
Q2:什么是氧化还原反应?A2:氧化还原反应是指在反应体系中,某些物质失去电子被氧化,而其他物质获得电子被还原的化学反应。
在这种反应中,共有两个反应途径,一个是氧化途径,一个是还原途径。
不同物种之间的氧化还原反应可以通过电位差ΔE来进行确定,ΔE越大,氧化还原反应就越有利。
Q3:什么是过渡金属化合物的化学性质?A3:过渡金属化合物的化学性质很特殊,其中最为显著的特点是配位作用和氧化还原反应的能力。
在配位作用方面,过渡金属离子能够与其他分子或离子的配位作用,形成配位化合物。
而在氧化还原反应的方面,过渡金属离子具有较强的氧化还原能力,它们能够参与不同电子转移反应,形成不同化合物。
第二部分:化学平衡化学平衡是指化学反应在时间、反应物浓度和温度等条件不变的情况下达到的一种稳定状态。
在无机及分析化学中,化学平衡的理论和应用十分广泛,其中主要涉及到酸碱平衡、溶液性质和化学平衡常数等方面。
Q4:什么是酸碱平衡?A4:酸碱平衡是指酸和碱之间相互转化达到平衡的一种反应。
无机化学第六章 练习答案
第六章 练习 一、选择题1. 从含有0.10 mol·L -1 Ag +的溶液中除去90%的Ag +,平衡时[24CrO -]等于( D )。
[K sp (Ag 2CrO 4)=2×10-12](A)2×10-12 (B)2×10-l1 (C)2×10-10 (D)2×10-82. 已知K sp :AgCl(1× 10-10),Ag 2CrO 4 (9 × l0-12),Ag 2C 2O 4 (3×l0-11)和AgBr(5×10-13)。
在下列难溶盐的饱和溶液中,Ag +浓度最大的是( C )。
(A)AgCl (B) Ag 2CrO 4 (C) Ag 2C 2O 4 (D) AgBr3. 下列有关分步沉淀的叙述正确的是( B )。
(A) 溶度积小者一定先沉淀出来 (B) 沉淀时所需沉淀试剂小者先沉淀出来 (C) 溶解度小的物质先沉淀 (D) 被沉淀离子浓度大的先沉淀4.在下列试剂中溶解度最大的是( A )。
(A) 0.10 mol·L -1 HAc (B) 0.10mol·L -1Sr(NO 3)3 (C) 纯水 (D) 1.0mol·L -1 Na 2CO 35. 欲使CaCO 3在水溶液中溶解度增大,可以采用的方法是( D )。
(A) 加入1.0 mol·L -1 Na 2CO 3 (B) 加入1.0 mol·L -1NaOH (C) 加入0.10mol·L -1CaCl 2 (D) 降低溶液的pH6. 向饱和AgCl 溶液中加水,下列叙述中正确的是( B )。
(A) AgCl 的溶解度增大 (B) AgCl 的溶解度,均不变 (C) AgCl 的增大 (D)AgCl 的溶解度,增大7. 欲使,转化为必使( D )。
(A) (B)(C) (D)二、填空题3SrCO sp K θspK θspK θ()12238.310SP Ag CO K θ-=⨯()12224 5.310SP Ag C O K θ-=⨯()()22_2430.64c C O c CO -<()()22_2431.6c C O c CO ->()()22_2431.6c C O c CO -<()()22_2430.64c C O c CO ->1. 某难溶强电解质M 2A ,在纯水中它的溶解度S =__________。
大学无机化学第六章试题及答案
大学无机化学第六章试题及答案第六章化学键理论本章总目标:1:掌握离子键、共价键和金属键的基本特征以及它们的区别;2:了解物质的性质与分子结构和键参数的关系;3:重点掌握路易斯理论、价电子对互斥理论、杂化轨道理论以及分子轨道理论。
4:熟悉几种分子间作用力。
各小节目标:第一节:离子键理论1:掌握离子键的形成、性质和强度,学会从离子的电荷、电子构型和半径三个方面案例讨论离子的特征。
2:了解离子晶体的特征及几种简单离子晶体的晶体结构,初步学习从离子的电荷、电子构象和半径三个方面来分析离子晶体的空间构型。
第二节:共价键理论1;掌握路易斯理论。
2:理解共价键的形成和本质。
掌握价键理论的三个基本要点和共价键的类型。
3:理解并掌握价层电子对互斥理论要点并学会用此理论来判断共价分子的结构,并会用杂化轨道理论和分子轨道理论来解释分子的构型。
第三节:金属键理论了解金属键的能带理论和三种常见的金属晶格。
第四节:分子间作用力1:了解分子极性的判断和分子间作用力(范德华力)以及氢键这种次级键的形成原因。
2;初步掌握离子极化作用及其强度影响因素以及此作用对化合物结构及性质的影响。
习题一选择题1.下列化合物含有极性共价键的是()(《无机化学例题与习题》吉大版)A.KClO3B.Na2O2C.Na2OD.KI2.下列分子或离子中键能最大的是()A.O2B.O2-C.O22+D.O22-3.下列化合物共价性最强的是()(《无机化学例题与习题》吉大版)A.LiIB.CIC.BeI2D.MgI24.极化能力最强的离子应具有的特性是()A.离子电荷高,离子半径大B.离子电荷高,离子半径小C.离子电荷低,离子半径小D.离子电荷低,离子半径大5.下列化合物中,键的极性最弱的是()(《无机化学例题与习题》吉大版)A.FeCl3B.AlCl3C.SiCl4D.PCl56.对下列各组稳定性大小判断正确的是()A.O2+>O22-B.O2->O2C.NO+>NOD.OF->OF7.下列化合物中,含有非极性共价键的离子化合物是()(《无机化学例题与习题》吉大版)A.H2O2B.NaCO3C.Na2O2D.KO38.下列各对物质中,是等电子体的为()A.O22-和O3B.C和B+C.He和LiD.N2和CO9.中心原子采取p2杂化的分子是()(《无机化学例题与习题》吉大版)A.NH3B.BCl3C.PCl3D.H2O10.下列分子中含有两个不同键长的是()A.CO2B.SO3C.SF4D.某eF411.下列分子或离子中,不含有孤电子对的是()(《无机化学例题与习题》吉大版)A.H2OB.H3O+C.NH3D.NH4+12.氨比甲烷易溶于水,其原因是()A.相对分子质量的差别B.密度的差别C.氢键D.熔点的差别13.下列分子属于极性分子的是()(《无机化学例题与习题》吉大版)l4B.CH3OCH3C.BCl3D.PCl514.下列哪一种物质只需克服色散力就能使之沸腾()A.HClB.CH3Cll4D.NH315.下列分子中,中心原子采取等性杂化的是()(《无机化学例题与习题》吉大版)A.NCl3B.SF4C.CHCl3D.H2O16.下列哪一种物质既有离子键又有共价键()2A.NaOHB.H2OC.CH3ClD.SiO217.下列离子中,中心原子采取不等性杂化的是()(《无机化学例题与习题》吉大版)A.H3O+B.NH4+C.PCl6-D.BI4-18.下列哪一种分子的偶极矩最大()A.HFB.HClC.HBrD.HI19.下列分子中,属于非极性分子的是()(《无机化学例题与习题》吉大版)A.SO2B.CO2C.NO2D.ClO220.下列分子或离子中,中心原子的杂化轨道与NH3分子的中心原子轨道最相似的是()(《无机化学例题与习题》吉大版)A.H2OB.H3O+C.NH4+D.BCl321.下列分子或离子中,构型不为直线形的是()(《无机化学例题与习题》吉大版)A.I3+B.I3-C.CS2D.BeCl222.下列分子不存在Ⅱ键的是()(《无机化学例题与习题》吉大版)A.COCl2B.O3C.SOCl2D.SO323.下列分子中含有不同长度共价键的是()(《无机化学例题与习题》吉大版)A.NH3B.SO3C.KI3D.SF424.下列化合物肯定不存在的是()(《无机化学例题与习题》吉大版)A.BNB.N2H4C.C2H5OHD.HCHO二填空题1.比较大小(《无机化学例题与习题》吉大版)(1)晶格能AlF3AlCl3NaClKCl(2)溶解度CuF2CuCl2Ca(HCO3)NaHCO32.NO+、NO2、NO2-的几何构型分别是、、、其中键角最小的是3.给出晶宝包中离子总数:立方ZnS;NaCl;CCl(《无机化学例题与习题》吉大版)4.CO2是分子;SO2是分子;BF3是分子;NF3是分子;PF5是分子。
无机化学第四版第六章思考题与习题答案
无机化学第四版第六章思考题与习题答案work Information Technology Company.2020YEAR第六章分子的结构与性质思考题1.根据元素在周期表中的位置,试推测哪些元素之间易形成离子键,哪些元素之间易形成共价键。
答:ⅠA、ⅡA族与ⅥA、ⅦA元素之间由于电负性相差较大,易形成离子键,而处于周期表中部的主族元素原子之间由于电负性相差不大,易形成共价键。
2.下列说法中哪些是不正确的,并说明理由。
(1)键能越大,键越牢固,分子也越稳定。
不一定,对双原子分子是正确的。
(2)共价键的键长等于成键原子共价半径之和。
不一定,对双原子分子是正确的。
(3)sp2杂化轨道是由某个原子的1s轨道和2p轨道混合形成的。
×由一个ns轨道和两个np轨道杂化而成。
(4)中心原子中的几个原子轨道杂化时,必形成数目相同的杂化轨道。
√(5)在CCl4、CHCl3和CH2Cl2分子中,碳原子都采用sp2杂化,因此这些分子都呈四面体形。
×sp3,CCl4呈正四面体形;CHCl2和CH2Cl2呈变形四面体形。
(6)原子在基态时没有未成对电子,就一定不能形成共价键。
×成对的电子可以被激发成单电子而参与成键。
(7)杂化轨道的几何构型决定了分子的几何构型。
×不等性的杂化轨道的几何构型与分子的几何构型不一致。
3.试指出下列分子中那些含有极性键?Br2CO2H2O H2S CH44.BF3分子具有平面三角形构型,而NF3分子却是三角锥构型,试用杂化轨道理论加以解释。
BF3中的B原子采取SP2杂化,NF3分子的N原子采取不等性的SP3杂化。
5.CH4,H2O,NH3分子中键角最大的是哪个分子键角最小的是哪个分子为什么 CH4键角最大(109028,),C采取等性的SP3杂化,NH3(107018,), H2O分子中的N、O采用不等性的SP3杂化,H2O分子中的O原子具有2对孤电子对,其键角最小(104045,)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大学无机化学第六章试题及答案Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】第六章化学键理论本章总目标:1:掌握离子键、共价键和金属键的基本特征以及它们的区别;2:了解物质的性质与分子结构和键参数的关系;3:重点掌握路易斯理论、价电子对互斥理论、杂化轨道理论以及分子轨道理论。
4:熟悉几种分子间作用力。
各小节目标:第一节:离子键理论1:掌握离子键的形成、性质和强度,学会从离子的电荷、电子构型和半径三个方面案例讨论离子的特征。
2:了解离子晶体的特征及几种简单离子晶体的晶体结构,初步学习从离子的电荷、电子构象和半径三个方面来分析离子晶体的空间构型。
第二节:共价键理论1;掌握路易斯理论。
2:理解共价键的形成和本质。
掌握价键理论的三个基本要点和共价键的类型。
3:理解并掌握价层电子对互斥理论要点并学会用此理论来判断共价分子的结构,并会用杂化轨道理论和分子轨道理论来解释分子的构型。
第三节:金属键理论了解金属键的能带理论和三种常见的金属晶格。
第四节:分子间作用力1:了解分子极性的判断和分子间作用力(范德华力)以及氢键这种次级键的形成原因。
2;初步掌握离子极化作用及其强度影响因素以及此作用对化合物结构及性质的影响。
习题一选择题1.下列化合物含有极性共价键的是()(《无机化学例题与习题》吉大版)2 C. Na2O2.下列分子或离子中键能最大的是()A. O2 C. O22+ D. O22-3. 下列化合物共价性最强的是()(《无机化学例题与习题》吉大版)C. BeI24.极化能力最强的离子应具有的特性是()A.离子电荷高,离子半径大B.离子电荷高,离子半径小C.离子电荷低,离子半径小D.离子电荷低,离子半径大5. 下列化合物中,键的极性最弱的是()(《无机化学例题与习题》吉大版)3 C. SiCl46.对下列各组稳定性大小判断正确的是()+>O22- B. O2->O2C. NO+>NOD. OF->OF7. 下列化合物中,含有非极性共价键的离子化合物是()(《无机化学例题与习题》吉大版)3 C. Na2O28.下列各对物质中,是等电子体的为()和O3 B. C和B+ C. He和Li D. N2和CO9. 中心原子采取sp2杂化的分子是()(《无机化学例题与习题》吉大版)3 C. PCl310.下列分子中含有两个不同键长的是()A .CO2 3 C. SF411. 下列分子或离子中,不含有孤电子对的是()(《无机化学例题与习题》吉大版)A. H2O B. H3O+ C. NH3D. NH4+12.氨比甲烷易溶于水,其原因是()A.相对分子质量的差别B.密度的差别C. 氢键D.熔点的差别13. 下列分子属于极性分子的是()(《无机化学例题与习题》吉大版)A. CCl43 C. BCl3D. PCl514.下列哪一种物质只需克服色散力就能使之沸腾( )15. 下列分子中,中心原子采取等性杂化的是()(《无机化学例题与习题》吉大版)A. NCl 3 4 C. CH Cl 316.下列哪一种物质既有离子键又有共价键( )17. 下列离子中,中心原子采取不等性杂化的是( )(《无机化学例题与习题》吉大版)A. H 3O +B. NH 4+C. PCl 6-18.下列哪一种分子的偶极矩最大( )19. 下列分子中,属于非极性分子的是( )(《无机化学例题与习题》吉大版)2 C. NO 220.下列分子或离子中,中心原子的杂化轨道与NH 3分子的中心原子轨道最相似的是( )(《无机化学例题与习题》吉大版) A. H 2O B. H 3O + C. NH 4+ D. BCl 321.下列分子或离子中,构型不为直线形的是( )(《无机化学例题与习题》吉大版) A. I 3+ B. I 3- C. CS 2 D. BeCl 222. 下列分子不存在Ⅱ键的是( )(《无机化学例题与习题》吉大版) A. COCl 2 B. 3 C D. SO 323. 下列分子中含有不同长度共价键的是( )(《无机化学例题与习题》吉大版) A. NH 3 B. SO 3 C. KI 3 D. SF 424. 下列化合物肯定不存在的是( )(《无机化学例题与习题》吉大版) A. BN B. N 2H 4 C. C 2H 5OH D. HCHO二 填空题1.比较大小(《无机化学例题与习题》吉大版) (1)晶格能 AlF 3 AlCl 3 NaCl KCl (2)溶解度 CuF 2 CuCl 2 Ca(HCO 3) NaHCO 3+、NO 2、NO 2-的几何构型分别是 、 、 、其中键角最小的是 。
3. 给出晶宝包中离子总数:立方ZnS ; NaCl ;CsCl 。
(《无机化学例题与习题》吉大版)是分子;SO2是分子;BF3是分子;NF3是分子;PF5是分子。
5. 下列各物质中,是CO的等电子体的有。
NO, O2, N2, HF, CN-。
(《无机化学例题与习题》吉大版)6.惰性气体由于存在,可在高压、温度极低时液化,而且随着增加,其沸点升高。
7.下列分子或离子中键角有大到小排列的顺序是。
(《无机化学例题与习题》吉大版)①BCl3 ②NH3③H2O ④PCl4+ ⑤HgCl2分子空间构型是直线形,C原子以2个sp杂化轨道分别和2个硫原子形成共价键。
CS2分子是分子;Cl2O分子的空间构型是V形,O原子以2个杂化轨道分别和2个Cl原子形成共价键。
Cl2O分子是分子。
9.离子极化的发生使键型由向过渡,通常表现出化合物的熔、沸点。
10.离子相互极化使Hg2+与S2-结合生成的化合物的键型有向转化,化合物的晶型有向转化,通常表现出化合物的熔沸点,颜色,溶解度。
(《无机化学例题与习题》吉大版) 三问答题1.用VB法和MO法分别说明为什么H2能稳定存在,而He2不能稳定存在2.下列情况要克服哪种类型的吸引力(除了色散力)a 冰融化b NaCl溶于水c MgCO3分解为MgOd I2溶于CCl4中3.下列分子中,哪些是极性的哪些是非极性的为什么(《无机化学例题与习题》吉大版)CH4、CHCl3、CO2、BCl3、H2S4.画出下列物质的结构图。
指出化学键的类型。
哪些分子中 有键键是否有极性分子是否有极性H 2、HCl、H2O、CS2、NH3、NaF、C2H4、Cu5.试用分子轨道能级图写出N2和O2的形成过程,并比较两分子的键级、稳定性大小。
6.说明卤素单质的熔、沸点随原子序数增加而递增的原因。
F 2、Cl2、Br2、I27.氟化硼分子是否有极性,为什么氟化硼、氯化硼、溴化硼是路易士酸还是路易士碱8.判断下列分子或离子的中心原子杂化类型:A. PCl6- B. XeF2C. SO2 D. SCl2E. OF29.应用价电子对互斥理论画出下列化合物的空间构型,确定杂化类型、化学键数,并标出孤电子对的位置。
A. XeOF4 B. ClO2- C. IO65-D. PCl3 E. I3-10.根据价电子对互斥理论画出下列分子(离子)的空间构型并写出中心原子的杂化轨道类型,标出孤电子对和 键。
①COCl2②ICl4-③NO3-④SO2⑤SF411.判断下列各组分子之间存在何种形式的反正间作用力。
(《无机化学例题与习题》吉大版)(1)CS2和CCl4(2)H2O和N2(3)CH3Cl (4)H2O与NH312.在H2、CH4、CH3Cl 和H2O中,分别存在何种类型的分子间作用力四计算题1.锂的升华焓为519KJ/mol,氟化锂固体的生成热为-612KJ/mol。
求氟化锂的晶格能是多少将所的值与氯化钠的相应值比较,并解释两者之差别。
2.利用下列数据求碘化钾的生成热△H0(KJ/mol)K(s)=K(g) +K(g)=K+(g)+e +1/2I2(g)=I(g) +I(g)+e=I-(g)I-(g)+ K+(g)=KI(s)1/2I2(g)= 1/2I2(s) +参考答案一 选择题1. A2. C3. C4. B5. D6. C7. C8. D 10. B 11. D 12. C 二 填空题1. (1)>,>;(2)<,<。
2. 直线型,角型,角型;NO 2-3. 8,8,24. 极性;非极性;极性;非极性5. N 2,CN -6. 色散力,色散力>1>4>2>38. 直线型或非极性,sp 3不等性,极性或角型9. 离子键,共价键,降低10.离子键,共价键,离子晶体,分子晶体,降低,加深,减小三 问答题1.答:氢的电子层结构为1s 1,氦的为1s 2。
价键理论认为:He 的电子层结构为,所有电子都已互相成对,当两个氦原子相互接近时,不能在相互配对, 因为氦原子没有未成对电子,所以不能形成He 2, 在1s轨道上有一个成单电子,当两个氢原子相互接近时,两个成单电子相互配对而形成稳定的化学键,故H 2能稳定存在。
分子轨道理论认为:如氦能形成He 2,则该分子的分子轨道排布为:2*121)()(s s σσ,其键极为(2-2)/2=0,说明不会形成He 2,因为进入成键和反键轨道的电子数目一样多,总能量互相抵消。
而对于H 2来说,其分子轨道排布为:21)(s σ 键极为(2-0)/2=1,存在一个稳定的化学键,故H 2能稳定存在。
2.答:a 情况要克服氢键,诱导力、取向力;b 情况要克服离子键;c 情况要克服共价键;d 情况要克服色散力。
3.答:CH 4、CO 2和BCl 3是非极性分子,CHCl 3是极性分子。
虽然上述5种分子它们的中心键均为极性键,但CH 4、CO 2、BCl 3的分子空间构型是完全对称的,所以为非极性分子。
而CHCl 3和H 2S 的分子空间构型不对称,所以为极性分子。
4.答:H2:H:H,非极性键,非极性分子 HCl:H:Cl,极性键,极性分子H2O::O:H H104.50极性键,极性分子CS2:S____C____S极性键,非极性分子,有π键NH3:NH H H极性键,极性分子NaF: Na+F-离子键(极性键),气态是极性分子,固态是离子晶体C2H4:C____CHHHH,极性键,非极性分子,有π键Cu:金属键,固态是金属晶体5.答:N2:2242*2222*121)())(()()()(ppssssσπσσσσ键极=(10-4)/2=3两个N间形成一个σ键,两个π键O2:121222222222222121*)(*)()()()(*)()(*)()(pzpypzpypssssππππσσσσσ键极=(10-6)/2=2,形成一个σ键,两个三电子π键可见,稳定性:N2>O26.答:卤素单质分子都是非极性分子,分子间的作用力是色散力,而色散力随着分子中电子数目的增加而增加,原子序数增加,色散力增大,分子变形性增加,所以熔点、沸点升高。
