山东大学无机化学
……无机化学大学排名

无机化学排名学校名称等级排名学校名称等级排名学校名称等级1南京大学A+7山东大学A13郑州大学A2吉林大学A+8东北师范大学A14清华大学A3南开大学A+9兰州大学A15武汉大学A4北京大学A+10复旦大学A16同济大学A5中国科学技术大学A11厦门大学A17苏州大学A6中山大学A12浙江大学AB+等(26个):北京师范大学、黑龙江大学、福州大学、湖南大学、北京理工大学、四川大学、中南大学、北京化工大学、华中科技大学、哈尔滨工业大学、安徽大学、长春理工大学、西北大学、天津大学、华东理工大学、山西大学、上海交通大学、宁波大学、上海大学、山西师范大学、大连理工大学、辽宁师范大学、辽宁大学、暨南大学、陕西师范大学、河南大学B等(25个):广西师范大学、河南师范大学、青岛科技大学、西北师范大学、河北大学、华东师范大学、华南理工大学、新疆大学、南昌大学、武汉理工大学、汕头大学、河北师范大学、曲阜师范大学、哈尔滨师范大学、安庆师范学院、安徽师范大学、内蒙古大学、华中师范大学、贵州大学、湖北大学、中北大学、沈阳化工学院、云南师范大学、江苏大学、西南大学The furthest distance in the worldIs not between life and deathBut when I stand in front of youYet you don't know thatI love you.The furthest distance in the worldIs not when I stand in front of youYet you can't see my loveBut when undoubtedly knowing the love from bothYet cannot be together.The furthest distance in the worldIs not being apart while being in loveBut when I plainly cannot resist the yearningYet pretending you have never been in my heart.The furthest distance in the worldIs not struggling against the tidesBut using one's indifferent heartTo dig an uncrossable riverFor the one who loves you.倚窗远眺,目光目光尽处必有一座山,那影影绰绰的黛绿色的影,是春天的颜色。
山东大学化学与化工学院化学专业
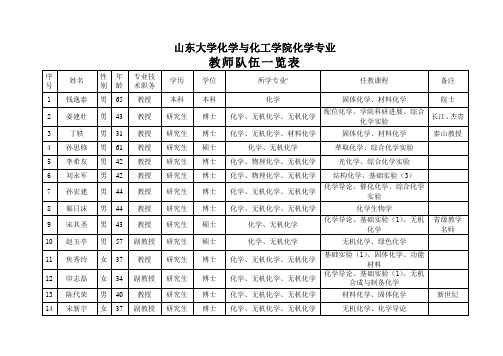
41
沈强
男
37
副教授
研究生
博士
化学、物理化学、物理化学
基础实验(2)物理化学与胶体化学
42
郝京诚
男
42
教授
研究生
博士
化学、物理化学、物理化学
物理化学
百人打算
43
薛庆斌
男
38
副教授
研究生
博士
化学、物理化学、物理化学
物理化学
44
于丽
女
34
副教授
研究生
博士
化学、化学工程、物理化学
8
郗日沫
男
44
教授
研究生
博士
化学、无机化学、无机化学
化学生物学
9
宋其圣
男
43
教授
研究生
硕士
化学、无机化学
化学导论、基础实验(1)、无机化学
省级教学名师
10
赵玉亭
男
57
副教授
研究生
硕士
化学、无机化学
无机化学、绿色化学
11
焦秀玲
女
37
教授
研究生
博士
化学、无机化学、无机化学
基础实验(1)、固体化学、功能材料
固体化学、材料化学
泰山教授
4
孙思修
男
61
教授
研究生
硕士
化学、无机化学
萃取化学、综合化学实验
5
李希友
男
42
教授
研究生
博士
化学、物理化学、无机化学
光化学、综合化学实验
6
刘永军
男
42
教授
化工专业研究生专业及院校排名
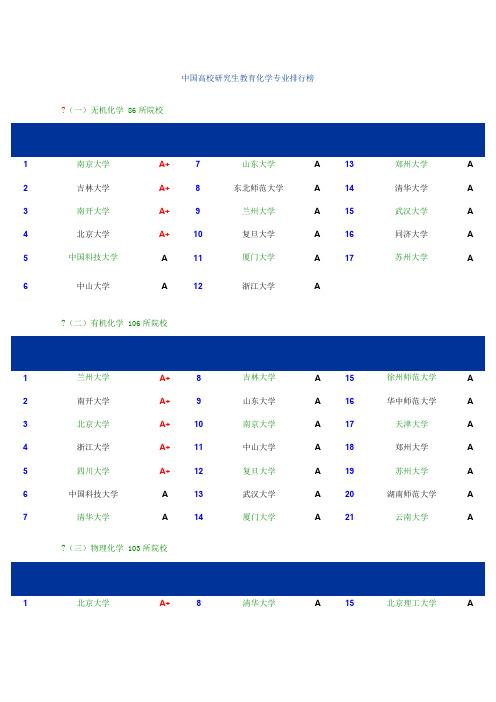
中国高校研究生教育化学专业排行榜?(一)无机化学 86所院校1南京大学A+7山东大学A13郑州大学A 2吉林大学A+8东北师范大学A14清华大学A 3南开大学A+9兰州大学A15武汉大学A 4北京大学A+10复旦大学A16同济大学A 5中国科技大学A11厦门大学A17苏州大学A 6中山大学A12浙江大学A?(二)有机化学 106所院校1兰州大学A+8吉林大学A15徐州师范大学A 2南开大学A+9山东大学A16华中师范大学A 3北京大学A+10南京大学A17天津大学A 4浙江大学A+11中山大学A18郑州大学A 5四川大学A+12复旦大学A19苏州大学A 6中国科技大学A13武汉大学A20湖南师范大学A 7清华大学A14厦门大学A21云南大学A ?(三)物理化学 103所院校1北京大学A+8清华大学A15北京理工大学A2吉林大学A+9南京大学A16福州大学A 3中国科技大学A+10大连理工大学A17华东师范大学A 4复旦大学A+11武汉大学A18天津大学A 5浙江大学A+12北京师范大学A19中山大学A 6厦门大学A13山东大学A20湖南大学A 7南开大学A14辽宁师范大学A?(四)分析化学 97所院校1武汉大学A+8西南大学A15山东大学A 2北京大学A+9东北大学A16西北师范大学A 3厦门大学A+10中国科技大学A17四川大学A 4南京大学A+11兰州大学A18陕西师范大学A 5湖南大学A12南开大学A19中南大学A 6浙江大学A13华东师范大学A7吉林大学A14复旦大学A?(五)高分子化学与物理 73所院校1吉林大学A+6南京大学A11中国科技大学A 2复旦大学A+7浙江大学A12北京化工大学A 3南开大学A+8四川大学A13清华大学A 4北京大学A9上海交通大学A14武汉大学A化学专业A+级中国科学院化学研究所(1)上海有机化学研究所;(2)北京化学研究所;(3)大连化学物理研究所;(4)长春应用化学研究所;(5)福建物质结构研究所——————————————————————————————————————————————————————————中国高校研究生教育化工专业排行榜(一)化学工程 55所院校1天津大学A+5北京化工大学A9中国石油大学A 2清华大学A+6大连理工大学A10四川大学A 3华东理工大学A7华南理工大学A11中南大学A 4浙江大学A8南京工业大学A(二)化学工艺 97所院校1中国石油大学A+8浙江大学A15湖南大学A 2华东理工大学A+9清华大学A16中南大学A 3北京化工大学A+10四川大学A17郑州大学A 4太原理工大学A+11南京工业大学A18西北大学A 5天津大学A12广西大学A19武汉科技大学A 6大连理工大学A13河北工业大学A—————————————————————————————————————————下面是各个专业研究生的考试科目070301无机化学专业研究生01配合物化学02无机材料化学03无机分子设计与组装04能源与环境化学05生物无机化学①101政治(含法律硕士)②201英语(含法律硕士)③730有机化学④912无机化学070302◢分析化学专业研究生01环境与工业过程监测02波谱分析(含电分析)03化学计量学与智能分析仪器04生化、医药检测新技术05现代光分析化学及联用技术06植物分析分离新技术①101政治(含法律硕士)②201英语(含法律硕士)③730有机化学④912无机化学070303有机化学专业研究生01功能高分子02医药原料及中间体合成03药用植物活性成分提取与分离04不对称合成与手性拆分05有机合成新方法研究06 应用电化学①101政治(含法律硕士)②201英语(含法律硕士)③730有机化学④912无机化学070304物理化学专业研究生01材料物理化学02热化学与热电化学03物质结构与性能04界面与催化05应用量子化学06应用电化学①101政治(含法律硕士)②201英语(含法律硕士)③730有机化学④912无机化学070305高分子化学与物理专业研究生01功能高分子(生物医用高分子、光电信息高分子、分离用高分子材料、高分子试剂和催化剂)02高分子的分子设计与合成03高分子凝聚态结构与性能04高分子复合材料05特种涂料与粘结剂①101政治(含法律硕士)②201英语(含法律硕士)③730有机化学④912无机化学080601◢冶金物理化学专业研究生01冶金热力学与动力学02应用电化学(含热电化学、光催化电化学)03材料物理化学(光电转换材料、能源材料、催化材料、纳米材料、功能高分子材料、无机非金属材料、超临界材料)04环境物理化学05冶金过程模拟与模型①101政治(含法律硕士)②201英语(含法律硕士)③301数学一④912无机化学081701◢化学工程专业研究生01催化反应工程02化工分离工程03生化分离工程04化工过程模拟优化05资源再生工程①101政治(含法律硕士)②201英语(含法律硕士)③302数学二④916化工原理081702◢化学工艺专业研究生01化工冶金02分离科学与工艺03精细化工04环境化工05化工新材料①101政治(含法律硕士)②201英语(含法律硕士)③302数学二④916化工原理081703◢生物化工专业研究生01药剂成型技术02天然药物活性成分分离技术03药物分子设计与构效关系04酶工程与生物转化05细胞工程06生物电化学①101政治(含法律硕士)②201英语(含法律硕士)③302数学二④910生物化学(C)081704◢应用化学专业研究生01精细化工新产品、新技术02信息功能材料(含生物医用材料、分子与固体电子材料、纳米材料等) 03应用电化学(化学电源及其新材料、电化学合成等)04能源材料化学05分子生物电化学06药物合成与构效分析07功能高分子材料①101政治(含法律硕士)②201英语(含法律硕士)③302数学二④912无机化学081705◢工业催化专业研究生01催化材料设计与制备02催化反应工程03相转移催化技术04酶制备与酶催化技术05电催化技术06电池催化材料①101政治(含法律硕士)②201英语(含法律硕士)(含法律硕士)③302数学二④916化工原理081720◢★制药工程专业研究生01药物反应工程02药物分离工程03药物制剂新技术04中药复方筛选与优化05制药过程在线检测与控制技术①101政治(含法律硕士)②201英语(含法律硕士)③302数学二④910生物化学(C)。
中级无机化学[第五章原子簇化合物] 山东大学期末考试知识点复习
![中级无机化学[第五章原子簇化合物] 山东大学期末考试知识点复习](https://img.taocdn.com/s3/m/9ac8ff1210a6f524ccbf8528.png)
山东大学化学院《中级无机化学》期末复习知识点总结
4.Wade 规则 K.Wade 提出骨架成键电子对数 b 与硼烷及其衍生物几何结构之间存在以下 关系:
n 为多面体的实际顶点数。 对于通式为[(CH)a(BH)pHq]d-的硼烷或硼烷阴离子,骨架成键电子对数为 式中:a 为 C 原子数;p 为 B 原子数;q 为除去 p 个 B—H 键、a 个 C—H 键中 的 H 原子外的 H 原子数;d 为所带电荷数。若顶点为 P 和 S 原子,电子数分别记 为 3 和 4。
山东大学化学院《中级无机化学》期末复习知识点总结
和 H2,但 B10H14,B10H102-,B12H122-在动力学上非常稳定。所有挥发性硼烷都有毒。 (4)化学键类型
3.金属原子簇 金属原子簇:指金属原子通过金属一金属键直接键合形成多面体骨架的化合 物,其主要特征为含有金属一金属键。金属原子簇中重要配体有羰基、亚硝酰、 卤离子、羧酸,过渡后 p 区主族金属元素主要形成无配体簇。 (1)影响金属-金属键的主要因素 金属原子的 d 电子特性:原子化焓大的金 属易形成金属-金属键,因此重过渡金属比轻过渡金属更容易形成金属-金属键。 氧化态:低氧化态的金属易形成金属-金属键。 配体的性质:具有π电子接受性质、能有效降低金属原子 d 电子密度的配体 有助于形成金属一金属键。过渡元素均可形成金属羰基簇,只有前几族过渡元素 可形成低价卤化物簇和 S,Se,Te 化物簇。桥联配体有利于金属一金属键的形成。 (2)羰基的红外伸缩振动频率与配位方式的经验关系
山东大学化学院《中级无机化学》期末复习知识点总结
第五章 原子簇化合物
1.原子簇 原子簇:指原子间互相成键形成的笼状或多面体结构化合物,包括非金属原 子簇和金属原子簇。原子簇多面体大多数由三角面构成,多面体可以不完整。 2.硼原子簇 硼原子簇:指硼烷及其衍生物。硼烷(即硼氢化合物)中,B 原子至少与两个 同类原子键合。衍生物主要为 C,P,S 等非金属原子以及金属原子取代硼原子形 成的化合物。 (1)命名 称作某某硼烷。例如,B5H9:戊硼烷(9);B12H122-:闭式十二硼烷阴 离子(2-)。 硼原子数:10 以下以“甲"、“乙”等十个干支数表示,10 以上用“十一” 等表示。 氢原子数:在词干后括号内用阿拉伯数字表示,若只有一种结构则可不标。 结构类型:用“巢式一”等前缀表示。 硼烷阴离子的电荷:在词干后括号内用阿拉伯数字表示,不注氢原子数。 (2)制备 二元硼烷:由 NaBH4 制备 B2H6,用 B2H6 的热分解制备较高级硼烷,或通过硼 烷阴离子与三卤化硼或氯化氢反应制备较高级硼烷。 硼烷阴离子:通过 B2H6 或其他含 BH3 基团的硼烷与较低级的硼烷阴离子反应, 或由较低级硼烷阴离子的热解,制取较高级的硼烷阴离子。 (3)物理化学性质 大多数硼烷是液体或固体,少数为气体。富氢硼烷 BnHn+6 的稳定性不如贫氢硼烷 BnHn+4,硼烷阴离子最定。大多数硼烷与氧气猛烈反应(通 常爆炸),中性硼烷只有 B10H14 在空气中稳定。几乎所有硼烷都水解生成 B(OH)3
考研无机化学(86)专业高校排名

无机化学(86)
排名学校名称
等
级排
名
学校名称
等
级
排
名
学校名称等级
1南京大学A+7山东大学A13郑州大学A
2吉林大学A+8东北师范大学A14清华大学A
3南开大学A+9兰州大学A15武汉大学A
4北京大学A+10复旦大学A16同济大学A
5中国科学技术大学A11厦门大学A17苏州大学A
6中山大学A12浙江大学A
B+等(26个):北京师范大学、黑龙江大学、福州大学、湖南大学、北京理工大学、四川大学、中南大学、北京化工大学、华中科技大学、哈尔滨工业大学、安徽大学、长春理工大学、西北大学、天津大学、华东理工大学、山西大学、上海交通大学、宁波大学、上海大学、山西师范大学、大连理工大学、辽宁师范大学、辽宁大学、暨南大学、陕西师范大学、河南大学
B等(25个):广西师范大学、河南师范大学、青岛科技大学、西北师范大学、河北大学、华东师范大学、华南理工大学、新疆大学、南昌大学、武汉理工大学、汕头大学、河北师范大学、曲阜师范大学、哈尔滨师范大学、安庆师范学院、安徽师范大学、内蒙古大学、华中师范大学、贵州大学、湖北大学、中北大学、沈阳化工学院、云南师范大学、江苏大学、西南大学
在报考研究生考试前要全方位的了解你所要报考的专业还有最重要的择校问题,对于跨考的同学来说,报考学校的信息是重中之重,一定要找专业的辅导机构来帮助你完成考前的信息搜集,备考的复习计划,以及考后的复试准备等,如果需要调剂这些机构也可以帮你了解到最全的信息,像北京的爱!考等!!。
山东大学部分专业主要课程
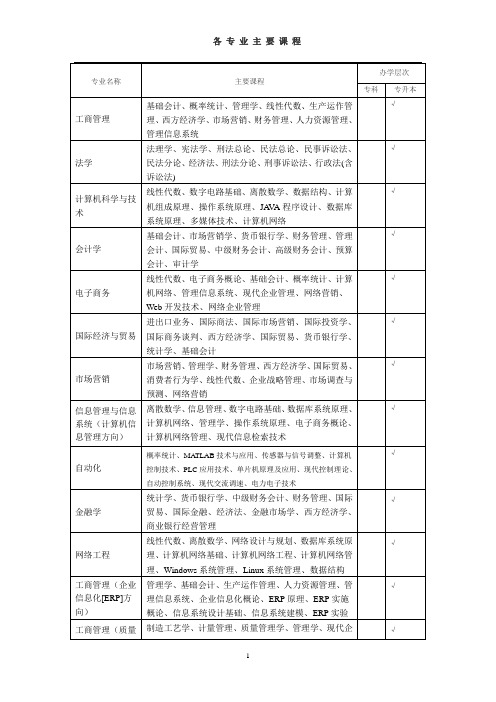
√
金பைடு நூலகம்学
统计学、货币银行学、中级财务会计、财务管理、国际贸易、国际金融、经济法、金融市场学、西方经济学、商业银行经营管理
√
网络工程
线性代数、离散数学、网络设计与规划、数据库系统原理、计算机网络基础、计算机网络工程、计算机网络管理、Windows系统管理、Linux系统管理、数据结构
√
√
工业工程
线性代数、基础会计、西方经济学、概率统计、管理学、运筹学、基础工业工程、现代制造系统、成本控制、生产计划与控制
√
土木工程
线性代数、工程制图、工程测量、结构力学、房屋建筑学、定额与工程概预算、路基路面工程、工程施工组织、道路勘测设计、钢筋混凝土结构设计原理
√
电气工程及其自动化
线性代数、电路、电磁场导论、电力电子技术、单片机原理与应用、发电厂变电所控制、微型机继电保护、电力系统分析、电力系统自动化、电网电能质量控制
专业名称
主要课程
办学层次
专科
专升本
工商管理
基础会计、概率统计、管理学、线性代数、生产运作管理、西方经济学、市场营销、财务管理、人力资源管理、管理信息系统
√
法学
法理学、宪法学、刑法总论、民法总论、民事诉讼法、民法分论、经济法、刑法分论、刑事诉讼法、行政法(含诉讼法)
√
计算机科学与技术
线性代数、数字电路基础、离散数学、数据结构、计算机组成原理、操作系统原理、JAVA程序设计、数据库系统原理、多媒体技术、计算机网络
√
焊接技术及自动化
化学与化工学院-山东大学本科生院

任选 2 学分 任选 2 学分 任选 2 学分 任选 2 学分 任选 2 学分
00054(00056) 人文学科类(或自然科学类) 2 00055(00057) 社会科学类(或工程技术类) 2 小 计 00090 通识教育选修课组 小 计 sd009201(0-1)0 0102001910 0102002010 0102000620 高等数学(1-2) 大学物理(1-2) 大学物理实验 小 计 无机化学(1-2) 化学分析 仪器分析 有机化学(1-2) 物理化学(1-2) 10 3 3 8 8 1 17 8 4 4 8 8 4 2
总学分:152 学分 ·071·
化学与化工学院
七、修业年限:
4年
八、授予学位:
理学学士学位
九、各类课程学时学分比例
课程性质 课程类别 通识教育必修课程 学科基础平台课程 必修课 专业基础课程 专业必修课程 实践环节 不含实验课程 含实验课程 125 学 分 29 17 56 13 10 36 10 27 3 14 152 432 2531+ 21 周 学 时 739 288 1216 288 21 周 832 160 48 224 2963+21 周 100% 17.76% 82.24% 占总学分百分比 19.08% 11.18% 36.84% 8.55% 6.58% 23.68% 6.58% 1.97% 9.21%
三、培养要求:
系统扎实地掌握化学基础知识和基本理论;熟练地掌握化学实验的基本技能;了解化学的发展历史、学 科前沿和发展趋势;掌握本专业所需的数学、物理、计算机等知识,了解化学工程、生命、材料、能源、环境 等相关领域的基础知识;初步掌握化学研究、开发和应用等基本方法和手段,初步具备发现、提出、分析和解 决化学及相关问题的能力;具有安全意识、环保意识和可持续发展理念;掌握必要的信息技术,能够获取、加 工和应用化学及相关信息;掌握一门外国语,具有国际视野和跨文化交流、竞争与合作能力;具有较强的学习、 表达、交流和协调能力及团队合作精神;具有一定的创新意识和批判性思维;初步具备自主学习、自我发展的 能力,能够适应科学技术和经济社会发展。
新版山东大学化学考研经验考研参考书考研真题

若在几十年前,我们的父辈们或许还可以告诉我们,未来从事怎样的职业,会有很好的发展,不至于失业。
而如今,他们大抵再也不能如此讲话了,只因这个世界变化的如此之快,在这变化面前,他们大概比我们还要慌乱,毕竟他们是从传统的时代走来的,这个更新换代如此迅速的世界只会让他们措手不及。
但是,虽然如此,他们却可以告诉我们一条永远也不会过时的生存法则,那就是掌握不断学习的能力。
所以,经过各种分析考量我终于选择了考研这条路,当然,这是只是,千万条路中的一条。
只不过我认为,这条路可操作性比较强,也更符合我们当下国情。
幸运的是,我如愿以偿,考到自己希望的学校。
一年的努力奋斗,让自己从此走上了截然不同的人生道路。
秋冬轮回,又是一年春风吹暖。
在看到录取名单之后,我终于按捺不住发了我一条朋友圈,庆祝考研胜利。
当时收到了很多平时不太联系的同学,发来的询问信息,这也促使我想将我的备考经验写下来,希望真的可以帮助接下来备考的学弟学妹们!因为想要讲的话太多,所以这篇文章会比较长,希望各位能够一点点看完。
或许会从我的经验教训中找到自己的方向以及方法来面对考研。
在结尾处会奉上我的学习资料供大家下载。
山东大学化学的初试科目为:(101)思想政治理论(201)英语一(628)理论化学(835)合成化学参考书目为:1、《物理化学简明教程》(第四版),印永嘉等主编,高等教育出版社2007版2、《无机化学》(第一版),宋其圣等主编,化学工业出版社2008年版;3、《分析化学》(第四版),武汉大学主编,高等教育出版社4、《精编有机化学教程》(第二版),郝爱友、孙昌俊主编,山东大学出版社2009年版先说说英语复习心得一.词汇词汇的复习流程其实都比较熟悉了,就是反复记忆。
考研要求掌握5500的词汇量,这是一个比较大的工,我建议考研词汇复习的参考书至少要有两本,一本是比较流行的按乱序编排的书,另一本是按考试出现频率编排的书,也就是所谓的分级词汇或分频词汇,我使用的是木糖的单词和真题,很精练,适合后期重点巩固使用,工作量也不是很大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2003-2004第二学期无机化学试题1答案及评分细则一.写出有关的化学反应方程式并配平(20分)。
每题2分,仅仅写出反应物及产物的化学式而未配平,则得1分;化学式写错不得分。
1.用氢碘酸处理CuO;2HI +CuO=CuI +H2O2.朱砂溶于王水;3HgS +2HNO3+ 12HCl =3H2[HgCl]4+2NO+4H2O+ 3S3.向磷与溴的混合物中滴加水;2P+ 3Br2 + 6H2O2H3PO3+ 6HBr↑4.五硫化二锑溶于烧碱溶液;Sb2S5+8NaOH=Na3SbO4+Na3SbS4+4H2O+Na2S5.光气与氨气反应;4NH3 + COCl2=CO(NH2)2+ 2NH4Cl6.单质磷溶于热烧碱溶液;P4+ 3NaOH + 3H2O= PH3 +3NaH2PO27.氯气通入含有氢氧化铋的烧碱溶液;Cl2+ Bi(OH)3+3NaOH =NaBiO3 +2NaCl+ 3H2O8.砷化氢通入硝酸银溶液;2AsH3+12AgNO3 + 3H2O=As2O3+ 12HNO3+12Ag↓9.向磷酸二氢钠溶液中滴加硝酸银溶液;H2PO4- +3Ag+ = Ag3PO4↓+2H+10.用烧热的铅除去酒中含有的醋酸。
Pb+2HAc=Pb(Ac)2+ H2二.简下列制备路线,并写出有关的反应方程式(30分),每题10分。
1.目前工业上主要采用什么方法生产氢氟酸、盐酸和氢溴酸?如果用H2和Br2直接燃烧法生产HBr而又不降低H Br的产率,实际生产中应采取什么措施?答:氢氟酸主要是通过氟化钙与浓硫酸反应制得:CaF2 + H2SO4 = 2HF+ CaSO4盐酸主要是通过氢气和氯气在光照下反应生成HCl,然后用水吸收:Cl2+ H2光照2HCl氢溴酸主要是通过单质溴和白磷在加热条件下加入水生成HBr,在用水吸收得到:2P+ 3Br2 + 6H2O ∆2H3PO3+ 6HBr↑直接燃烧法由氢气和溴蒸气合成HBr,主要存在的问题是HBr在高温下容易分解,产率较低,而降低温度虽然能提高HBr的产率,但是反应速率太低,无法实现实际上生产。
解决这一矛盾的关键就是寻找、合成专用的催化剂,催化剂的作用就是在较低温度下提高氢气和溴蒸气的反应速率,目前,用于该反应的专用催化剂已经投入实际生产。
2.以硼镁矿为主要原料制备乙硼烷。
①用烧碱溶液浸取硼镁矿Mg2B2O5⋅H2O+ 2 NaOH = 2NaBO2 + 2Mg(OH)2↓②过滤除去Mg(OH)2和其他难溶杂质,然后向滤液中通入CO2调节溶液pH使AlO2-、CrO2-等沉淀为氢氧化物:4NaBO2 + CO2+10H2O = Na2B4O7⋅10H2O +Na2CO3③过滤并将滤液浓缩重结晶得到硼砂,后用H2SO4处理使硼砂转化为难溶于水的硼酸:Na2B4O7 + H2SO4 + 5H2O=4H3BO3↓+Na2SO4④过滤、洗涤、晾干硼酸晶体,加热分解得到B2O32H3BO3∆===B2O3 +3H2O⑤在高压及三氯化铝催化下,用铝和氢气还原B2O3制得乙硼烷B2O3+ 2Al+ 3H2−−→−32Cl Al B2H6+Al2O33.以铬铁矿为主要原料制备铬黄。
(1)高温煅烧4Fe(CrO2)2+ 8Na2CO3+7O2==8Na2CrO4 +2Fe2O3 + 8CO2加入纯碱和白云石使SiO2变为CaSiO3、Al2O3变为NaAlO2。
(2) 水浸、过滤、除渣,滤液用酸调PH =7~8Al(OH)4-+H+=A(OH)3(3)过滤除区Al(OH)3,滤液中加入PbCl2溶液,反应得到铬黄Na2CrO4+ PbCl2=PbCrO4↓+2NaCl 过滤、洗涤、干燥、研磨即可得到黄色颜料铬黄。
三.回答下列问题(40分),每题5分。
1.向Hg2+溶液中加入KI溶液时生成红色HgI2沉淀,继续加入过量的KI溶液,HgI2沉淀溶解得无色的HgI42-配离子溶液。
请说明HgI2有色而HgI42-无色的原因。
答:HgI2产生颜色的原因是Hg2+离子半径较大,具有较强的极化作用和变形性,I-离子同样半径较大变形性较大,因此HgI2中正负离子的相互极化作用很强,导致化学键由离子键向共价键转化,电荷迁移明显,吸收的能量处在可见光范围,当可见光照射时,吸收红色光的互补光,从而显红色。
在HgI42-中中心离子Hg2+的价层电子构型为d10,属于全充满构型,因此中心离子不存在电子的d-d跃迁,基本上不吸收可见光,所以为HgI42-无色。
2.什么是自旋-禁阻跃迁?为什么Mn(H2O)62+配离子几乎是无色的?答:对于d5构型的中心离子来讲,当中心离子与弱场配体形成配合物时,5个价层d电子均匀地分布在每一个d轨道中,自选方向相同,这种状态是一种非常稳定的状态(类似于基态原子d轨道的半充满状态),假如处于低能态轨道的d电子吸收可见光跃迁至高能态轨道,就不可避免地克服电子间的排斥作用在同一轨道中配对,而且电子的自选方向要发生翻转,从理论上讲这种跃迁是自选禁阻的,发生的几率非常低,因此d5构型的中心离子形成的弱场配合物几乎都是无色的。
例如Mn2+与H2O、Cl-等弱场配体形成的配合物基本都是无色的。
这种现象就称之为自旋禁阻。
3.一些顺式铂的配合物可以作为活性抗癌药剂,如cis-PtCl4(NH3)2、cis-PtCl2(NH3)2、cis-PtCl2(en)等。
实验测得它们都是反磁性物质,试用杂化轨道理论说明它们的成键情况,指出它们是内轨型配合物还是外轨型配合物。
答:既然它们都是反磁性物质,说明在其原子中均不存在成单电子,Pt2+离子的价层电子构型为d8,Pt4+离子的价层电子构型为d6,既然各自的配合物均显示反磁性,证明它们都是内轨型配合物。
在cis-PtCl4(NH3)2中中心离子采取d2sp3杂化,Pt4+的6个杂化轨道分别与4个Cl-离子3p轨道和2个NH3分子的sp3杂化轨道重叠形成6个σ键,分子构型为八面体。
在cis-PtCl2(NH3)2、cis-PtCl2(en)中中心离子都是采取dsp2杂化,Pt2+的4个杂化轨道分别与2个Cl-离子3p轨道和2个N原子的sp3杂化轨道重叠形成4个σ键,分子构型为平面四边形。
4.KClO3固态受热,在360℃时出现一吸热过程,500℃时出现一放热过程,580℃时再次放热并显著失重,770℃时又发生一吸热过程。
请加以解释。
在360℃时KClO3熔化吸收热量,表现出吸热过程;500℃时KClO3分解转分化成KCl和KClO4,由于KCl和KClO4键能大、稳定性高,因此表现出放热现象;580℃时KClO4分解生成KCl和O2,再次放热并显著失重;770℃时KCl熔化表现出吸热现象。
5.常见的金属硫化物中,哪些易溶于水?哪些可溶于稀盐酸?哪些可溶于浓盐酸?哪些可溶于硝酸溶液?哪些可溶于王水?答:常见硫化物中,易溶于水的有:Na2S、K2S、(NH4)2S、BaS等;难溶于水,但可溶于稀盐酸的有:FeS、ZnS、MnS等;难溶于稀盐酸,但可溶于浓盐酸的有:SnS、CdS、CoS、NiS、PbS等;难溶于盐酸,但可溶于硝酸的有:Ag2S、CuS、AS2S5、Sb2S5等;难溶于硝酸,但可溶于王水的有:HgS。
试用6种试剂,将下列6种固体从混合物中逐一溶解,每种试剂只能溶解一种物质,并说明溶解次序。
BaCO3,AgCl,KNO3,SnS2,CuS,PbSO4。
答:水溶解KNO3;氨水溶解AgCl:盐酸溶解BaCO3:醋酸溶解PbSO4:硫化钠溶解SnS2;硝酸溶解CuS。
6.写出下列物质主要成分的化学式:毒重石,孔雀石,绿柱石,萤石,天青石。
毒重石BaCO3;孔雀石CuCO3Cu(OH)2;绿柱石3BeO·Al2O3·6H2O;萤石CaF2;天青石SrSO4。
7.分析说明NH3、N2H4、NH2OH、N3H的酸碱性变化规律。
答:由NH3→N2H4→NH2OH→N3H,氨分子NH3中的氢原子逐渐被吸电子作用更强的―NH2、―OH、―N2基团取代,原NH3中N原子上孤电子对的电子云密度逐渐减小,因此碱性逐渐降低,到叠氮酸N3H已经表现出明显的酸性。
8.设计实验方案分离下列离子:Al3+、Cr3+、Fe3+、Zn2+、Hg2+。
答:Al3+、Cr3+、Fe3+、Zn2+、Hg2+↓NaOH(过量)S:Fe(OH)3+HgO↓Al(OH)4-、Cr(OH)63-、Zn(OH)42-↓HCl+ H2S ↓HClAl(OH)3、Cr(OH)3、Zn(OH)2P:S:↓NH3·H2OHgS +S Fe2+A l(OH)3、Cr(OH)3 Z n(NH 3)42+↓Na OH + Cl 2Al(OH)3↓ C rO 42-四.计算题(10分)。
向0.010mol ·dm -3ZnCl 2溶液通H 2S 至饱和,当溶液的pH =1.0时刚好有Zn S沉淀产生。
若在此Zn Cl 2溶液中事先加入1.0mol ·d m-3KCN,再通入H 2S 至饱和,求在多大pH 时会有Zn S沉淀产生?已知K 稳[Zn(CN)42-]=5.0×1016;H 2S 的电离常数:K a 1=1.0×10-8,K a2=1.0×10-15;HC N 电离常数:Ka =6.0×10-10。
答:pH=1.0,[H +]=0.10mol·dm -3,[Zn 2+]=0.010 mol·dm-3ﻫS]H []H []S H [01.0]][S Zn [)ZnS (221222122K K K K K sp =⨯==+-+ﻫ加入KCN 后,设[Zn2+]=x mol·dm -3则ﻫZn 2+ + 4C N- === Zn(CN)42-平衡浓度/ mo l·dm -3 x 1.0-4(0.01-x) 0.01-x4)]01.0(40.1[01.0x x x K s ---= ﻫ 得到191035.2-⨯=x ,即[Zn2+]191035.2-⨯= mol·d m-3ﻫ22211922]H []S H [1035.2]][S [Zn ZnS)(+--+⨯⨯==K K K sp222119221]H []S H [1035.2]S H [+-⨯⨯=K K K K可得[H +]=4.85⨯10-10 mol·dm -3,pH=9.31。
——完——2003-2004第二学期无机化学试题2答案及评分细则一.写出有关的化学反应方程式并配平(20分)。
每题2分,仅仅写出反应物及产物的化学式而未配平,则得1分;化学式写错不得分。
