实验八乙醚的制备
实验八 有机化学实验研究 乙醇结构式的测定 上交

实验八有机化学实验研究——乙醇结构式的测定【实验教学研究目的】1.掌握乙醇结构式定量测定实验的成功关键,学会其测定的实验技能;2.通过乙醇结构式测定的探究性实验,训练科学探究方法,提高科学探究能力;3.学习和探讨组织中学生进行探究性学生实验的教学方法。
【实验教学研究内容】1.测定乙醇的结构式;2.组织中学生进行乙醇结构式测定的探究性实验的教法。
【实验研究方案设计】一、实验原理确定有机物分子式、结构式通常采取的方法和途径具体归纳如下:已知乙醇的分子式为C2H6O,根据C四价,O二价,H一价的价键规则写出它可能的结构式;这6个氢原子的位置和性质是怎样的?可通过实验证明其中一个氢原子与其它5个氢原子的性质不同,因而可以推断这个氢原子与其它5个氢原子的所处的位置不同。
利用乙醇与金属钠反应,生成氢气的性质来测定其结构式为(1)式;取一定量的乙醇与金属钠反应,将收集到的V2体积的氢气,根据理想气体状态方程换算成标准状态下的体积V1。
p V T p V T11 1222p1、V1、T1为标准状态下气体的压强、体积、温度。
p2、V2、T2为实验时气体的压强、体积、温度。
T1∶273.15为绝对温度。
p1∶一个标准大气压。
T 2:273.15+t根据气体摩尔体积可计算出氢气的物质的量。
氢气的物质的量=V L 1224. 设:乙醇分子中可被金属钠置换的氢原子个数为x则:C H O xNa C H ONa x H x x 262622+=+-↑ 122241mol x mol Amol V mol 乙醇可以生成氢气取乙醇反应生成氢气.即:122242224111∶∶x A V x V A ==..()实验时取GmL 无水乙醇进行反应,其密度为0.79g ·mL -1,摩尔质量为46g/molA G =⨯079462.() 将(2)式代入(1)式整理后:x V G =⨯⨯⨯⨯2462240791.. 实验时应测的数据:p 2、T 2、V 2、G 。
乙醚的制备实验报告

实验名称:乙醚的制备实验一、 实验目的1.原理和方法——在酸作用下醇分子间脱水制备2.基本操作——①控制温度来控制反应方向进行;②低沸点依然液体的蒸馏,洗涤分离等基本操作要点。
二、实验原理或主要反应式1.酸作用下,醇分子间脱水成醚本实验在浓硫酸作用下,乙醇发生分子间脱水生成乙醚。
反应方程式:2.基本反应历程3.副反应 在反应过程中,如果温度控制不好,就可能发生乙醇分子内脱水成烯、氧化为醛或酸的副反应。
反应方程式:三、主要试剂及药品液体药品:95%乙醇、浓硫酸、5%氢氧化钠溶液、饱和氯化钙溶液、饱和食盐水 固体药品:无水氯化钙四、实验装置图五、实验步骤六、产品质量及产率(网络授课可忽略此项)七、实验注意事项1. 仪器要干燥,安装要严密,滴液漏斗下端要浸入液面以下。
2. 注意温度计位置:制备乙醚和蒸馏乙醚时温度计的位置不一样。
3. 分批加浓硫酸时,注意边加边摇边冷却,防止乙醇进一步氧化。
4. 控制好反应温度及滴加乙醇的速度(约1 滴/秒)。
5. 反应完后要先停止加热,稍冷却后再拆下接收瓶,防止产物挥发。
6. 乙醚是易燃溶剂,在洗涤分离、蒸馏时要远离明火,注意通风,保证安全。
八、实验小结或问题讨论1.在乙醚的制备过程中,滴液漏斗的下端为什么要伸到液面以下?防止乙醇还没有参加反应就被蒸出。
2.在洗涤分离过程中,每一步分别除去的是哪些杂质?(除杂的原则;粗盐如何提纯)用氢氧化钠溶液洗涤除去酸性物质:乙酸、亚硫酸;用饱和食盐水洗涤除去残留的碱并减少乙醚在水中的溶解度;用饱和氯化钙溶液洗涤除去乙醇。
3.制备乙醚时,反应温度过高或过低对反应有什么影响?反应温度过高,则副反应增多,产率降低;反应温度过低,则反应速率很慢。
4.在制备乙醚和蒸馏乙醚时,温度计的位置是否相同?为什么?制备乙醚时,温度计的水银球须浸入液面以下距瓶底约0.5~1cm处,与漏斗脚末端齐平。
蒸馏乙醚时,温度计水银球应位于蒸馏头支管口。
实验八Fe3+、Al3+离子的分离

实验八 Fe 3+、Al 3+离子的分离——液-液萃取与分离[实验目的]学习萃取分离法的基本原理;初步了解铁、铝离子不同的萃取行为。
学习萃取分离和蒸馏分离两种基本操作。
在6mol ·L -1盐酸中,Fe 3+离子与Cl -离子生成了[FeCl 4]-配离子。
在强酸-乙酸萃取体系中,乙醚(2t E O )与离子结合,生成了离子(2t E O ·H +)。
由于[FeCl 4]-离子与2t E O ·H +离子都有较大的体积和较低的电荷。
因此,容易形成缔合物2t E O ·H +·[FeCl 4]-,在这种离子缔合物中,Cl -离子和2t E O 分别取代了Fe 3+离子和H +离子的配位水分子,并且中和了电荷,具有疏水性,能够溶于乙醚中。
因此,就从水相转移到有机相中了。
Al 3+离子在6mol ·L -1盐酸中与Cl -离子生成配离子的能力很弱,因此,仍然留在水相中。
将Fe 3+离子由有机相中再转移到水相中去的过程叫做反萃取。
将含有Fe 3+离子的乙醚相与水相混合,这时体系中的H +离子浓度和Cl -离子浓度明显降低。
离子2t E O ·H +和配离子[FeCl 4]-解离趋势增加,Fe 3+离子又生成了水合铁离子,被反萃取到水相中。
由于乙醚沸点较低(35.6),因此,采用普通蒸馏的方法,就可以实现醚水的分离。
这样Fe 3+又恢复了初始的状态,达到了Fe 3+、Al 3+分离的目的。
[实验用品]仪器:圆底烧瓶(250mL )、直管冷凝器、尾接管,抽滤瓶、烧杯、梨形分液漏斗(100mL)、量筒(100mL)、铁架台、铁环液体药品:FeCl 3(5%)、浓盐酸(化学纯)、乙醚(化学纯)、K 4Fe(CN)6(5%)、NaOH(2mol ·L -1、6mol ·L -1)、茜素S 酒精溶液、冰水、热水材料:乳胶管、橡皮管、玻璃弯管、滤纸、pH度纸[基本操作]1.萃取,参见第六章二。
乙醚制备_精品文档

乙醚的精制
洗涤
5%氢氧化钠洗涤 饱和氯化钠洗涤 饱和氯化钙洗涤
干燥
无水氯化钙干燥
蒸馏
水浴的使用方法
注意事项
安全问题
乙醇和硫酸混合时要注意安全,是 将硫酸逐渐加入到乙醇中,而且是 慢慢加入,注意搅拌和振荡,注意 用冰水浴冷却。
乙醚是易燃烧和易爆炸(和空气混 合)的物质,安装蒸馏装置时要注 意,不要离的太近,不要用明火加 热。
联想:如何提高产率?提高反应速率?
谢谢
2014-3-13
CH3CH2OCH2CH3 + H2SO4
副反应
1
CH3CH2OH
H2SO4170C Nhomakorabea2CH2
H2O
+ + +
+
2
CH3CH2OH
3炭化
H2SO4
[O]
CH3CHO CH3COOH SO2 H2O
装置图
实验操作步骤
反应液的混合
在三口烧瓶中加入12毫升95%乙醇,将烧 瓶置于冰水浴中,在不断搅拌或震荡下缓慢加 入12毫升浓硫酸,混合均匀。
有机化学实验
乙醚的制备
实验目的
掌握乙醚制备的原理和方法 学习低沸点、易燃烧、易爆炸
物质的基本操作要点 熟练掌握洗涤、蒸馏、水浴加
热等操作
反应原理
主要反应
CH3CH2OH + H2SO4 100 ~ 130
CH3CH2OSO3H + H2O
CH3CH2OSO3H + CH3CH2OH 130 ~ 145
仪器安装
在三口烧瓶上安装恒压滴液漏斗、温度计 和蒸馏头,滴液漏斗插入液面以下,温度计用 搅拌器套管固定,蒸馏头连接冷凝管,再通过 接液管与烧瓶连接,并把烧瓶置于冰水浴中, 接液管的侧口用橡胶管导入下水道。在滴液漏 斗中加入25毫升95%乙醇。
实验八_乙醚的制备

乙醚实验室制法[实验原理]CH 3CH 2OH +H 2SO 4CH 3CH 2OSO 2OH +H 2OCH 3CH 2OSO 2OH +CH 3CH 2OH CH 3CH 2OCH 2CH 3+H 2SO 4CH 3CH 2OH +CH 3CH 2OCH 2CH 3H 2O CH 3CH 2OH 170CH 2CH 2+H 2O CH 3CHO +SO 2+H 2OCH 3CHO H 2SO 4CH 3COOH +SO 2+H 2O SO 2H 2O +H 2SO 3100-130。
C 。
C 。
C 135-145140。
C [O]H 2SO 4H 2SO 4主反应:副反应::总反应式[实验步骤] 按图安装好装置12.5ml95%乙醇当反应液温度上升到140℃,开始滴加(控制135-140℃)6mL95%乙醇6mL 浓H 2SO 4边反应边蒸馏馏出液4mL5%NaOH 洗涤4mL 饱和NaCl 洗涤4mL 饱和CaCl 2洗涤两次无水CaCl 2干燥蒸馏热水浴收集33-38℃馏分,称重,计算产率,测折光率[注意事项] 1.在反应装置中,滴液漏斗末端和温度计水银球必须浸入液面以下,接受器必须浸入冰水浴中,尾接管支管接橡皮管通入下水道或室外。
2.控制好滴加乙醇的速度(1D/S )和反应温度(135-145℃)。
3.乙醚是低沸点易燃的液体,仪器装置连接处必须严密。
在洗涤过程中必须远离火源。
制备乙醚实验装置图乙醚的制备.1. 乙醚的制备①在干燥的三角烧瓶中加入12ml乙醇,缓缓加入12ml浓H2SO4混合均匀。
①滴液漏斗中加入25ml乙醇。
②如图连接好装置。
③用电热套加热,使反应温度比较迅速升到1400C。
开始由滴液漏斗慢慢滴加乙醇。
④控制滴入速度与馏出液速度大致相等(1滴/s)。
⑤维持反应温度在135-1450C内30-45min滴完,再继续加热10min,直到温度升到1600C,停止反应。
2. 乙醚的精制①将馏出液转至分液漏斗中,依次用8ml5%NaOH,8ml饱和NaCl洗涤,最后用8ml饱和CaCl2洗涤2次②分出醚层,用无水CaCl2干燥。
实验八大黄中蒽醌类成分的提取分离和鉴定

留存的乙醚液,置圆底烧瓶中,回收乙醚,放置。抽滤收 集沉淀,经水洗,抽干移至表面皿上,干燥后称重。 4.鉴定 (1)碱液试验:分别取蒽醌化合物结晶少许,置试管中,加 1ml乙醇溶解,加数滴5%氢氧化钾试剂振摇,溶液呈红色 (2)醋酸镁试验:分别取各蒽醌化合物结晶少许,置试管中, 加1ml乙醇溶解,加数滴0.5%醋酸镁试剂,产生橙、红、紫等颜色
③
芦荟大黄素的分离
留存在分液漏斗中的乙醚液,用0.5%NaOH水溶液 每次15ml萃取3~4次。乙醚溶液再以蒸馏水萃取 2~3次,以洗去碱液。合并NaOH和水的提取液, 加盐酸调pH2~3,放置。抽滤析出沉淀,收集沉淀, 经水洗,抽干移至表面皿上,干燥后称重。
(三) 蒽醌类化合物的提取与分离
蒽 醌 的 提 取 与 分 离
蒽苷的分离 比苷元困难 ,分离前一 般先用溶剂 法除去大部 分杂质,得 较纯的总苷 后,再用柱 色谱分离。
(3)薄层检识
(4)纸色谱检识
支持剂:新华色谱滤纸(中速、20cm×7cm) 样品:各蒽醌成分1%三氯甲烷溶液
对照品:1%大黄酸三氯甲烷溶液;1%大黄素三氯甲烷溶液; 1%芦荟大黄素三氯甲烷溶液
展开剂:甲苯 显色剂:0.5%醋酸镁甲醇溶液
四、思考题
1.在实验过程中采用pH梯度萃取法分离游离蒽醌,萃取过程中 若出现乳化现象,应如何处理? 2.大黄酚和大黄素甲醚结构相似,怎样分离?
②
大黄素的分离
留存在分液漏斗中的乙醚液,用5%Na2CO3水溶液每次 15~20ml如上法相同萃取数次,直至提取液呈色较浅时为止, 约需6~7次,合并Na2CO3提取液,小心滴加盐酸酸化至pH2~3, 放置待沉淀析出,抽滤收集析出物经水洗涤,抽干移至表面皿上, 干燥后称重。
苯乙醚
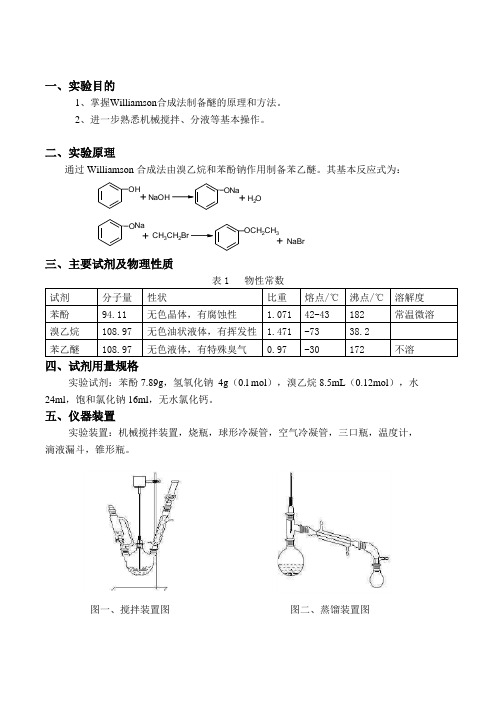
一、实验目的
1、掌握Williamson 合成法制备醚的原理和方法。
2、进一步熟悉机械搅拌、分液等基本操作。
二、实验原理
通过Williamson 合成法由溴乙烷和苯酚钠作用制备苯乙醚。
其基本反应式为:
OH
++H O 2
NaOH
Na
O NaBr
CH 3CH 2Br
+
Na
O CH 2CH 3
+
三、主要试剂及物理性质
表1 物性常数
四、试剂用量规格
实验试剂:苯酚7.89g ,氢氧化钠 4g (0.l mol ),溴乙烷8.5mL (0.12mol ),水24ml ,饱和氯化钠16ml ,无水氯化钙。
五、仪器装置
实验装置:机械搅拌装置,烧瓶,球形冷凝管,空气冷凝管,三口瓶,温度计,滴液漏斗,锥形瓶。
图一、搅拌装置图 图二、蒸馏装置图
七、实验结果
理论值=7.89÷94.11×108.97÷0.97=9.478ml
实际值=23×8÷46.7=3.940ml
产率=3.940/9.478×100%=41.57%
八、实验讨论
数据分析:产率偏低,但是产物比较清澈。
产率偏低的可能原因:
1、可能在刚开始时滴加溴乙烷速度控制不当,滴加过快,导致反应不完全,从
而使产率偏低;
2、在分液使油层有损失;
3、反应时,NaOH附在烧瓶壁上没有完全参与反应。
注意事项:
1、反应阶段控制溴乙烷的滴加速度,不能太快;
2、反应阶段的三口瓶和滴液漏斗、蒸馏阶段装置要事先干燥。
苯乙醚的制备

苯乙醚的制备一、危险性评估及相应防护措施苯酚危险性概述健康危害:苯酚对皮肤、粘膜有强烈的腐蚀作用,可抑制中枢神经或损害肝、肾功能。
急性中毒:吸入高浓度蒸气可致头痛、头晕、乏力、视物模糊、肺水肿等。
误服引起消化道灼伤,出现烧灼痛,呼出气带酚味,呕吐物或大便可带血液,有胃肠穿孔的可能,可出现休克、肺水肿、肝或肾损害,出现急性肾功能衰竭,可死于呼吸衰竭。
眼接触可致灼伤。
可经灼伤皮肤吸收经一定潜伏期后引起急性肾功能衰竭。
慢性中毒:可引起头痛、头晕、咳嗽、食欲减退、恶心、呕吐,严重者引起蛋白尿。
可致皮炎。
环境危害:对环境有严重危害,对水体和大气可造成污染。
燃爆危险:该品可燃,高毒,具强腐蚀性,可致人体灼伤。
防护及急救措施防护措施呼吸系统防护:可能接触其粉尘时,佩戴自吸过滤式防尘口罩。
紧急事态抢救或撤离时,应该佩戴自给式呼吸器。
眼睛防护:戴化学安全防护眼镜。
身体防护:穿透气型防毒服。
手防护:戴防化学品手套。
其它:工作现场禁止吸烟、进食和饮水。
工作毕,淋浴更衣。
单独存放被毒物污染的衣服,洗后备用。
保持良好的卫生习惯急救措施皮肤接触:立即脱去被污染的衣着,用甘油、聚乙烯乙二醇或聚乙烯乙二醇和酒精混合液(7:3)抹洗,然后用水彻底清洗。
或用大量流动清水冲洗,至少15分钟。
就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:立即给饮植物油15-30mL。
催吐。
就医。
溴乙烷危险性概述健康危害:会刺激肺部、眼睛和皮肤,可能引起头昏眼花、平衡失调,精神混乱,甚至昏迷和死亡,长期接触会损害肝、肾及心跳。
环境危害:醚味,蒸气比空气重会传播至远处,遇火源可能造成回火。
高温会分解生成刺激性的溴化氢及溴毒气。
主要症状:头昏眼花, 失去平衡, 胡言乱语, 意识不清。
防护措施吸入:立即把患者移到空气新鲜处。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验八乙醚的制备
TPMK standardization office【 TPMK5AB- TPMK08- TPMK2C- TPMK18】
乙醚实验室制法
[实验原理]
[实验步骤] 按图安装好装置
[注意事项] 1.在反应装置中,滴液漏斗末端和温度计水银球必须浸入液面以下,接受器必须浸入冰水浴中,尾接管支管接橡皮管通入下水道或室外。
2.控制好滴加乙醇的速度(1D/S)和反应温度(135-145℃)。
3.乙醚是低沸点易燃的液体,仪器装置连接处必须严密。
在洗涤过程中必须远
离火源。
制备乙醚实验装置图
乙醚的制备.
1. 乙醚的制备
①在干燥的三角烧瓶中加入12ml乙醇,缓缓加入12ml浓H2SO4混合均匀。
①滴液漏斗中加入25ml乙醇。
②如图连接好装置。
③用电热套加热,使反应温度比较迅速升到 1400C。
开始由滴液漏斗慢慢滴加乙醇。
④控制滴入速度与馏出液速度大致相等(1滴/s)。
⑤维持反应温度在135-1450C内30-45min滴完,再继续加热10min,直到温度升到1600C,停止反应。
2. 乙醚的精制
①将馏出液转至分液漏斗中,依次用8ml5%NaOH,8ml饱和NaCl洗涤,最后用8ml饱和CaCl2洗涤2次
②分出醚层,用无水CaCl2干燥。
③分出醚,蒸馏收集33-380C馏液。
④计算产率。
四、思考题
1、反应温度过高或过低对反应有什么影响?
参考答案
1、主要由原料CH3COOH(b.p.118℃)生成物水(b.p.100℃)的沸点所决定。
控制在105℃这样可以保证原料CH3COOH充分反应而不被蒸出,生成的水立即移走促使反应向生成物方向移动,有利于提高产率。
三十一乙醚的制备
204. 实验室使用或蒸馏乙醚时应注意哪些问题?
答:在实验室使用或蒸馏乙醚时,实验台附近严禁有明火。
因为乙醚容易挥发,且易燃烧,与空气混和到一定比例时即发生爆炸。
所以蒸馏乙醚时,只能用热水浴加热,蒸馏装
置要严密不漏气,接收器支管上接的橡皮管要引入水槽或室外,且接收器外要用冰水冷却。
另外,蒸馏保存时间较久的乙醚时,应事先检验是否含过氧化合物。
因为乙醚在保存期间与空气接触和受光照射的影响可能产生二乙基过氧化物(C2H5OOC2H5),过氧化物受热容易发生爆炸。
检验方法:取少量乙醚,加等体积的2% KI 溶液,再加几滴稀盐酸振摇,振摇后的溶液若能使淀粉显蓝色,则表明有过氧化合物存在。
除去过氧化合物的方法:在分液漏斗中加入乙醚(含过氧化物),加入相当乙醚体积1/5的新配制的硫酸亚铁溶液(55 ml水中加3 ml浓硫酸,再加30g 硫酸亚铁),剧烈振动后分去水层即可。
205. 在制备乙醚时,滴液漏斗的下端若不浸入反应液液面以下会有什么影响?如果滴液漏斗的下端较短不能浸入反应液液面下应怎么办?
答:滴液漏斗的下端应浸入反应液液面以下,若在液面上面,则滴入的乙醇易受热被蒸出,无法参与反应,造成产率低、杂质多。
如果滴液漏斗下端较短而不能浸入反应液液面以下,应在其下端用一小段橡皮管接一段玻璃上去。
但要注意,橡皮管不要接触到反应液,以免反应液中的浓硫酸腐蚀橡皮管。
206. 在制备乙醚和蒸馏乙醚时,温度计被装的位置是否相同?为什么?
答:不同。
在制备乙醚时,温度计的水银球必须插入反应液的液面以下。
因为此时温度计的作用是测量反应温度;而蒸馏时,温度计的位置是在液面上即水银球的上部与蒸馏烧瓶的支管下沿平齐,因为此时温度计的作用是测量乙醚蒸气的温度。
207. 在制备乙醚时,反应温度已高于乙醇的沸点,为何乙醇不易被蒸出?
答:因为此时,乙醇已与浓硫酸作用形成了盐。
该盐是离子型化合物,沸点较高,不易被蒸出。
208. 制备乙醚时,为何要控制滴加乙醇的速度?怎样的滴加速度才比较合适?
答:制乙醚时,反应液加热到130-140 oC 时,产生乙醚。
此时再滴加乙醇,乙醇将继续与硫酸氢乙酯作用生成乙醚。
若此时滴加乙醇的速度过快,不仅会降低反应液的温度,而且,滴加的部分乙醇因来不及作用就会被蒸出。
若滴加乙醇的速度过慢,则反应时间会太长,瓶内的乙醇易被热的浓硫酸氧化或碳化。
因此,滴加乙醇的速度应控制到能保持与馏出乙醚的速度相等为宜(1滴/秒)。
209. 在粗制乙醚中有哪些杂质?它们是怎样形成的?实验中采用了哪些措施将它们一一除去的?
答:在粗制乙醚中尚含有水、醋酸、亚硫酸以及未反应的乙醇。
实验中用NaOH溶液除去酸性物质:醋酸和亚硫酸;用饱和氯化钙除去乙醇;用无水氯化钙干燥除去所剩的少量水和乙醇。
210. 在用NaOH溶液洗涤乙醚粗产物之后,用饱和氯化钙水溶液洗涤之前,为何要用饱和氯化钠水溶液洗涤产品?
答:因为在用NaOH水溶液洗涤粗产物之后,必然有少量碱残留在产品乙醚里,若此时直接用饱和氯化钙水溶液洗,则将有氢氧化钙沉淀产生,影响洗涤和分离。
因此用氢氧化钠水溶液洗涤产品之后应用饱和氯化钠水溶液洗涤。
这样,既可以洗去残留在乙醚中的碱,
又可以减少乙醚在水中的溶解度。
211. 若精制后的乙醚沸程仍较长,估计可能是什么杂质未除尽?如何将其完全除去?答:若精制后的乙醚沸程仍较长,则说明此乙醚中还含有较少量的
乙醇和水未除干净。
它们能与乙醚形成共沸物。
为了得到绝对乙醇,可将此乙醚先用无水氯化钙干燥处理,然后,用金属钠干燥。
212. 用乙醇和浓硫酸制乙醚时,反应温度过高或过低对反应有何影响?怎样控制好反应温度?
答:若反应温度过高(大于140oC)时,则分子内脱水成乙烯的副反应加快,从而减少了乙醚的得率。
同时浓硫酸氧化乙醇的副反应也加剧,对乙醚的生成不利。
温度过低,乙醚难以形成,而部分乙醇因受热而被蒸出,也将减少乙醚的产量。
同时,乙醚中的乙醇量过多,给后处理将带来麻烦。
正确的控制温度方法是:迅速使反应液温度上升至140 0C,控制滴加乙醇的速度与乙醚蒸馏出的速度大致相等,以维持反应温度在1400C左右。
