流式细胞仪检测细胞周期操作步骤
流式细胞仪检测细胞周期

流式细胞仪细胞周期测定步骤
1)将细胞以1×106接种于60mm培养板,80%汇合后转染。
2)24小时后在新鲜培养液中加入适当的抗生素(真核表达载体上的抗性标记)进行培养(该步可选)。
3)48-72小时后用胰酶消化收集细胞,PBS洗两遍,弃上清,加入1ml 70%预冷乙醇中,吹打均匀,4℃固定12小时以上。
4)PBS洗涤去乙醇,1000rpm, 5min,洗两遍。
5)0.5mlPBS重悬细胞,加入PI和 RNaseA至终浓度50µg/ml,37℃ 温浴30 min。
6)用流式细胞仪测定周期。
PI:碘化丙啶,以PBS配成1mg/ml,4℃保存。
RNaseA:10mg/ml
应用:通过流式细胞仪分析各时期的细胞百分数,可检测细胞的增殖、凋亡。
流式细胞仪细胞周期测定经验:1.在测定细胞周期的时候(以BD公司的Calibur为例),除了设置好获取数据的模版外,另外设置以FL3为横坐标的直方图,测量模式为对数(log),调整放大倍数,使二倍体峰出现在横坐标10*3的位置,就很容易的找到了二倍体峰和细胞周期个时相细胞的分布情况。
根据它再调节FL2(线性模式下)的放大倍数,使二倍体峰在10*2的位置即可。
流式细胞仪检测细胞周期操作步骤
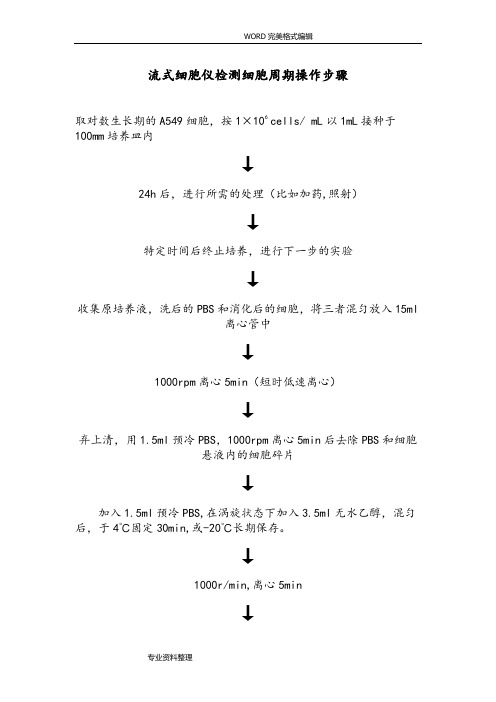
流式细胞仪检测细胞周期操作步骤取对数生长期的A549细胞,按1×106 cells/ mL以1mL接种于100mm培养皿内↓24h后,进行所需的处理(比如加药,照射)↓特定时间后终止培养,进行下一步的实验↓收集原培养液,洗后的PBS和消化后的细胞,将三者混匀放入15ml离心管中↓1000rpm离心5min(短时低速离心)↓弃上清,用1.5ml预冷PBS,1000rpm离心5min后去除PBS和细胞悬液内的细胞碎片↓加入1.5ml预冷PBS,在涡旋状态下加入3.5ml无水乙醇,混匀后,于4℃固定30min,或-20℃长期保存。
↓1000r/min,离心5min↓将乙醇吸除,加PBS清洗混匀↓1000r/min,5min再离心一遍,将残留在细胞上的乙醇除去↓吸除离心管内PBS,加入200ul PBS和2ul的RNA酶(0.25mg/ml)(37℃下孵育30min)↓加入0.5ml的50ug/ml的PI溶液室温下避光染色30min↓将离心管内的细胞过滤(300um尼龙网膜)至含有PBS的EP管中(PI 具有很强的粘附性,容易使细胞聚团),标记EP管↓提前一天网上预约↓开机(先开仪器后开软件)↓流式细胞仪的结构一般分为5部分:①流动室及液流驱动系统;②激光光源及光束成形系统;③光学系统;④信号检测、存贮、显示、分析系统;⑤细胞分选系统。
↓检测前先涡旋使细胞混匀悬浮呈单个细胞,然后插入流式细胞仪上↓流动室内充满鞘液,细胞排成单列由喷嘴中心喷出,形成细胞液柱↓液柱与激光束相交,细胞上的荧光染料被激发产生荧光(488nm激发光源)↓荧光信号变成电信号输出到计算机,软件分析(荧光染料和细胞DNA分子特异性结合,可以检测出细胞周期各时相细胞比例)↓在用第三方软件分析之前,将流式结果按如下所示导出结果分析——Modfit软件分析——Flowjo 软件分析图片拷贝:直接Ctrl+CFCM-DNA 量分析 1 个细胞增殖群时,可将DNA 含量分布组方图分为三部分,即 G0/1、S 、G2M 。
利用流式细胞仪分析细胞存活率细胞周期ROS

利用流式细胞仪分析细胞存活率细胞周期ROS 流式细胞仪(Flow cytometry)是一种广泛应用于生物医学研究领域的技术,可用于分析细胞数量、形态、存活率、细胞周期等多个参数。
下面将详细介绍如何利用流式细胞仪来分析细胞存活率、细胞周期和ROS (Reactive Oxygen Species)。
一、分析细胞存活率细胞存活率是研究细胞毒性或细胞凋亡过程中的重要参数。
在流式细胞仪中,常用细胞染色剂PI(Propidium Iodide)来评估细胞的存活率。
PI是一种能够穿透破损细胞膜并结合DNA的染色剂,可以通过荧光检测器来测量。
具体操作步骤如下:1.培养待测试的细胞,并将细胞备样。
可以使用PBS洗涤一遍,以获得单细胞悬浮液。
2. 使用细胞培养基或PBS将细胞悬浮液稀释至合适的细胞浓度,通常在1×10^6 - 1×10^7 cells/mL之间。
3.加入适量的PI染色剂到细胞悬浮液中,一般终浓度为1-10μg/mL。
4.在黑暗条件下,在4°C冷藏室中孵育15-30分钟,避免光照和温度升高。
5.使用流式细胞仪进行测量。
设置PI染色剂的激发波长和检测通道,根据实验需要选择适当的过滤器。
6. 将细胞悬浮液转移到流式细胞仪的样本管中,进行数据采集和分析。
可以设置门控(gating)策略以排除细胞碎片和颗粒物。
通过分析样本中PI染色的细胞数量,可以计算出细胞的存活率。
二、分析细胞周期细胞周期分析是研究细胞增殖和凋亡机制的一项重要实验。
在流式细胞仪中,通过DNA染色剂染色和分析可以了解细胞的周期分布情况。
具体操作步骤如下:1.培养待测试的细胞,并将细胞备样。
可以使用PBS洗涤一遍,以获得单细胞悬浮液。
2. 使用细胞培养基或PBS将细胞悬浮液稀释至合适的细胞浓度,通常在1×10^6 - 1×10^7 cells/mL之间。
3.用酒精或细胞固定液固定细胞,一般在-20°C的环境中固定20-30分钟。
流式细胞术检测细胞周期

流式细胞术检测细胞周期
流式细胞术检测细胞周期(PI染色)操作步骤
1、将单细胞悬液加入2ml圆底离心管中,离心,1500rpm , 5min,弃上清液。
2、加入PBS 1ml离心洗涤1次,弃上清。
3、加入2ml预冷的70%酒精,4℃固定30min,或是-20℃固定过夜。
4、离心,弃上清液。
5、用1×PBS 1ml洗涤1次,离心。
6、加入RNase A (工作浓度20ug/ml)于500ul 1×PBS中,37℃孵育30min,离心。
7、用1×PBS 1ml洗涤1次,离心。
8、加入PI(工作浓度50ug/ml) 于500ul 1×PBS中,室温避光孵育30min。
9、混匀,过300目筛网,置流式管中,4℃冰箱保存,待测。
10、用流式细胞仪检测细胞周期
11、用Flowjo软件分析流式细胞仪检测数据,并导出细胞周期分析结果
备注:
1、RNase A:贮液浓度:1mg/ml ;
工作液配制:加1 mg/ml贮液10ul于500ul 1×PBS中,使终浓度为20ug/ml。
2、PI:贮液浓度:2.5mg/ml;
工作液配制:加2.5 mg/ml贮液10ul于500ul 1×PBS中,使终浓度为50ug/ml。
4、检测样品细胞浓度1x106 /ml。
流式分析细胞周期

流式分析细胞周期
最近在做加药物的细胞周期,做了好几次,出现如下图的流式拟合图,师姐们都说你这样的拟合是强行的拟合,s期不明显,需要重新做,可是做了好多次还是这样的结果。
望专家教教我是哪里出错。
做细胞周期的步骤是:
1. 先铺板,2E5/孔。
过夜培养后加药(24h)
2. 再经过24h后可以进行测量。
3. 收集上清,并用PBS洗涤,再用胰酶消化,接着用PBS再洗一遍(在15ml管子中进行)
4. 1500转离心,小心去除上清,加入1ml的预冷PBS(记得要冲洗一下管壁),混匀后吸到1.5ml管中,再次在大厅中的离心机1500转4-5min(经过这样的一遍洗涤即可)
固定
5. 用枪吸走上清,剩余50ul左右,切勿吸走细胞,随后➕300ul 预冷PBS(用左手拿着EP管小拇指抵住涡旋震荡仪,右手拿住吸有700ul的乙醇的枪)缓慢打入其中,(这个过程尽量要慢)
6. 置于-20°冰箱中20min(有的说1h),若是过夜要要置于4°(有的说4h以上)
7. 1500转离心3-5min,小心吸上清
8. 加入1ml预冷PBS,重悬
9. 1500转离心3-5min,吸取上清,轻弹
染色
10. 0.5ml/管的碘化丙锭染色液(PI)缓慢加入,并充分的混匀
11. 37°避光30min
先配好染色的溶液
12. 4°避光存放2h
13. 上流式仪。
BD-FACSCalibur 流式细胞仪-细胞周期-操作步骤

BD/FACSCalibur流式细胞仪检测细胞周期操作步骤1、先给鞘液桶接超纯水。
2、把鞘液桶装上,拧紧。
3、开左边开关,从右向左依次打开,即总电源插头-交流稳定电压-插板-稳定输出电源。
(关机时从左向右关)。
4、按流式细胞仪开关。
换上新的已装超纯水的流式管。
5、将减压阀调至“run”(水缸旁边的黑色按钮)。
6、排气:将白色的手动排气阀从小头向大头移动,排气,2-3次,至无气泡。
最后停至小头。
自动排气:开始时是“低速”“standby”,调至“低速”“prime”,待排气完成会自动跳到“standby”,如此循环,到流式管内无气泡为止。
7、插电脑白色插头,打开电脑。
8、到无气泡时候调到“hign”“run”。
9、输入开机密码,打开电脑桌面上的“CELLQuest”(第四个图标)启动软件。
File→open Document→date→先找到打开自己之前的文件(cell dw 2018LSD)→Acquire→Connect to Cytometer→Acquisition面板中点击“change”修改文件名和日期,count改成1,即从第一个开始。
10、Acquire→counters→点击下面Acquisition control面板中的Acquire,看是否正常。
11、上样。
使仪器处于low run状态,样品管支架左移,上样品管后支架回位。
确认Acquisition control 窗口中Setup前需打勾(即不收集数据,用于仪器设置),点击Acquire。
仪器设置完成后,取消Setup前的“√”,点击Acquire 正式开始收集数据。
调界面操作:Cytometer → Detectors/Amps出现 Detectors/Amps 界面后,调FSC和SSC和FL2和FL2-W。
FSC调节的是门内(R1)细胞位置的左右,FSC的“Voltage”调到“E-1”,“E-1”是指个体很大细胞;“Amo Gain”的值调节门内(R1)细胞位置的宽度。
流式细胞术检测细胞周期的原理及技术流程
流式细胞术检测细胞周期的原理及技术流程哎呀,这可是个不简单的活儿啊!今天我们就要聊聊流式细胞术检测细胞周期的原理及技术流程。
话说这个方法可是科学家们研究细胞生长和分裂的重要工具呢,那咱们就好好聊聊吧!咱们得明白什么是细胞周期。
简单来说,就是细胞从一个生命周期阶段到另一个阶段的过程。
就像人一样,从出生到长大再到老去,每个阶段都有不同的特点和任务。
而细胞也是这样,它们也有自己的生命周期,从分裂开始,到分化成不同的细胞类型,再到死亡或修复损伤。
如何知道这些细胞在什么时候开始分裂、什么时候结束呢?这就需要用到流式细胞术了。
流式细胞术的原理其实很简单,就是通过激光或其他光源对细胞进行照射,然后利用特殊的摄像头捕捉不同颜色的荧光染料标记的细胞。
这些荧光染料会因为细胞内部的某些分子而发光,所以我们可以通过观察荧光的颜色和强度来判断细胞的状态和位置。
咱们就来看看流式细胞术的技术流程吧。
第一步,准备工作。
先要把待检测的细胞样本准备好,然后把它们稀释到一定浓度,这样可以让更多的地方都能看到荧光信号。
接着,要把样品放到流式细胞仪上,这里有一个小技巧:要尽量让样品均匀分布,这样才能保证检测结果的准确性哦!第二步,激光照射。
这时候要用到激光器或者其他光源对样品进行照射。
记住啊,这个过程一定要快,否则荧光信号可能会减弱或者消失。
不过不用担心,现在的流式细胞仪都设计得很聪明,能够自动调整激光功率和时间长度,以获得最佳的检测效果。
第三步,数据采集。
照射完成后,流式细胞仪就会自动记录下每个荧光信号的位置、强度和持续时间等信息。
这些数据会被传输到电脑上进行分析和处理。
别看这步骤听起来简单,实际上需要非常高的精度和速度才能做到哦!第四步,数据分析。
这一步主要是通过软件对收集到的数据进行分析和比对,找出其中的规律和异常情况。
比如说,我们可以通过观察不同细胞的荧光信号强度来判断它们的生命周期阶段;也可以通过比较不同样品之间的荧光信号差异来寻找潜在的疾病标志物等等。
方法--流式细胞术检测细胞
2.2.2.5 流式细胞术检测细胞周期2.2.2.5.1 实验原理用流式细胞仪检测细胞周期,通常用碘化丙啶(propidium iodide,PI)染细胞核。
PI在一定波长的光下发出荧光,其强度与DNA含量成正比。
通过流式细胞仪分析各时期的细胞百分数,可检测细胞的增殖、凋亡。
2.2.2.5.2流式细胞仪检测A549细胞周期步骤收集对数生长期细胞,计数,以(1~5)×105/孔接种于6孔板,置37℃,5%CO2条件下培养过夜,使细胞贴壁。
次日更换培养液,各孔分别加入含有0、80、400、2000、10000 mg/L不同浓度茶氨酸的细胞培养液2 mL/孔,继续常规培养;每24 h同法换液一次。
每个浓度设3个重复。
48 h后,中止培养,胰酶消化后,收集细胞于流式管1000 r/min离心5min,弃上,冷PBS洗涤细胞3次,离心去上清;一边震荡一边向细胞沉淀中加入70%预冷乙醇混匀,4℃固定18 h以上;离心,弃去乙醇上清,加入预冷的PBS洗沉淀1次,离心去上清;加入RNA酶(50 mg/L)10 μL/孔和PI(50 mg/L)300 μL/孔,震荡混匀。
室温、避光反应30 min;流式细胞仪进行DNA检测,用Modifit软件分析各时相细胞周期的比例。
2.2.2.6流式细胞仪检测A549细胞凋亡2.2.2.6.1实验原理在正常细胞中,磷脂酰丝氨酸(PS)只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧。
AnnexinV 是一种分子量为35~36 kD的Ca2+依赖性磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。
因此AnnexinV被作为检测细胞早期凋亡的灵敏指标之一。
碘化丙啶(PI)是一种核酸染料,它不能透过完整的细胞膜,但对凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核染红。
流式细胞周期结果图解读.docx
流式检测细胞周期操作步骤1. 细胞培养:取对数生长期的细胞,按1×106cells/ mL以1mL接种24孔板或2mL接种于6孔板内,进行所需的处理(比如加入药物),特定时间后终止培养,进行下一步的实验。
2. 细胞固定:800rpm离心5min,收集细胞沉淀,弃上清,用预冷PBS洗涤两次,加入预冷75%乙醇,于4℃固定4h以上。
3. 细胞染色:1500rpm离心5min,弃上清,以3mL的PBS洗涤一次,加入400uL溴化乙锭(PI,50ug/mL),100ul RNase A(100ug/mL ),4℃避光孵育30min。
4. 流式分析:以标准程序用流式细胞仪检测,一般计数2~3万个细胞,结果用细胞周期拟和软件ModFit分析。
注:上机前要以50um尼龙网膜或35um细胞过滤器过滤细胞!因为PI具有很强的粘附性,容易使细胞聚团!流式细胞周期结果图解读1、纵坐标Cell Number:即计数的有效细胞数;2、横坐标DNA Content:即DNA含量;3、G1、G2、S三期在图中已经标示;4、右侧数字含义:Dip G1-53.84% at 55.56,即G1期DNA含量平均值为55.56;53.84%即G1期细胞数占总数的53.84%;Dip G2-5.64% at 107.72,即G2期DNA含量平均值为107.72,5.64%即G2期细胞数占总数的5.64%;以此类推…流式细胞周期结果图的意义,主要从细胞周期的角度看各参数的意义:1、细胞周期指由细胞分裂结束到下一次细胞分裂结束所经历的过程,所需的时间叫细胞周期时间。
1、细胞周期可分为四个阶段:①G1期(gap1),指从有丝分裂完成到期DNA复制之前的间隙时间;②S期(synthesis phase),指DNA复制的时期;③G2期(gap2),指DNA复制完成到有丝分裂开始之前的一段时间;④M期又称D期(mitosis or division),细胞分裂开始到结束。
流式检测细胞周期实验步骤
以标准程序用流式细胞仪检测,一般计数2~3万个细胞,结果用细胞周期拟和软件ModFit分析。
2. 细胞固定:
800rpm离心5min,收集细胞沉淀,弃上清,用预冷PBS洗涤两次,加入预冷75%乙醇,于4℃固定4h以上。
3. 细胞染色:
1500rpm离心5min,弃上清,以3mL的PBS洗涤一次,加入400uL的CCAA溶液(PI染液,engreen),100ul RNase A(100ug/mL ),4℃避光孵育30min。
取对数生长期的细胞按1106cellsml以1ml接种24孔板或2ml接种于6孔板内进行所需的处理比如加入药物特定时间后终止培养进行下一步的实验
流式检测细胞周期实验步骤
1. 细胞培养:
取对数生长期的细胞,按1×106cells/ mL以1mL接种24孔板或2mL接种于6孔板内,进行所需的处理(比如加入药物),特定时间后终止培养,进行下一步的实验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
流式细胞仪检测细胞周期操作步骤
取对数生长期的A549细胞,按1×106 cells/mL以1mL接种于
100mm培养皿内
↓
24h后,进行所需的处理(比如加药,照射)
↓
特定时间后终止培养,进行下一步的实验
↓
收集原培养液,洗后的PBS和消化后的细胞,将三者混匀放入15ml
离心管中
↓
1000rpm离心5min(短时低速离心)
↓
弃上清,用1.5ml预冷PBS,1000rpm离心5min后去除PBS和细胞
悬液内的细胞碎片
↓
加入1.5ml预冷PBS,在涡旋状态下加入3.5ml无水乙醇,混匀后,于4℃固定30min,或-20℃长期保存。
↓
1000r/min,离心5min
↓
将乙醇吸除,加PBS清洗混匀
↓
1000r/min,5min再离心一遍,将残留在细胞上的乙醇除去
↓
吸除离心管内PBS,加入200ul PBS和2ul的RNA酶(0.25mg/ml)(37℃下孵育30min)
↓
加入0.5ml的50ug/ml的PI溶液室温下避光染色30min
↓
将离心管内的细胞过滤(300um尼龙网膜)至含有PBS的EP管中(PI 具有很强的粘附性,容易使细胞聚团),标记EP管
↓
提前一天网上预约
↓
开机(先开仪器后开软件)
↓
流式细胞仪的结构一般分为5部分:①流动室及液流驱动系统;②激光光源及光束成形系统;③光学系统;④信号检测、存贮、显示、分析系统;⑤细胞分选系统。
↓
检测前先涡旋使细胞混匀悬浮呈单个细胞,然后插入流式细胞仪上
↓
流动室内充满鞘液,细胞排成单列由喷嘴中心喷出,形成细胞液柱
↓
液柱与激光束相交,细胞上的荧光染料被激发产生荧光(488nm激
发光源)
↓
荧光信号变成电信号输出到计算机,软件分析(荧光染料和细胞DNA分子特异性结合,可以检测出细胞周期各时相细胞比例)
↓
在用第三方软件分析之前,将流式结果按如下所示导出
结果分析——Modfit软件分析
——Flowjo软件分析
图片拷贝:直接Ctrl+C
FCM-DNA 量分析 1 个细胞增殖群时,可将DNA 含量分布组方图分为三部分,即 G0/1、S、G2M。
G0/1和G2M 细胞峰的 DNA 分布均为
正态分布,S 期可以认为是一个加宽的正态分布
↓
检测结果刻录光盘保存
↓
关机(先关软件后关仪器,关机前需清洗)
正常细胞DNA含量:2n-4n
凋亡细胞:核内DNA断裂,乙醇固定后膜通透性增加,小片段DNA 穿膜丢失,胞内DNA含量减少。
PI染色后,荧光强度减小而形成一个DNA含量小于2n的分布区(亚G1峰)。
1、纵坐标Cell Number:即计数的有效细胞数;
2、横坐标DNA Content:即DNA含量;
3、G1、G2、S三期在图中已经标示;
4、右侧数字含义:Dip G1-53.84% at 55.56,即G1期DNA含量平均值为55.56;53.84%即G1期细胞数占总数的53.84%;Dip G2-5.64% at 107.72,即G2期DNA含量平均值为107.72,5.64%即G2期细胞数占总数的5.64%;
Annexin V-EGFP/PI双染法检测细胞凋亡
基本原理:
磷脂酰丝氨酸(PS)能与连接素Ⅴ(AnnexinⅤ)发生特异结合;PI是核酸荧光染料,不能透过正常细胞膜,只能进入已经破损的细胞膜,在嵌入双链DNA后释放红色荧光,荧光强度与PI结合量呈良好的线性关系。
正常细胞:膜完整,PS不外翻——PI-/AnnexinⅤ-
凋亡早期:膜完整,PS翻转——PI-/AnnexinⅤ+
凋亡晚期:PS外翻,膜通透性增加——PI+/AnnexinⅤ+
坏死细胞:膜严重破损,PS不外翻——PI+/AnnexinⅤ+
几乎不存在膜结构——PI+/AnnexinⅤ-
实验步骤:
取对数生长期的细胞,按1×106 cells/ mL以1mL接种于培养皿内
↓
24h后,进行所需的处理(比如加入药物)
↓
特定时间后终止培养,进行下一步的实验
↓
细胞用0.25%胰酶37℃消化5min(胰酶消化时间不易过长,以防引起假阳性)
↓
加入PBS制成细胞悬液(移液枪吹打6-8次)
↓
倒置显微镜下观察细胞状态(单个分离悬浮)
↓
将细胞悬液移入15ml离心管中
↓
2000rpm离心5min,PBS吸除
↓
用PBS 清洗细胞2次(2000rpm,离心5min收集细胞)
↓
用400ul 1×Binding Buffer 悬浮细胞(浓度大约为1×106
cells/ml)
↓
在细胞悬液中加入5ul Annexin V-EGFP,轻轻混匀后于2-8℃避光
条件下孵育15 min
↓
加入10ul PI 后轻轻混匀,于2-8℃避光条件下孵育5 min
↓
……………………………………………………………最新资料推
荐…………………………………………………
在1 h内用流式细胞仪检测
流式细胞仪激发光波长采用Ex.= 488nm双波长激发,Em.= 510 nm检测EGFP荧光(FL1 channel)和>575 nm的发射波长检测PI。
细胞应可分成三个亚群:活细胞仅有很低的荧光强度,凋亡细胞有较强的绿色荧光,坏死细胞(包括极晚期凋亡细胞)有绿色和红色荧光双重染色。
在流式细胞术双参数散点图上左下象限显示活细胞,为
(Annexin V-/PI-);右上象限是非活细胞,即坏死细胞,
为Annexin V +/PI+;而右下象限为凋亡细胞,显现
Annexin V +/PI-。
