高考化学三轮专题训练:第27题
专题27 化学反应与能量变化(教师版)十年(2013-2022)高考化学真题分项汇编(全国通用)
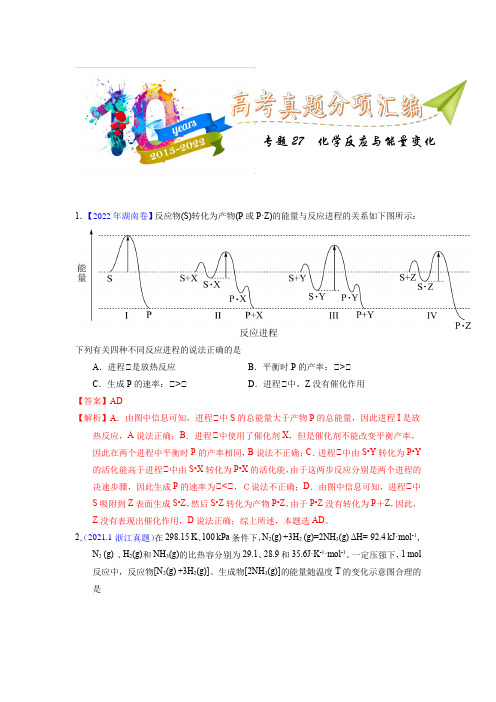
专题27 化学反应与能量变化1.【2022年湖南卷】反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如下图所示:下列有关四种不同反应进程的说法正确的是A.进程Ⅰ是放热反应B.平衡时P的产率:Ⅰ>ⅠC.生成P的速率:Ⅰ>ⅠD.进程Ⅰ中,Z没有催化作用【答案】AD【解析】A.由图中信息可知,进程Ⅰ中S的总能量大于产物P的总能量,因此进程I是放热反应,A说法正确;B.进程Ⅰ中使用了催化剂X,但是催化剂不能改变平衡产率,因此在两个进程中平衡时P的产率相同,B说法不正确;C.进程Ⅰ中由S•Y转化为P•Y 的活化能高于进程Ⅰ中由S•X转化为P•X的活化能,由于这两步反应分别是两个进程的决速步骤,因此生成P的速率为Ⅰ<Ⅰ,C说法不正确;D.由图中信息可知,进程Ⅰ中S吸附到Z表面生成S•Z,然后S•Z转化为产物P•Z,由于P•Z没有转化为P+Z,因此,Z没有表现出催化作用,D说法正确;综上所述,本题选AD。
2.(2021.1·浙江真题)在298.15 K、100 kPa条件下,N2(g) +3H2 (g)=2NH3(g) ΔH=-92.4 kJ·mol-1,N2 (g) 、H2(g)和NH3(g)的比热容分别为29.1、28.9和35.6J·K-1·mol-1。
一定压强下,1 mol 反应中,反应物[N2(g) +3H2(g)]、生成物[2NH3(g)]的能量随温度T的变化示意图合理的是A.B.C.D.【答案】B【解析】该反应为放热反应,反应物的总能量大于生成物的总能量,根据题目中给出的反应物与生成物的比热容可知,升高温度反应物能量升高较快,反应结束后反应放出的热量也会增大,比较4个图像B符合题意,故答案选B。
3.(2018·上海高考真题)H2(g)和I2(g)、H2(g)和I2(s)以及HI(g)的能量高低如图所示,下列判断错误的是()A.1molH2(g)和1molI2(g)的能量总和高于2molHI(g)的能量B.I2(g)→I2(s)+QkJ(Q>0)C.H2(g)+I2(g)→2HI(g)+9.3kJD.H2(g)+I2(s)→2HI(g)+53.0kJ【答案】D【解析】A.由能量高低图分析可知,2molHI(g)→1molH2(g)和1molI2(g)需要吸收9.3kJ的能量,故1molH2(g)和1molI2(g)的能量总和高于2molHI(g)的能量,正确;B.由能量高低图可知,I2(g)→I2(s)放出能量,即I2(g)→I2(s)+QkJ(Q>0),正确;C.根据能量高低图分析可知,H2(g)+I2(g)→2HI(g)放出9.3kJ的能量,故H2(g)+I2(g)→2HI(g)+9.3kJ,正确;D.根据能量高低图分析可知,H2(g)+I2(s)→2HI(g)吸收53.0kJ的能量,故H2(g)+I2(s)→2HI(g)-57.3kJ,错误;答案选D。
高考化学 专题27 有机合成与推断热点题型和提分秘籍(含解析)

专题27 有机合成与推断热点题型和提分秘籍【高频考点解读】有机合成与推断是历年高考的热点,也是重点。
有机物推断主要以框图填空题为主,常对有机物的组成、结构、性质的考查融为一体,具有较强的综合性,并多与新的信息紧密结合。
有机合成主要是利用一些基本原料(如甲烷、乙烯、乙炔、丙烯、丁二烯、苯、甲苯等)并限定合成路线或设计合成路线来合成有机物,并与有机物的结构简式、同分异构体、有机反应类型、有机反应方程式的书写等基础知识的考查相结合。
着力考查阅读有机合成方案、利用题设信息、解决实际问题的能力,也考查了学生对信息接受和处理的敏锐程度、思维的整体性和对有机合成的综合分析能力。
【热点题型】题型一有机合成中的重要桥梁——卤代烃例1、已知:R—CH===CH2+HX―→A、B、C、D、E有如下转化关系:其中A、B分别是化学式为C3H7Cl的两种同分异构体。
根据图中各物质的转化关系,填写下列空白:(1)A、B、C、D、E的结构简式:A________、B________、C________、D________、E________。
(2)完成下列反应的化学方程式:①A―→E_____________________________________________________;②B―→D__________________________________________________;③C―→E____________________________________________。
【答案】【提分秘籍】卤代烃在有机合成中的主要应用(1)在烃分子中引入官能团,如引入羧基、羟基等。
(2)改变官能团在碳链上的位置,由于不对称的烯烃与HX加成时条件不同,会引起卤原子连接的碳原子不同,又有卤代烃在NaOH的水溶液中可发生取代反应生成醇;在NaOH的醇溶液中发生消去反应生成不饱和键,这样可通过:卤代烃a―→消去―→加成―→卤代烃b―→水解,会使卤原子的位置发生改变或引起其他官能团(如—OH)的位置发生改变。
高考化学三轮专题训练:第27题

第27题无机化学综合应用【知识汇总】1.粗读题干,挖掘图图示中一般会呈现超出教材范围的知识,但题目中往往会有提示或者问题中不涉及,所以一定要关注题目的每一个关键字,尽量弄懂流程图,但不必将每一种物质都推出,只需问什么推什么。
如制备类无机化工题,可粗读试题,知道题目制取什么、大致流程和有什么提示等。
2.携带问题,精读信息这里的“信息〞包括三个方面:一是主干,二是流程图,三是设置的问题。
读主干抓住关键字、词;读流程图,常见问题的设置方向如下:反响速率与平衡理论的运用;氧化复原反响的判断、化学方程式或离子方程式的书写;利用控制pH别离除杂;化学反响中的能量变化;实验根本操作:除杂、别离、检验、洗涤、枯燥等;流程中的物质转化和循环,资源的回收和利用;环境保护与绿色化学评价。
3.跳跃思维,标准答题答题时应注意前后问题往往没有“相关性〞,即前一问未答出,不会影响后面答题。
对反响条件的分析可以从以下几个方面着手:对反响速率有何影响,对平衡转化率有何影响,对综合生产效益有何影响(原料是否价廉易得,是否可再生,能源消耗的多少,设备能否满足生产条件的要求,对环境的影响如何)。
(1)要求用化学理论答复的问题一般采用“四段论法〞:此题“改变了什么条件〞(或“是什么条件〞)―→根据什么理论―→所以有什么变化―→结论。
[答案及评分标准](1)MgBO ·H O +2HSO △,2H 3BO +2MgSO(2分) 提高反响温度、减小2 2 522434铁硼矿粉粒径(2分)(2)FeO(1分)SiO 和CaSO(2分)3 424(3)将Fe 2+氧化成Fe 3+(1分) 使Fe 3+与Al 3+形成氢氧化物沉淀而除去 (1分)(4)(七水)硫酸镁(1 分)(5)Na+(2分)△(6)2H 3BO 3=====B 2O 3+3H 2O 、B 2O 3+3Mg △,2B +3MgO(2分)[阅卷人的忠告](1) 元素符号错、不标准、看不清的不得分,方程式不写“△〞扣分。
高考化学复习27题

一页纸教育-------从这里走出去、改变世界。
一页纸教育个性化辅导授课教案教师:阮淑帅学生: 时间:2013 年月日—段课题:高考化学27题针对训练教学目标:教学重难点:教学内容:1.(15分)氢气是一种清洁能源,氢气的制取与利用是氢能源领域的研究热点。
已知:CH4(g)+H2O(g)====CO(g)+3H2(g)△H=206.2 kJ •mol—1CH4(g)+ CO2(g)====2CO(g)+2H2(g)△H=247.4 kJ •mol—1(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为____ __。
(2)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图27-1所示。
图中A、B表示的物质依次是_______。
(3)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图27-2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。
电解时,阳极的电极反应式为_____ __。
(4)上述方法制得的H2可以和CO在一定条件下合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。
当两者以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是。
a.汽油b.甲醇c.甲醛d.乙酸(5)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)若一体积可变的密闭容器中充入3 molH2、3 molCO、1mol CH3OCH3、1molCO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
则反应开始时正、逆反应速率的大小:v(正)v(逆)(填“>”、“<”或“=”),理由是,平衡时n(CH3OCH3)= mol。
2.(14分)第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。
汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
2024年高考化学一轮复习练习第27讲酸碱中和滴定

课时作业27酸碱中和滴定一、选择题(每小题只有1个选项符合题意)1.用0.010 0 mol·L-1的KMnO4标准溶液滴定某未知浓度的H2C2O4溶液,下列说法错误的是()A.用酸式滴定管量取标准KMnO4溶液,该滴定实验不需要指示剂B.该实验用到的玻璃仪器有酸式滴定管、碱式滴定管、锥形瓶C.滴定管使用前需检验是否漏液D.若滴定终止时,俯视读数,所测H2C2O4浓度偏低2.有甲、乙、丙三瓶等体积、等物质的量浓度的NaOH溶液,若甲不变,将乙蒸发掉一半水(溶质不析出),丙中通入一定量的CO2。
然后以甲基橙作指示剂,用相同浓度的盐酸滴定,分别达到终点消耗盐酸的体积是()A.V甲=V乙>V丙B.V丙>V乙>V甲C.V乙>V丙>V甲D.V甲=V乙=V丙3.准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1 NaOH溶液滴定。
下列说法正确的是()A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定B.随着NaOH溶液的滴入,锥形瓶中溶液pH由小变大C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小4.用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0 mol·L-1盐酸过程中的pH变化如图所示。
下列说法错误的是()A.b点时,加入极少量NaOH溶液都会引起pH的突变B.选指示剂时,其变色范围应在4.30~9.70之间C.若将盐酸换成同浓度的CH3COOH溶液,曲线ab段将会上移D.都使用酚酞作指示剂,若将NaOH溶液换成同浓度的氨水,所消耗氨水的体积较NaOH溶液小5.硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是常用的分析试剂。
实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体。
高考化学27题练习

27题练习1.(2014•丽水二模)神舟十号飞船是中国“神舟”号系列飞船之一,它是中国第五艘搭载太空人的飞船.神舟十号飞船发射成功后,将与2011年发射升空的天宫一号目标飞行器进行交会对接,开展相关空间科学试验.火箭推进器是成功发射的重要因素,事实上,推进器的发展经历了一个漫长的过程.(1)20世纪前,黑火药是世界上唯一的火箭推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为:S+2KNO3+3C═K2S+N2↑+3CO2.(I)K2S的电子式为,C02的结构式为.②已知S和氯水反应会生成两种强酸,其离子方程式为③取黑火药爆炸后的残留固体,加水溶解过滤,得到滤液.写出检验此溶液中是否含有K+的实验操作方法.(2)20世纪60年代,火箭使用的是液体推进剂,常用的氧化剂有四氧化二氮、液氧等,可燃物有麟(N2H4)、液氢等.①肼(N2H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:②一种与N2H4电子数相等的绿色氧化剂,能将油画表面黑色的PbS氧化成白色的PbSO4,使油画变白、翻新,化学方程式为:.(3)以上的火箭推进剂一般含有氮元素,含氮化合物种类丰富.有一含氮化合物,具有很强的爆炸性,86g该化合物爆炸分解会生成标况下N2 67.2L 和另一种气体单质H2.写出其爆炸的化学方程式.2.(18分)I.有X、Y、Z、R四种短周期元素,Y、Z、R同周期。
相关信息如下:反应为黄色(1)Z元素在周期表的位置是▲ ,Y、Z、R简单离子的半径从大到小的顺序是▲ (用离子符号表示);(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。
甲遇水蒸气可形成一种常见的漂白性物质。
则甲的结构式为;(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色。
高考化学 考前三月冲刺 高考13题 第27题 题组二 以化

题组二 以化工流程为载体的综合题 典例剖析(12分)工业上由黄铜矿(主要成分为CuFeS 2)冶炼铜的主要流程如下:(1)气体A 中的大气污染物可选用下列试剂中的________吸收。
a.浓硫酸b.稀硝酸c.NaOH 溶液d.氨水(2)用稀硫酸浸泡熔渣B ,取少量所得溶液,滴加KSCN 溶液后呈血红色,说明溶液中存在________(填离子符号),检验溶液中还存在Fe 2+的方法是________________________(注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学方程式为________________________。
(4)以CuSO 4溶液为电解质溶液进行粗铜(含Al 、Zn 、Ag 、Pt 、Au 等杂质)的电解精炼,下列说法正确的是________。
a.电能全部转化为化学能b.粗铜接电源正极,发生氧化反应c.溶液中Cu 2+向阳极移动d.利用阳极泥可回收Ag 、Pt 、Au 等金属(5)利用反应2Cu +O 2+2H 2SO 4===2CuSO 4+2H 2O 可制备CuSO 4,若将该反应设计为原电池,其正极电极反应为____________________________。
[答案及评分标准] (1)cd(2分) (2)Fe 3+(2分) 取少量溶液,滴加酸性KMnO 4溶液(1分),酸性KMnO 4溶液褪色(1分) (3)3Cu 2O +2Al=====高温Al 2O 3+6Cu(2分)(4)bd(2分) (5)4H ++O 2+4e -===2H 2O(2分)[阅卷人的忠告] (1)必须小写,大写不得分;对而不全得1分,错选得0分。
(2)①滴加“酸性KMnO 4溶液”或“酸性高锰酸钾溶液”或“MnO -4溶液”均对得1分,“KMnO 4”化学式有错不得分;现象答“KMnO 4褪色”或“紫色褪去”或“紫红色褪去”或“红色褪去”得1分;若现象答“溶液变为红色”不得分;注“不变紫色、变色”都不给分,“不呈紫色、无紫色、不显紫色、褪色、褪去”都得分。
2023全国乙卷化学27题

2023全国乙卷化学27题摘要:一、引言二、全国乙卷化学27 题背景及题目要求三、解题思路分析1.理解题目2.分析问题3.制定解题策略四、解题过程详解1.步骤一2.步骤二3.步骤三五、答案与解析六、总结正文:一、引言全国乙卷化学27 题是2023 年全国高考化学试卷中的一道重要题目,主要考察学生对化学知识的综合运用能力和解决问题的能力。
本文将对该题进行详细解析,帮助大家理解题目要求和解题思路。
二、全国乙卷化学27 题背景及题目要求全国乙卷化学27 题以某种化学反应为背景,要求学生根据反应方程式和实验数据,计算出反应物的摩尔质量和反应热等参数。
题目要求学生在理解化学反应原理的基础上,熟练运用化学计算方法,解决实际问题。
三、解题思路分析1.理解题目首先,学生需要认真阅读题目,理解题目所给出的化学反应方程式和实验数据,明确题目要求计算的目标参数。
2.分析问题其次,学生需要分析题目所给出的信息,找出与目标参数相关的数据,并确定计算过程中所需的已知条件。
3.制定解题策略针对题目要求,学生需要制定合适的解题策略,明确计算步骤和方法,确保解题过程的准确性。
四、解题过程详解1.步骤一根据题目所给反应方程式,计算出反应物的摩尔质量。
这一步需要运用化学计算方法,如摩尔质量的计算公式等。
2.步骤二根据实验数据,计算出反应热。
这一步需要运用热力学原理,如燃烧热、中和热等概念,进行相关计算。
3.步骤三根据计算结果,得出反应物的摩尔质量和反应热。
五、答案与解析根据计算结果,给出反应物的摩尔质量和反应热。
并对解题过程中涉及到的化学原理和计算方法进行解析,帮助学生更好地理解题目。
六、总结全国乙卷化学27 题主要考察学生对化学知识的综合运用能力和解决问题的能力。
解题过程中,学生需要认真阅读题目,理解题目要求,分析问题,制定解题策略,并熟练运用化学计算方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第27题无机化学综合应用【知识汇总】1.粗读题干,挖掘图图示中一般会呈现超出教材范围的知识,但题目中往往会有提示或者问题中不涉及,所以一定要关注题目的每一个关键字,尽量弄懂流程图,但不必将每一种物质都推出,只需问什么推什么。
如制备类无机化工题,可粗读试题,知道题目制取什么、大致流程和有什么提示等。
2.携带问题,精读信息这里的“信息”包括三个方面:一是主干,二是流程图,三是设置的问题。
读主干抓住关键字、词;读流程图,常见问题的设置方向如下:(1)反应速率与平衡理论的运用;(2)氧化还原反应的判断、化学方程式或离子方程式的书写;(3)利用控制pH分离除杂;(4)化学反应中的能量变化;(5)实验基本操作:除杂、分离、检验、洗涤、干燥等;(6)流程中的物质转化和循环,资源的回收和利用;(7)环境保护与绿色化学评价。
3.跳跃思维,规范答题答题时应注意前后问题往往没有“相关性”,即前一问未答出,不会影响后面答题。
(1)对反应条件的分析可以从以下几个方面着手:对反应速率有何影响,对平衡转化率有何影响,对综合生产效益有何影响(原料是否价廉易得,是否可再生,能源消耗的多少,设备能否满足生产条件的要求,对环境的影响如何)。
(2)要求用化学理论回答的问题一般采用“四段论法”:本题“改变了什么条件”(或“是什么条件”)―→根据什么理论―→所以有什么变化―→结论。
[答案及评分标准] (1)Mg 2B 2O 5·H 2O +2H 2SO 4△,2H 3BO 3+2MgSO 4(2分) 提高反应温度、减小铁硼矿粉粒径(2分)(2)Fe 3O 4(1分) SiO 2和CaSO 4(2分)(3)将Fe 2+氧化成Fe 3+(1分) 使Fe 3+与Al 3+形成氢氧化物沉淀而除去(1分) (4)(七水)硫酸镁(1分)(5)Na + (2分)(6)2H 3BO 3=====△B 2O 3+3H 2O 、B 2O 3+3Mg△,2B+3MgO(2分)[阅卷人的忠告] (1)元素符号错、不规范、看不清的不得分,方程式不写“△”扣分。
(2)SiO 2和CaSO 4少写,或错写其他杂质均不得分。
(3)名称写成化学式不得分。
(4)电子式漏掉离子符号或不写“[ ]”均不得分。
【基础练习】1.工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:请回答下列问题:(1)CeCO3F中,Ce元素的化合价为________。
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。
写出稀硫酸、H2O2与CeO2反应的离子方程式:______________________________________________________。
(3)向Ce(BF4)3中加入KCl溶液的目的是___________________________________________________________________________________________________________。
(4)溶液中的c(Ce3+)等于1×10-5mol·L-1可认为Ce3+沉淀完全,此时溶液的pH为________。
(已知K sp[Ce(OH)3]=×10-20)(5)加热CeCl3·6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是:________________________________________________________________________。
(6)准确称取 0 g CeCl3样品置于锥形瓶中,加入适量过硫酸铵溶液将Ce3+氧化为Ce4+,然后用0 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗 mL标准溶液。
(已知:Fe2++Ce4+===Ce3++Fe3+)①该样品中CeCl3的质量分数为________(保留两位小数)。
②若使用久置(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质量分数________(填“偏大”、“偏小”或“无影响”)。
答案(1)+3(2)H2O2+2CeO2+6H+===2Ce3++4H2O+O2↑(3)避免三价铈以Ce(BF4)3沉淀的形式损失或除去BF-4或提高CeCl3的产率(4)9 【提示:c(OH-)=3Ksp[Ce OH3]c Ce3+】(5)NH4Cl固体受热分解产生HCl,抑制CeCl3水解(6)①%②偏大解析(1)根据化合价的代数和等于零计算,C为+4价、O为-2价、F为-1价。
(5)从Ce(OH)3的溶度积可知CeCl3易水解,氯化铵分解产生的HCl可抑制CeCl3的水解。
(6)①由反应信息可得关系式:CeCl3~(NH4)2Fe(SO4)2,再根据硫酸亚铁铵的物质的量和关系式即可计算n(CeCl3)。
②久置的(NH4)2Fe(SO4)2中Fe2+已部分被氧化,必然消耗(NH4)2Fe(SO4)2的量增多,因而测定结果偏大。
2.磷及其化合物在生产、生活中有重要的用途。
回答下列问题:(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式:_______________________________。
②n越大,直链聚磷酸铵的水溶性越________(填“大”或“小”)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
H2PO-2+Ag++________===PO3-4+Ag+________(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44 ℃,沸点280 ℃),主要生产流程如下:①除砷过程在75 ℃时进行,其合理的原因是________(填字母)。
a.使白磷熔化,提高反应活性 b.降低白磷的毒性c.温度不宜过高,防止硝酸分解 d.适当提高温度,增大反应速率②生产过程在高纯氮气保护下进行,其目的是____________________________________________________________________________________________________。
③硝酸氧化除砷时被还原为NO,写出砷转化为砷酸的化学方程式:________________________________________________________________________。
氧化相同质量的砷,当转化为亚砷酸的量越多时,消耗硝酸的量越________(填“多”或“少”)。
④某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图所示,砷的脱除率从a点到b点降低的原因是_____________________________________________________________________________________。
答案(1)①H3PO4H++H2PO-4②小 (2)1 4 6OH- 1 4 4H2O (3)①acd ②防止白磷被空气中氧气氧化③3As+5HNO3+2H2O===3H3AsO4+5NO↑少④硝酸浓度变大,氧化性增强,有较多的硝酸用于氧化白磷,脱砷率降低3.过二硫酸(结构如图)是一种白色晶体,其酸及盐均为强氧化剂。
(1)(NH 4)2S 2O 8在水溶液中的电离方程式为_____________________________________ ________________________________________________________________________。
(2)在Ag +及加热的条件下,S 2O 2-8可将溶液中的Mn 2+氧化为MnO -4,该反应的离子方程式为________________________________________________________________________ ________________________________________________________________________, 观察到的现象是_______________________________________________________。
(3)由氯碘酸(ClSO 3H)与过氧化氢作用可得固态的过二硫酸,该反应的化学方程式为________________________________________________________________________。
(4)工业上制备过二硫酸溶液的流程之一如下:电解时阳极的电极反应式为____________________________________________________, 阳极材料能否用铜丝代替铂丝?________(填“能”或“不能”),说明理由:________________________________________________________________________。
答案 (1)(NH 4)2S 2O 8===2NH +4+S 2O 2-8(2)2Mn 2++5S 2O 2-8+8H 2O=====Ag +△2MnO -4+10SO 2-4+16H + 溶液颜色变为紫色 (3)2ClSO 3H +H 2O 2===H 2S 2O 8↓+2HCl↑(4)2SO 2-4-2e -===S 2O 2-8 不能 铜是活性电极,铜作阳极时本身会失去电子解析 (2)由过二硫酸结构可知,分子中S 元素处于最高价+6价,其中的-1价O 具有强氧化性,则离子方程式:5S 2O 2-8+2Mn 2++8H 2O=====Ag +△2MnO -4+10SO 2-4+16H +,由于生成MnO -4,溶液会变为紫色。
(4)电解产物中的H 2一定在阴极生成,则阳极产物为S 2O 2-8,电极反应式为2SO 2-4-2e -===S 2O 2-8,阳极用铜时,铜失电子,不能生成S 2O 2-8。
4.Na 2S 、H 2O 2在从含镍电镀废渣(除含镍外,还含有Cu 、Zn 、Fe 、Cr 等杂质)中提取含镍化合物时有重要作用。
提取过程如下:①电镀废渣先用过量酸进行酸化处理,得到溶液;②向溶液中滴入适量的Na 2S 溶液,除去Cu 2+、Zn 2+,过滤;③保持滤液在40 ℃左右,用6%的H 2O 2溶液氧化Fe 2+,再在95 ℃时加入NaOH 溶液调节pH ,过滤除去铁和铬;④在滤液中加入足量Na 2CO 3溶液,搅拌,得NiCO 3沉淀;⑤……(1)步骤②中除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:__________ ____。
