甲烷燃烧热量
燃料燃烧释放的热量2

3、常见的燃料 煤、石油、天然气-----化石燃料 4、如何提高燃料的使用效率
A、防止环境污染、发展洁净煤技术 B、提高热效率 C、开发高能清洁能源 D、开发综合利用煤的新技术
二、燃烧中的热量变化
1、燃烧中的能量变化
化学反应
根据能量变化情况
放热反应
吸热反应
2、燃烧中能量变化的实质
反应物
键断裂 键形成
燃料燃烧释放的热量
写出下列各热化学方程式
1、常温下14g一氧化碳在足量氧气中充分燃烧, 放出141.3kJ热量。
CO O2 (g)===CO2 (g) ; △ H =- 282.6kJ/mol
2、1g硫粉在氧气中完全燃烧并放出9.36kJ热量。
(g)+ 1 2
点燃
S(s) + O2 (g)===SO2 (g); △ H=-299.5kJ/mol
解:根据题意:甲烷燃烧的热化学方程式为:
CH4(g)+2O2(g)===CO2(g)+2H2O(l); △ H=-890kJ/mol
即甲烷的燃烧热为890kJ/mol 10000L甲烷的物质的量为: nCH4=(10000L)/(22.4L/mol)=446mol 446mol×890kJ/mol=3.97×105kJ 答:
点燃
3、1g甲烷在氧气中完全燃烧生成液态水和二 氧化碳并放出55.6kJ热量。
CH4(g)+2O2(g)==2H2O(l)+CO2(g); △H=-889.6kJ/mol
点燃
一、燃料的燃烧
1、燃烧:可燃物与氧气发生的发光、 发热的
剧烈的化学反应。
实例:煤、石油、天然气的燃烧。
2、燃烧的条件 A、与氧气接触 B、达到着火点
LNG特性及危险性分析_段玉龙

液化天然气 (LNG) 是一种低温液体,主要由 甲烷组成,且含有少量其他轻质烃类,例如:乙 烷,丙烷,丁烷等。天然气遍布世界各地,人类早 已对其进行开采并通过管道运送给用户和工厂。许 多大型管道都是从离岸井沿着海底或穿过大陆进行
燃气供应的。但有些大型天然气产地距离消费者较 远,管道运输不经济,因此 LNG 海上运输便成为了 一种比较经济的运输方式,从而拓展了天然气的贸 易网络。
甲烷 16.043 111.67 (-161.5) 422.5 1.810 0.6685
特立尼达岛 16.55 112.1
(-161.05) 430.9 1.799 0.6894
尼日利亚 17.91 112.7
(-160.4) 452.8 1.776 0.7459
阿曼 18.615 113.3 (-159.9) 463.6 1.763 0.7751
喷射火也是自身高危险性的。若泄露孔径较 大,其后果较严重,将导致人员死亡,设备损坏。 其热辐射也是高危险性的。 2.2 户外蒸气云爆炸
意外释放的 LNG 可能导致下列危险: (1) 闪火,池火或喷射火导致的辐射烧伤和结 构弱化; (2) 半封闭蒸气云爆炸导致的超压和脉冲; (3) 封闭蒸气云爆炸导致的超压和脉冲; (4) 快速相变 (RPT) 爆炸导致 LNG 迅速扩 散,蒸发或超压; (5) 窒息; (6) 冻伤; (7) 翻滚。 按时间顺序事故从泄漏开始形成液池,经蒸发 形成蒸气云团,随后蒸气云扩散发生闪火,最后变 为池火。 2.1 闪火,池火,或喷射火 溢流的 LNG 引发的主要危险为火灾。因此对 LNG 的最大危险性主要集中在池火方面。喷射火仅 发生在处理装置压力释放时,因此其对公众的威胁 性较小。 陆上或海上溢流的 LNG 形成的液池将迅速蒸 发,并在其下风处形成蒸气云。如果蒸气云中的任 何一点达到可燃浓度并被点燃时,将发生闪火,并 顺风燃烧,也有可能逆风燃烧。闪火将沿预混合边
1立方天然气热值

1立方天然气热值
1立方天然气热值是指一方天然气在完全燃烧时释放出的热量。
天
然气主要由甲烷(CH4)、乙烷(C2H6)、丙烷(C3H8)等多种化合物
组成,有时还会含有少量的二氧化碳(CO2)、浓度低的水蒸气(H2O)或其他有机化合物。
1立方天然气的热值根据其组成组分及比例而不同,一般可以在35-45MJ/m³之间。
甲烷(CH4)是天然气中最重要的组分,大约占95%以上,它的热
值为37.6MJ/m³、千卡/立方米(KCal/m³)或美国热单位
(BTU/SCF),而乙烷(C2H6)的热值相对较低,为25~26MJ/m³,是
甲烷的约三分之一左右。
此外,除了甲烷和乙烷两种常见的组成组分
之外,有时天然气还含有少量的丙烷(C3H8)、环烷烃(C4H10)以及
二氧化碳(CO2)等,这些组成组分也都有自身的热值,如丙烷的热值
为42.3MJ/m³,环烷烃的热值为45MJ/m³,而二氧化碳的热值则要较高,为50 MJ/m³。
因此,1立方天然气的热值就取决于其组成组分的比例,当其由纯
甲烷构成时,其热值可以达到35 - 45 MJ/m³,而当其中含有少量的
其它组成组分时,其热值也会随之变化,一般来说,如果这些组成组
分的比例较高,那么1立方天然气的热值也会超过45MJ/m³,如果比
例较低,则其热值可能低于35MJ/m³。
FTA原理VSFID原理在可燃气LEL监测领域的应用
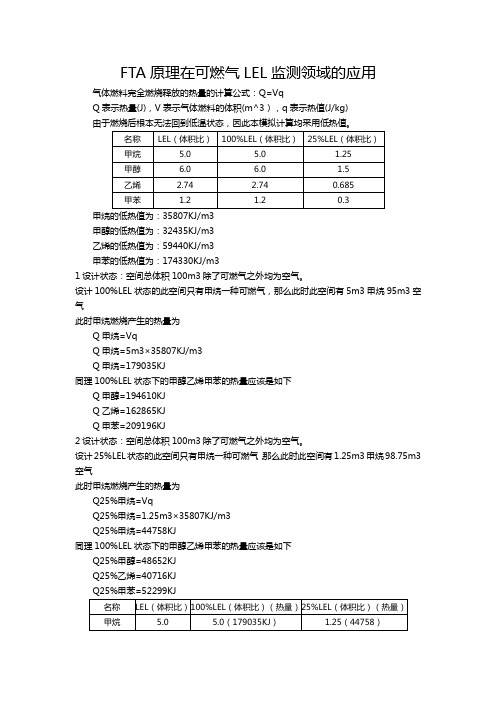
FTA原理在可燃气LEL监测领域的应用气体燃料完全燃烧释放的热量的计算公式:Q=VqQ表示热量(J),V表示气体燃料的体积(m^3),q表示热值(J/kg)甲醇的低热值为:32435KJ/m3乙烯的低热值为:59440KJ/m3甲苯的低热值为:174330KJ/m31设计状态:空间总体积100m3除了可燃气之外均为空气。
设计100%LEL状态的此空间只有甲烷一种可燃气,那么此时此空间有5m3甲烷95m3空气此时甲烷燃烧产生的热量为Q甲烷=VqQ甲烷=5m3×35807KJ/m3Q甲烷=179035KJ同理100%LEL状态下的甲醇乙烯甲苯的热量应该是如下Q甲醇=194610KJQ乙烯=162865KJQ甲苯=209196KJ2设计状态:空间总体积100m3除了可燃气之外均为空气。
设计25%LEL状态的此空间只有甲烷一种可燃气,那么此时此空间有1.25m3甲烷98.75m3空气此时甲烷燃烧产生的热量为Q25%甲烷=VqQ25%甲烷=1.25m3×35807KJ/m3Q25%甲烷=44758KJ同理100%LEL状态下的甲醇乙烯甲苯的热量应该是如下Q25%甲醇=48652KJQ25%乙烯=40716KJQ25%甲苯=52299KJFTA使用乙烯作为标气,氢气的热值作为基准点即FTA输出0%LEL值的时候检测器热值为H2热值140000KJFTA输出100%LEL值的时候检测器热值为H2热值加100%LEL乙烯热值140000KJ+162865KJ=302865KJ扣除氢气的热值(作为零点基准点)背景即FTA输出0%LEL值的时候检测器热值为无热值0KJFTA输出100%LEL值的时候检测器热值为100%LEL乙烯热值162865KJ乙烯作为标气在FTA检测器中LEL值对应热值可以得出如下的线性关系X坐标为0-100%LELY坐标为0-162865KJ热量(检测器中其他影响因素均是相同的,因此可以作为背景全部扣除)上图可知若以乙烯100%LEL浓度时释放的热量162865KJ作为100%LEL那么甲烷在热量达到162865KJ(100%LEL)时的实际浓度则为90%LEL左右同理甲醇在热量达到162865KJ(100%LEL)时的实际浓度则为82%LEL左右同理甲苯在热量达到162865KJ(100%LEL)时的实际浓度则为78%LEL左右举例其它气体对比乙烯标定的FTA空间总体积100m3除了可燃气之外均为空气。
化学化学反应的能量变化计算

化学化学反应的能量变化计算化学反应的能量变化计算在化学反应中,粒子之间的相互作用导致能量的变化,这种变化可以通过热力学来描述和计算。
化学反应的能量变化通常以焓变(ΔH)的形式表示,它表示在恒定压力下,反应物与生成物之间的能量差异。
化学反应的能量变化计算是一项重要的研究内容,它能够帮助我们理解反应的热学性质,并为实验设计和工业生产提供指导。
本文将介绍几种常见的能量变化计算方法。
一、燃烧反应的能量变化计算燃烧反应是一种常见的化学反应,它的能量变化可以通过燃烧热的计算来确定。
燃烧热表示在单位摩尔反应物完全燃烧时释放或吸收的能量。
以甲烷燃烧为例,其反应方程式为:CH4 + 2O2 -> CO2 + 2H2O燃烧热可以通过实验测定得到,例如通过燃烧热量计。
假设在该实验中甲烷燃烧产生的热量为Q(单位为J),而摩尔数为n(单位为mol),则燃烧热ΔH可以计算为:ΔH = Q / n二、反应热的测定除了燃烧反应,其他化学反应的能量变化也可以通过反应热的测定来计算。
反应热定义为在一定压力和温度下,反应过程中吸收或释放的能量。
常见的反应热测定方法包括热量计、燃烧弹量热计和恒压流动热量计等。
这些实验装置能够测定反应过程中的温度变化,并进而计算出反应热。
通过实验测定得到的反应热常用符号ΔH表示,它表示物质在反应过程中的能量变化。
ΔH的单位为焦耳/摩尔(J/mol)。
三、化学键能的估算除了实验测定,化学键能的估算也是一种常见的能量变化计算方法。
化学键能是指在平衡态下,解离一个摩尔的共价键需要吸收的能量。
不同化学键的能量不同,常见的键能估算方法有伯恩斯坦法、波特-雷德法和聚合度法等。
这些方法通过基于一定的假设和经验规律,计算得到化学键的能量,并进而推算出反应的能量变化。
需要注意的是,化学键能的估算方法存在一定的误差,因此在实际应用中需要谨慎使用,并结合其他实验数据进行验证。
结论化学反应的能量变化计算是化学热力学研究的重要内容,它能够帮助我们理解反应过程中的能量变化规律,并为实验设计和工业生产提供参考。
燃烧焓的测定实验报告

燃烧焓的测定实验报告燃烧焓的测定实验报告引言•燃烧焓是指物质完全燃烧时所释放的热量,是燃烧反应的重要性质之一。
•本实验旨在通过测量燃烧反应的温度变化,并结合相关计算,确定甲烷的燃烧焓。
实验方法1.预先称取一定质量的甲烷气体,并充分混合气体。
2.将混合气体注入燃烧装置燃烧室中,并点燃。
3.同时记录开始时和结束时的温度,并用温度计定期测量燃烧室内的温度。
4.待燃烧完全结束后,关闭火源。
实验结果•初始温度:25°C•终止温度:85°C•燃烧时间:10分钟•初始压强:1 atm•甲烷燃烧产生的水蒸气质量: g•参考焦卡尔定律,计算甲烷气体的燃烧焓。
数据处理根据理想气体状态方程:PV=nRT 1. 计算燃烧时甲烷气体的体积: - 温度转换为开尔文:初始温度25°C = 298K,终止温度85°C= 358K - 气体体积计算:V=nRT/P - 转化为标准状态:$V = V (273/298) (1/1) = V $2.计算甲烷的摩尔数:–初始摩尔数:n1=P1V1/RT1–终止摩尔数:n2=P2V2/RT2–平均摩尔数:n=(n1+n2)/23.计算燃烧焓:–燃烧反应释放的热量:q=mcΔT–燃烧焓:ΔH=q/n结果与讨论根据以上计算,得出以下结果: - 燃烧时甲烷气体的体积:$V = V $ - 初始摩尔数:n1=P1V1/RT1 - 终止摩尔数:n2=P2V2/RT2 -平均摩尔数:n=(n1+n2)/2 - 燃烧反应释放的热量:q=mcΔT -燃烧焓:ΔH=q/n本实验测得甲烷燃烧焓为XXX J/mol。
实验中可能存在一些误差,如测量温度的不准确、燃烧不完全等。
为提高测量的准确性,可采取多次重复实验并取平均值。
结论通过实验测定并计算,本实验得出了甲烷的燃烧焓为XXX J/mol。
这一结果对于进一步研究相关燃烧反应的热力学性质具有重要意义。
通过改进实验方法和减小误差,可以进一步提高实验结果的准确性。
化学反应的燃烧热计算方法

化学反应的燃烧热计算方法燃烧热是指在恒定压力下,物质燃烧时释放或吸收的热量。
它是研究化学反应热力学性质的重要参数之一。
准确计算化学反应的燃烧热,对于理解化学反应的能量变化以及工业生产和环境保护方面具有重要意义。
1. 燃烧热的定义与表达式燃烧热的定义是指在常压条件下,单位物质的完全燃烧所释放的热量。
在反应中,反应物A经过化学反应变成产物B,反应热ΔH与反应物和产物的焓变相关。
表达式如下:ΔH = H(反应物) - H(产物)2. 根据化学方程式计算燃烧热计算燃烧热的常用方法是通过化学方程式。
以燃烧反应为例,假设甲烷完全燃烧生成二氧化碳和水的反应方程式为:CH4 + 2O2 → CO2 + 2H2O根据燃烧反应方程式,可以得到:ΔH = H(“二氧化碳和水”) - H(“甲烷和氧气”)其中,H(“二氧化碳和水”)表示二氧化碳和水的混合物的焓值,H(“甲烷和氧气”)表示甲烷和氧气的混合物的焓值。
3. 反应物和产物的焓变计算对于计算燃烧热,需要了解反应物和产物的焓变。
焓变是指在恒定压力下,物质在化学反应中吸收或释放的能量。
常见的焓变计算方法有以下几种:(1) 标准生成焓变法:通过测定反应物和产物所需的摩尔生成焓变,计算燃烧热。
这种方法适用于已经测定了物质生成焓变的情况。
(2) 基流体焓法:将物质的生成焓变视为其组成元素的焓变相加。
这种方法在一些无法直接测定生成焓变的物质中有较广泛的应用。
(3) 存在焓法:通过测定物质在不同物态下的焓变,计算燃烧热。
这种方法适用于无法在标准生成焓变法或基流体焓法中得到准确结果的物质。
4. 实例应用以甲烷的燃烧为例,通过标准生成焓变法计算燃烧热。
甲烷完全燃烧生成二氧化碳和水,反应方程式如下:CH4 + 2O2 → CO2 + 2H2O根据已知数据,甲烷的生成焓变为ΔHf(CH4) = -74.86 kJ/mol,二氧化碳的生成焓变为ΔHf(CO2) = -393.5 kJ/mol,水的生成焓变为ΔHf(H2O) = -285.8 kJ/mol。
甲烷是易燃易爆炸气体吗

甲烷是易燃易爆炸气体吗甲烷是一种无色无味的气体,是天然气的主要成分之一。
很多人会认为甲烷是易燃易爆炸的气体,但这种说法是否正确呢?本文将从多个方面来解答这个问题。
甲烷的燃烧和爆炸特性首先,我们来看一下甲烷的燃烧和爆炸特性。
甲烷是一种非常容易燃烧的气体,只需要接触到或者靠近火源就能够燃烧,因此甲烷经常用作燃料。
当甲烷和氧气混合在一定比例下,就能够发生燃烧。
甲烷燃烧的化学方程式是:CH4 + 2O2 -> CO2 + 2H2O在燃烧过程中,甲烷所释放的热量非常大,可以产生高温、高压的燃烧气体。
如果燃烧空间不足或者燃烧过程中受到限制,就可能产生爆炸。
爆炸是指在短时间内产生大量的热、光、声等现象,爆炸产生的动力能量非常巨大,容易引起周围物体的损坏甚至爆炸。
甲烷的易燃性和易爆性接下来,我们来看一下甲烷的易燃性和易爆性。
这里要注意,易燃和易爆并不完全相同。
易燃性是指要点火有一定的困难,但是一旦点燃就容易燃烧起来。
易爆性则是指一旦遇到适当的火源或者能量,就能够产生爆炸。
甲烷的易燃性很高,只需要一定的助燃条件就能够燃烧起来,但并不是所有的甲烷都具有明显的易爆性。
甲烷只有在特定的条件下才会对外界产生明显的爆炸危险,这取决于多种因素,如氧气浓度、甲烷浓度、温度、压力等。
甲烷的安全性虽然甲烷是一种易燃易爆炸的气体,但是在特定的条件下,它也是非常安全的。
例如,在天然气管道中,甲烷以高压形式存在,但是经过严格的管道检测和数据监测,管道本身的安全性很高。
此外,在生产或者实验室中,甲烷也可以是相对安全的。
只要对甲烷的存储、使用、处置等环节严格进行管理,控制甲烷的浓度和扩散范围,降低其潜在的危险,就可以保障工作环境的安全性。
结论综上所述,甲烷确实是一种易燃易爆炸的气体,但并不是所有的甲烷都具有明显的易爆性,而且在特定条件下也可以是相对安全的。
因此,在使用甲烷的过程中,要严格按照相关规定进行操作和管理,以确保工作环境的安全性和稳定性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲烷燃烧热量
1. 介绍
甲烷是一种无色、无臭的天然气,由碳和氢元素构成。
它是化学式为CH4的最简单的烷烃化合物。
作为一种重要的能源来源,甲烷广泛应用于家庭、工业和交通领域。
在甲烷与氧气发生完全反应的过程中,会释放出大量的能量,这就是所谓的甲烷燃烧。
本文将深入探讨甲烷燃烧过程中产生的能量释放,包括其原理、计算方法以及应用领域。
2. 原理
甲烷与氧气发生反应时会产生水和二氧化碳,并释放出大量的能量。
这个反应可以用以下方程式表示:
CH4 + 2O2 → CO2 + 2H2O + 燃料释放出的能量
该方程式表明,每一个分子的甲烷与两个分子的氧气反应,生成一个分子的二氧化碳和两个分子的水,并且伴随着能量释放。
这种能量释放是因为在反应过程中C-H键和O-O键的断裂和形成。
甲烷中的C-H键是一种高能键,而氧气中的O-O键也是一种高能键。
当这些键断裂并重新组合成
CO2和H2O时,会释放出大量的能量。
3. 燃烧热量计算
为了计算甲烷燃烧的热量,我们需要知道反应过程中涉及的化学反应焓变(ΔH)。
ΔH代表了反应过程中吸收或释放的能量。
对于甲烷燃烧反应,我们可以使用标准生成焓变(ΔHf)来计算。
标准生成焓变是指在标准状态下,1摩尔物质形成时吸收或释放的能量。
根据实验数据,甲烷(CH4)在标准状态下生成1摩尔二氧化碳(CO2)和2摩尔水(H2O)时,其标准生成焓变分别为-393.5kJ/mol和-285.8kJ/mol。
因此,甲烷完全燃烧时释放的总能量可以通过以下公式计算:
总能量释放= 1 * ΔHf(CO2) + 2 * ΔHf(H2O)
将上述数值代入公式中,我们可以得到:
总能量释放 = 1 * (-393.5kJ/mol) + 2 * (-285.8kJ/mol) = -802.6kJ/mol
这意味着每摩尔甲烷完全燃烧时会释放出802.6千焦耳的能量。
4. 应用领域
甲烷燃烧的高热量释放使其在许多领域得到广泛应用。
4.1 家庭供暖和炊具
甲烷作为一种清洁、高效的燃料,被广泛用于家庭供暖和炊具。
通过将甲烷与空气混合并点火,可以产生大量的热能,提供室内供暖或用于加热食物。
4.2 工业生产
甲烷在工业生产中也扮演着重要角色。
它可以作为工业锅炉、干衣机和发电机的主要燃料。
由于其高效率和低污染特性,许多工厂选择使用甲烷来满足能源需求。
4.3 车辆动力
甲烷还被用作车辆的动力来源。
天然气汽车(CNG)使用压缩天然气(包括甲烷)
作为燃料,与传统汽油或柴油车相比,其排放更为清洁,并且在能源效率方面具有优势。
4.4 燃气轮机发电
燃气轮机是一种使用甲烷等天然气作为燃料的发电设备。
这种发电方式具有高效率、低污染的特点,被广泛应用于电力工业。
结论
甲烷燃烧是一种高效、清洁的能源转化过程。
它通过将甲烷与氧气反应产生二氧化碳和水,释放出大量的能量。
通过计算标准生成焓变,我们可以确定每摩尔甲烷完全燃烧时释放的能量。
由于其高效率和低污染特性,甲烷被广泛应用于家庭供暖和炊具、工业生产、车辆动力以及发电行业。
随着对可再生能源和环境保护的关注增加,我们需要继续探索更加可持续和环保的能源替代方案,以减少对传统化石能源如甲烷的依赖。
