(完整word版)第九章卤代烃
大学有机化学第九章卤代烃
❖ 3、反应的进攻试剂(HO-)从离去基团的反面 进攻反应底物,产物的构型翻转(瓦尔登转化)
❖ 4、反应过程中是通过一个过渡态而转化为产 物,没有碳正离子中间体生成,不发生重排, 无重排产物。
2. 单分子亲核取代反应(SN1):
C2H5
4-乙基-6-氯-2-己烯
二. 卤代烃的物理性质
❖ 常温常压下:CH3Cl,C2H5Cl及CH3Br Gas ❖ 其它常见RX Liquid
❖ >C15
Solid
❖ RX:分子极性小,不溶于水,易溶于许多有机化
合物(做溶剂)。如:氯仿(CHCl3)
❖ 卤代烷:X数增加,可燃性降低。CCl4为灭火剂
CH3
CH3 C Cl + NaOH
CH3
CH3 C CH2 +NaCl + H2O
CH3
CH2 CH2 Cl ,
Cl
x 几乎不反应
❖ C、由于多数RX由相应的醇制备,因此用此
法制备醇在合成上意义不大。但少数醇可以 用此法。例如:
CH3 Cl2 hv
CH3CH=CH2
Cl2 hv
CH2Cl H2O/NaOH 加加
加热才沉淀
7、与炔钠的反应 (亲核试剂:RC≡C-)
RC≡CH NaNH2 RC≡CNa
液NH3
10 R’X
RC≡CR’
注意:NaNH2是强碱,不能使用叔(30)卤烷,否则 将主要得到烯烃。乙烯型卤代物,卤苯型化合物在
该条件下反应几乎不发生。
二、亲核取代反应历程及立体化学
δR δX + Nu 反应物 亲核试剂
按②:
09第09章_卤代烃

sp3
构型反转
此图取自于K.彼得C.福尔特等著《有机化学结构与功能》,化学工业出版社, 2006
总目录
特点:
① 反应过程:
反应物→过渡态→产物 一步协同反应,即旧键 的断裂和新键的形成是同 时进行的,反应过程形成 过渡态。
② 结构变化:
CSP3 →CSP2 →CSP3
③ 立体化学:构型反转
④ 能量变化(右图)
第九章 卤代烃
(halogenated hydrocarbon )
第一节 卤代烃的分类、命名及同分异构现象 一、分类 二、命名 第二节 一卤代烃 一、物理性质 二、光谱性质 三、结构特点 四、化学性质 第三节 亲核取代反应历程 一、SN2和SN1反应历程 二、SN2和SN1的立体化学 三、影响亲核取代反应速率的因素 第四节 一卤代烯烃和一卤代芳烃 一、分类 二、结构特点 三、反应活性 第五节 卤代烃的制备 第六节 重要的卤代烃 第七节 有机氟化物
第四节 一卤代烯烃和一卤代芳烃
一、分类
乙烯式:RCH=CHX,ArX 烯丙式:RCH=CHCH2X,ArCH2X 孤立式:RCH=CH(CH2)nX (n≥2)
二、结构特点
乙烯式:p-π共轭使键的强度增大,不易断裂。 烯丙式:因形成C+后存在p-π共轭,故其活性增大。
总目录
三、反应活性
总目录
第二节 一卤代烃
一、物理性质(自学) 二、光谱性质
1. IR:处于指纹区 2. HNMR:X—C—H δ:3~5
总目录
三、结构特点
卤原子电负性大于碳,使C—X键的电子云偏向 卤原子,为极性键。 C—F
偶极矩 C· m 键长 nm 键能 kJ· mol-1 6.7× 10-30
第九章_卤代烃

2021/8/25
37
Grignard试剂的反应及在有机合成中的应用
(1)与活性氢的反应 R'OH H2O
RMgX + H2NH R'C RH
Mg X OR'
Mg X OH
Mg NH2 X
XMgC CR'
+ RH
HX
MgX2
可否用 HC CCH2CH2Br 和 CH3CHCH2CH2CH2Br 制备相应的格氏试剂?
(1) CH3CH CHCH2Cl
(2) CH3CH2CH2CH2Br
(3)
Cl
(4) (CH3)3CCl
(5)
Cl
20(261/)8/2B5 rCH2CH2CH2Cl
12
卤代烷的物理性质:
• 沸点 • 毒性 • 水溶性 • 可燃性 • 分子偶极矩
2021/8/25
13
电负性:
F Cl
Br
I
C
4.0 3.5 2.8 2.6 2.5
第九章 卤代烃
2021/8/25
1
• 由C H X(Cl、Br、I)组成的烃类化合物称
为卤代烃。单纯卤代烃,天然存在的并不多见,
常见的都是合成产物。Cl
பைடு நூலகம்
• 如 :杀虫剂DDT
Cl CH C Cl
Cl
•
灭火剂 CCl4
Ci
•
冷冻剂
CF2Cl2 CFCl3 CF4
•
聚氯乙烯单体 CH2CHCl
•
化工产品的重要原料、溶剂 C6H5CH2Cl CH3I CH2Cl2
有机化学--第九章 卤代烃

卤素交换反应,可通过加入相转移催化剂而加速。 例如:
相转移催化卤离子交换反应,已用于工业生产上。
35
(6)与硝酸银作用*
卤代烷与硝酸银的乙醇溶液反应,生成卤化银沉淀:
不同的卤代烷,其活性次序是:RI>RBr>RCl;当 卤原子相同而烃基结构不同时,其活性次序为: 3°>2°>1°,其中伯卤代烷通常需要加热才能使反应 进行。此反应可用于卤代烷的定性分析。
26
由亲核试剂的进攻而发生的取代反应,称为亲核取 代反应。卤代烷所发生的取代反应是亲核取代反应,可 用代表式表示如下:
27
(1)水解
卤代烷与强碱的水溶液共热,则卤原子被羟基(— OH)取代生成醇,称为水解反应。例如:伯卤代烷与强 碱(如NaOH等)的稀水溶液共热时,主要发生取代反应 生成醇。
28
41
偕和邻二卤代烷还可以脱去两分子卤化氢生成炔烃,尤其是 邻二卤代烷脱两分子卤化氢是制备炔烃的一种有用的方法。例如:
上述脱卤化氢的反应一般分两步进行,首先生成乙烯型卤代烃,它很 不活泼,常常需要在很强烈条件下才能进一步脱卤化氢,且离去基团 处于反式时反应速率快。
42
邻二卤代环烷脱卤化氢时,也可能生成共轭二烯烃。 例如:
15
16
特性:
①碘代烷和溴代烷,尤其是碘代烷,长期放置因分解产生游离碘 和溴而有颜色。 ②一卤代烷有不愉快的气味,其蒸气有毒。氯乙烯对眼睛有刺激 性,有毒,是一种致癌物(使用时应注意防护)。一卤代芳烃具有 香味,但苄基卤则具有催泪性。
17
③在卤代烃分子中,随卤原子数目的增多,化合物的可燃性降低。 例如,甲烷可作为燃料,氯甲烷有可燃性,二氯甲烷则不燃,而四 氯化碳可作为灭火剂;氯乙烯、偏二氯乙烯可燃,而四氯乙烯则不 燃。某些含氯和含溴的烃或其衍生物还可作为阻燃剂,如含氯量约 为70%的氯化石蜡主要用作阻燃剂,可作为合成树脂的不燃性组分, 以及不燃牲涂料的添加剂等。
第九章 卤代烃 9-1

2. 与PX3反应( X = Cl、Br、I )
3R-OH + PCl3 3CH3CH2OH + I2 2P + 3I2
P
3R-Cl + P(OH)3
亚磷酸
3CH3CH2I + P(OH)3
2 PI3
3. 与亚硫酰氯作用
R-OH + SOCl2 R-Cl + SO2↑ + HCl↑
四、氯甲基化(柏朗克反应)
§ 9.11 多卤代烃简介
§ 9.12 氟代烃简介
卤代烃是烃分子中一个或多个氢原子被子卤素(F、Cl、
Br、I)取代的衍生物,它在自然界中存在极少,绝大多数 是人工合成的。
比比皆是的聚氯乙烯制品,千家万户使用的冰箱中的致
冷剂、防火必备的四氯化碳灭火剂等到,都是卤代烃。 卤代烃也是实验室中最常用的有机化合物,它经常起着 从一种化合物变成另一种化合物的桥梁作用,是有机合成中 经常用到的化合物。 人们在使用卤代烃的同时,也带来了严重的污染问题, 六六六被禁用,DDT被取缔。近年来,科学家证明臭氧层 空洞的形成与使用氟氯烃有关。
β-溴萘
§ 9.3
一、以烃为原料
烷烃直接卤代
卤代烃的制法
此法简单,但副产物多,得不到纯净物。 R-H + Cl2
光照
R-Cl + HCl
光照
CH3-CH-CH3 Cl 烷烃的溴代反应的选择性比氯代要好。
CH3-CH2-CH3 + Br2 hν CH3CH2CH2Br + CH3-CH-CH3 127℃ Br 丙烷 3% 97 %
卤代烷分子尽管有极性,但不溶于水,能溶于醇、醚等到 有机溶剂。 卤代烷有令人不愉快的气味,其蒸气有毒,尤其是碘代烃 毒性较大。
第九章 卤代烃

H C C I
H C C I F
F CH3
(E)-2-氟-1-碘丙烯
Br
Cl
(Z)-1-氟-1-溴-2-碘乙烯
Cl
CH2Cl
CH2OH
Br
1-氯环己烷
苯一氯甲烷
Hale Waihona Puke 3-氯-5-溴苯甲醇9.1.2 卤烷的制法
卤代烃在自然界中是不存在的(多已成盐)。 所以卤烃必须用人工合成的方法来制备。主要有以 下几种方法:
亲核取代反应可用下面反应式表示
Nu
-
+
C
+
X
-
Nu
C
产物
+
X离去基团
亲核试剂
(Nucleophile)
底物
亲核试剂 (Nu):带负电荷的离子或带未共用电子对的中性分子
Nu =
HO-、RO-、-CN、NH
3、-ONO2、ROH、H2O
..
..
底物:反应中接受试剂进攻的物质。 离去基团:带着一对电子离去的分子或负离子。 由亲核试剂进攻引起的取代反应称为亲核取代反应(用SN表示)。
卤代烷与水作用,水解为醇,反应是可逆反应。如:
CH3CH2Br + H2O CH3CH2OH + HBr
一般情况下,反应很慢。为增大反应速率,提高 醇的产率,常加入强碱(NaOH),使生成的HX与 强碱反应,可加速反应并提高了醇的产率。
CH3CH2Br + NaOH CH3CH2OH + NaBr
此反应工业用途不大,因卤烷在工业上是由醇制 取,但可用于有机合成中官能团的转化。用于复杂 分子中引入羟基(先卤代,再水解)。
例如:
在多卤烷的命名中,常用“对称”和“不对称”、 “偏”等字样来命名多卤烷。例如二氯乙烷的两个异 构体:
卤代物

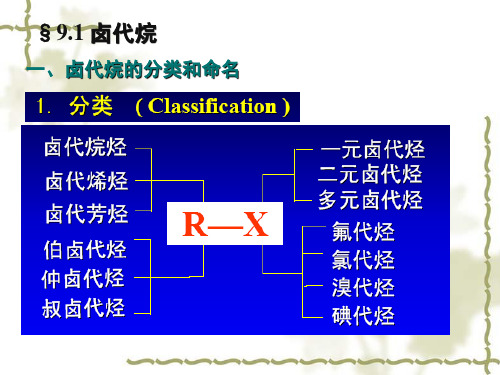
第九章卤代烃§9-1卤代烃的分类、命名及同分异构一、分类1.根据卤原子数目不同可分一卤代烃:CH3X C6H5X 多卤代烃:CHX3C6H6X62.根据卤代烃中烃基的结构不同可分饱和卤代烃、不饱和卤代烃、芳香卤代烃3.根据和卤原子相连的C原子不同可分为伯卤代烃、仲卤代烃、叔卤代烃(卤原子相连的C原子是伯、仲、叔C)。
4.根据卤原子的不同可分为氟卤代烃、氯代烃、溴代烃和碘代烃。
二、同分异构卤代烃的同分异构数目比相同碳的烷烃异构体要多。
有碳胳异构和官能团的位置异构。
三、命名系统命名法是把卤原子当作取代基,即烃的卤代衍生物。
它的命名与烃的命名相似,但在烃名称前面需标明卤原子的位置、数目和名称。
1.选主链:选择含有卤素的最长的碳链作主链。
2.主链编号使卤原子或取代基的位次最小。
卤原子和其它侧链为取代基。
不饱和卤代烃的主链编号,要使双键或叁键位次最小。
CH2=CH-CH-CH2-ClCH33-甲基-4-氯-1-丁烯(不叫2-甲基-1-氯-3-丁烯)3.卤代芳烃一般以芳烃为母体来命名。
CH2CH3Cl邻-氯乙苯§9-2 一卤代烃一、物理性质一般为无色液体,沸点随着C原子数的增加而升高。
相同C原子数卤代烃,直链异构体沸点最高,支链越多沸点降低。
二、光谱性质1.红外光谱碳卤键的吸收频率是随着卤素原子量的增加而减小的。
C—F键的化合物其吸收带频率在1400~1000cm-1;C—Cl键的化合物其吸收带频率在800~600cm-1;C—Br键的化合物其吸收带频率在600~500cm-1;C—I键的化合物其吸收带频率靠近500cm-1;2.核磁共振由于卤素电负性比碳大,因此,在卤代烷中使直接与卤原子相连的碳和邻近碳上质子的屏蔽降低:①质子的化学位移向低场移动,δ值大于烷烃。
②随着卤代烷中卤原子电负性的增加其化学位移也增加。
HC—F:4~4.5;HC—Cl:3~4;HC—Br:2.5~4;HC—I:2~4;三、化学性质卤代烃的化学性质比烷烃活泼得多,这主要是由于分子中的碳卤键的极性(C-X )所引起的,因卤原子有较强的电负性,当与C 原子形成碳卤键时,共用电子对偏向于卤素。
卤代烃-有机化学PDF课件-中国科技大学-09

5 4 3
CH3
2 1
Cl H3C
1 2
CH3
3 4 5
CH CH2 CH CH 3
CH CH CH2 CH 3
2-甲基-4-溴戊烷
(取代基离两端等距离,
3-甲基-2-氯戊烷
偏后的基团先列出 )
Organic Chem
1
CH2Cl H3C CH2 CH CH2 CH3
4 3 2 5
Br H3C CH CH CH CH3
合 成 上 非 常 有 用
不同类RX的鉴别:
RX + AgNO3
R
PhCH2 H2C CH CH2 3° 2° 1° CC
立即产生沉淀
RONO2 + AgX
反应现象
加热,产生沉淀 加热,等一段时间 才产生沉淀 长时间加热, 也不产生沉淀
Organic Chem
(2) 中性分子
中性分子
NH3 RNH3XROH2 ROR' H NH3 - H+ - H+ RNH2 + NH4XROH ROR'
Organic Chem
四、亲核取代反应的历程及影响因素
(一).两种反应历程 SN1和SN2
1.双分子亲核取代反应(SN2)
CH3Br + OHCH3OH + Br-
υ= k[CH3Br][OH-], 动力学上表现为二级反应 速控步骤: 双分子参与。级数与分子数 不一定总相同(如溶剂解:双分子,一级反应) 历程:
Organic Chem
常见的亲核取代反应:
底物 + 亲核试剂
(1)中性 负离子 HOR'OCN RX + IHSRSC CR NO2-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第九章 卤代烃教学要点:1.介绍了卤代烃的分类及同分异构现象、卤代烃的命名、卤代烷的结构和物理性 质、化学性质、制备方法。
2.介绍了一卤代烷的取代反应、消去反应(查依采夫规则)、还原反应。
几种常见 的有机金属化合物。
3.介绍了S N 1和S N 2反应历程、碳正离子的生成、结构、不同结构碳正离子的相对稳定性。
4.一卤代烯烃和一卤代芳烃的分类、物理性质、化学性质、有机氟化合物的特性、有机氟化合物的应用。
本章重点:卤代烷的结构,卤代烷的化学反应,亲核取代反应的机理,一卤代烯烃和一卤代芳烃,卤代烃的制备方法,几种常见的有机金属化合物。
本章难点:卤代烷的化学反应,亲核取代反应的机理。
考核要求:识记:卤代烷的命名,一卤代烷的结构。
领会:亲核取代反应的机理。
综合分析:SN1和SN2反应立体化学及影响因素。
熟练应用:一卤代烷的化学反应,卤代烃的制备方法,几种常见的有机金属化合物。
教学时数:6学时 教学内容:第一节 卤代烃的分类、命名及同分异构现象;第二节 卤代烃;第三节 亲核取代反应历程;第四节 一卤代烯烃和一卤代芳烃;第五节 卤代烃的制法; 第六节 重要的卤代烃;第七节 有机氟化合物;第二十四次课 (第47~48学时)卤代烃可以看作是烃分子中一个或多个氢原子被卤原子取代后所生成的化合物。
卤原子是卤代烃的官能团。
常所说的卤代烃是指氯代烃、溴代烃和碘代烃。
而氟代烃的性质和制法都较为特殊。
一卤代烃的性质比较活泼,能发生多种化学反应转化成各种其他类型的化合物。
所以卤代烃是重要的合成中间产物。
第一节 卤代烃的分类、同分异构和命名一、分类 二、命名 三、同分异构现象一、分类卤代烃氟代烃碘代烃溴代烃氯代烃一卤代烃多卤代烃根据卤代烃分子中所含卤原子的数目:根据卤代烃分子中所含卤原子的种类:根据卤代烃分子中烃基的类型:饱和卤代烃不饱和卤代烃芳香族卤代烃根据和卤原子直接相连的碳原子类型:一级卤代烃(伯卤代烃) R -CH 2-X 10-X 二级卤代烃(仲卤代烃) R 2CH-X 20-X 三级卤代烃(叔卤代烃) R 3C-X 30-X二、命名 1.简单的卤代烃,按卤原子相连的烃基的名称来命名,称为卤代某烃或某基卤。
CH 3Cl :氯甲烷(甲基氯)(CH 3)3CCl :氯代叔丁烷(叔丁基氯)(CH 3)2CHBr : 溴代异丙烷(异丙基溴)C 6H 5CH 2Cl :氯代苄(苄基氯)2.复杂的卤代烃按系统命名法命名。
以相应的烃为母体,将卤原子作为取代基。
命名时,需在烃名称前标上卤原子及支链等取代基的位置、数目和名称。
(1)卤代烷的命名:以含有卤原子的最长碳链作为主链,卤原子与其他支链作为取代基,碳原子编号一般从离取代基较近的一开始。
命名时,取代基按“顺序规则”较优基团在后列出。
2-溴丁烷CH 3CHCH 2CH 3Br4-甲基-2-氯已烷CH 3CHCH 2CHCH 3ClCH 32-乙基-1-氯戊烷CH 3CH 2CH 2CHCH 2CH 32Cl3-氯-4-溴已烷BrCl CH 3CH 2-CH-CHCH 2CH 3(2)卤代烯烃的命名:以烯烃为母体,选择含有双键的最长碳链为主链,并以双键的位次最小为原则进行编号,把卤原子作为取代基CH 2==CH-CH 2Br3-溴丙烯CH 2==CH-CH-CH 2Cl3-甲基-4-氯-1-丁烯CH 3(3)卤代芳烃的命名:以芳烃为母体,卤原子作为取代基。
2-氯甲苯(邻氯甲苯)2,4-二溴甲苯1-氯-4-溴苯CH 3ClCH 3BrBr ClBr侧链卤代芳烃的命名:以烷烃为母体,卤原子和芳环都作为取代基。
苯氯甲烷 1-氯-2-苯丙烷CH 2Cl(氯代苄,苄基氯)CHCH 2Cl CH 3卤代环烷烃的命名:以脂环烃为母体,卤原子和支链都看作是取代基。
H BrHCH 3**(1R,2S)-1-甲基-2-溴环已烷顺-1-甲基-2-溴环已烷或者较小的(原子序数小的)基团,编号最小注:三、同分异构现象 卤代烷的同分异构体数目比相应的烷烃的异构体要多。
碳干异构位置异构CH 3CH 2CH 2-Cl 1-氯丙烷2-氯丙烷1-氯丁烷2-氯丁烷 2-甲基-1-氯丙烷CH 3-C-CH 3ClClCH 3ClCH 32-甲基-2-氯丙烷CH 3CH 2-CH-CH 3*ClCH 3CH 2CH 2CH 2CH 3CH-CH 2ClCH 3-CH-CH 31-溴戊烷2-溴戊烷 3-溴戊烷BrBrCH 3CH 2CH 2CH 2CH 2Br CH 3CH 2CH 2-CHCH 3CH 3CH 2-CHCH 2CH 3第二节卤代烷一、物理性质二、光谱性质三、偶极矩四、化学性质五、多卤代烷的性质一、物理性质在室温下,氟甲烷、氟乙烷、氟丙烷、氯甲烷、氯乙烷及溴甲烷为气体。
其它常见的卤代烷均是液体。
纯粹的卤代烷是无色的,但碘代烷易分解出碘而带有棕红色。
卤代烷的蒸气有毒。
卤代烷在铜丝上燃烧时能产生绿色火焰,可用来鉴定卤代烷。
卤代烷的沸点是随着碳原子数的增加而升高。
比相应的烷烃的沸点高。
烃基相同的卤代烷,以碘代烷的沸点最高,其次为溴代烷、氯代烷、氟代烷。
同一卤代烷的各异构体中,直链异构体的沸点最高,支链越多的沸点越低。
P231 表9—1 卤代烷的物理常数二、光谱性质1.红外光谱:在红外光谱里,碳卤键的吸收频率是随着卤素原子量的增加而减小的。
νC-F 1400~1000cm-1νC-Cl 800~600cm-1 νC-Br 600~500cm-1 νC-I 500cm-12.核磁共振谱:由于卤素的电负性比碳大,使直接与卤原子相连的碳上的质子的δ值大于烷烃,并且随着卤代烷中卤原子电负性的增加(I 2.5,Br 2.8,Cl3.0, F4.0)其化学位移值也增加。
δ值:H C-F:4-4.5;H C-Cl :3-4;H C-Br :2.5-4;H C-I:2-4.P232 图9—1 溴乙烷的NMR图三、偶极矩在卤代烷分子中,由于卤原子的电负性大于碳,使C—X键的电子云偏向卤原子,使C—X键成为一个极性共价键。
P232 表9—2 一些简单卤代烷的偶极矩(D)四、化学性质卤代烷分子中由于卤原子的存在,使其化学性质活泼。
由于碳—卤键是极性共价键,易发生取代、消除、还原等反应。
当极性试剂与它作用时,C-X键在试剂电场的诱导下极化,由于C-X键的键能(除C-F键外)都比C-H键小(C-I 218KJ/mol;C-Br 285;C-Cl 339;C-H 414)。
因此,C-X键比C-H键容易异裂而发生各种化学反应。
1.亲核取代反应卤代烷可以和许多试剂作用,使分子中的卤原子被其他基团取代,生成各类有机化合物。
Nu:OH, RO- ,HS- ,RS-, -CN ,R-COO-, NH3这些进攻的离子或分子都能供给一对电子与缺电子的碳形成共价键,它们具有亲核的性质,称为亲核试剂。
由亲核试剂进攻引起的取代反应称为亲核取代反应。
或者以上这些取代反应,都是由带负电荷或具有未共用电子对的分子进攻卤代烷分子中带正电荷的碳原子所引起的,称为亲核取代反应。
把能产生负离子的试剂称为亲核试剂。
R:L+:Nu R:Nu+:L (L-离去基团; N u-亲核试剂)RX+NaOHH2OROH+NaX 如:用来合成醇类化合物此反应在分子中增加了一个碳原子,并形成一个新的C—C键,在合成上常用作增长碳链。
引入的—CN基可进一步转化为其它官能团;—COOH、—CONH2等。
RXNaCN+醇RCN NaX+CH 2BrNaCN2CN++(CH 3)2CHBrCH(CH 3)2CH 3C ≡C-Na(CH 3)2CHCH 2I+CH 3C ≡C-CH 2CH (CH 3)23卤代烷还可与硝酸银的醇溶液反应,生成卤化银沉淀;硝酸酯用此反应鉴别卤化物。
卤代烷在取代反应中的反应活性:RI > RB r > RC l > RF究其原因:一方面是由于碳卤键键能为:C-F>C-Cl>C-Br>C-I 。
另一方面,对C-X 键来说,共价键的极化度随原子半径的增大而增大,键极化度的强弱次序为:C-I > C-Br > C-Cl > C-F,这种动态极化,在分子的化学反应活性方面起着决定作用。
2.消除反应卤代烷与氢氧化钠(或氢氧化钾)的醇溶液作用,与碳上的氢原子脱去一分子卤化氢而生成烯烃。
此种反应叫消除反应。
或者卤代烷与氢氧化钠(或KOH )的醇溶液作用时,卤素常与β碳上的氢原子脱去一分子卤化氢而生成烯烃。
这种脱去一个简单分子的反应叫做消除反应。
消除反应的难易次序:三级卤代烷 >二级卤代烷 > 一级卤代烷。
二级或三级卤代烷在硝除卤化氢时,反应有时可以在碳链的两个不同方向进行,可得到两种不同的产物。
如:实验证明,消除反应的主要产物是双键碳上连接烃基最多的烯烃:这个经验规律叫做札依采夫规则。
3.与金属反应卤代烷能和某些金属发生反应,生成有机金属化合物。
有机金属化合物是指金属原子直接与碳原子相连的一类化合物。
(1) 与金属镁的反应卤代烷与镁在乙醚溶剂中作用生成有机镁化合物,有机镁化合物称为格林尼亚试剂,简称格氏试剂(格氏试剂是由R 2Mg 、MgX 2、(RMgX )等多种成分形成的平衡体系混合物,一般用RMgX 表示)。
是有机合成中重要的试剂。
可用来合成烷烃、醇、醛、羧酸等各类化合物。
RX 活性:R-I > R-Br > RCl苯、四氢呋喃等都可以作为溶剂。
一卤代烷生成格氏试剂格氏试剂的性质非常活泼,能与多种含有活泼氢的化合物作用,生成相应的烃。
RH RHRH RH ++++Mg MgMgX 2MgXOHX ORX CCR'通过上述反应,可用格式试剂用来测知某化合物中所含活泼氢的数目。
可以用定量的甲基碘化镁与一定量的含活泼氢的化合物作用,便可定量地得到甲烷,通过测定甲烷的体积,可以计算出化合物所含活泼氢的数量,这叫做活泼氢测定法。
由于格氏试剂遇水就分解,所以,格氏试剂制备时时必须用无水溶剂和干燥的反应器。
格氏试剂还可与还原电位低于镁的金属卤化物作用,合成其它金属有机化合物。
3RMgCl + AlCl 3R 3Al + 3MgCl 22RMgCl + CdCl 22Cd + 2MgCl 24RMgCl + SnCl 4R 4Sn + 4MgCl 2(2)与碱金属反应 卤代烷与金属钠反应,生成的有机钠化合物立即与卤代烷反应生成烷烃R X + 2Na R-R + NaX 醚醚用此反应来合成含偶数碳原子,结构对称的烷烃,称为伍慈合成。
如:CH 3CH 2CH 2-CH 2CH 2CH 3Na 醚2CH 3CH 2CH 2Br卤代烷与金属锂作用生成有机锂化合物:C 4H 9X + 2LiC 4H 9Li + LiX 有机锂化合物的性质与格氏试剂很相似,反应性能更活泼,遇水、醇、酸等即分解。
