高一上学期化学假期作业一
高一化学假期作业一
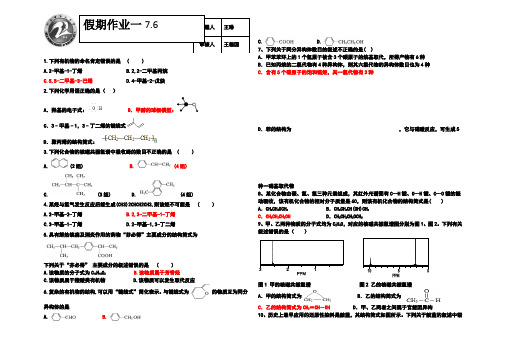
1.下列有机物的命名肯定错误的是( )A.2-甲基-1-丁烯B.2,2-二甲基丙烷C.5,5-二甲基-3-己烯D.4-甲基-2-戊炔2.下列化学用语正确的是()A.羟基的电子式: B.甲醇的球棍模型:C.3﹣甲基﹣1,3﹣丁二烯的键线式D.聚丙烯的结构简式:3.下列化合物的核磁共振氢谱中吸收峰的数目不正确的是( )A.(2组)B.(4组)C. (3组)D. (4组)4.某烃与氢气发生反应后能生成(CH3)2CHCH2CH3,则该烃不可能是( )A.2-甲基-2-丁烯B.2,3-二甲基-1-丁烯C.3-甲基-1-丁烯D.2-甲基-1,3-丁二烯5.具有解热镇痛及消炎作用的药物“芬必得”主要成分的结构简式为下列关于“芬必得” 主要成分的叙述错误的是( )A.该物质的分子式为C13H18O2B.该物质属于芳香烃C.该物质属于羧酸类有机物D.该物质可以发生取代反应6.复杂的有机物的结构,可以用“键线式”简化表示。
与键线式为的物质互为同分异构体的是A. B.C. D.7、下列关于同分异构体数目的叙述不正确的是( )A.甲苯苯环上的1个氢原子被含3个碳原子的烷基取代,所得产物有6种B.已知丙烷的二氯代物有4种异构体,则其六氯代物的异构体数目也为4种C.含有5个碳原子的饱和链烃,其一氯代物有3种D.菲的结构为,它与硝酸反应,可生成5种一硝基取代物8、某化合物由碳、氢、氧三种元素组成,其红外光谱图有C—H键、O—H键、C—O键的振动吸收,该有机化合物的相对分子质量是60,则该有机化合物的结构简式是( )A.CH3CH2OCH3 B.CH3CH2CH(OH)CH3C.CH3CH2CH2OH D.CH3CH2CH2OCH39、甲、乙两种物质的分子式均为C2H4O,对应的核磁共振氢谱图分别为图1、图2。
下列有关叙述错误的是()图1 甲的核磁共振氢谱图2 乙的核磁共振氢谱A.甲的结构简式为 B.乙的结构简式为C.乙的结构简式为CH2=CH-OH D.甲、乙两者之间属于官能团异构10、历史上最早应用的还原性染料是靛蓝,其结构简式如图所示。
(word完整版)高一化学必修一上学期寒假作业及答案
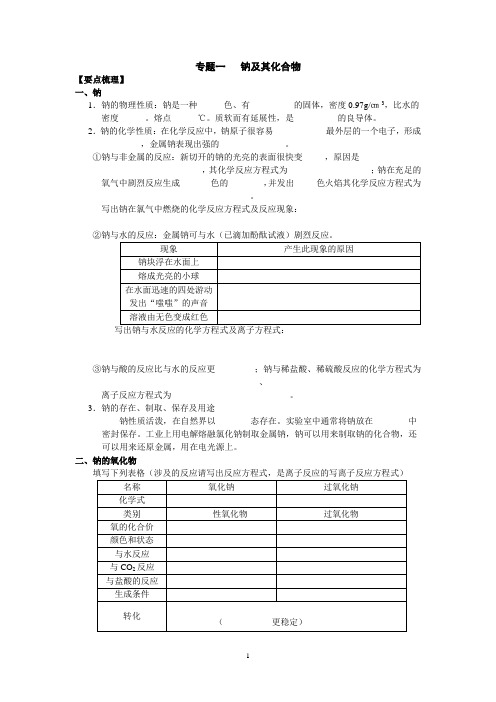
专题一钠及其化合物【要点梳理】一、钠1.钠的物理性质:钠是一种______色、有__________的固体,密度0.97g/㎝3,比水的密度______。
熔点______℃。
质软而有延展性,是__________的良导体。
2.钠的化学性质:在化学反应中,钠原子很容易____________最外层的一个电子,形成_________,金属钠表现出强的_______________。
①钠与非金属的反应:新切开的钠的光亮的表面很快变_____,原因是____________________________________,其化学反应方程式为___________________;钠在充足的氧气中剧烈反应生成_______色的________,并发出____ 色火焰其化学反应方程式为__________________________________。
写出钠在氯气中燃烧的化学反应方程式及反应现象:___________________________ ________________________________②钠与水的反应:金属钠可与水(已滴加酚酞试液)剧烈反应。
写出钠与水反应的化学方程式及离子方程式:③钠与酸的反应比与水的反应更_________;钠与稀盐酸、稀硫酸反应的化学方程式为____________________________________、____________________________________离子反应方程式为___________________________。
3.钠的存在、制取、保存及用途钠性质活泼,在自然界以________态存在。
实验室中通常将钠放在________中密封保存。
工业上用电解熔融氯化钠制取金属钠,钠可以用来制取钠的化合物,还可以用来还原金属,用在电光源上。
二、钠的氧化物填写下列表格(涉及的反应请写出反应方程式,是离子反应的写离子反应方程式)1、物理性质:氢氧化钠俗名________、_________、________,是一种_____色固体,易吸收空气中的水分而________,___溶于水并放热,水溶液有涩味,有强________性。
人教版高中化学必修一高一化学寒假作业1.docx

高中化学学习材料(灿若寒星**整理制作)高一化学寒假作业1(满分:100分)可能用到的相对原子质量: Na:23 Mg:24 Al:27 K:39 Zn:65 O:16 Cu:64C:12 Cl:35.5 Mn:55 Fe:56 H:1 S:32一、选择题(共30小题,每小题2分,共60分。
每小题只有一个选项符合题意)1、下列各组物质,按化合物、单质、混合物顺序排列的是()A、烧碱、液态氧、碘酒B、生石灰、白磷、熟石灰C、干冰、铁、氯化氢D、空气、氮气、胆矾2.下列仪器:①容量瓶②蒸镏烧瓶③漏斗④燃烧匙⑤天平⑥分液漏斗⑦胶头滴管,常用于物质分离的是()A.①③⑤ B.②④⑦ C.①②⑥ D.②③⑥3.下列化学反应的离子方程式,书写不正确...的是A.硫酸铜溶液与氢氧化钡溶液反应:Ba2++ SO42-= BaSO4↓+2H2O B.向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH—=AlO2C.氯化亚铁溶液中通入少量氯气:Cl2+ 2Fe2+=2Fe3+ +2Cl—D.向碳酸钙固体中加入稀盐酸:CaCO3+2H+=Ca2+ +CO2↑+H2O4.下列叙述正确的是 ( ) A.1 mol H2O的质量为18g/molB.CH4的摩尔质量为16gC.3.01×1023个SO2分子的质量为32gD.标准状况下,1 mol任何物质体积均为22.4L5.下列说法或做法正确的是()A CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性弱于碳酸B 金属钠着火燃烧时,用泡沫灭火器灭火C 铝比铁活泼,所以铝比铁更容易被腐蚀D 正常雨水PH 等于7,酸雨的PH 小于76、在强酸性溶液中能大量共存,且溶液为无色透明的离子组( )A 、K +、Fe 2+、AlO 2-、NO 3-B 、NH 4+、Al 3+、NO 3-、SO 42-C 、K +、NH 4+、CO 32-、S 2-D 、Cu 2+、Ag +、NO 3-、CI -7.用N A 表示阿伏德罗常数,下列叙述正确的是( )A .标准状况下,22.4L H 2O 含有的分子数为 N AB .常温常压下,1.06g Na 2CO 3含有的Na +离子数为0.02 N AC .通常状况下,N A 个CO 2分子占有的体积为22.4LD .物质的量浓度为0.5 mol/L 的MgCl 2溶液中,含有Cl - 个数为N A8.下列物质的水溶液能导电,但属于非电解质的是 ( )A.HClO B .Cl 2 C .NaHCO 3 D .CO 29.用特殊方法把固体物质加工到纳米级(1nm-100nm )的超细粉末粒子,然后制得纳米材料。
高一假期化学作业(一)有答案

高一假期化学作业(一)说明:可能用到的相对原子质量:H 1 C 12 O 16 Na 23 N 14 Mg 24 S 32 本卷分第Ⅰ卷和第Ⅱ卷。
满分为100分。
考试时间90分钟第Ⅰ卷(选择题共45分)一、选择题(本题共9小题,每小题2分,共20分。
每小题只有1个选项符合题意)1.X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z是()A.Mg Al Si B.Li Be Mg C.N O S D.P S O2.下列关于卤族元素由上到下性质递变的叙述,正确的是()①单质的氧化性增强②单质的颜色加深③气态氢化物的稳定性增强④单质的沸点升高⑤阴离子的还原性增强A.①②③ B.②③④ C.②④⑤ D.①③⑤3.对于放热反应A+B C+D,以下说法正确的是(E A、E B、E C、E D分别表示A、B、C、D所具有的能量 ()A.E A>E C B.E A >E C+E D C.E A+E B >E C+E D D.E A+E B <E C+E D4.据报道,氢燃料电池公交汽车已经驶上北京街头。
下列说法正确的是A.电解水制取氢气是理想而经济的制氢方法B.发展氢燃料电池汽车不需要安全高效的储氢技术C.氢燃料电池汽车的使用可以有效减少城市空气污染D.氢燃料电池把氢气和氧气燃烧放出的热能转化为电能5.乳酸()在一定条件下经聚合生成一种塑料()用这种新型塑料制成的餐具,在乳酸菌的作用下,60天内分解成无害的物质,不会造成白色污染。
在该聚合反应中生成的另一种产物是()A.H2O B.CO2C.O2 D.H26.下列叙述正确的是()A.油脂水解的最终产物是葡萄糖B.蛋白质水解的最后产物是各种氨基酸C.蛋白质溶液中加入K2SO4溶液后,蛋白质从溶液中析出而变性D.所有糖类、油脂和蛋白质在一定条件下都能水解7.1 mol甲烷和氯气在光照条件下反应生成物质的量相同的4中取代物,则消耗氯气的物质的量是()A.5mol B.2.5mol C.1mol D.2mol8.苯加溴水后,溴水层颜色变浅,这是由于()A.溴挥发了 B.发生了取代反应 C.发生了萃取 D.发生了加成反应9.下列说法不正确的是()A.通过煤的干馏可以获得焦炭 B.煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来C.通过煤的干馏可以获得粗氨水 D.煤液化后可以得到甲醇10.下列事实不能说明X元素比Y元素的非金属性强的是()A.与H2化合时X单质比Y单质容易B. X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强C. X原子的最外层电子数比Y原子的最外层电子数多D. X单质可以把Y从其氢化物中置换出来二、选择题(本题共9小题,每小题2分,共24分。
高一化学假期实践作业.

高一化学假期实践作业1、常用化学电池种类、名称等,废旧电池的回收途径和处理方法。
2、每人(最好组成小组)至少到附近化工厂调查一次:①产品;②原料;③反应原理;④节能减排措施;⑤污染问题;⑥减小污染措施;⑦你对污染问题提出建议。
3、测酸雨pH(至少收集3次不同时间或地点的雨水)4、调查各种酒的成份及酒精的含量和周围人群中因喝酒而引发的事故。
5、设计家庭(特别是厨房)中可以完成的几个实验。
高一生物假期实践作业要求:学生可根据自身实际,利用自己的社会资源优势,从以下10个课题中任选一个,独立或合作完成,写出高质量的调查报告。
一、社会调查类1、过敏症的调查。
2、某种人类遗传病调查(例:多指、聋哑、色盲等)3、抗虫棉种植比例调查。
4、某区域污染企业调查。
具体要求:用表格或坐标图等形式列举出详尽的数据,然后对数据进行分析、整理,结合所学知识,分析其内在机理或提出合理化建议。
二、参观类5、参观制药厂。
6、参观酿造厂(酒厂、酱油厂、食醋厂)具体要求:列举出工厂或实验室的具体工艺操作流程,分析其中的生物学知识的原理应用。
三、动手实践类7、动植物标本的制作。
具体要求:列出采集地点、主要特征、生活习性等,对标本作一注释性说明,最后交标本或标本照片。
8、自酿米酒或葡萄酒具体要求:上网查阅资料,明确酿制方法流程,自己动手酿制,写出每天的观察记录,最后带来酿制成果更好。
4高一年级暑假实践性作业同学们:暑假已至,这是我们接触社会,拓展能力的大好时机。
我们设计了假期实践性作业,要求大家运用已学的课内知识,利用网络和其他社会资源,开展一些初步研究探索。
下学期开学,我们将组织展示和评比,将优秀实践性作业编辑成册,在校报报刊上发表并予以奖励。
高一语文暑假实践作业一、个人家庭情况调查1、指导思想:家庭是社会的基础细胞。
作为学生了解自己的家庭至关重要,而有些同学却对家庭状况所知不多,这不利于学生责任心的培养和个人素质的提高。
2、过程、步骤:①了解父母从事的具体工作及收入情况;②跟随父母到其单位具体考察工作情况,体味父母艰辛与不易;③了解父母性格以及对子女的期望。
高一化学上学期寒假作业

高一化学上学期寒假作业12、在下列反应中, HCl 作氧化剂的是A.NaOH+HCl=NaCl+H2OB.Zn+2HCl=ZnCl2+H2C.MnO2+4HCl(浓) MnCl2+2H2O+Cl2D.CuO+2HCl=CuCl2+H2O13.下列关于胶体的说法中正确的是A.胶体外观不均匀B.胶体能通过半透膜C.胶体微粒做不停的无秩序运动D.胶体不稳定,静置后容易产生沉淀14.下列各组在溶液中的反应,不管反应物量的多少,都只能用同一个离子方程式来表示的是A.FeBr2与Cl2B.Ba(OH)2与H2SO4C.HCl与Na2CO3D.Ca(HCO3)2与NaOH15.下列反应的离子方程式正确的是A.氨气通入醋酸溶液CH3COOH+NH3 == CH3COONH4B.澄清的石灰水跟盐酸反应H++OH- == H2OC.碳酸钡溶于醋酸BaCO3+2H+ == Ba2++H2O+CO2D.金属钠跟水反应Na+H2O == Na++OH-+H216.以下说法正确的是A.物质所含元素化合价升高的反应叫还原反应B.在氧化还原反应中,失去电子的元素化合价降低C.物质中某元素失去电子,则此物质是氧化剂D.还原剂中必定有一种元素被氧化17.下列说法正确的是A.电解质与非电解质的本质区别,是在水溶液或熔化状态下能否电离B.强电解质与弱电解质的本质区别,是其水溶液导电性的减弱C.酸、碱和盐类都属于电解质,其他化合物都是非电解质D.常见的强酸、强碱和大部分盐都是强电解质,其他化合物都是非电解质18.在无色透明溶液中,不能大量共存的离子组是A.Mg2+、Na+、SO42-、Cl-B.K+、Na+、HCO3-、NO3-C.OH-、HCO3-、Ca2+、Na+D.Ba2+、Na+、OH-、NO3-19.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是A.Na+、K+、OH-、Cl-B.Na+、Cu2+ 、SO42-、NO3-C.Mg2+、Na+、SO42-、Cl-D.Ba2+、HCO3-、NO3-、K+20.关于氧化剂的叙述正确的是A.分子中含有氧元素,且化合价升高的物质B.分子中一定含有氧元素C.在反应中易失电子的物质D.在反应中易结合电子的物质21.制印刷电路时常用氯化铁溶液作为腐蚀液。
高一化学上学期寒假作业高一全册化学试题1

虾对市爱抚阳光实验学校高一〔上〕化学寒假作业〔2〕一、选择题〔共4小题,每题3分,总分值12分〕1.〔3分〕〔2021秋•七里河区校级期末〕以下装置或操作正确的选项是〔〕A.用甲图装置验证CH3COOH、H2CO3和H2SiO3的酸性强弱B.用乙图装置配制一浓度的稀硫酸C.用丙图装置验证NaHCO3和Na2CO3的热稳性D.用丁图装置制备并收集少量NO2气体2.〔3分〕〔2021秋•七里河区校级期末〕以下说法中正确的选项是〔〕A.飞机上的隔热陶瓷瓦属于优质合金材料B.将少量CO2通入CaCl2溶液能生成白色沉淀C.蔗糖中参加浓硫酸后出现发黑现象,说明浓硫酸具有吸水性D.碱性氧化物一是金属氧化物,金属氧化物不一是碱性氧化物3.〔3分〕〔2021秋•七里河区校级期末〕除去以下物质中的杂质〔括号内为杂质〕,所选用的试剂和方法都正确的选项是〔〕选项物质试剂方法A SiO2〔Al2O3〕氢氧化钠溶液过滤B AlCl3〔MgCl2〕氢氧化钠溶液过滤C CO2〔SO2〕饱和碳酸氢钠溶液洗气D 乙醇〔水〕汽油萃取、分液A.A B.B C.C D.D4.〔3分〕〔2021秋•七里河区校级期末〕以下能到达预期目的是〔〕A.检验溶液中是否含有CO32﹣:滴加稀盐酸,将产生的气体通入澄清石灰水B.检验溶液中是否含有SO42﹣:先滴加氯化钡溶液,再滴加稀盐酸C.检验溶液中是否含有Fe2+:先滴加氯水,再滴加KSCN溶液D.检验溶液中是否含有NH4+:先滴加浓NaOH溶液并加热,再用湿润的石蕊试纸二、【选做题】〔共1小题,每题3分,总分值3分〕5.〔3分〕〔2021秋•七里河区校级期末〕A、B、C、D四种物质中均含同种元素,且它们之间的转化关系如图.以下说法正确的选项是〔〕A.A一为单质B.C一为氧化物C.D一为酸D.A、B、C的相对分子质量之差为16或16的倍数三、选择题〔共3小题,每题3分,总分值9分〕6.〔3分〕〔2021秋•七里河区校级期末〕溶液中含有NO3﹣、SO32﹣、Cl﹣和NH4+,假设向其中参加足量的盐酸,溶液里上述四种离子的浓度根本保持不变的是〔〕A.NO3﹣B.SO32﹣C.Cl﹣D.NH4+7.〔3分〕〔2021秋•七里河区校级期末〕以下变化只需通过一步化合反就可以实现的是〔〕A.FeCl3→FeCl2B.Al2O3→Al〔OH〕3C.SiO2→H2SiO3D.S→SO38.〔3分〕〔2021秋•七里河区校级期末〕化学反中,有时存在“一种物质过量,另一种物质仍不能完全反〞的特殊情况.以下反中属于这种情况的是〔〕①过量的锌与18mol•L﹣1的硫酸反②过量的氢气与少量氮气在一温度、压强和催化剂存在下充分反③加热条件下浓盐酸与过量的MnO2反④加热条件下过量铜与浓硫酸反⑤过量稀硫酸与块状石灰石反.A.②③④⑤B.②③④C.①③④D.①②③④⑤四、解答题〔共1小题,总分值0分〕9.〔2021秋•七里河区校级期末〕一量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol•L﹣1的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.10mol.〔1〕上述变化中涉及三个化学反,其中一个反为H2+Cl 22HCl,请写出另外两个反的离子方程式:、.〔2〕参加反的氢气和氯气的物质的量之比n〔H2〕 n〔Cl2〕为.〔3〕工业制取漂白粉的原料是氯气和石灰乳,漂白粉的有效成分为.选做题10.〔2021秋•七里河区校级期末〕某研究性学习小组利用以下装置探究氯气与氨气之间的反.其中A、F分别为氨气和氯气的发生装置,C为纯洁枯燥的氯气与氨气反的装置.请答复以下问题:〔1〕为了快速制备氨气,装置A中烧瓶内的固体可以是〔填序号〕.①二氧化硅②过氧化钠③生石灰④氢氧化钠固体⑤氯化钙〔2〕请在B处虚线框内画上适宜的装置图并注明所装试剂名称.〔3〕装置F中发生反的离子方程式为:.〔4〕装置D和E的位置〔填“能〞或“不能〞〕调换,装置E 的作用是:.〔5〕通入C装置的两根导管左边较长、右边较短,目的是:.〔6〕装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出发生反的化学方程式,并标出电子转移的方向和数目:.〔7〕从装置C的G处逸出的尾气可能含有污染环境的气体,如何处理?.高一〔上〕化学寒假作业〔2〕参考答案与试题解析一、选择题〔共4小题,每题3分,总分值12分〕1.〔3分〕〔2021秋•七里河区校级期末〕以下装置或操作正确的选项是〔〕A.用甲图装置验证CH3COOH、H2CO3和H2SiO3的酸性强弱B.用乙图装置配制一浓度的稀硫酸C.用丙图装置验证NaHCO3和Na2CO3的热稳性D.用丁图装置制备并收集少量NO2气体考点:化学方案的评价.菁分析:A.发生强酸制取弱酸的反;B.不能将浓硫酸直接注入容量瓶中;C.碳酸氢钠受热易分解;D.二氧化氮与水反.解答:解:A.由图可知,醋酸与碳酸钠反生成二氧化碳,二氧化碳与硅酸钠反生成硅酸,均发生强酸制取弱酸的反,用甲图装置验证CH3COOH、H2CO3和H2SiO3的酸性强弱,故A正确;B.不能将浓硫酸直接注入容量瓶中,在烧杯中稀释、冷却后转移到容量瓶中,故B 错误;C.碳酸氢钠受热易分解,那么图中小试管内为碳酸氢钠,故C错误;D.二氧化氮与水反,那么不能利用排水法收集,故D错误;应选A.点评:此题考查化学方案的评价,为高频考点,涉及酸性比拟、溶液配制、物质性质,把握物质的性质及反原理、操作为解答的关键,注意的评价性分析,题目难度不大.2.〔3分〕〔2021秋•七里河区校级期末〕以下说法中正确的选项是〔〕A.飞机上的隔热陶瓷瓦属于优质合金材料B.将少量CO2通入CaCl2溶液能生成白色沉淀C.蔗糖中参加浓硫酸后出现发黑现象,说明浓硫酸具有吸水性D.碱性氧化物一是金属氧化物,金属氧化物不一是碱性氧化物考点:酸、碱、盐、氧化物的概念及其相互联系;浓硫酸的性质;金属陶瓷超导材料.菁分析:A、陶瓷是硅酸盐产品;B、CO2通入CaCl2溶液中不反;C、蔗糖中参加浓硫酸后出现发黑,是蔗糖被脱水;D、碱性氧化物一是金属氧化物,金属氧化物不一是碱性氧化物.解答:解:A、陶瓷是硅酸盐产品,故不是合金材料,故A错误;B、CO2通入CaCl2溶液中不反,H2CO3是弱酸,不能制出HCl,故B错误;C、蔗糖中参加浓硫酸后出现发黑,是蔗糖被脱水,表达了浓硫酸的脱水性,不是吸水性,故C错误;D、碱性氧化物一是金属氧化物,但金属氧化物不一是碱性氧化物,如Na2O2不是碱性氧化物,Al2O3是氧化物,故D正确.应选D.点评:此题考查了浓硫酸的三大特性之一的脱水性和碱性氧化物的概念,根据性质来辨析是解题关键,难度不大.3.〔3分〕〔2021秋•七里河区校级期末〕除去以下物质中的杂质〔括号内为杂质〕,所选用的试剂和方法都正确的选项是〔〕选项物质试剂方法A SiO2〔Al2O3〕氢氧化钠溶液过滤B AlCl3〔MgCl2〕氢氧化钠溶液过滤C CO2〔SO2〕饱和碳酸氢钠溶液洗气D 乙醇〔水〕汽油萃取、分液A.A B.B C.C D.D考点:物质的别离、提纯的根本方法选择与用.菁分析:A.二者均与NaOH溶液反;B.二者均与NaOH溶液反;C.二氧化硫与碳酸氢钠反,而二氧化碳不能;D.乙醇中引入杂质汽油.解答:解:A.二者均与NaOH溶液反,不能除杂,选稀盐酸、过滤,故A错误;B.二者均与NaOH溶液反,将原物质反掉,不能除杂,故B错误;C.二氧化硫与碳酸氢钠反,而二氧化碳不能,那么选择饱和碳酸氢钠、洗气可除杂,故C正确;D.乙醇中引入杂质汽油,不能除杂,加CaO、蒸馏,故D错误;应选C.点评:此题考查混合物别离提纯,为高频考点,把握物质的性质及发生的反、混合物别离方法选择为解答的关键,侧重分析与能力的考查,题目难度不大.4.〔3分〕〔2021秋•七里河区校级期末〕以下能到达预期目的是〔〕A.检验溶液中是否含有CO32﹣:滴加稀盐酸,将产生的气体通入澄清石灰水B.检验溶液中是否含有SO42﹣:先滴加氯化钡溶液,再滴加稀盐酸C.检验溶液中是否含有Fe2+:先滴加氯水,再滴加KSCN溶液D.检验溶液中是否含有NH4+:先滴加浓NaOH溶液并加热,再用湿润的石蕊试纸考点:常见阳离子的检验;常见阴离子的检验.菁分析:A、能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫;B、溶液中含有银离子也会出现此现象;C、氯水具有氧化性,能氧化亚铁离子生成铁离子,铁离子与硫氰化钾反出现血;D、和氢氧化钠反生成氨气的离子是铵根离子.解答:解:A、能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,所以向某溶液中参加稀HCl,放出能使澄清的石灰水变浑浊的气体,原溶液中不一有碳酸根离子,可能有碳酸根离子、碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子中的一种或几种,故A 错误;B、某溶液中滴加氯化钡溶液有白色沉淀产生,再参加稀硝酸,沉淀不消失,可能是含有银离子或硫酸根离子,故B错误;C、铁离子与硫氰化钾反出现血,故铁离子会干扰亚铁离子的检验,可先滴加硫氰化钾,假设不出现,再滴加过氧化氢,假设溶液变红,证明含亚铁离子,故C错误;D、溶液中参加氢氧化钠溶液,加热后能产生使湿润的石蕊试纸变蓝的气体即氨气,那么溶液中含有NH4+,故D正确;应选D.点评:此题考查了常见阴阳离子的检验,难度不大,注意B选项,和稀HCl放出能使澄清的石灰水变浑浊的气体的离子有碳酸根离子、碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子.二、【选做题】〔共1小题,每题3分,总分值3分〕5.〔3分〕〔2021秋•七里河区校级期末〕A、B、C、D四种物质中均含同种元素,且它们之间的转化关系如图.以下说法正确的选项是〔〕A.A一为单质B.C一为氧化物C.D一为酸D.A、B、C的相对分子质量之差为16或16的倍数考点:无机物的推断.菁分析:A、B、C、D四种物质中均含同种元素,A能连续被氧化生成C,说明B中有变价元素,A可能是非金属元素单质,如:C、S、N,也可能是金属单质,如Na,也可能是化合物如NH3,根据物质之间的转化分析解答.解答:解:A、A可以为化合物NH3,NH 3NO NO 2HNO3,故A错误;B、B被氧气氧化生成氧化物C,所以C是氧化物,故B正确;C、如果C是Na,Na Na2O Na2O 2 NaOH,那么D是NaOH,故C错误;D、A、B、C、D相对分子质量之差不一为16或16的倍数,如NH 3NO,故D错误.应选:B.点评:此题考查了无机物的推断,短周期中能实现上述关系的主要有Na、C、S、N元素的单质、化合物,同时考查学生发散思维能力、归纳总结能力,难度中.三、选择题〔共3小题,每题3分,总分值9分〕6.〔3分〕〔2021秋•七里河区校级期末〕溶液中含有NO3﹣、SO32﹣、Cl﹣和NH4+,假设向其中参加足量的盐酸,溶液里上述四种离子的浓度根本保持不变的是〔〕A.NO3﹣B.SO32﹣C.Cl﹣D.NH4+考点:离子共存问题.菁分析:含有NO3﹣、SO32﹣、Cl﹣和NH4+,加盐酸,发生NO3﹣、SO32﹣氧化复原反生成NO和SO42﹣,以此来解答.解解:含有NO3﹣、SO32﹣、Cl﹣和NH4+,加盐酸,发生NO3﹣、SO32﹣氧化复原反生成NO和答:SO42﹣,那么SO32﹣、NO3﹣浓度减小,且加盐酸引入氯离子,那么Cl﹣增大,根本不变的为NH4+,应选D.点评:此题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反为解答的关键,侧重氧化复原反的离子共存考查,题目难度不大.7.〔3分〕〔2021秋•七里河区校级期末〕以下变化只需通过一步化合反就可以实现的是〔〕A.FeCl3→FeCl2B.Al2O3→Al〔OH〕3C.SiO2→H2SiO3D.S→SO3考点:硅和二氧化硅;铁盐和亚铁盐的相互转变.菁分析:根据物质的性质,分析该物质转化成另一指物质的反,结合化合反的概念判断解答.解答:解:化合反为多种物质反生成一种物质,A.氯化铁与铁反生成氯化亚铁,属于化合反,故A正确;B.Al2O3不溶于水,与水不能反生成Al〔OH〕3,Al2O3→Al〔OH〕3不能一步化合得到,故B错误;C.二氧化硅不溶于水,与水不反,SiO2→H2SiO3不能一步化合得到,故C错误;D.硫与氧气化合生成二氧化硫,S→SO3不能一步化合得到,故D错误;应选:A.点评:此题考查了元素化合物的相关知识,熟练掌握有关的化学反方程式是解题关键,题目难度不大.8.〔3分〕〔2021秋•七里河区校级期末〕化学反中,有时存在“一种物质过量,另一种物质仍不能完全反〞的特殊情况.以下反中属于这种情况的是〔〕①过量的锌与18mol•L﹣1的硫酸反②过量的氢气与少量氮气在一温度、压强和催化剂存在下充分反③加热条件下浓盐酸与过量的MnO2反④加热条件下过量铜与浓硫酸反⑤过量稀硫酸与块状石灰石反.A.②③④⑤B.②③④C.①③④D.①②③④⑤考点:浓硫酸的性质;化学反的可逆性.菁分析:从两个角度考虑,一是可逆反,二是物质的性质与浓度有关,例如某些酸在浓度较大时具有较强的氧化性或复原性,当浓溶液时可以发生反,但随着反的消耗,变成稀溶液往往就不具备继续反的性质.解答:解:①锌不管与浓硫酸还是稀硫酸都能反,一种物质过量时,另一种能完全反,故①错误;②合成氨是一个可逆反,无论如何充分反,都不能完全反而到达百分之百,故②正确;③浓盐酸反到最后变成稀盐酸了,无法完全反,浓盐酸中H+和Cl﹣的浓度大,复原性强,在加热条件下能被MnO2氧化,生成Cl2,随反进行,H+和Cl﹣的浓度逐渐减小,复原性逐渐减弱,当到达一程度时,MnO2就不可以氧化Cl﹣了,因此二氧化锰和稀盐酸不会反,故③正确;④随反进行浓硫酸变为稀硫酸,铜无法与稀硫酸反,无论铜怎么过量,都不能完全消耗完硫酸,故④正确;⑤稀硫酸与块状石灰石反生成微溶物硫酸钙,附着在碳酸钙外表阻止反的进一步发生,故⑤正确;应选A.点评:此题考查物质的性质,难度不大,注意化学反中的一些特殊情况,此题的可逆性和浓度问题.四、解答题〔共1小题,总分值0分〕9.〔2021秋•七里河区校级期末〕一量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol•L﹣1的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.10mol.〔1〕上述变化中涉及三个化学反,其中一个反为H2+Cl 22HCl,请写出另外两个反的离子方程式:H++OH﹣=H2O 、Cl2+2OH﹣=Cl﹣+ClO﹣+H2O .〔2〕参加反的氢气和氯气的物质的量之比n〔H2〕 n〔Cl2〕为1:3 .〔3〕工业制取漂白粉的原料是氯气和石灰乳,漂白粉的有效成分为Ca〔ClO〕2〔或次氯酸钙〕.考点:化学方程式的有关计算.菁分析:〔1〕氢气在氯气中燃烧生成氯化氢气体,盐酸可以和氢氧化钠之间发生反,氯气可以和强碱之间反生成氯化钠、次氯酸钠和水;〔2〕根据次氯酸钠的物质的量,计算反Cl2+2NaOH=NaCl+NaClO+H2O中氯气、氢氧化钠物质的量,进而计算与HCl反的NaOH,再根据H2+Cl22HCl计算该反中消耗氢气与氯气的物质的量;〔3〕漂白粉的有效成分是次氯酸钙.解答:解:〔1〕盐酸可以和氢氧化钠之间发生反,离子方程式为:H++OH﹣=H2O,氯气可以和强碱之间反生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,故答案为:H++OH﹣=H2O;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;〔2〕NaClO的物质的量为0.10mol,根据Cl2+2NaOH=NaCl+NaClO+H2O,可知消耗的氯气为0.1mol,消耗NaOH的物质的量为0.20mol,故与HCl反的NaOH为0. 1L×3mol/L﹣0.2mol=0.1mol,故HCl为0.1mol,由可知H2+Cl22HCl,该反中氢气为0.05mol,氯气为0.05mol,故氯气的总物质的量是0.15mol,参加反的n〔H2〕:n〔Cl2〕=0.05mol:0.15mol=1:3,故答案为:1:3;〔3〕漂白粉的成分为氯化钙、次氯酸钙,有效成分是次氯酸钙,故答案为:Ca〔ClO〕2〔或次氯酸钙〕.点评:此题考查混合物有关计算,难度不大,明确发生的反是关键,注意对根底知识的理解掌握.选做题10.〔2021秋•七里河区校级期末〕某研究性学习小组利用以下装置探究氯气与氨气之间的反.其中A、F分别为氨气和氯气的发生装置,C为纯洁枯燥的氯气与氨气反的装置.请答复以下问题:〔1〕为了快速制备氨气,装置A中烧瓶内的固体可以是③④〔填序号〕.①二氧化硅②过氧化钠③生石灰④氢氧化钠固体⑤氯化钙〔2〕请在B处虚线框内画上适宜的装置图并注明所装试剂名称.〔3〕装置F中发生反的离子方程式为:MnO2+4H++2Cl﹣Mn2++Cl2↑+2H2O .〔4〕装置D和E的位置不能〔填“能〞或“不能〞〕调换,装置E的作用是:除去氯气中混有的HCl .〔5〕通入C装置的两根导管左边较长、右边较短,目的是:使密度大的氯气与密度小的氨气能够快速且充分混合,反更迅速.〔6〕装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出发生反的化学方程式,并标出电子转移的方向和数目:.〔7〕从装置C的G处逸出的尾气可能含有污染环境的气体,如何处理?将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中.考点:氯气的室制法;氨的室制法.菁分析:〔1〕生石灰与水反生成氢氧化钙,同时放出大量的热;氢氧化钠溶于水放出大量的热,能够促进氨气的挥发;〔2〕氨气为碱性气体,选择碱性枯燥剂;〔3〕二氧化锰在加热条件下能够氧化盐酸生成氯化锰、氯气和水;〔4〕制取的氯气中含有氯化氢、水蒸气,要制取纯洁枯燥氯气,先除去氯化氢再除去水蒸气;氯气在饱和食盐水中溶解度不大,氯化氢易溶于饱和食盐水;〔5〕依据氯气与氨气的密度解答;〔6〕氨气和氯化氢气体反生成白烟氯化铵,根据元素守恒判断另一种物质;根据氮气和转移电子之间的关系式计算解答;〔7〕根据氯气的性质选取尾气处理试剂.解答:解:〔1〕浓氨水中存在平衡:NH4++OH﹣ NH3•H2O NH3+H2O,加热或者加热碱性物质能够促进平衡正向移动,有利于氨气的挥发,而生石灰与水反生成氢氧化钙,同时放出大量的热;氢氧化钠溶于水放出大量的热,氢氧化钙、氢氧化钠溶于水电离产生氢氧根离子,促进平衡向正方向移动,有利于氨气的挥发,应选:③④;〔2〕氨气为碱性气体,选择碱性枯燥剂,碱石灰为氢氧化钠和氧化钙的混合物,可以枯燥氨气,图为,故答案为:;〔3〕二氧化锰在加热条件下能够氧化盐酸生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl﹣Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl﹣Mn2++Cl2↑+2H2O;〔4〕要制取枯燥纯洁的氯气,先通过盛有饱和食盐水的洗气瓶除去氯化氢,然后通过浓硫酸除去水,假设颠倒顺序那么不能除去水蒸汽;故答案为:不能;除去氯气中混有的HCl;〔5〕氯气密度大于空气密度,氨气密度小于空气密度,所以为了使二者能够快速且充分混合,通入C装置的两根导管左边较长、右边较短;故答案为:使密度大的氯气与密度小的氨气能够快速且充分混合,反更迅速;〔6〕氨气和氯化氢气体反生成白烟氯化铵,另一生成物是空气的主要成分之一,根据元素守恒知,另一种物质是氮气,所以反方程式为:3Cl2+8NH3=N2+6NH4Cl,反中氯气中的0价的Cl→Cl﹣,氨气中+3价的N→NH4Cl,电子转移方向和数目为,故答案为:;〔7〕未反的氯气能和氢氧化钠溶液反生成氯化钠、次氯酸钠和水,所以尾气中的氯气可用氢氧化钠溶液吸收,故答案为:将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中.点评:此题为题,考查了氯气、氨气的制备和性质,熟悉气体制备原理是解题关键,题目难度中.。
苏教版高中化学必修一高一年级寒假作业 化学(1).doc

高中化学学习材料唐玲出品泗阳桃州中学高一年级寒假作业 化学(1)友情提醒:请将选择题答案填写在答题栏内,50分钟内完成本习题。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5一、选择题(每小题只有1个正确答案,各3分,共24分)1.下列物质属于容易导电的单质是 ( )A .熔融的NaClB .KNO 3溶液C .NaD .金刚石2.下列反应中属于氧化还原反应的是: ( )A .CO 2+H 2O==H 2CO 3B .H 2CO 3==CO 2+H 2OC .CaCO 3+2HCl==CaCl 2+H 2O+CO 2D .CO 2+C==2CO3.下列说法中错误的是 ( )A .置换反应一定是氧化还原反应B .化合反应不可能是氧化还原反应C .分解反应可能是氧化还原反应D .凡是氧化还原反应,都不可能是复分解反应4.容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式A ①③⑤B ③⑤⑥C ①②④D ②④⑥ ( )5.同温同压下,1mol Cl 2和36.5g HCl 气体的体积相比,前者和后者的大小关系是( )A 大于B 等于C 小于D 不能肯定6.等质量的①CH 4、②H 2、③HCl 、④SO 2,在标况下体积由大到小顺序是 ( )A ②>①>③>④B ④>③>①>②C ③>②>④>①D ①>④>②>③7.在一定温度和压强下,气体体积主要取决于 ( )A 气体分子间的平均距离B 气体分子微粒大小C 气体分子数目的多少D 气体分子式量的大小8.不能用胶体的知识解释的现象是 ( )A.牛油与氢氧化钠溶液共煮,向反应后所得的液体中加入食盐,会有固体析出B.一支钢笔使用两种不同牌号的蓝墨水,容易出现堵塞C.向氯化铁溶液中加入NaOH 溶液,会出现红褐色沉淀D .在河水与海水的交界处,易形成三角洲二、选择题(每小题有1或2个正确答案,各3分,共33分)9.a g 某气体中含有的分子数为b ,则c g 该气体在标准状况下的体积是 ( ) A a N bc A ⋅4.22L B c N ab A ⋅4.22L C b N acA ⋅4.22L D A acN b 4.22L10.今有0.1mol/L Na 2SO 4溶液300mL ,0.1mol/L MgSO 4溶液200mL 和0.1mol/L Al 2(SO 4)3溶液100mL ,这三种溶液中硫酸根离子浓度之比是 ( )A 1︰1︰1B 3︰2︰1C 3︰2︰3D 1︰1︰311.设N A 为阿佛加德罗常数,下列说法不正确的是 ( )A 标准状况下,22.4 L 氦气中含2N A 个氦原子B 18g 水中含有的电子数为10N AC 含有N A 个氢原子的H 2的物质的量为0.5molD 在1L2mol/L 的硝酸镁溶液中含有的硝酸根离子数为4N A12.将H 2、N 2、O 2三种气体分别放入不同容器中,使它们的温度、密度相同,则其压强(p )大小的关系,符合 ( )A p(H 2)>p(O 2)>p(N 2)B p(O 2)>P(N 2)>p(H 2)C p(H 2)>P(N 2)>p(O 2)D P(N 2)>p(O 2)>p(H 2)13.在无土栽培中需用浓度为0.5mol/L NH 4Cl 、0.16mol/L KCl 、0.24mol/L K 2SO 4的培养液,若用KCl 、NH 4Cl 和(NH 4)2SO 4三种物质来配制1.00L 上述营养液,所需三种盐的物质的量正确的是 ( )A 0.4mol 、0.5mol 、0.12molB 0.66mol 、0.5mol 、0.24molC 0.64mol 、0.5mol 、0.24molD 0.64mol 、0.02mol 、0.24mol14.VmL Al 2(SO 4)3溶液中含a g SO 42-,若把此溶液取一半加水稀释至2V mL ,则稀释后溶液中Al 3+的物质的量浓度为 ( ) A V a 576mol/L B V a 36125mol/L C V a 36250mol/L D V a72125mol/L 15.下列各组中,两种气体的分子数一定相等的是 ( )A 温度相同、体积相同的O 2和N 2B 体积相等、密度不等的N 2和C 2H 4C 体积相等、密度相等的CO 和C 2H 4D 压力相同、体积相同的N 2和O 216.已知一定条件下3O 2==2O 3下列说法正确的是 ( )A .只要有单质参加反应,则该反应是氧化还原反应B .有单质生成的反应,肯定是氧化还原反应C .有单质参加的化合反应肯定是氧化还原反应D .有单质生成的分解反应肯定是氧化还原反应17.下列说法正确的是 ( )A 、胶体区别于其它分散系的最本质特征是丁达尔现象B 、利用半透膜可以除去淀粉溶胶中的少量NaClC 、硅酸胶体带正电荷D 、加入电解质,胶体能发生凝聚18.为了除去粗盐中的 Ca 2+、Mg 2+、SO 42-及泥砂,可将粗盐溶于水,然后进行下列五项操作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一上学期寒假作业一
一、单选题
1.下列的分离方法不正确的是
A.用过滤的方法除去食盐水中的泥沙B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘D.用降温结晶的方法从溶液中获得KNO3
2.据报道“目前世界上近20亿人患有缺铁性贫血。
” 这里的“铁”是指
A.铁单质B.铁元素C.四氧化三铁D.三氧化二铁
3.下列物质在水溶液中的电离方程式正确的是
A.KHSO4=K++HSO4-B.Ba(OH)2= Ba2++ OH2-
C.KOH=K++O2-+H+D.KCl=K++Cl-
4.下列反应的离子方程式书写正确的是()
A.钠与冷水:Na+2H2O===Na++2OH-+H2↑
B.Al与稀HCl:2Al+6H+===2Al3++3H2↑
C.Fe与稀H2SO4:2Fe+6H+===2Fe3++3H2↑
D.Al与NaOH溶液:Al+OH-===AlO+H2↑
5.对电解质的叙述正确的是( )
A.在水溶液中能导电的物质B.熔融状态能导电的物质
C.不是电解质就是非电解质D.在水溶液中或熔融状态下能导电的化合物
6.金刚砂(SiC)可由SiO2和碳在一定条件下反应制得,反应方程式为SiO2+3C SiC+2CO↑,下列有关制造金刚砂的说法中正确的是
A.该反应中的氧化剂是SiO2,还原剂为C
B.该反应中的氧化产物和还原产物的物质的量之比为1∶2
C.该反应中转移的电子数为12e-
D.该反应中的还原产物是SiC、氧化产物是CO,其物质的量之比为1∶2
7.下列物质中既能导电,又属于电解质的一组物质是()
A.石墨、醋酸溶液、食盐晶体B.熔融状态的KOH、熔融状态的NaCl
C.稀H2SO4、NaOH溶液、纯HNO3D.液氨、石灰水、水银8.苹果汁是人们喜爱的饮料。
由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变化为棕黄色。
若榨汁时加入维生素C,可有效防止这种现象发生。
这说明维生素C具有()
A.氧化性B.还原性C.碱性D.酸性
9.已知强弱顺序:还原性I->Fe2+>Br->Cl-,氧化性Cl2>Br2>Fe3+>I2,下列反应的化学方程式或叙述不成立的是()
A.Br2+2HI=I2+2HBr B.2FeCl2+Cl2=2FeCl3
C.2FeCl2+2HCl+I2=2FeCl3+2HI D.Cl2通入NaBr和NaI的混合溶液中:I-先被氧化
10.下列物质中属于纯净物、化合物、盐、钙盐的是( )
A.石灰水B.Ca(OH)2C.CaCO3D.NH3
11.在反应3NO2+H2O===2HNO3+NO中,发生还原反应和发生氧化反应的物质质量之比为A.3∶1 B.1∶3
C.1∶2 D.2∶1
二、填空题
12.钠及其重要化合物之间的转化关系如下图所示,回答下列问题:
(1)少量的金属钠应保存在;
(2)Na2O2的颜色为;
(3)反应①的氧化剂是;
(4)Na2CO3溶液与BaCl2溶液反应产生白色沉淀,其中Na2CO3参加反应的离子是(填“Na+”或“CO32-”)。
(5)反应②的化学方程式为。
13.(1)5.4 g H2O的物质的量是________,含有__________________个水分子,含有________mol H。
(2)11.7 g NaCl的物质的量是________,含有________个Na+,________________个Cl-,共含离子________mol。
(3)6.02×1022个OH-的质量为________,含有质子的物质的量为________,含有电子的物质的量为________,这些OH-与________mol NH3的质量相同,和________g Na+含有的离子数相同。
14.KClO3和浓盐酸在一定温度下反应可表示为
____KClO3+____HCl(浓)=____KCl+____ClO2↑+____Cl2↑+____H2O
(1)请配平上述化学方程式。
(2)标出电子转移方向和数目
(3)氧化剂是,还原产物是。
(写化学式)
(4)浓盐酸在反应中显示出来的性质是________(填编号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(5)产生0.1molCl2,转移电子的物质的量为________mol。
15.铝是一种活泼的金属,在高温下能与Fe2O3反应生成Fe和Al2O3。
该反应中___________(填化学式)是还原剂,_____________(填化学式)氧化剂。
当2molFe2O3参加反应时,转移了____________ mol电子。
16.(10分)在实验室里,某同学取一小块金属钠做与水反应的实验。
试完成下列问题:
(1)切开的金属钠暴露在空气中,最先观察到的现象是,所发生反应的化学方程式是。
(2)将钠投入水中后,钠融化成一个小球,根据这一现象你能得出的结论是
①,②。
将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是
A.有气体生成B.钠融化成小球并在液面上游动
C.溶液底部有银白色的金属钙生成D.溶液变浑浊
(3)钠与水反应的离子方程式为。
在反应过程中,若生成标准状况下224mL的H2,则转移的电子的物质的量为。
(4)根据上述实验过程中钠所发生的有关变化,试说明将金属钠保存在煤油中的目的是。
17.除去括号内的杂质,写出除杂的试剂,并写出溶液中反应的离子方程式。
(1)FeSO4(CuSO4)试剂,离子方程式__________ ________。
(2)CO2 (HCl)试剂,离子方程式__________ __________。
(3)Cu(CuO)试剂,离子方程式_____________ __________。
18.欲用98%的浓硫酸(g=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线D.洗净所用仪器
E.稀释浓H2SO4F.将溶液转入容量瓶
其操作正确的顺序依次为______________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度__________(“偏高”、“偏低”、“无影响”)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若搅拌过程中有液体溅出结果会使浓度偏____________。
④在转入容量瓶前烧杯中液体应____________,否则会使浓度偏____________;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度____________。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度____________;仰视则使浓度___________。
