高考二轮复习阿伏伽德罗常数的计算练习题
高考化学二轮复习——阿伏伽德罗定律训练题

(3)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。
24.按要求完成下列填空:
(1)0.05mol的硫酸钠中含有___个氧原子。
(2)12.4gNa2X含有0.4molNa+,Na2X的摩尔质量为___,X的相对原子质量为____。
(3)1molHNO3的质量是___g,1molHNO3约含有___个原子。
(4)标准状况下11.2LHCl的物质的量是___mol。
16.下列说法不正确的是
A.英国科学家道尔顿提出原子学说,为近代化学的发展奠定了基础
B.电解质水溶液在通电的情况下才会自动地解离成离子
C.当光束通过氢氧化铁胶体时可以看到一条光亮的通路,是因为直径介于 之间的分散质粒子对光线散射形成的
D.在相同的温度和压强下,分子数相同的任何气体都具有相同的体积
17.同温同压下,等质量的SO2气体和SO3气体相比较,下列叙述中正确的是
8.下列有关等物质的量的 和 的比较中正确的是
①所含的分子数目之比为 ②所含的O原子数目之比为
③所含的原子总数目之比为 ④所含的C原子数目之比为
A.①②B.②③C.③④D.①②③④
9.同温同压下,等质量的氧气和二氧化碳相比较,下列叙述正确的是
A.体积之比为11∶8B.氧原子质量之比为8∶11
C.原子数目之比为2∶3D.气体密度之比1∶1
高三化学二轮复习专题——阿伏加德罗常数

B )。
题型分析
11
【解析】常温常压下,124 g P4的物质的量是1 mol,由于白磷是正四面 体结构,因此所含P—P键数目为6NA,A项错误;铁离子在溶液中发生水解 ,所以100 mL 1 mol·L-1FeCl3溶液中所含Fe3+的数目小于0.1NA,B项错误;1 mol甲烷或乙烯分子中均含有4 mol氢原子,标准状况下,11.2 L甲烷和乙 烯混合物的物质的量是0.5 mol,其中含氢原子数目为2NA,C项正确;反应 2SO2+O2 2SO3是可逆反应,因此密闭容器中,2 mol SO2和1 mol O2催化反 应后分子总数大于2NA,D项错误。
学生对物质世界的微观认识。
【真题示范】
B
题型分析
4
题型分析 5
4 L NH3的物质的量为1 mol,含有的电子数为10NA;B项,浓HNO3与铜生成NO2的反应为Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O,1 mol的 Cu完全反应转移2 mol电子,正确;C项,N不水解,1 L 0.
单一纯净物直接计算;因同位素而造
(√)
成 D2O的组摩成尔的质物量质不)分同别的计物算质(如H2O、
(√)
立志是事业的大门,工作是登门入室的旅程。
关键能力
16
并谁非不神 向仙前才看能,命角烧谁陶就题度器会,面有临志许的多人困总难可。以学得精手艺。 举例
强行者有志。
判断 正误
注意事项
三人鸟军生不可 志 展夺气翅帅立膀也,难,所高匹贵飞夫功。不业可昌夺。志①原也子28。数g乙为烯2N和A 环丁烷(C4H8)的混合气体中含有的碳
④1 mol Na与足量O2反应,转移的电子数为NA。
2020高考化学二轮专题精练专题2 阿伏加德罗常数含答案

2020高考化学二轮专题精练专题2阿伏加德罗常数1.(2019·衡中同卷综合一)设N A表示阿伏加德罗常数的值。
下列说法正确的是() A.1 L 0.1 mol·L-1的AlCl3溶液中所含离子总数为0.4N AB.标准状况下,22.4 L空气中所含原子的总数目为2N AC.向含有等物质的量的氯化铁和氯化铜的混合溶液中加入5.6 g铁粉,充分反应后,置换出铜原子的数目为0.1N AD.1 mol铜与足量浓硫酸反应,转移的电子数为2N A2.(2019·四川名校联考)N A为阿伏加德罗常数的值,下列说法正确的是()A.1 mol C2-2中含有的电子数为10N AB.0 ℃、101 kPa时,22.4 L SO3中含有的氧原子数目为3N AC.25 ℃时,向1 L 0.5 mol/L的CH3COONa溶液中加入醋酸溶液至混合溶液呈中性,则混合溶液中CH3COO-的数目为0.5N AD.将足量的Cu与50 mL 18 mol/L的浓硫酸充分反应,转移的电子数为0.9N A3.(2019·四川三市联考)N A代表阿伏加德罗常数的值。
下列说法正确的是()A.在6.0 g SiO2晶体中,含有的Si—O键数目为0.2N AB.完全燃烧乙酸、葡萄糖混合物6.0 g,消耗的O2数目为0.2N AC.在常温下,1 m3 pH=4的溶液中由水电离出的H+数目为0.1N AD.2.24 L Cl2完全与CH4发生取代反应,生成的HCl数目为0.1N A4.(2019·成都第一次诊断)N A代表阿伏加德罗常数的值。
下列判断正确的是() A.1 L pH=13的Ba(OH)2溶液中含OH-的数目为0.2N AB.46 g CH3CH2OH含C-H键数目为6N AC.4.6 g Na与含0.1 mol CH3COOH的稀醋酸完全反应,转移的电子数为0.1N AD.2.24 L CH4和0.5 mol Cl2充分反应所得混合物中氯原子数为N A5.(2019·成都石室中学模拟)N A代表阿伏加德罗常数的值。
阿伏加德罗常数【 答案+解析】

N2 充分反应,得到 NH3 的分子数小于 NA,D 项错误。
5.设 NA 为阿伏加德罗常数的值。下列说法错误的是( )
A.11.2 L 甲烷和乙烯的混合物中含氢原子数目等于 2NA B.含 NA 个 C 的 Na2CO3 溶液中,Na+数目大于 2NA
C.密闭容器中,2 mol SO2 和足量 O2 充分反应,产物的分子数小于 2NA
2.国际计量大会对摩尔的最新定义为“1 摩尔包含 6.022 140 76×1023 个基本单元,这 一常数称作阿伏加德罗常数(NA),单位为 mol-1。”下列叙述正确的是( ) A.标准状况下,22.4 L SO3 含有 NA 个分子 B.6.4 g CH4O 含有的 C—H 键为 0.6NA C.0.1 mol Na2O2 与 CO2 反应转移的电子数为 0.2NA
3..NA 为阿伏加德罗常数的值,下列叙述正确的是( )
A.18 g D2 O 中含有的质子数为 10NA
B.60 g 二氧化硅中含有的 Si—O 键数目为 4NA
C.密闭容器中,2 mol NO 与 1 mol O2 充分反应,产物的分子数为 2NA
D.标准状况下,22.4 L 氯气通入足量水中充分反应后转移电子数为 NA
D.4.0 g CO2 气体中含电子数目等于 2NA
A 解析 未指明气体在什么条件下,所以不能确定气体的物质的量及微粒数目,A 项错
误;Na2CO3 电离产生的 Na+、C 消耗,所以若溶液中含 NA 个 C
的个数比为 2∶1,在溶液中 C 由于发生水解反应而 ,则 Na+数目大于 2NA,B 项正确;SO2 与 O2 反应生成 SO3
D.常温常压下,4.6 g NO2 所含的氮原子数目为 0.1NA
高考化学《阿伏加德罗常数的应用》真题练习含答案

高考化学《阿伏加德罗常数的应用》真题练习含答案1.[2024·吉林卷]硫及其化合物部分转化关系如图。
设N A 为阿伏加德罗常数的值,下列说法正确的是( )A .标准状况下,11.2 L SO 2中原子总数为0.5N AB .100 mL 0.1 mol·L -1 Na 2SO 3溶液中,SO 2-3 数目为0.01N AC .反应①每消耗3.4 g H 2S ,生成物中硫原子数目为0.1N AD .反应②每生成1 mol 还原产物,转移电子数目为2N A答案:D解析:二氧化硫在标准状况下为气体,11.2 L 二氧化硫为0.5 mol ,其原子总数为1.5N A ,A 错误;亚硫酸根离子在溶液中会水解,故亚硫酸根离子数目小于0.01N A ,B 错误;反应①为2H2S +SO2===3S ↓+2H2O ,则3.4 g (0.1 mol )硫化氢反应生成的硫原子数目为0.15N A ,C 错误;反应②为3S +6OH -===2S2-+SO2-3+3H2O ,每3 mol S 发生反应转移4 mol 电子,其中2 mol S 被还原,则每生成1 mol 还原产物S2-,转移2 mol 电子,D 正确。
2.[2023·辽宁卷]我国古代四大发明之一黑火药的爆炸反应为:S +2KNO 3+3C===K 2S +N 2↑+3CO 2↑。
设N A 为阿伏加德罗常数的值,下列说法正确的是( )A .11.2 L CO 2含π键数目为N AB .每生成2.8 g N 2转移电子数目为N AC .0.1 mol KNO 3晶体中含离子数目为0.2N AD .1 L 0.1 mol·L -1 K 2S 溶液中含S 2-数目为0.1N A答案:C解析:1个CO 2分子含有2个π键,题中没有说是标况条件下,气体摩尔体积未知,无法计算π键个数,A 项错误;2.8 g N 2的物质的量n =m M =2.828mol =0.1 mol ,生成1 mol N 2转移的电子数为12N A ,则生成0.1 mol N 2转移的电子数为1.2N A ,B 项错误;KNO 3晶体含有的离子为K +、NO -3 ,0.1 mol KNO 3晶体中含离子数目为0.2N A ,C 项正确;S 2-水解使溶液中S 2-的数目小于0.1N A ,D 项错误;答案选C 。
高考化学二轮复习热考题型分级练三物质的量与阿伏加德罗常数含解析

高考化学二轮复习:热考题型分级练(三) 物质的量与阿伏加德罗常数(A级)1.设N A为阿伏加德罗常数的值,下列说法正确的是( )A.34 g H2O2中含有的阴离子数为1N AB.4.6 g乙醇中含有的C—H键的个数为0.6N AC.标准状况下,V L水含有的氧原子个数约为V22.4D.1 mol Fe2+与足量的H2O2溶液反应,转移N A个电子2.设N A为阿伏加德罗常数的值,下列说法正确的是( )A.2.24 L NH3与1.8 g H2O中所含的电子数均为N AB.1 mol N2与3 mol H2充分反应后,转移6N A个电子C.22 g N2O与CO2的混合气体中含有1.5N A个O原子D.11 g D182O中含有6N A个中子3.设N A为阿伏加德罗常数的值,下列说法正确的是( )A.1 mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为N AB.室温时,1.0 L 0.01 mol·L-1的CH3COONa溶液中含有CH3COO-的数目为0.01N A C.Fe与水蒸气反应生成22.4 L氢气,转移电子数为2N AD.14 g分子式为C3H6的链烃中含有的C—H键的数目为2N A4.N A代表阿伏加德罗常数的值。
下列说法正确的是( )A.在标准状况下,11.2 L CH2Cl2分子中含氯原子数目为N AB.14 g Li投入100 mL 1 mol·L-1盐酸中转移电子数目为0.1N AC.1 L 0.1 mol·L-1 H2S溶液中H+数目为0.2N AD.2.0 g含D2O和H182O的混合物中含中子数目为N A5.设N A为阿伏加德罗常数的值,下列说法正确的是( )A.0.1 mol 16OD-离子含有的电子、中子数均为1.0N AB.标准状况下,4.48 L己烷含有的分子数为0.2N AC.总质量为5.6 g的CaO和CaC2混合物中,所含离子总数小于0.2N AD.常温常压下,0.1 mol NH3与0.1 mol HCl充分反应后所得产物含0.1N A个分子6.用N A表示阿伏加德罗常数的值,下列叙述正确的是( )A.100 g质量分数是98%的浓硫酸中所含氧原子数为4N AB.标准状况下,33.6 mL氯气通入足量水中发生反应,转移电子数为1.5×10-3N AC.常温常压下,5.6 g乙烯与丁烯的混合物中含有的氢原子数目为0.8N AD.同温下,pH=1体积为1 L的硫酸溶液所含氢离子数与pH=13体积为1 L的氢氧化钠溶液所含氢氧根离子数均为0.1N A7.设N A表示阿伏加德罗常数值。
高考二轮复习:阿伏伽德罗常数的计算NA
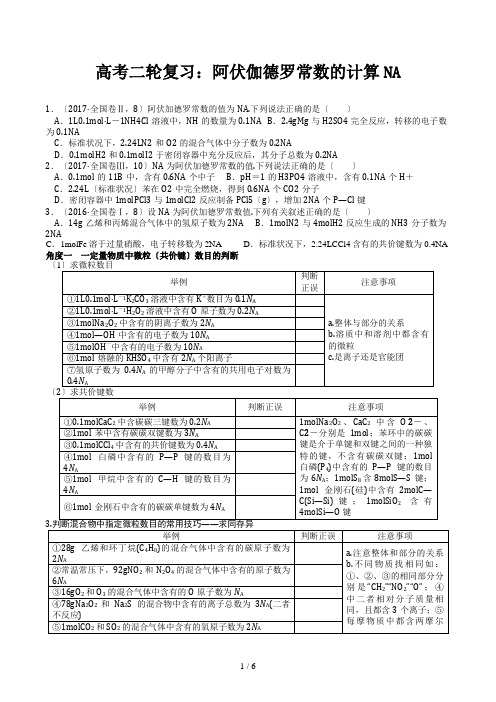
高考二轮复习:阿伏伽德罗常数的计算NA 1.〔2017·全国卷Ⅱ,8〕阿伏加德罗常数的值为NA.下列说法正确的是〔〕A.1L0.1mol·L-1NH4Cl溶液中,NH的数量为0.1NA B.2.4gMg与H2SO4完全反应,转移的电子数为0.1NAC.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NAD.0.1molH2和0.1molI2于密闭容器中充分反应后,其分子总数为0.2NA2.〔2017·全国卷Ⅲ,10〕NA为阿伏加德罗常数的值.下列说法正确的是〔〕A.0.1mol的11B中,含有0.6NA个中子 B.pH=1的H3PO4溶液中,含有0.1NA个H+C.2.24L〔标准状况〕苯在O2中完全燃烧,得到0.6NA个CO2分子D.密闭容器中1molPCl3与1molCl2反应制备PCl5〔g〕,增加2NA个P—Cl键3.〔2016·全国卷Ⅰ,8〕设NA为阿伏加德罗常数值.下列有关叙述正确的是〔〕A.14g乙烯和丙烯混合气体中的氢原子数为2NA B.1molN2与4molH2反应生成的NH3分子数为2NAC.1molFe溶于过量硝酸,电子转移数为2NA D.标准状况下,2.24LCCl4含有的共价键数为0.4NA 角度一一定量物质中微粒〔共价键〕数目的判断〔〔A.1mol的羟基与1mol的氢氧根离子所含电子数均为9NA B.12g石墨和C60的混合物中质子总数为6NAC.84gNaHCO3晶体中含有NA个CO D.标准状况下,0.1mol己烷中共价键数目为19NA 1.用NA表示阿伏加德罗常数的值,下列说法不正确的是〔〕A.1molF2和Ar所含质子数均为18NA B.标准状况下,2.24L甲烷和氨气的混合气,所含电子数是NAC.14gCnH2n中含有的碳原子数目为NA D.标准状况下,22.4L空气中含有NA个单质分子2.设NA为阿伏加德罗常数的值,下列叙述不正确的是〔〕A.20gD2O中所含的电子数为10NA B.60gSiO2晶体中含有Si—O键的数目为2NAC.0.2mol金属钠与足量的O2反应,产物中离子数为0.3NAD.1molOD-中含有的质子、中子数均为9NA3.设NA为阿伏加德罗常数的值,则下列说法不正确的是〔〕A.3.0g甲醛和甲酸甲酯的混合物中含有的原子数为4NA B.8.0gCu2S和CuO的混合物中含有铜原子数为0.1NAC.常温常压下,1.6gO2和O3的混合气体中所含电子数为0.8NAD.常温下,4.4gCO2和N2O混合物中含有的原子数为0.3NA4.设NA为阿伏加德罗常数的值.下列叙述正确的是〔〕A.100g含氢元素质量分数为12%的乙烯与乙醛的混合气体中氧原子数为NAB.0.1molCl2与过量稀NaOH溶液反应,转移电子的数目为0.2NAC.常温下,1L0.1mol·L-1Na2SO3溶液中SO的数目一定等于0.1NAD.标准状况下,22.4LCHCl3中含有氯原子数目为3NA512.例A.1molI-被氧化为I2时失去电子数为2NA B.2L0.5mol·L-1亚硫酸溶液中含有的H+的数目为2NAC.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NAD.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA1.用NA表示阿伏加德罗常数的值,下列说法正确的是〔〕A.密闭容器中46gNO2含有的分子数为NA B.1mol·L-1碳酸钠溶液中Na+的数目是2NA C.0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒D.VLamol·L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 2.用NA表示阿伏加德罗常数的值.下列有关叙述正确的是〔〕A.0.5molFe2+被足量的H2O2溶液氧化,转移0.5NA个电子B.用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023C.1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NAD.高温下,16.8gFe与足量水蒸气完全反应失去0.9NA个电子3.NA表示阿伏加德罗常数的值.下列说法正确的是〔〕A.一定条件下,1molN2和3molH2混合,反应转移的电子数目为6NAB.1.0L0.1mol·L-1Na2S溶液中含有的S2-数为0.1NAC.1molCu与含2molH2SO4的浓硫酸充分反应,生成的SO2的分子个数为NAD.向含有FeI2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子的数目至少为3NA4.〔2015·全国卷Ⅱ,10〕NA代表阿伏加德罗常数的值.下列叙述正确的是〔〕A.60g丙醇中存在的共价键总数为10NA B.1L0.1mol·L-1的NaHCO3溶液中HCO和CO离子数之和为0.1NAC.钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NAD.235g核素U发生裂变反应:U+nSr+Xe+10n,净产生的中子〔n〕数为10NA5.设NA为阿伏加德罗常数的值,下列说法正确的是〔〕A.34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NAB.反应3H2〔g〕+N2〔g〕2NH3〔g〕ΔH=-92kJ·mol-1,若放出热量4.6kJ,则转移电子的数目为0.3NAC.常温常压下,28g乙烯与丙烯的混合气体中含有的碳原子数目无法计算D.6.4gCu与40mL10mol·L-1浓硝酸作用生成NO2的分子数为0.2NA高考12题逐题特训A组1.设NA为阿伏加德罗常数的值,下列说法正确的是〔〕A.标准状况下,22.4L空气中O2、N2分子总数为NA B.0.1mol羟基中所含电子数为NAC.28g乙烯、丙烯混合气体中所含原子数为6NA D.5.6g铁与硝酸完全反应时转移的电子数为0.3NA 2.NA为阿伏加德罗常数的数值,下列说法正确的是〔〕A.常温常压下,28gN2所含电子数为10NA B.46g钠充分燃烧时转移电子数为2NAC.0.1mol·L-1NH4Cl溶液中Cl-数为0.1NA D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA3.NA为阿伏加德罗常数的值.下列说法正确的是〔〕A.标准状况下,11.2LH2与11.2LD2所含的质子数均为NA B.1L0.1mol·L-1FeCl3溶液中含Fe3+数目为0.1NAC.6.4gCu与3.2gS混合并隔绝空气加热充分反应,转移电子数为0.2NAD.0.1mol乙醇与0.1mol乙酸在浓硫酸催化并加热条件下充分反应,生成乙酸乙酯的分子数为0.1NA 4.设NA代表阿伏加德罗常数的值,下列说法正确的是〔〕A.22.4LCO和CO2的混合气体中所含的碳原子数一定是NA B.标准状况下,22.4L丙烷所含共用电子对数为8NAC.常温常压下,32gO2和32gO3所含氧原子数都是2NAD.常温下,1L0.1mol·L-1NH4NO3溶液中含有的NH数是0.1NA5.设NA为阿伏加德罗常数的值,下列叙述正确的是〔〕A.5.4gAl分别与含溶质0.2mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NAB.5.35gNH4Cl固体中含有的N—H键个数为0.4NAC.将含有1molFeCl3的浓溶液全部制成胶体,含Fe〔OH〕3胶粒的数目为NAD.120g熔融的NaHSO4中含阳离子总数为2NA6.设NA为阿伏加德罗常数的值,下列叙述正确的是〔〕A.用石墨作电极电解饱和食盐水时,若阴极得到2NA个电子,则阳极产生22.4L气体B.2L0.05mol·L-1乙酸溶液中H+数目为0.1NA C.等物质的量的Na2O和Na2O2中含有的阴离子总数不同D.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA7.用NA表示阿伏加德罗常数的值,下列说法正确的是〔〕A.0.1mol环丙烷中含有共价键的数目为NA B.0.1molCl2全部溶于水后转移电子的数目为0.1NA C.标准状况下,2.24LSO3中含有氧原子的数目为0.3NAD.9.2g由乙醇和二甲醚〔CH3OCH3〕组成的混合物中含有氧原子的数目为0.2NA8.设NA表示阿伏加德罗常数的值,下列关于7.8g过氧化钠固体的说法正确的是〔〕A.其中所含电子总数为0.4NA B.其中所含离子总数为0.4NAC.与足量的H2O反应,生成O2分子数为0.1NA D.与足量的CO2反应,转移电子数为0.1NA 9.用NA表示阿伏加德罗常数的值.下列叙述正确的是〔〕A.常温、常压下,92g的NO2和N2O4混合气体中含有的原子数为6NAB .用惰性电极电解食盐水,若电路中通过NA 个电子,则阳极产生气体11.2LC .0.25molNa2O2中含有的阴离子数为0.5NAD .在反应KIO3+6HI===KI +3I2+3H2O 中,每生成3molI2转移的电子数为6NAB 组1.设NA 为阿伏加德罗常数的值,下列说法正确的是〔 〕A .标准状况下,1LC2H5OH 完全燃烧后生成的CO2分子个数为NA 11.2B .将1molCO2通入水中,HCO 、CO 粒子数之和为NAC .含3.0gHCHO 的水溶液中原子总数为0.4NAD .3.4gNH3中共用电子对数为0.6NA2.用NA 表示阿伏加德罗常数的数值.下列叙述正确的是〔 〕A .常温常压下,22.4L 乙烯中含C —H 键的数目为4NAB .4.2g 由丙烯〔C3H6〕和环丙烷〔C3H6〕组成的混合气体中碳原子数为0.3NAC .含4.9gH2SO4与4.9gH3PO4的混合溶液中氧原子数为0.4NAD .25℃时,Ksp 〔BaSO4〕=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA3.设NA 为阿伏加德罗常数的值,下列说法正确的是〔 〕A .1molFe 〔NO3〕3与足量HI 溶液反应时转移的电子数为3NAB .将1molCl2通入水中,HClO 、Cl -、ClO -粒子数之和为2NAC .分子数目为0.1NA 的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NAD .将CO2通过Na2O2使其增重ag 时,反应中转移电子数为aNA 144.某学习小组需0.1000mol·L -1的Na2CO3溶液450mL.下列有关配制时的说法正确的是〔 〕A .称量前应将Na2CO3·xH2O 灼烧至恒重B .配制时需用托盘天平称取4.8g 无水Na2CO3C .100.00mL 上述溶液含离子总数为0.03NAD .配制好的Na2CO3溶液应转移到带玻璃塞的试剂瓶中5.设NA 为阿伏加德罗常数值,下列说法正确的是〔 〕A .1molFe 与过量稀HNO3反应,电子转移数为2NAB .120g 由NaHSO4和KHSO3组成的混合物含硫原子数为NAC .标准状况下,22.4LCH2Cl2含氯原子数为2NAD .0.3mol·L -1Al 〔NO3〕3溶液中含Al3+数小于0.3NA6.常温常压下,某烧碱溶液与0.05mol 氯气恰好完全反应,得到pH =9的混合溶液〔溶质为NaCl 与NaClO 〕.下列说法正确的是〔NA 代表阿伏加德罗常数的值〕〔 〕A .氯气的体积为1.12LB .原烧碱溶液中含溶质离子数为0.2NAC .所得溶液中含OH -的数目为1×10-5NAD .所得溶液中ClO -的数目为0.05NA7.设NA 是阿伏加德罗常数的值,下列说法正确的是〔 〕A .某温度下纯水的pH =6,该温度下10LpH =11的NaOH 溶液中含OH -的数目为NAB .1molCl2与足量的铁反应转移的电子数与1mol 铁与足量的Cl2反应转移的电子数相等C .在标准状况下,11.2LNO 与11.2LO2混合后所含分子数为0.75NAD .0.5mol ·L -1Na2SO4溶液中含有的阴、阳离子总数为1.5NA8.NA 代表阿伏加德罗常数的值.下列有关说法正确的是〔 〕A .工业上炼银时,若转移2mol 电子,则产生O2的分子数为NAB .乙醇催化氧化生成44g 乙醛时转移电子数为NAC .在标准状况下,11.2LH2和D2的混合气体中含质子数为NAD .1molN2和5molH2在一定条件下反应生成NH3的数目为2NA9.设NA 表示阿伏加德罗常数的值.下列说法正确的是〔 〕A .向含有FeBr2的溶液中通入适量氯气,当有1 mol Fe2+被氧化时,该反应转移电子数目为3NAB .40gCuO 和Cu2S 混合物中所含铜原子的数目不等于0.5NAC .含0.1molNH4HSO4的溶液中,阳离子数目略小于0.2NAD .C3H8分子中的2个H 原子分别被1个—NH2和1个—OH 取代,1mol 此有机物所含共用电子对数目为13NA二轮专题复习 NA高考真题DAA角度一〔1〕 5√〔2〕3.5√〔3〕6×例1B1-5DBAAC角度二阿伏加德罗常数的综合考查1.全× 2.全×例2C1-5DADCB高考12题逐题特训A组1-5 CBACB 6-9DDDA B组1-5DBCAB 6-9BACD。
2022届高三高考化学二轮复习知识点突破训练 阿伏伽德罗常数应用练习题(一)

2022届高三高考化学二轮复习知识点突破训练 阿伏伽德罗常数应用练习题(一)-原卷一、单选题(共15题)1.A N 为阿伏加德罗常数的值,下列叙述正确的是( )A.常温下,含A N 个3Al +的()33Al NO 溶液中3NO -的数目大于3A NB.标准状况下,22.4L 氖气含有的质子数为20A NC.1mol 链式葡萄糖分子结构中含有的—OH 数为6A ND.在322KClO 6HCl()KCl 3Cl 3H O ++↑+浓反应中,若有21.3g 氯气生成,转移电子的数目为0.6A N2.A N 为阿伏加德罗常数的值,则下列叙述正确的是( ) A.1 mol中位于同一平面的原子数目最多为14 A NB.巯基(-SH )的电子式为C.24N H 的结构式:D.常温下,1L 0.2mol/L 3AlCl 溶液中含3Al +数为0.2A N 3.工业上常用“碳氯法”制备2MgCl ,原理为22ΔMgO+C+Cl MgCl +CO 。
A N 代表阿伏加德罗常数的值,下列叙述错误的是( ) A.反应中断裂1molCl Cl -键,转移的电子数为2A N B.反应中消耗6gC ,生成CO 的体积为11.2L (标准状况) C.密度、体积均相同的2Cl 和CO ,CO 的分子数更多 D.将2MgCl 溶于水配成120.1mol LMgCl -⋅溶液,阴离子总数大于0.2A N4.设A N 为阿伏加德罗常数的值,下列说法正确的是( ) A.2.0gHF 的水(182H O )溶液中,含有的电子总数为A NB.0.5mol 六六六(分子结构:)中的共价键数目为6A NC.电解精炼铜,阳极质量减小64g ,过程中转移电子总数为2A ND.1L 总酸含量为4.5g/100mL 的食醋中()()-33A N CH COOH +N CH COO =0.75N 5.已知A N 是阿伏加德罗常数的值,下列说法正确的是( ) A.1mol 氮气与3mol 氢气反应,生成的氨分子数目为2A N B.14g 聚乙烯与聚丙烯的混合物,含C-H 键的数目为2A N C.电解饱和食盐水,当阳极产生11.2L 2H 时,转移的电子数为A N D.常温下,133L0.1mol L FeCl -⋅溶液所含3Fe +数目为0.3A N 6.设A N 为阿伏加德罗常数的值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阿伏伽德罗常数分类练习
类型一:气体摩尔体积的适用条件及物质的聚集状态
判断正误(正确的打“√”,错误的打“×”)。
(1)2.24 L CO2中含有的原子数为0.3N A。
()
(2)常温下,11.2 L甲烷气体含有的甲烷分子数为0.5N A。
()
(3)标准状况下,2.24 L氨水含有NH3分子数为0.1N A。
()
(4)标准状况下,22.4 L SO3中含有SO3分子数为N A。
()
(5)标准状况下,22.4 L氧气、氮气和CO的混合气体中含有2N A个原子。
()
答案:(1)×(2)×(3)×(4)×(5)√
类型二物质的量或质量与状况
判断正误(正确的打“√”,错误的打“×”)。
(1)常温常压下,3.2 g O2所含的原子数为0.2N A。
()
(2)标准状况下,18 g H2O所含的氧原子数目为N A。
()
(3)室温下,1 mol CH4中含有5N A原子。
()
(4)常温常压下,1 mol CO2与SO2的混合气体中含氧原子数为2N A。
()
答案:(1)√(2)√(3)√(4)√
类型三物质的组成与结构
判断正误(正确的打“√”,错误的打“×”)。
(1)17 g —OH与17 g OH-所含电子数均为10N A。
()
(2)30 g SiO2中含有硅氧键个数为N A。
()
(3)32 g甲醇中所含共价键数目为5N A。
()
(4)常温常压下,32 g O2和O3的混合气体中含有的原子数为2N A。
()
(5)56 g乙烯中所含共用电子对数目为12N A。
()
(6)78 g苯中含有3N A碳碳双键。
()
(7)60 ℃时,92 g NO2与N2O4的混合气体中含有的原子总数为6N A。
()
答案:(1)×(2)×(3)√(4)√(5)√(6)×(7)√
类型四电解质溶液中粒子数目的判断
判断正误(正确的打“√”,错误的打“×”)。
(1)0.1 L 3.0 mol·L-1的NH4NO3溶液中含有的N原子数目为0.6N A。
()
(2)等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2N A。
()
(3)0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2N A。
()
(4)25 ℃时,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1N A。
()
(5)1 L 0.1 mol·L-1的Na2CO3溶液中所含氧原子数目为0.3N A。
()
答案:(1)√(2)×(3)×(4)√(5)×
类型五物质转化中的“隐含反应”
判断正误(正确的打“√”,错误的打“×”)。
(1)50 mL 12 mol·L-1的盐酸与足量MnO2共热,转移的电子数为0.3N A。
()
(2)常温下,56 g铁片投入足量浓H2SO4中生成N A个SO2分子。
()
(3)一定条件下合成氨反应,用1.5 mol H2和0.5 mol N2充分反应后,可得到NH3分子数为N A。
()
(4)1 L 0.01 mol·L-1 的KAl(SO4)2溶液中含有的阳离子数大于0.02N A。
()
解析:(1)随着反应的进行,浓盐酸变为稀盐酸,反应停止。
(2)常温下,铁遇浓硫酸钝化。
(3)合成氨反应为可逆反应,不可能完全反应。
(4)一个铝离子水解,产生三个氢离子(阳离子)。
答案:(1)×(2)×(3)×(4)√
类型六氧化还原反应中电子转移数目的判断
判断正误(正确的打“√”,错误的打“×”)。
(1)5.6 g铁粉与硝酸反应失去的电子数一定为0.3N A。
()
(2)0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,转移的电子数目为0.2N A。
()
(3)1 mol Na2O2与足量CO2充分反应转移的电子数为2N A。
()
(4)向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为N A。
()
(5)1 mol Cl2参加反应转移电子数一定为2N A。
()
解析:(1)当铁粉过量时生成Fe2+。
(2)盐酸不足,Zn不能完全反应。
(3)该反应为Na2O2中-1价的氧元素的歧化反应,1 mol Na2O2反应转移1 mol电子。
(4)I-的还原性比Fe2+强,Cl2首先氧化I-。
(5)氯气与水、碱反应时既是氧化剂又是还原剂。
答案:(1)×(2)×(3)×(4)×(5)×。
