常见晶体模型教程文件
(完整版)常见晶胞模型

氯化钠晶体离子晶体(1)NaCI晶胞中每个Na+等距离且最近的Cl-(即Na+配位数)为6个(2)(3)NaCI晶胞中每个CI-等距离且最近的Na+(即CI-配位数)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4个; 占有的CI-4个。
在该晶体中每个Na+周围与之最接近且距离相等的Na+ 与每个Na+等距离且最近的CI-所围成的空间几何构型为CsCI晶体(注意:右侧小立方体为CsCI晶胞;左侧为8个晶胞)(1)CsCI晶胞中每个Cs+等距离且最近的C「(即Cs+配位数)为8个CsCI晶胞中每个CI-等距离且最近的Cs+(即CI-配位数)为8个,这几个Cs+在空间构成的几何构型为正方体。
(2)在每个Cs+周围与它最近的且距离相等的Cs+有6个这几个Cs+在空间构成的几何构型为正八面体。
• Cs* OCI- (3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的CI- 1个CaF2晶体(1))Ca2+立方最密堆积,F-填充在全部四面体空隙中。
(2)CaF2晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数)为8个CaF2晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个(3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个;占有的F-8个。
ZnS晶体:(1)1个ZnS晶胞中,有4 个S2「,有4个Zn2+(2)Zn2+的配位数为4个, S2_的配位数为4个O£n?,•原子晶体(1) 金刚石晶体a 每个金刚石晶胞中含有 8个碳原子,最小的碳环为 6元环,并且不在同一平面(实际为椅 式结构),碳原子为sp 3杂化,每个C 以共价键跟相邻的_4_个 C 结合,形成正四面体。
键角109° 28'b 、 每个碳原子被12个六元环共用,每个共价键被6个六元环共用c 、 12g 金刚石中有2mol 共价键,碳原子与共价键之比为 (2) Si 晶体由于Si 与碳同主族,晶体Si 的结构同金刚石的结构。
常见晶体模型与晶胞计算 Word版含解析

常见晶体模型与晶胞计算1.典型晶体模型晶体晶体结构晶体详解原子晶体金刚石(1)每个碳与相邻4个碳以共价键结合,形成正四面体结构(2)键角均为109°28′(3)最小碳环由6个C 组成且六原子不在同一平面内(4)每个C 参与4条C —C 键的形成,C 原子数与C —C 键数之比为1∶2SiO 2(1)每个Si 与4个O 以共价键结合,形成正四面体结构(2)每个正四面体占有1个Si,4个“12O”,n (Si)∶n (O)=1∶2(3)最小环上有12个原子,即6个O,6个Si分子晶体干冰(1)8个CO 2分子构成立方体且在6个面心又各占据1个CO 2分子(2)每个CO 2分子周围等距且紧邻的CO 2分子有12个离子晶体NaCl 型(1)每个Na +(Cl -)周围等距且紧邻的Cl -(Na +)有6个,每个Na +周围等距且紧邻的Na +有12个(2)每个晶胞中含4个Na +和4个Cl -CsCl 型(1)每个Cs+周围等距且紧邻的Cl -有8个,每个Cs +(Cl-)周围等距且紧邻的Cs+(Cl-)有6个(2)如图为8个晶胞,每个晶胞中含1个Cs+、1个Cl-金属晶体简单立方堆积典型代表Po ,配位数为6,空间利用率52%面心立方最密堆积又称为A 1型或铜型,典型代表Cu 、Ag 、Au ,配位数为12,空间利用率74%体心立方堆积又称为A 2型或钾型,典型代表Na 、K 、Fe ,配位数为8,空间利用率68%六方最密堆积又称为A3型或镁型,典型代表Mg 、Zn 、Ti ,配位数为12,空间利用率74%2.晶胞中微粒的计算方法——均摊法【重难点指数】★★★【重难点考向一】常见晶胞类型和结构特点【典型例题1】(1)【2015·高考全国卷Ⅰ,37(5)】碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:石墨烯晶体金刚石晶体①在石墨烯晶体中,每个C原子连接________个六元环,每个六元环占有________个C原子。
高三化学课件常见的晶胞模型

(4)设金属原子的摩尔质量为M g/mol,
则晶胞密度ρ为
体心六方晶胞
g/cm3
/
n
m
ρ=
=
−7 3 =
−
(×10 )
(×10 7)3
Hale Waihona Puke 2×10213=
g/cm
3
二、金属晶体
3、面心立方最密堆积(A 1 型或铜型)
典型代表 Ca Al Cu Ag Au Pd Pt
(4)金属镁形成的晶体中,每个镁原子周围与其距离最近的原子有6个。(×)
三、分子晶体
1、干冰(CO 2 )
2、冰(H 2 O)
3、碘晶体
(1)每个水分子最多与相邻的4个水分子,以氢键相连接
(2)含1 mol H2O的冰中,最多可形成2 mol“氢键”
碘晶体晶胞(长方体)
(3)1 mol液态水中氢键数小于2NA
四、离子晶体
1、氯化钠(型)
(1)每个晶胞中含4个Na+和4个Cl-
(2)每个Na+(Cl-)周围等距且紧邻的Cl-(Na+)有6个
每个Na+周围等距且紧邻的Na+有12个
ClNa+
在氯化钠晶胞中,
与每个Na+等距离且最近的几个Cl-所围成的空间几何构型为 正八面体
四、离子晶体
2、氯化铯(型)
则a=2r
简单六方晶胞
V球=
4
3
πr3 V晶胞=a3
空间利用率=V球/V晶胞×100%=52%
二、金属晶体
2、体心六方堆积(A 2 型或钾型)
典型代表 Li Na K Ba W Fe
(1)晶胞内含原子个数为 2
(2)配位数为 8
常见晶体模型及晶胞计算

常见晶体模型及晶胞计算晶体是由晶体胞重复堆积而成的,晶体胞是晶体的最小构造单元。
晶体的结构可以用晶胞参数表示,晶胞参数包括晶格常数、晶胞的角度、晶胞的体积等。
根据晶体的晶胞参数,可以推导出晶胞的几何形状和晶体的晶体类别。
根据晶体的晶胞形状,晶体可以分为立方晶系、四方晶系、六方晶系、正交晶系、单斜晶系和三斜晶系。
每个晶系又可以进一步分为各种晶体类别,如立方晶系下又有体心立方晶体和面心立方晶体等。
晶体模型描述了晶体的结构和排列方式。
常见的晶体模型有球模型、格点模型和球与棍模型。
1.球模型:球模型是一种简化的晶体表示方法,将晶体中的原子用球体表示,球的大小和颜色常用来表示原子的种类和其它信息。
2.格点模型:格点模型是用晶体胞中的原子位置来表示晶体结构的一种方法,晶体胞中的每个原子位置称为格点。
在格点模型中,晶体中的每个原子都用一个点来表示,这样形成了一个点阵,点阵反映了原子的排列方式。
常见的格点模型有立方格点模型、面心立方格点模型和体心立方格点模型。
3.球与棍模型:球与棍模型是一种结合了球模型和格点模型的晶体表示方法。
在球与棍模型中,每个原子用一个球来表示,不同原子之间用直线连接表示键的形成。
在进行晶胞计算时,需要确定晶体的晶胞参数。
晶胞参数可以通过实验测量得到,也可以通过计算方法获得。
晶胞计算主要包括以下几个步骤:1.实验测量:通过实验手段,如X射线衍射、电子衍射等,测量晶体的晶胞参数。
2.计算方法:根据晶体的晶胞参数和晶体的晶格类型,可以使用计算方法来预测和计算晶体的晶胞参数。
常见的计算方法有密度泛函理论(DFT)和分子力场(MM)等。
3.晶胞优化:通过晶胞优化算法,寻找晶体的最稳定结构。
晶胞优化算法可以通过改变晶胞参数、原子位置或局部结构等来寻找最低能量的晶体结构。
4.校正和验证:使用计算得到的晶胞参数进行校正和验证,与实验结果进行比较,确保计算结果的准确性和可靠性。
总之,晶体模型和晶胞计算是研究和描述晶体结构的重要工具。
(完整)MS晶体建模基本方法

MS晶体建模基本方法星期三, 2008-11-19 09:09 - Elizerbeth软件名称:Materials Studio第一种情况: 从程序自带的各种晶体及有机模型中导入体系的晶胞1.打开MS,由file〉import>structures>metals\〉pure—metals〉Fe导入Fe 的晶胞。
2.由build〉Surfaces〉cleave Surfaces打开对话框。
在对话框中输入要建立的晶面(hkl),选择position,其中depth控制晶面层数。
3.进入build〉Supercell,输入A 、B 、C的值,得到想要的超晶胞。
4.到该步骤,我们已经建立了一个周期性的超晶胞。
如果要做周期性计算,则应选择build>Crystals〉build vaccum slab,其中真空层通常选择10埃以上。
如果建立团簇模型则选择build〉Symmetry〉Non-periodic Structure,去掉模型的周期性,并跟据自己的实际需要删除部分原子,得到想要的团簇模型.5.在表面插入分子时通过菜单栏上的几个小图标添加即可.第二种情况: 手动建模,优点是可控制晶格常数。
6.首先从文献中查到晶体的晶格常数的实验值。
7.打开build>Crystals〉build crystals,可见到对话框。
在对话框中选择空间群与点群,然后在Lattice Parameter中设置晶胞基矢的长度及夹角。
8.然后打开build>Add atom,从对话框中输入坐标。
这里只需输入几个有代表性的原子的坐标,不必全部输入。
在坐标输入前首先在option页面中选择coordinate system,或者分数坐标或者卡迪尔坐标.9.以下步骤重复2-5步。
10.需要注意的是,采取什么样的团簇并不是任意的.原因是很多模型构造出来后在优化过程中往往不收敛。
要避免这个问题的办法是查阅文献,参考文献上模型进行选取,因为它们的模型通常是经过试验证实收敛的。
(完整版)常见晶胞模型.docx

离子晶体氯化钠晶体(1) NaCl 晶胞中每个 Na+等距离且最近的 Cl-(即 Na+配位数)为 6 个NaCl 晶胞中每个 Cl-等距离且最近的 Na+(即 Cl-配位数)为 6 个(2)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4_个;占有的 Cl-4 个。
(3)在该晶体中每个 Na+周围与之最接近且距离相等的 Na+共有 12 个;与每个 Na+等距离且最近的 Cl -所围成的空间几何构型为正八面体CsCl 晶体(注意:右侧小立方体为CsCl 晶胞;左侧为8 个晶胞)(1)+等距离且最近的-+配位数)CsCl 晶胞中每个 Cs Cl(即 Cs为 8个CsCl 晶胞中每个 Cl-等距离且最近的Cs+(即 Cl -配位数)为 8 个,这几个 Cs+在空间构成的几何构型为正方体++(2)在每个 Cs 周围与它最近的且距离相等的Cs 有。
6 个这几个 Cs+在空间构成的几何构型为正八面体(3)一个晶胞内由均摊法计算出一个晶胞内占有的。
Cs+ 1 个;占有的Cl- 1 个。
CaF2晶体(1)) Ca2+立方最密堆积, F-填充在全部四面体空隙中。
(2) CaF2晶胞中每个 Ca2+等距离且最近的 F-(即 Ca2+配位数)为 8 个CaF2晶胞中每个 F-等距离且最近的 Ca2+(即 F-配位数)为 4 个( 3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4 个;占有的 F-8 个。
ZnS晶体:(1)1 个 ZnS晶胞中,有 4 个 S2-,有 4 个 Zn2+。
(2)Zn2+的配位数为 4 个, S2-的配位数为 4 个。
原子晶体金刚石金刚石晶胞金刚石晶胞分位置注释( 1)金刚石晶体a、每个金刚石晶胞中含有8 个碳原子,最小的碳环为 6 元环,并且不在同一平面(实际为椅式结构),碳原子为 sp3杂化,每个 C 以共价键跟相邻的 _4_个 C 结合,形成正四面体。
键角109° 28’b、每个碳原子被 12 个六元环共用,每个共价键被 6 个六元环共用c、12g 金刚石中有 2mol 共价键,碳原子与共价键之比为1:2(2) Si 晶体由于 Si 与碳同主族,晶体Si 的结构同金刚石的结构。
2022届高考化学大一轮复习教师用书:选修3 第3节 考点3 几种常见的晶体 Word版含解析
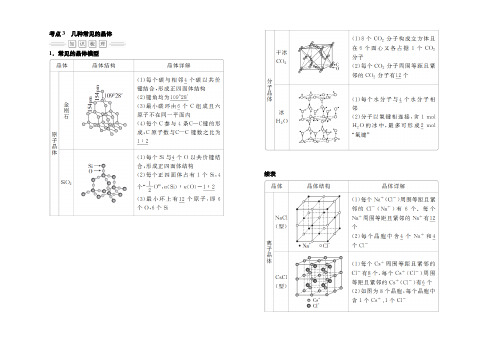
考点3几种常见的晶体1.常见的晶体模型续表2.石墨晶体石墨晶体是混合型晶体,呈层状结构。
同层内碳原子以共价键形成正六边形平面网状结构,平均每个正六边形拥有的碳原子个数是2,C 原子实行的杂化方式是sp2。
层与层之间以分子间作用力结合。
所以石墨晶体熔、沸点很高,但硬度不大,有滑腻感,能导电。
易错警示推断某种粒子四周等距且紧邻的粒子数目时,要留意运用三维想象法。
如NaCl 晶体中,Na +四周的Na +数目(Na +用“”表示):每个面上有4个,共计12个。
推断正误,正确的画“√”,错误的画“×”。
(1)1 mol 金刚石和SiO 2中含有的共价键数目均为4N A 。
(×)(2)金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子。
(√)(3)氯化钠晶体中,每个Na +四周距离相等且最近的Na +共有6个。
(×) (4)冰中包含的作用力有范德华力、氢键和共价键。
(√)(5)金属晶体能导电是由于金属晶体在外加电场作用下可失去电子。
(×)题组一 依据晶胞结构推断晶体类型 1.下图为几种晶体或晶胞的示意图:请回答下列问题:(1)上述晶体中,粒子之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的挨次为____________________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体,缘由是_________________________________________________________________________________。
(4)每个Cu晶胞中实际占有________个铜原子,CaCl2晶体中Ca2+的配位数为________。
答案(1)金刚石晶体(2)金刚石、MgO、CaCl2、冰、干冰(3)小于MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-)(4)4 8解析(1)冰晶体、干冰晶体均为分子晶体,粒子间通过分子间作用力结合成晶体,Cu晶体中微粒间通过金属键结合形成晶体,MgO和CaCl2晶体中微粒之间通过离子键结合形成晶体。
常见晶体模型及晶胞计算PPT课件

) = 1︰1 ,化学为 CsCl
。
思考:NaCl、CsCl同属AB型离子晶体, NaCl晶体中 Na+的配位数与CsCl晶体中Cs+的配位数是否相等?
第6页/共32页
CaF2的晶体结构
(1)每个Ca2+周围等距且紧邻的F-有 Ca2+配位数为 。
8
8
(2)每个F-周围等距且紧邻的Ca2+有 个, F-配位数为 。
堆积模型
采纳这种堆积 的典型代表
空间利用率
配位数
简单立方
Po(钋)
52%
6
体心立方 (钾型)
K、Na、Fe
68%
8
六方最密 (镁型)
Mg、Zn、Ti
74%
12
面心立方最密 (铜型)
Cu, Ag, Au
74%
12
第27页/共32页
晶胞
原子晶体
金刚石
该晶胞实际分摊到的碳原子数为 (4 + 6 ×1/2 + 8 ×1/8) = 8个。
第28页/共32页
小结:高考常见题型 (一) 晶胞中微粒个数的计算, 求化学式
(二) 确定配位数
(三) 晶体的密度及微粒间距离 的计算
第29页/共32页
练习
1、(2013·江苏,21A(1)) 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数 为2。元素Y基态原子的3p 轨道上有4个电子。
每个晶胞含 4 个原子
第18页/共32页
铜型
12
6
3
54
12
6
3
54
12
6
3
54
第三层的另一种排列方式,是将球 对准第一层的 2,4,6 位,不同于 AB 两层的位置,这是 C 层。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子晶体
观察后回答题:
1、二氧化碳分 子处于立方体 的什么位置?
顶点和面心
2、一个立方体 中含有多少个 二氧化碳分子?
二氧化碳晶体—面心立方体
8×1/8+6×1/2 = 4
代表一个 二氧化碳分子
结论:绝大多数 分子晶体为面心 立方体
碘晶体结构
面心 Cu, Ag, Au 74% 12 (铜型)
晶胞
确定化学式
A2B
AB
A2BC2
ABC
防止类推中的失误
题目:最近科学家发现一种由钛原子和碳原子构成的 气态团簇分子,如右图所示。顶角和面心的原于是钛 原子,棱的中心和体心的原子是碳原子,则它的分子 式是 ( D )
A.TiC B.Ti4C4, C.Ti14C13 D.Ti13C14
金属晶体的原子堆积模型
(1)几个概念 紧密堆积:微粒之间的作用力使微粒间尽
可能的相互接近,使它们占有最小的空间
配位数:在晶体中与每个微粒紧密相邻的 微粒个数
空间利用率:晶体的空间被微粒占满的体积 百分数,用它来表示紧密堆积的程度
(2)金属晶体的原子在二维平面堆积模型 金属晶体中的原子可看成直径相等的
小球。将等径圆球在一平面上排列,有两 种排布方式,按(b)图方式排列,圆球 周围剩余空隙最小,称为密置层;按(a) 图方式排列,剩余的空隙较大,称为非密 置层。
与4个碳相连,呈空间正四面体形
6个碳原子形成一个环 一个碳被12个环共有 碳原子与键数比是( 1:2 )
金刚石晶体
原
子
晶
Si
体
o
109º28´
共价键
混合晶体-石墨
可移动的电子:
石墨的晶体结构俯视图
层状结构的基本单元
石墨的层状结构
碳原子与键数比是( 2:3 )
石墨的层间移动
可自由移动的电子:
石墨晶体
下图是此种六方 紧密堆积的前视图
A
B A B A
3.镁型
第三层的另一 种排列方式,是将 球对准第一层的 2 ,4,6 位,不同 于 AB 两层的位置 ,这是 C 层。
12
6
3
54
12 63
54
12
6
3
54
第四层再排 A,
A
于是形成 ABC ABC
三层一个周期。 得
C
到面心立方堆积。
B
12
A
6
3
,
12
6
3
54
12
6
3
54
AB
关键是第三层,对第一、二层来说,第三层 可以有两种最紧密的堆积方式。
第一种是将球对准第一层的球。
12
6
3
54
于是每两层形成一 个周期,即 AB AB 堆 积方式,形成六方紧 密堆积。
配位数 12 。 ( 同层 6,上下层各 3 ) ,空 间利用率为74%
12
6
3
54
C
54
B
A
配位数 12 。 ( 同层 6, 上下层各 3 ) 此种立方紧密堆积的前视图
④面心立方:铜型
C B A
镁型
铜型
金属晶体的两种最密堆积方式
堆积 采纳这种堆 空间 配位数
模型 积的典型代 利用
表
率
简单 Po (钋) 52%
6
立方
体心 K、Na、Fe 68%
8
(钾型)
六方 Mg、Zn、Ti 74% 12 (镁型)
(a)非密置层 (b)密置层
(3)金属晶体的原子在三维空间堆积模型 ①简单立方堆积(Po)
简单立方堆积
②体心立方堆积—钾型(碱金属)
体 心 立 方 堆 积
配位数:8
③六方(镁型)和面心(铜型)
镁型
铜型
第二层 对第一层来讲最紧密的堆积方 式是将球对准1,3,5 位。 ( 或对准 2, 4,6 位,其情形是一样的 )
四种
六方最密堆
晶胞中微粒的计算
思考:处于晶胞顶点上、 棱上、面上的离子分别被 多少个晶胞共用?
处于晶胞面上粒子被2个 晶胞共用
处于晶胞棱上粒子被4 个晶胞共用
处于晶胞顶点上粒子被 8个晶胞共用
原子晶源自109º28´体共价键
原子晶体
基本单元: 六元环
观察,一个碳原子与多少个碳 原子相连,多少个碳原子形成 一个环? 一个碳被几个环共有? 碳原子与键数比是 ?
分子的非密堆积
冰中1个水分子周围有4个水分子
冰的结构
离 子 晶 体
陪位数:在晶体中离每个微粒最近的其他微粒数
氯化铯的晶体结构
CsCl的晶体结构示意图
---Cs+ ---Cl-
返回原处
CaF2的晶胞
ok
返回原处
C 练习推导化学式
B A
A:B:C=1:1:3 ABC3
A:B:C=1:1:3 ABC3
