O_2_CO_2气氛下石灰石煅烧分解的动力学和热力学研究
石灰石的预处理和煅烧

.
煅烧工艺条件
石灰石的粒度、形状、装窑方法
窑气的温度、压力和密封
煅烧的温度、碳酸钙的分 解率和二氧化碳浓度
无烟煤粒 度、配煤
率
预热区: 对流传热。 700-900℃
煅烧区:辐射 为主,传导对 流为辅。1050-
1150℃石灰石的粒度越均 匀,源自烧成的石灰质量 越稳定。.
煅烧工艺条件 ---石灰石的形状:
各边尺寸比 煅烧时间h
1:1:1 1
1:1:2 1.23
1:1.5:2 1.6
1:2:3 2.2
名义尺寸相同,各边尺寸比例不同的石灰石煅烧时间
1:3:4 2.6
球形或者立方形的 石灰石煅烧时间最 短
.
煅烧工艺条件 ---无烟煤的粒度(一):
.
煅烧的原理
煅烧中提供热源的燃料有:煤炭,煤气,天然气 等。
我们选用的是无烟煤,其特点是密度大,含碳量 高,挥发分少,发热量大(约29308KJ/kg),灰分少, 含硫量低。
煤的主要可燃性元素是:碳,其次是氢。
.
煅烧的原理
影响燃料完全燃烧并释放高温的因素之一是空气 的存在和使用。
空气由78%的氮和21%的氧,以及少量的二氧化碳 和二氧化硫等组成。有效助燃的成分是氧气。
石灰石的预处理和煅烧
.
.
煅烧:活性石灰生产 1、石灰石的预处理 2、煅烧原理 3、煅烧石灰石的区段划分 4、煅烧的工艺条件 5、煅烧的工艺流程 6、回转窑煅烧系统工艺及结构
.
石灰石的预处理
根据石灰石的形状和粒度的大小以及污染情况等 各项入窑煅烧的理化指标,必须对石灰石进行预处理。
石灰窑石灰石的煅烧原理

石灰窑石灰石的煅烧原理
石灰窑石灰石的煅烧原理主要涉及到物理、化学和热力学过程,其基本原理可以总结为以下几个方面。
首先,石灰窑石灰石的煅烧是一个高温反应过程。
石灰窑内是一个封闭的高温环境,其中石灰石在高温下发生分解和化学反应。
一般情况下,石灰窑的工作温度可以达到800至1200摄氏度,这种高温条件能够使石灰石中的碳酸钙分解生成氧化钙。
其次,石灰窑石灰石的分解反应是一个放热反应。
在高温下,石灰石中的碳酸钙分解为二氧化碳和氧化钙。
碳酸钙的化学式为CaCO3,分解反应式为:
CaCO3(s) →CaO(s) + CO2(g)
这个分解反应是放热反应,即反应过程中会释放出大量的热能。
这种热能的释放使得石灰石的分解反应在高温下能够持续进行。
第三,石灰窑石灰石的煅烧还涉及到固相和气相之间的传质过程。
在高温下,石灰石中生成的氧化钙需要通过气体相传输到石灰窑的出口处。
同时,分解产生的二氧化碳也需要通过气相进行传输并排出石灰窑。
这种固相和气相之间的传质过程对于石灰窑石灰石的煅烧过程至关重要。
最后,石灰窑石灰石煅烧过程中的高温热能由燃烧器提供。
石灰窑通常使用燃烧器将燃料燃烧产生的高温热能导入到窑内,使得石灰石能够达到所需的高温条件。
燃烧器通常使用煤、天然气或油等作为燃料,通过燃料的燃烧来产生高温热能。
总的来说,石灰窑石灰石的煅烧原理可以归纳为高温下石灰石的分解反应,放热反应,固相和气相之间的传质过程以及高温热能由燃烧器提供。
这些原理共同作用,使得石灰窑石灰石得以充分分解,产生出所需的氧化钙。
高温煅烧石灰石实验结果记录表格

标题:高温煅烧石灰石实验结果详解在古代,人们发现高温煅烧石灰石可以得到一种新的物质,用于建筑、涂料等方面。
石灰石在高温下的变化引起了人们的好奇,也促使科学家进行了大量的实验来探索其奥秘。
在本文中,我们将深入研究高温煅烧石灰石的实验结果,并结合个人观点进行全面探讨。
实验一:温度对石灰石的影响1. 温度为800°C时石灰石经过800°C的高温煅烧后,发生了明显的变化。
其外观由灰白色变为浅黄色,质地变得更加坚硬。
在加热的过程中,石灰石释放出二氧化碳,产生了氧化钙。
这表明,800°C的高温已经使石灰石发生了部分煅烧,产生了新的化学物质。
2. 温度为1000°C时当温度升至1000°C时,石灰石的变化更加显著。
它的颜色更加深黄,质地变得更加坚硬,表面呈现出一些晶体结构。
此时,石灰石已经完全煅烧,变成了氧化钙。
实验二:煅烧时间的影响1. 煅烧时间为30分钟在800°C的温度下,煅烧30分钟后,石灰石的变化并不明显。
仍然保持着浅黄色,质地也没有太大的改变。
这表明,短时间的煅烧并不能使石灰石完全发生化学变化。
2. 煅烧时间为60分钟将石灰石煅烧60分钟后,其颜色变得更加深黄,质地更加坚硬。
虽然未达到完全煅烧的程度,但已经有了一定的变化。
结论与回顾:从以上实验结果可以得知,在高温下煅烧石灰石,石灰石会产生明显的变化,并最终转化为氧化钙。
温度和煅烧时间对石灰石的变化也有一定的影响。
在实际应用中,可以根据需要选择适当的温度和时间进行煅烧,以得到符合要求的氧化钙。
个人观点:高温煅烧石灰石是一个古老而神奇的实验,通过控制温度和时间,可以使石灰石转化为有用的化学物质。
这不仅在建筑、涂料等方面有着广泛的应用,也展示了人类对自然物质的探索和利用。
希望未来可以有更多的实验来深入研究石灰石高温煅烧的过程,以及其在环境保护和新材料研发方面的应用。
通过本文的全面讨论,相信你已经对高温煅烧石灰石有了更深入的了解。
石灰煅烧机理

石灰煅烧机理石灰煅烧是指将石灰石(CaCO3)在高温下分解成氧化钙(CaO)和二氧化碳(CO2)的过程。
这个过程不仅在工业生产中广泛应用,也在冶金、建筑、环保等领域发挥着重要作用。
本文将详细介绍石灰煅烧的机理。
石灰煅烧的机理可以通过两个主要反应来解释:石灰石的分解反应和氧化反应。
首先是石灰石的热分解反应,化学方程式为CaCO3(s) → CaO(s) + CO2(g)。
这个反应在900~1000℃之间进行,需要输入大量的热量。
石灰石分解的主要原因是在高温下,CaCO3的分解活化能降低,使得分子内的化学键能够被破坏。
具体来说,随着温度的升高,CaCO3的晶格结构发生变化,相邻Ca和CO3离子之间的距离增加,石灰石颗粒内部的压力增大,导致材料发生脆性断裂。
分子内的键被破坏后,CaO和CO2分开,形成氧化钙和二氧化碳。
其次是氧化反应,化学方程式为CaO(s) + 1/2 O2(g) → CaO(s)。
在空气中,氧化钙会与氧气发生反应,生成CaO。
这个反应是一个氧化还原反应,氧化钙失去电子生成Ca2+离子,氧气获得电子生成O2-离子。
由于氧化反应伴随着释放热量,所以这个反应是放热反应。
通过这个反应,氧化钙可以得到更加稳定的化学结构,使得石灰石的煅烧产物更加纯净。
在石灰煅烧的过程中,还有一些次要反应参与其中。
一方面,石灰石的分解反应是一个端头反应,需要从石灰石颗粒的表面开始进行。
因此,石灰石的分解速率也受到颗粒表面的条件和外界环境的影响。
另一方面,由于煅烧温度较高,石灰石颗粒中的杂质(如镁、铁、铝等)有可能发生固相反应或溶解反应。
这些反应可以改变石灰石的煅烧产物的性质,使得产物的纯度和质量发生变化。
石灰石的煅烧过程涉及到多个物理和化学因素的相互作用。
首先是温度的影响。
石灰石分解反应的速率随着温度的升高而增加,但反应速率也会受到温度过高时颗粒烧结的影响。
其次是氧气的影响。
较高的氧浓度可以提高氧化反应的速率,但过高的氧浓度会加剧石灰石颗粒的烧结现象。
、同学们对实验煅烧石灰石展开了探究.资料石灰石中的
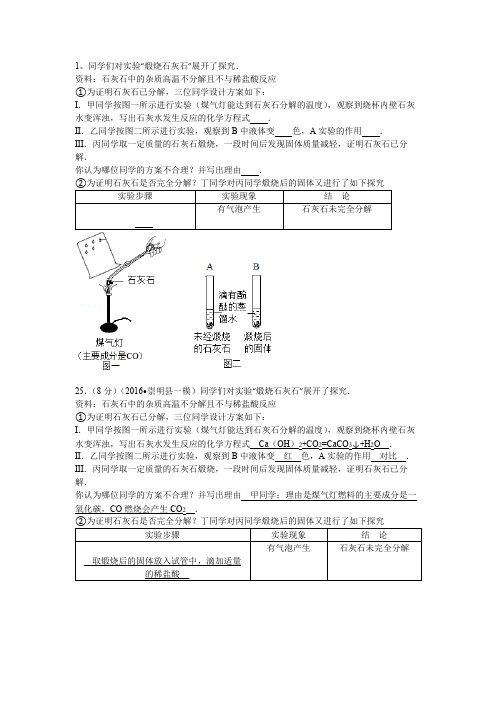
1、同学们对实验“煅烧石灰石”展开了探究.资料:石灰石中的杂质高温不分解且不与稀盐酸反应①为证明石灰石已分解,三位同学设计方案如下:I.甲同学按图一所示进行实验(煤气灯能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式.II.乙同学按图二所示进行实验,观察到B中液体变色,A实验的作用.III.丙同学取一定质量的石灰石煅烧,一段时间后发现固体质量减轻,证明石灰石已分解.你认为哪位同学的方案不合理?并写出理由.25.(8分)(2016•崇明县一模)同学们对实验“煅烧石灰石”展开了探究.资料:石灰石中的杂质高温不分解且不与稀盐酸反应①为证明石灰石已分解,三位同学设计方案如下:I.甲同学按图一所示进行实验(煤气灯能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式Ca(OH)2+CO2=CaCO3↓+H2O.II.乙同学按图二所示进行实验,观察到B中液体变红色,A实验的作用对比.III.丙同学取一定质量的石灰石煅烧,一段时间后发现固体质量减轻,证明石灰石已分解.你认为哪位同学的方案不合理?并写出理由甲同学;理由是煤气灯燃料的主要成分是一氧化碳,CO燃烧会产生CO2.【分析】①Ⅰ、石灰水变浑浊是由于二氧化碳和澄清石灰水发生了反应,该反应生成了难溶于水的碳酸钙,可以据此解答该题;Ⅱ、氧化钙可以和水反应生成氢氧化钙,而氢氧化钙溶液呈碱性,可以使酚酞试液变红,可以据此解答;Ⅲ、煤气灯的主要成分为一氧化碳,而一氧化碳燃烧生成了二氧化碳,可以据此解答该题;②根据碳酸盐遇到酸会生成二氧化碳气体.【解答】解:①Ⅰ、石灰水变浑浊是由于二氧化碳和澄清石灰水发生了反应,该反应生成了难溶于水的碳酸钙,其化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;Ⅱ、氧化钙可以和水反应生成氢氧化钙,而氢氧化钙溶液呈碱性,可以使酚酞试液变红,所以可以观察到试管B中液体变红,试管A起到了对照作用;Ⅲ、煤气灯的主要成分为一氧化碳,而一氧化碳燃烧生成了二氧化碳,所以澄清石灰水变浑浊不一定是来源于碳酸钙的分解,所以甲同学的方案不合理;②为证明石灰石是否完全分解,取煅烧后的固体放入试管中,滴加适量的稀盐酸,有气泡产生,石灰石未完全分解.故答案为:(1)Ⅰ、Ca(OH)2+CO2=CaCO3↓+H2OⅡ、红;对比(或比较,合理均可)Ⅲ、甲同学;理由是煤气灯燃料的主要成分是一氧化碳,CO燃烧会产生CO2(写全给分)②取煅烧后的固体放入试管中,滴加适量的稀盐酸.【点评】本题难度不是很大,掌握溶液的酸碱性、二氧化碳的化学性质、碳酸盐的化学性质等是正确解题的关键.2、Y型管是实验改进中经常使用的仪器,用下图所示装置(夹持固定仪器省略)来探究二氧化碳的相关性质.在不打开装置的情况下,将Y型管a向右倾斜,使稀硫酸流入装有碳酸钠的试管中,再恢复至图示装置的角度,即可产生二氧化碳.(提示:棉花的作用是防止反应速度过快,导致泡沫堵塞导管).①观察Y型管B的现象,可以证明二氧化碳的性质是,干燥的紫色石蕊试纸用于证明.在Y型管B中,只要用二张湿润紫色石蕊试纸,即可证明二氧化碳的密度大于空气,则湿润紫色石蕊试纸放置方法是.②预测Y型管C中可能出现的现象是.③证明CO2不能燃烧,不能支持燃烧的操作方法是.④有同学认为在A、B装置处添加E装置可以使实验更严密,E装置中无水硫酸铜的作用是,该药品不能用生石灰替代,用化学方程式解释主要原因是.【分析】①二氧化碳可与湿润的石蕊滤纸条中的水发生反应生成碳酸,碳酸可使石蕊变红,二氧化碳不能使石蕊变红;要证明二氧化碳密度比空气大,且不改变装置,可分别在Y型管管口和底部放置湿润紫色石蕊滤纸条进行实验,观察现象.②根据二氧化碳的性质分析.③证明CO2不能燃烧,可以使燃着的木条熄灭.④根据制取二氧化碳时可以带出少量水蒸汽以及二氧化碳后被生石灰吸收分析.【解答】解:①二氧化碳可与湿润的石蕊滤纸条中的水发生反应生成碳酸,碳酸可使石蕊变红,而二氧化碳不能使石蕊变红;证明二氧化碳的密度大于空气,可以将一张湿润紫色石蕊试纸放在Y型管管口,一张湿润紫色石蕊试纸放在Y型管底部.②二氧化碳与水发生反应生成碳酸,碳酸可使石蕊变红,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,所以澄清石灰水先变浑浊,过量的二氧化碳又可使石灰水变澄清;③证明CO2不能燃烧,可以将燃着的木条伸入D集气瓶中,木条会熄灭.④制取二氧化碳时可以带出少量水蒸汽,二氧化碳与水蒸气反应生成碳酸,也可能使干燥的紫色是蕊试纸变色,所以在A、B装置处添加E装置可以使实验更严密,E装置中无水硫酸铜的作用是吸收水分;如果无水硫酸铜用生石灰替代,会发生CaO+H2O=Ca(OH)2和CO2+Ca(OH)2=CaCO3↓+H2O反应,将二氧化碳吸收.故答案为:①二氧化碳与水反应;二氧化碳不能使干燥紫色石蕊试纸变红色;将一张湿润紫色石蕊试纸放在Y型管管口,一张湿润紫色石蕊试纸放在Y型管底部(合理给分)②石蕊变红色,澄清石灰水先变浑浊(后变澄清);③燃着的木条伸入D集气瓶中,熄灭.(合理给分)④吸收水分;CaO+H2O=Ca(OH)2;CO2+Ca(OH)2=CaCO3↓+H2O.【点评】本题考查了学生二氧化碳的性质分析解题和设计实验的能力,能训练学生的思维和应用知识解答问题的能力.3、某学习小组准备探究气体的测定和数据处理方法.【提出问题】利用碳酸钙与稀盐酸反应来测定生成CO2的量.【实验设计】通过下列两个实验分别测定CO2的质量和体积.【分析处理】实验一:①将小烧杯中的稀盐酸分几次加入到大烧杯中,并不断搅拌,判断反应后盐酸过量的依据是.②若稀盐酸足量,计算理论上能产生二氧化碳的物质的量实验二:③先连接好装置,再(填操作),然后装好药品,最后将20mL稀盐酸快速推入锥形瓶中.若缓慢推入,则可能造成的后果是.根据以上实验过程和数据综合分析,最终生成CO2的体积是mL.【反思与评价】⑤经过分析,下列说法错误的是.A.实验一的操作简单,便于读数B.实验一最终得到的数据和通过计算得出的理论值完全相等C.实验二在密闭体系内反应,更环保D.实验二中若将碳酸钙粉末改成块状的大理石,更安全.4、用碳、一氧化碳还原氧化铜的仪器、装置如图.(连接装置的橡皮管省略)请回答以下问题:①一氧化碳还原氧化铜的实验中,除A装置外,还需选用的仪器、装置组合是(填字母),选用该仪器、装置的目的是、.②碳还原氧化铜的实验中(将A中的酒精灯换成酒精喷灯),反应的化学方程式是.③用碳和一氧化碳还原氧化铜的两个实验中,装置A中观察到的现象是.④现有一包混有少量碳粉的氧化铜粉末,为了测定其碳粉的质量分数,称取m g样品进行高温加热,实验过程中获取两组数据:Ⅰ.反应前后仪器a中质量减少x g;Ⅱ.吸收生成物的仪器中质量增加y g.假设反应充分,称量准确,你认为应选择哪组数据进行计算会更为合理准确?你的理由是,请列出计算碳粉质量分数的式子.(用m、x、y表示).【分析】(1)根据最后一次加入稀盐酸后,电子天平上的示数不再发生变化进行解答;(2)根据石灰石和盐酸反应放出二氧化碳气体的化学方程式进行计算;(3)根据制取气体要先检查装置的气密性进行解答;(4)根据从第10分钟后气体的体积不再变化进行解答;(5)根据实验的图的优点在密闭体系内反应更加环保,现象更加直观进行解答.【解答】解:【分析处理】实验一:①将小烧杯中的稀盐酸分几次加入到大烧杯中,并不断搅拌,判断反应后盐酸过量的依据是最后一次加入稀盐酸后,电子天平上的示数不再发生变化.②nCaCO3==0.05mol.设产生的二氧化碳为xmolCaCO3+2HCl=CaCl2+H2O+CO2↑1 10.05mol x则,解得x=0.05mol故若稀盐酸足量,理论上能产生二氧化碳的物质的量为0.05mol.实验二:③先连接好装置,再检查装置气密性,然后装好药品,最后将20mL稀盐酸快速推入锥形瓶中.若缓慢推入,则可能造成的后果是锥形瓶内产生大量气体,压强变大,导致盐酸无法推入.根据以上实验过程和数据综合分析,最终生成CO2的体积是90mL﹣20mL=70mL.【反思与评价】⑤A.实验一的操作简单,便于读数,说法正确;B.实验一最终得到的数据和通过计算得出的理论值完全相等,说法错误;C.实验二在密闭体系内反应,更环保,说法正确;D.实验二中若将碳酸钙粉末改成块状的大理石,更安全,说法正确.故选:B.故答案为:(1)最后一次加入稀盐酸后,电子天平上的示数不再发生变化(或“不再减小”或“没有气泡产生”)(3)检查装置气密性;锥形瓶内产生大量气体,压强变大,导致盐酸无法推入;(4)70;(5)B.【点评】掌握装置气密性检验一般方法,本题主要考查分析和应用信息解答实际问题的能力,要结合物质的性质和反应规律进行综合分析.5、如图装置可用于探究可燃物的燃烧条件(夹持仪器略去)实验操作步骤及现象如下:第1步:检查装置气密性;第2步:如图所示加入药品;第3步:向B试管冷水中的白磷通氧气,白磷不燃烧;第4步:待A试管中不再产生氧气时,再向B试管中加入90℃的热水,白磷不燃烧第5步:向B试管热水中的白磷通氧气,白磷燃烧,产生白烟.①写出A试管中发生反应的化学方程式;第步和第5步26.(8分)如图装置(夹持仪器略去)可用于探究碳及其氧化物的某些性质.①甲处发生的化学方程式为;②丙处可观察黑色的氧化铜变为色,发生反应的化学方程式为;③丁处可观察到澄清石灰水变浑浊,发生反应的化学方程式为,该现象能否证明一氧化碳还原氧化铜的气体产物为二氧化碳?理由是;④从环保角度考虑,指出该装置的不足之处.【分析】大理石中的碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;高温条件下,二氧化碳和碳反应生成一氧化碳;高温条件下,一氧化碳和氧化铜反应生成铜和二氧化碳;二氧化碳能使澄清石灰水变浑浊;一氧化碳有毒,扩散到空气中会污染环境.【解答】解:①甲处中的碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,发生反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;②丙处可观察黑色的氧化铜变为红色,是因为氧化铜和一氧化碳反应生成了铜和二氧化碳,发生反应的化学方程式为:CO+CuO Cu+CO2;③丁处可观察到澄清石灰水变浑浊,是因为氢氧化钙和二氧化碳反应生成了碳酸钙和水,发生反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;该现象不能证明一氧化碳还原氧化铜的气体产物为二氧化碳,理由是甲处生成的CO2在乙处可能没有完全反应,丁中使澄清石灰水变浑浊的CO2可能是甲处生成的CO2;④从环保角度考虑,该装置的不足之处是缺少尾气处理装置.故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;红;CO+CuO Cu+CO2;Ca(OH)2+CO2═CaCO3↓+H2O;不能,甲处生成的CO2在乙处可能没有完全反应,丁中使澄清石灰水变浑浊的CO2可能是甲处生成的CO2;缺少尾气处理装置.【点评】实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.6、工业上利用高温分解石灰石(主要成分CaCO3,杂质不参与任何反应),得到生石灰.现实验室利用此原理来分析石灰石的纯度,使用100g原料,完全分解后得到固体64.8g,计算:(写出计算过程)(1)反应中得到的二氧化碳气体的物质的量为多少摩尔?(2)原料中的碳酸钙纯度为多少?7、生命离不开水,生活中也离不开水:①电解水可以说明水是由氢、氧元素组成的,写出水电解的方程式;②我们一般用到的水往往都是自来水,下图是课本中“自来水厂生产流程图”:步骤五可用O3来消毒,O3是(填写化学式)的同素异形体.步骤四的作用和实验室里(填写操作名称)作用相似.该图圈中“未净化的污水”最好改为.③在某些国家极度缺乏淡水,可利用海水淡化得到淡水.若1吨含可溶性物质3.5%的海水蒸发后浓度变为5%,则得到淡水吨.目前海水淡化用的较多的是“闪蒸”方法,是指一定温度的海水在压力突然降低的条件下,部分海水急骤蒸发的现象.多级闪蒸海水淡化是将经过加热的海水,依次在多个压力逐渐降低的闪蒸室中进行蒸发,将蒸汽冷凝而得到淡水.有关该方法说法正确的是(选填编号).A.送入闪蒸室前,要将海水加热至沸腾B.该方法可以将海水蒸干,可得到更多的淡水C.蒸发后的海水,还可作为生产食盐的原料D.该方法无需将海水进行预处理,就可生产.【分析】①根据通电能使水电解,在两极生成氢气和氧气解答;②根据臭氧和氧气为同素异形体解答;根据步骤四是将不溶性固体和液体分离解答;根据该图圈中“未净化的污水”最好改为自然界中较为纯净的水源解答;③根据蒸发前后溶质质量不变解答;【解答】解:①通电能使水电解,在两极生成氢气和氧气,化学方程式为:2H2O 2H2↑+O2↑;②臭氧和氧气为同素异形体;步骤四是将不溶性固体和液体分离,步骤四的作用和实验室里过滤作用相似.该图圈中“未净化的污水”最好改为自然界中较为纯净的水源;③设得到淡水的质量为x1t×3.5%=(1t﹣x)×5%x=0.3t海水淡化用的较多的是“闪蒸”方法,是指一定温度的海水在压力突然降低的条件下,部分海水急骤蒸发的现象.多级闪蒸海水淡化是将经过加热的海水,依次在多个压力逐渐降低的闪蒸室中进行蒸发,将蒸汽冷凝而得到淡水,由此可以看出:蒸发后的海水,还可作为生产食盐的原料是正确的.答案:①2H2O 2H2↑+O2↑;②O2;过滤;自然界中较为纯净的水源;③0.3;C【点评】解答本题要掌握净化水的方法等方面的知识,只有这样才能对相关方面的问题做出正确的判断.8、对一瓶久置出现变质的氢氧化钙固体进行如下探究活动.探究活动一:氢氧化钙样品是否完全变质.(1)用化学方程式表示氢氧化钙变质的原因:.取3克部分变质的氢氧化钙样品与足量的稀盐酸反应,测量生成气体的体积(气体不溶于植物油),从而计算出样品中R的质量,便可求出样品中R的质量分数.实验装置(气密性良好)如图1所示.(3)将稀盐酸滴入样品中,产生气体的化学方程式为,反应一段时间后,当观察到(填实验现象),才停止滴加稀盐酸.(4)实验中量筒的作用是.(5)实验结束后,量筒内进入水的体积如图2所示,其读数为mL.【分析】(1)根据图象中的数据可以看出生成二氧化碳的质量为8.8g;(2)根据二氧化碳的质量和化学方程式计算参加反应的碳酸钠的质量,然后计算碳酸钠的质量分数;(3)根据质量守恒定律计算所得溶液的质量.【解答】解:(1)从图象中的数据可以看出,生成二氧化碳的质量为8.8g;(2)设参加反应的碳酸钠的质量为xNa2CO3+2HCl=2NaCl+H2O+CO2↑106 44x 8.8g=x=21.2g所以纯碱样品中所含Na2CO3的质量分数为:×100%=92.2%;(3)所得到的溶液质量为:23+150+160﹣8.8=324.2g.故答案为:(1)8.8g;(2)92.2%;(3)324.2g.【点评】本题主要考查化学方程式的书写和有关化学方程式的计算,完成此题,可以依据已有的知识进行.。
化学反应动力学与热力学

化学反应动力学与热力学化学反应动力学和热力学是研究化学反应的两个重要分支。
动力学研究反应速率和反应机理,而热力学研究反应热力学性质和平衡状态。
两者相互补充,为我们理解和控制化学反应提供了深入的认识。
一、化学反应动力学化学反应动力学研究反应速率、反应机理和反应中的分子碰撞等。
反应速率是反应物浓度变化率与时间的比值。
当浓度变化快时,反应速率很高;而当浓度变化慢时,反应速率很低。
动力学研究反应速率的变化规律,以及影响反应速率的因素。
1. 反应速率的定义反应速率可以定义为单位时间内反应物浓度变化量与摩尔数的比值。
对于一个简单的反应:A +B →C + D反应速率可以表示为:v = -1/2Δ[A]/Δt = -1/2Δ[B]/Δt = 1/2Δ[C]/Δt = 1/2Δ[D]/Δt2. 影响反应速率的因素反应速率受到温度、浓度、催化剂和表面积等因素的影响。
- 温度: 反应速率随着温度的升高而增加。
这是因为温度的升高会增加分子的动力学能量,促使反应物分子之间更频繁地碰撞。
- 浓度: 反应速率正比于反应物浓度的幂。
当浓度增加时,反应物分子之间的碰撞概率增加,从而加快反应速率。
- 催化剂: 催化剂可以提高反应速率,但在反应过程中不消耗。
催化剂通过提供新的反应路径,降低反应的活化能,从而加速反应。
- 表面积: 如果反应物处于固体状态,表面积的增加会促进反应。
这是因为反应物分子需要先吸附到固体表面才能发生反应,增大表面积会提供更多的吸附位点,从而加速反应。
二、化学反应热力学化学反应热力学研究反应的热力学性质和平衡状态。
热力学关注反应的焓、熵以及自由能变化等方面。
化学反应必须遵守热力学第一、第二定律,从而满足热力学的平衡条件。
1. 焓变焓变表示在化学反应中热量的变化。
反应的焓变可以是吸热(ΔH>0)或放热(ΔH<0)。
吸热反应吸收热量,放热反应释放热量。
2. 熵变熵变表示在化学反应中系统熵的变化。
熵是系统无序程度的度量。
石灰石的煅烧原理是

石灰石的煅烧原理是石灰石的煅烧原理是指将石灰石加热到高温下,使其分解为二氧化碳和氧化钙的化学过程。
这个过程涉及到石灰石的结构和化学性质,以及煅烧条件的控制等。
石灰石,化学式为CaCO3,是一种常见的碳酸盐矿物。
其晶体结构是钙离子(Ca2+)和碳酸根离子(CO32-)之间的离子键构成的。
在石灰石中,钙离子和碳酸根离子形成了紧密的结晶格子。
石灰石可分为不同的晶型,包括方解石、菱镁矿和方铅矿等。
当石灰石加热到高温时,温度升高使晶体中原子和离子的热运动增加。
在一定温度范围内,石灰石开始发生煅烧反应。
石灰石的煅烧反应可表述为:CaCO3(固体)→CaO(固体)+ CO2(气体)在高温下,石灰石分解为两个产物,一是氧化钙(CaO),也称为生石灰或石灰,另一个是二氧化碳(CO2),以气体形态释放出来。
这个化学反应是一个热分解反应,需要供给热能才能进行。
石灰石煅烧的温度一般在900到1200之间,具体的温度取决于石灰石的类型和要求的产物纯度。
较纯的石灰石通常需要高温才能达到较完全的分解。
煅烧过程中,石灰石分解时,晶体结构发生破坏,离子键断裂,生成的氧化钙具有较高的活性,易于与水反应形成氢氧化钙(Ca(OH)2)。
氢氧化钙在水中溶解后可以与二氧化碳反应重新形成石灰石,这个过程称为石灰石的烘干回化。
这样,通过适当的工艺条件和操作,可以利用煅烧后的石灰石进行不断的循环利用。
石灰石煅烧反应的速率取决于多个因素,包括温度、石灰石的颗粒大小、氧化钙生成的扩散等。
通常情况下,较小颗粒的石灰石更易于分解,煅烧温度越高,反应速率越快。
此外,通风条件和保温条件也会影响煅烧反应的进行。
石灰石的煅烧是重要的工业过程,产生的氧化钙可以用于制备石灰、水泥、炼钢和炼铁等工艺中。
石灰类产品在建筑、冶金、化工等多个领域有着广泛的应用。
在环保方面,煅烧石灰石可以用于CO2捕获技术,减少大气中的二氧化碳浓度,对于应对气候变化具有一定的意义。
总之,石灰石的煅烧原理是高温条件下,石灰石发生热分解反应,分解为氧化钙和二氧化碳。
催化反应中的反应动力学与热学分析

催化反应中的反应动力学与热学分析催化反应是一种利用催化剂促进化学反应,提高反应速率和反应产率的化学过程。
而反应动力学和热学则是催化反应中的重要分析方法。
本文将详细介绍催化反应中的反应动力学与热学分析。
一、反应动力学分析反应动力学是研究化学反应速率与化学反应机理的一门学问。
在催化反应中,反应速率通常可以用速率常数k来表示。
反应动力学分析的主要任务是确定k值及其与反应条件的关系,阐明反应机理。
了解反应机理,对于优化催化剂设计、提高反应速率和产率、改进反应条件等都是非常有帮助的。
通常,反应速率k的大小与反应物的浓度有关,越高的浓度通常会导致更高的反应速率。
但是在催化反应中,催化剂起到的作用也十分重要,因为催化剂可以改变反应的活化能,从而提高反应速率。
因此,研究催化剂对反应速率的影响十分关键。
一般来说,反应动力学分析有两种方法:实验方法和理论计算方法。
实验方法包括批量反应和流动反应,其中批量反应是指在封闭容器内进行反应,而流动反应则是指在固定反应器内进行反应。
理论计算方法和实验方法相对来说比较复杂,需要建立数学模型和计算化学反应物的能量和热力学参数等。
因此,在催化反应中,实验方法和理论计算方法通常是结合使用的。
二、热学分析热学分析是一种研究化学反应热效应的方法。
在催化反应中,热学分析可以通过测量反应的热效应来确定反应是否放热或吸热,以及该反应能量释放量的大小等信息,这对于确定催化剂的热稳定性、提高反应产率和控制反应温度等方面都有重要意义。
常见的热学分析方法包括热量计、差示扫描量热仪、热重分析仪等。
其中,热量计用于测量反应物与产物之间的放热或吸热过程,而差示扫描量热仪可以更加精细地分析反应热效应的变化情况。
热重分析仪则可以通过测量样品重量的变化来分析反应过程中质量的变化和反应产物的形成情况。
总之,催化反应中的反应动力学与热学分析在实践中具有重要的应用价值。
通过对于反应动力学和热学的探究,可以更好地了解催化反应的机制和优化反应过程,从而提高催化反应的效率和产量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O2/C O2气氛下石灰石煅烧分解的动力学和热力学研究Kinetic and thermodynamic analysis on limestone calcination under O2/CO2atmosphere毛玉如1,2,方梦祥2,骆仲泱2(1.中国环境科学研究院,北京 100012;2.浙江大学能源洁净利用与环境工程教育部重点实验室,浙江杭州 310027)摘要:富氧燃烧是一种能够综合控制燃煤污染物排放的新型洁净燃烧技术。
针对O2/CO2气氛下石灰石煅烧分解特性进行了热力学分析和热重试验结果的动力学分析,将热力学分析结果与热重试验结果进行了对比,得出石灰石的起始分解温度随CO2分压比的增大而增高。
关键词:O2/CO2气氛;煅烧动力学;热力学Abstract:Oxy gen-enriched combustion technology is one of the new clean coal combustion technologies that can controlpollutant em ission.Thermodynamic analysis of limestone calcination under O2/CO2atm osphere in fluidized bed conditionwas experimented.The results were accorded with therm odynamic analysis.The initial decomposing temperature of Ca-CO3increased with the increasing of CO2fractional pressure,but the increasing breadth was decreased.Key words:O2/CO2atmosphere;calcination;thermogravim ertic analysis中图分类号:X511 文献标识码:B 文章编号:1009-4032(2004)04-0043-03 富氧燃烧技术采用烟气再循环的方式,以烟气中的C O2和空气分离获得的O2一起参与燃烧。
富氧燃烧技术不仅使得分离收集CO2和处理SO2容易进行,还能减少NO x排放,是一种能够综合控制燃煤污染物排放的新型洁净燃烧技术[1]。
富氧燃烧技术也称为O2/CO2燃烧技术,或空气分离/烟气再循环技术。
富氧燃烧过程是在O2/CO2气氛下进行的,研究该气氛下石灰石煅烧反应行为对于了解高C O2浓度对石灰石煅烧和脱硫的影响具有重要意义。
1 石灰石煅烧分解的动力学研究现状目前,国内外进行了广泛的石灰石热分解动力学特征研究,但由于影响石灰石煅烧反应过程的因素很多,如反应物的化学晶格特征、颗粒粒度、反应气氛、实验条件等,使得其化学反应机理始终没有定论[2]。
缩核模型是目前应用最广泛的描述化学反应过程的模型之一,它认为反应物和生成物之间有明显的界面,随着反应的进行,该界面从表面往核心方向收缩,未反应的部分不断减少,直至所有的反应物都变成生成物[3]。
Satterfield和Feakes提出了控制反应速率的3个决定性因素:①对颗粒表面的传热;②从反应表面经由产物层的CO2扩散传质;③化学反应速率。
他们认为反应过程中没有明显的界面,还发现反应中的颗粒与加热炉之间的温差最大可达到140℃[2]。
Borg wardt依据反应过程受化学反应动力学控制而提出了均匀转化模型[4]。
Milne等认为流动反应器中Ca CO3的煅烧过程既不像缩核模型描述的存在明显的分界面,也不像均匀转化模型所描述的那样在整个颗粒界面上反应程度不同,而是在颗粒内部形成复杂的反应区域,并且在前人的实验基础上提出了经验修正后的缩核模型[5]。
Gal-lagher、Johnson及Caldwell等通过热重实验发现,传热是总反应速率的限制因素,提出了热解吸热引起的自冷效应[6]。
Ingraham和Marier发现,仅仅通过产物层的传质是反应速率的控制因素。
而Campbell 和Hills发现分解反应受C O2通过产物层的传质和传热控制。
2 O2/C O2气氛下石灰石煅烧分解的热重试验 热重试验使用SINKU RIKO TGD-5000RH差示热重分析仪,试验样品量约为4mg/次,载气量为80 基金项目:国家重点基础发展规划项目(G1999022105)43ml /min ,温升速率为40K /min 。
试验用石灰石样品的成分见表1。
试验得到的长广石灰石在O 2/C O 2气氛下的转化率曲线见图1,CaCO 3起始分解温度和CO 2分压比的关系见图2。
CaC O 3起始分解温度随CO 2分压比P SO 2(P CO 2为CO 2实际分压力和标准大气压的比值,%)的增大而提高,在试验控制温度范围(室温~1273K )内,不同气氛下的石灰石均能够完全煅烧分解。
表1 石灰石的光谱化学成分%项目CaOMgO SiO 2Fe 2O 3Al 2O 3Los s Total 周浦石灰石54.2360.34671.230.07570.009443.6999.59长广石灰石52.080.693.160.930.5442.1399.533 动力学分析采用简便易行的Freeman -Caroll 法来求解Ca -CO 3煅烧分解的动力学关系式,令反应级数为x ,反应速率可表示为:d αd t =-d Xd t=kX x (1) 结合阿累尼乌斯定律可以求得不同气氛下各石灰石煅烧反应的表观活化能E 和反应级数x ,见图3、图4。
从图3可以看出,随着P CO 2的增大反应活化能增加,说明反应所需要的能量增加。
但是,活化能的变化随着CO 2浓度的提高增幅变小。
另外,由阿累尼乌斯公式还可以看出,活化能的增大会明显减弱升温对煅烧反应的加速作用。
将试验所得到的周浦和长广石灰石的表观活化能平均,然后进行数据拟合,获得石灰石煅烧分解的表观活化能与CO 2分压比的表达式(2)。
数据拟合时去除了纯氧工况,各点的平方误差为0.9809;同理得到石灰石煅烧分解的反应级数x 与P CO 2的关系式(3),各点的平方误差为0.9583。
E =34.835ln P C O 2+127.65(2)x =0.1062ln P CO 2+0.1952(3)444 O 2/C O 2气氛下石灰石煅烧分解的热力学分析 通过热力学分析可以确定化学反应的平衡条件(或破坏化学平衡的条件),这对于化学分析、工业设计都具有重要意义。
石灰石煅烧分解反应(4)为吸热反应,温度升高促使反应向正方向进行。
由于Ca CO 3分解产生的CO 2数量较少,一般不会影响流化床内气体的压力,放出的反应热不会对颗粒的温度有很大影响,也不会对反应气氛中其他组分的熵引起明显变化,因而,我们假设反应(4)是在等温、等压条件下发生的,可以利用吉布斯自由能变化ΔG T 来衡量反应的方向及平衡条件[7]。
CaCO 3※CaO +CO 2-183kJ /mol(4)G =H -TS (5)S O T=S O 298+∫T298ΔC P d TT(6)ΔH OT=ΔH O298+∫T 298C Pd T(7)ΔS =-RT ln P 2/P 1(8) 由吉布斯函数的定义式(5)、无相变条件下的能斯特热定理(6)、无相变条件下的焓变公式(7)、理想气体的等温熵变公式(8)以及各个反应物和生成物在标准状态下的状态参数得到反应温度为T ,C O 2分压比为P CO 2条件下正反应方向的吉布斯自由能变化ΔG T 为:ΔG T =-RT ln P CO 2+18.4004RT -2.4365×10-3RT 2-22174.8R -1528.75TR +0.3334RT ln T +1.1787×10-16R ln T (9) 由热力学第二定律,式(9)的平衡条件为ΔG T =0。
令ΔG T =0,可以得到CaC O 3煅烧分解起始温度与CO 2分压比之间的关系如图1。
由图1可知,热力学分析结果和热重试验结果趋势吻合,数值接近。
CaC O 3的起始分解温度曲线的斜率ΔT /ΔP 随着C O 2分压比的增高而逐渐减小,即CaC O 3刚达到起始分解温度时,同样的颗粒内部CO 2浓度差ΔP ,在温度低时需要更大的温差ΔT 来克服高CO 2浓度产生的抑制作用。
5 结语本文对石灰石颗粒在O 2/CO 2气氛下的煅烧分解进行了热力学分析,并与热重试验结果进行了比较,发现CaCO 3起始分解温度随气氛中C O 2分压比的增大而提高,但增幅逐步减小。
随着C O 2分压比的增大反应活化能增加,活化能的变化随着C O 2浓度的提高增幅变小。
参考文献:[1]Alan M Wols ky ,Edward J D aniels ,Bassam J J ody .Recovering CO 2fromlarge and medium s ize stationary combustors [J ].Air Was te Manage As -s oc ,1991,(4):449-454.[2]刘妮.钙基脱硫剂反应性能评价体系及反应机理的研究[D ].杭州:浙江大学,2002.[3]Irfan Ar ,Gulsen Dogu .Calcination kinetics of high purity li mestones [J ].Chem Eng J ,2001,(83):131-137.[4]Borgwardt R .Calc ulation kinetics and surface area of dispersed limes toneparticles [J ].J AlChE ,1985,(31):103-111.[5]Milne C .Calcination and s intering models for application to high te mpera -ture ,short ti me s ulfation of calcium -bas ed s orbents [J ].Ind Eng Chem R es ,1990,(29):129-149.[6]Gallagher P ,J ohns on D .Thermo magnetometry and thermal dec ompos itionof siderite 〔J 〕,Thermochi m Acta ,1973,(6):67-83.[7]Vojtech fried ,Hendrik F Hameka ,Ul dis Blukis .Phys ics chemis try [M ].New York :Macmillan Publ is hing Co Inc ,1977.收稿日期:2004-05-30;修回日期:2004-09-15作者简介:毛玉如(1974-),男,山西太原人,博士,从事清洁生产、生态工业、循环经济、物质代谢,以及能源与环境系统工程等方面的理论研究与应用实践。
