配位化合物结构与性质习题答案
高中化学: 物质结构与性质(5)配位键配合物

向NaCl溶液中滴 加AgNO3溶液和 氨水
向NaCl溶液中滴加AgNO3溶液,产生 Ag++Cl-===AgCl↓
__白__色__沉淀,再滴入氨水,沉淀消失, AgCl+2NH3===
得到澄清的_无__色___溶液
[Ag(NH3)2]Cl
1.配位键实质上是一种特殊的共价键( √ ) 2.提供孤电子对的微粒既可以是分子,也可以是离子(√ ) 3.有配位键的化合物就是配位化合物( × ) 4.配位化合物都很稳定( × ) × 5.在配合物[Co(NH3)5Cl]Cl2中的Cl-均可与AgNO3反应生成AgCl沉淀( ) 6.Ni(CO)4是配合物,它是由中心原子与配体构成的(√ )
合
配配合合物物
离子(称为配体或配位体)以_配__位__键___结合形成的化合物,简称配合物。
物
(2)配合物的组成
配位原子
大π键
配体:含有孤电子对的分子或离子,如NH3、H2O、Cl-、SCN-等。 中心离子:一般是金属离子,特别是配过位体渡金配属位离数子,如Cu2+、Fe3+等。 配位数:直接同中心原子(或离子)配位的含有孤电子对的分子(或离子)
K3[Fe(CN)6]在水中可以电离出配离子[Fe(CN)6]3-,该配离子的中心离子、配体 是什么?配位数是多少?[Fe(CN)6]3-和Fe3+的性质一样吗?
考点突破
考点突破1:配合物理论的应用
B 例1.下列组合中,中心原子的电荷数和配位数均相同的是
A.K[Ag(CN)2]、[Cu(NH3)4]SO4 B.[Ni(NH3)4]Cl2、[Cu(NH3)4]SO4 C.[Ag(NH3)2]Cl、K3[Fe(SCN)6] D.[Ni(NH3)4]Cl2、[Ag(NH3)2]Cl
化学配位化合物的立体结构与异构体练习题详解

化学配位化合物的立体结构与异构体练习题详解化学配位化合物的立体结构与异构体是化学领域中的重要概念,对于理解化学反应和化学性质起着关键作用。
在本文中,我们将详解一些关于化学配位化合物立体结构与异构体的练习题,帮助读者更好地理解这个概念。
一、以下是一些关于配位配合物立体结构的问题,请回答并说明原因:1. 对称型配合物的空间群是否一定具有反射面?2. 说一说平面六配位配合物的形状和空间构型。
3. 请画出一个具有三方截尖顶体及其等价面的四配位配合物的球棍模型。
4. 对于配位配合物[Ni(Cl)4]2-,根据VSEPR理论,它的形状是什么?5. 高配位数的配合物中,配位键倾角是否会改变?1. 对称型配合物的空间群是否一定具有反射面?答案:不一定具有反射面。
空间群是描述晶体中原子或分子排列的对称性的指标,它包含了各种对称操作,如旋转、反射、平移等。
对称型配合物的立体结构中,即使具有对称性,也不一定具有反射面。
因此,对称型配合物的空间群不一定具有反射面。
2. 说一说平面六配位配合物的形状和空间构型。
答案:平面六配位配合物具有八面体的空间构型,形状呈六角形平面。
在平面六配位结构中,配体以六个顶点均匀分布在配合物的一个平面上,而中心金属离子位于这个平面的中心。
3. 请画出一个具有三方截尖顶体及其等价面的四配位配合物的球棍模型。
答案:[球棍模型]4. 对于配位配合物[Ni(Cl)4]2-,根据VSEPR理论,它的形状是什么?答案:根据VSEPR理论,[Ni(Cl)4]2-的形状是正方形平面。
根据VSEPR理论,该配合物的中心金属离子Ni2+被四个氯离子(Cl-)配位,形成一个正方形平面结构。
5. 高配位数的配合物中,配位键倾角是否会改变?答案:是的,高配位数的配合物中配位键倾角会改变。
配位键倾角是指配体和中心金属离子之间的键角,它受到电子云的排斥作用影响。
在高配位数的配合物中,由于配体的增加,电子云之间的排斥作用增强,导致配位键倾角变小。
配位化合物习题

第四章配位化合物1、举例说明什么叫配合物,什么叫中心离子(或原子)。
答:配合物的定义是:由一个中心离子(或原子)和几个配位体(阴离子或原子)以配位键相结合形成一个复杂离子(或分子)通常称这种复杂离子为结构单元,凡是由结构单元组成的化合物叫配合物,例如中心离子Co3+和6个NH3分子以配位键相结合形成[Co(NH3)6]3+复杂离子,由[Co(NH3)6]3+配离子组成的相应化合物[Co(NH3)6]Cl3是配合物。
同理,K2[HgI4]、 [Cu(NH3)4]SO4等都是配合物。
每一个配位离子或配位分子中都有一个处于中心位置的离子,这个离子称为中心离子或称配合物的形成体。
2、什么叫中心离子的配位数,它同哪些因素有关。
答:直接同中心离子(或原子)结合的配位原子数,称为中心离子(或原子)的配位数。
影响中心离子配位数的因素比较复杂,但主要是由中心离子和配位体的性质(半径、电荷)来决定。
(1)中心离子的电荷越高,吸引配位体的能力越强,因此配位数就越大,如Pt4+形成PtCl62-,而Pt2+易形成PtCl42-,是因为Pt4+电荷高于后者Pt2+。
(2)中心离子半径越大,其周围可容纳的配位体就越多,配位数就越大,例如Al3+的半径大于B3+的半径。
它们的氟配合物分别是AlF63-和BF4-。
但是中心离子半径太大又削弱了它对配位体的吸引力,反而配位数减少。
(3)配位体的负电荷增加时,配位体之间的斥力增大,使配位数降低。
例如:[Co(H2O)6]2+和CoCl42-。
(4)配位体的半径越大,则中心离子周围容纳的配位体就越小,配位数也越小。
例如AlF63-和AlCl4-因为F-半径小于Cl-半径。
2、命名下述配合物,并指出配离子的电荷数和中心离子的氧化数?根据配合物分子为电中性的原则,由配合物外界离子的电荷总数确定配离子的电荷数、中心离子氧化数。
解:配合物命名配离子电荷数中心离子氧化数[Co(NH3)6]Cl3三氯化六氨合钴(Ⅲ) +3 +3K2[Co(NCS)4] 四异硫氰合钴(Ⅱ)酸钾-2 +2Na2[SiF6] 六氟合硅(Ⅳ)酸钠-2 +4[Co(NH3)5Cl]Cl2二氯化一氯·五氨合钴(Ⅲ) +2 +3K2[Zn(OH)4] 四羟基合锌(Ⅱ)酸钾-2 +2[Co(N3)(NH3)5]SO4 硫酸一叠氮·五氨合钴(Ⅲ) +2 +3[Co(ONO)(NH3)3(H2O)2]Cl2二氯化亚硝酸根·三氨·二水合钴(Ⅲ) +2 +33、指出下列配离子中中心离子的氧化数和配位数:配离子中心离子氧化数配位数(1) [Zn(NH3)4]2+ +2 4(2) [Cr(en)3]3+ +3 6(3) [Fe(CN)6]3- +3 6(4) [Pt(CN)4(NO2)I]2- +4 6(5) [Fe(CN)5(CO)]3- +2 6(6) [Pt(NH3)4(NO2)Cl]2+ +4 64、指出下列化合物中的配离子、中心离子及其配位数。
结构化学 配位化合物的结构和性质习题及答案

一、填空题
1. 在氮分子与金属形成配位键M-N≡N时,N2的轨道上的一对电子提供给金属原子空轨道,形成键,另一方面又以轨道与金属d轨道形成键,因此在N2的络合物中由于键的形成,使N2活化了。
二、选择题
1. CO与过渡金属形成羰基配合物时,CO键会( C )
A. 不变
B.加强
C. 削弱
D.段裂
2. 配合物中心离子的d轨道在正方形场中,将分裂成几个能级【C 】
A. 2
B. 3
C. 4
D. 5
3. 物质颜色的产生是由于吸收了【D 】
A. 红外光
B. 微波
C. 紫外光
D. 可见光
4. Ni(3d84s2)与CO形成羰基配合物Ni(CO)n,式中n是【C 】
A. 6
B. 3
C. 4
D. 5
三、回答问题
1. 请分析蔡斯盐K [PtCl3(C2H4)]中乙烯与Pt2+之间的成键情况。
(蓝色),吸水后变为粉红色,试用配位场理论解释2. 硅胶干燥剂中常加入CoCl
2
其原因。
解:Co2+为d7构型,在无水CoCl2中,Co2+受配体Cl-的作用d轨道能级发生分裂,7个d电子按电子排布三原则填充在分裂后的轨道上,当电子发生d-d跃迁时,吸收波长为650~750nm的红光,因而显示蓝色。
但CoCl2吸水后变为[Co(H2O)6]Cl2,即由相对较强的配体H2O取代了相对较弱的配体Cl-,引起d轨道分裂能变大,使d电子发生d-d跃迁时吸收的能量增大,即吸收光的波长缩短(蓝移),[Co(H2O)6]Cl2吸收波长为490~500nm的蓝光,因而呈粉红色。
第3章配位化学-习题答案
39 天天learn()为您提供大学各个学科的课后答案、视频教程在线浏览及下载。
NH3
Cl
O2N
NH3
Co
O2N
NH3
Cl
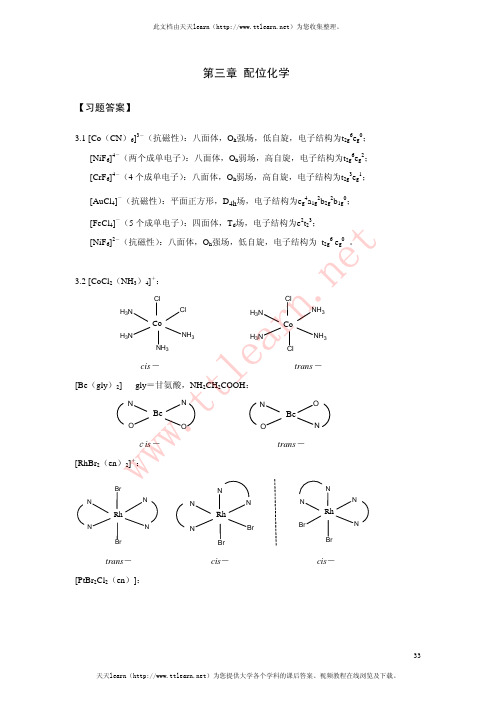
3.19 有两种几何异构体的配合物为(d)MA2BC (平面四边形)
A
B
M
A
C
A
B
M
C
A
cis-
trans-
3.20
配离子
成对能P / cm-1 △ / cm-1 d 电子排布 磁矩μs(μB)B
[Co(NH3)6]3+
17 800
23 000
t2g6eg0
3.8 (b)Fe(H2O)62+产生Jahn-Teller效应。
3.9
H3N H3N
NO2 NH3
Co
NO2
NO2
mer-
H3N O2N
NO2
Co
NH3
NH3 NO2
fac-
3.10 具有平面四边形结构的配合物为(c)PtCl42—。
3.11 (a)4CoCl2· 6H2O + 4NH4Cl + 20NH3 + O2 → 4[Co(NH3)6]Cl3 + 26H2O (b)K2Cr2O7 + 7 H2C2O4 → 2K[Cr(C2O4)2(H2O)2]+ 6CO2 + 3H2O
(b) 平面四边形[IrH(CO)(PR3)2]HBiblioteka PR3IrOC
PR3
H
PR3
Ir
R3P
CO
cis-
trans-
(c)八面体[Co(NO2)3(NH3)3]
化学_朱文祥_第3章配位化学-习题答案
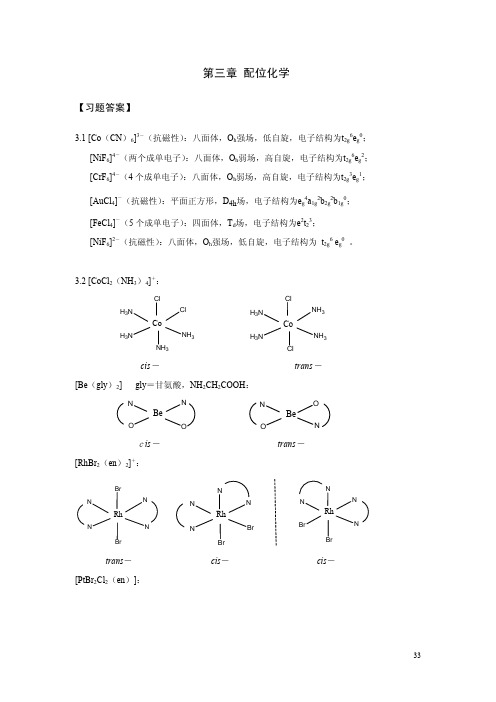
CoCl42-为正四面体构型。由于正四面体场的分裂能较小,所以(e)CoCl42-为高自旋。
3.6 配离子中的配体均为弱场配体,一般为高自旋构型。但是Co3+为d6组态,其与水分子配 位时产生的分裂能略大于电子成对能,因此(c)Co(H2O)63+为低自旋构型。
3.7 (c)的论述正确。F-为弱场配体,晶体场分裂能Δ小,CoF63-因采取高自旋构型而呈顺 磁性。
3.8 (b)Fe(H2O)62+产生Jahn-Teller效应。
3.9
H3N H3N
NO2 NH3
Co
NO2
NO2
mer-
H3N O2N
NO2
Co
NH3
NH3 NO2
fac-
3.10 具有平面四边形结构的配合物为(c)PtCl42—。
3.11 (a)4CoCl2· 6H2O + 4NH4Cl + 20NH3 + O2 → 4[Co(NH3)6]Cl3 + 26H2O (b)K2Cr2O7 + 7 H2C2O4 → 2K[Cr(C2O4)2(H2O)2]+ 6CO2 + 3H2O
3.17 粉红色固体用AgNO3溶液滴定时迅速生成 3 mol AgCl沉淀,说明 3 个Cl-在外界,粉红 色固体的化学式为 [Co(NH3)5(H2O)]Cl3,即三氯化五氨•一水合钴(Ⅲ)。受热外界的 1 个Cl-进入内界占据所失水分子的配位位点,因此紫色固体的化学式为 [CoC(l NH3)5]Cl2, 即二氯化一氯·五氨合钴(III)。
化学配位化合物练习题配位键性质与配位数计算
化学配位化合物练习题配位键性质与配位数计算化学配位化合物是指由中心金属离子(阳离子)和周围的配体(阴离子或中性分子)通过配位键结合而形成的化合物。
配位键是通过金属离子和配体之间的共价键或均衡异构的键来连接的。
配位键的性质和配位数的计算是化学实验和理论研究中的重要内容。
本文将通过一些练习题来探讨配位键性质和配位数的计算方法。
练习题一:考虑一个由钴离子(Co2+)和六个氰化物(CN-)配体组成的六配位化合物,请回答以下问题:1. 描述该配合物中配位键的性质。
2. 计算该配合物的配位数。
解答一:1. 钴离子的电子构型为[Ar]3d74s2,失去两个电子后形成Co2+离子,电子构型为[Ar]3d74s0。
氰化物是典型的强配体,具有强的键合能力。
在该配合物中,钴离子和氰化物配体之间形成了六个配位键。
配位键的形成是通过配体中的氮原子与钴离子的空位轨道相重叠而形成的。
2. 该配合物中有六个配位键,因此配位数为六。
练习题二:考虑一个由铜离子(Cu2+)和四个氯化物(Cl-)配体组成的四配位化合物,请回答以下问题:1. 描述该配合物中配位键的性质。
2. 计算该配合物的配位数。
解答二:1. 铜离子的电子构型为[Ar]3d104s1,失去一个电子后形成Cu2+离子,电子构型为[Ar]3d94s0。
氯化物是典型的卤素配体,具有较强的键合能力。
在该配合物中,铜离子和氯化物配体之间形成了四个配位键。
配位键的形成是通过配体中的氯原子与铜离子的空位轨道相重叠而形成的。
2. 该配合物中有四个配位键,因此配位数为四。
练习题三:考虑一个由亚铁离子(Fe3+)和六个水(H2O)配体组成的六配位化合物,请回答以下问题:1. 描述该配合物中配位键的性质。
2. 计算该配合物的配位数。
解答三:1. 亚铁离子的电子构型为[Ar]3d54s0,失去三个电子后形成Fe3+离子,电子构型为[Ar]3d54s0。
水是典型的配位键强度较弱的配体。
在该配合物中,亚铁离子和水配体之间形成了六个配位键。
结构化学习题
1.在八面体配位场中,3d 轨道分裂成几组( A)二组;(B)三组;( C)四组;( D)五组。
2.在弱八面体场中,拥有最大的配位场稳固化能的是以下的哪一个( A) d1( B) d2( C) d3( D) d43.配离子 [Mn(CN) 6]4-中 d 能级分裂状况可由以下哪一种实验测得( A)核磁共振( B)顺磁共振(C)红外光谱( D)电子能谱4.在正四周体配位场中, d 轨道将分裂成几组(A) 1(B)2(C)3(D)45.在八面体配合物中,拥有以下的哪一种电子组态的配合物可能是发生大的畸变( A) t2g5g2(B) t 2g4g2( C) t2g6g3(D) t2g4e e e[Fe( CN)6] 的磁性是以下的哪一种( A)反磁性(B)顺磁性(C)铁磁性(D)反铁磁性7.四周体配合物大多拥有以下那种性质( A)低自旋(B)高自旋(C)反旋(D)铁旋8.在正方形配合物中,若四个配位体分别位于X 轴 Y 轴上,则最高能级的 d 轨道是()。
(A) d xz( B) d z2( C) d xy( D) d x2-y29.关于配位体CN-和 F-各自形成的配位场的强弱比较结果,以下哪一种说法正确( A) CN-强于F-( B) F-强于CN-(C)同样( D)没法判断10.配位场理论是理论的发展,其本质是。
答案 :10.略第七章晶体学基础1.关于晶体的空间构造点阵型式的种类,以下哪一种说法是正确的(A)7种1. 在八面体配位场中, 3d 轨道分裂成几组? ( A )二组;( B )三组;( C )四组;( D )五组。
2. 在弱八面体场中,拥有最大的配位场稳固化能的是以下的哪一个? ( A ) d 1 ( B ) d 2 ( C ) d 3 ( D )d 43. 配离子 [Mn(CN) 6] 4- 中 d 能级分裂状况可由以下哪一种实验测得? ( A )核磁共振 (B )顺磁共振( C )红外光谱 ( D )电子能谱4. 在正四周体配位场中, d 轨道将分裂成几组?(A ) 1(B )2(C )3(D )45. 在八面体配合物中,拥有以下的哪一种电子组态的配合物可能是发生大的畸变? 5242634( A ) t 2g e g (B )t 2g e g (C ) t 2g e g ( D )t 2g6.K 4[Fe ( CN ) 6] 的磁性是以下的哪一种? ( A )反磁性( B )顺磁性( C )铁磁性( D )反铁磁性7. 四周体配合物大多拥有以下那种性质?( A )低自旋 ( B )高自旋 ( C )反旋 8. 在正方形配合物中,若四个配位体分别位于X 轴( D )铁旋Y 轴上,则最高能级的d 轨道是()。
结构化学练习题带答案
结构化学复习题一、选择填空题第一章量子力学基础知识1.实物微粒和光一样,既有性,又有性,这种性质称为性。
2.光的微粒性由实验证实,电子波动性由实验证实。
3。
电子具有波动性,其波长与下列哪种电磁波同数量级?(A)X射线 (B)紫外线(C)可见光(D)红外线4。
电子自旋的假设是被下列何人的实验证明的?(A)Zeeman (B)Gouy (C)Stark (D)Stern-Gerlach5。
如果f和g是算符,则(f+g)(f—g)等于下列的哪一个?(A)f2-g2;(B)f2—g2-fg+gf; (C)f2+g2; (D)(f—g)(f+g)6.在能量的本征态下,下列哪种说法是正确的?(A)只有能量有确定值;(B)所有力学量都有确定值;(C)动量一定有确定值; (D)几个力学量可同时有确定值;7.试将指数函数e±ix表示成三角函数的形式——--——8.微观粒子的任何一个状态都可以用来描述; 表示粒子出现的概率密度。
9。
Planck常数h的值为下列的哪一个?(A)1.38×10-30J/s (B)1.38×10—16J/s (C)6。
02×10—27J·s (D)6.62×10—34J·s 10。
一维势箱中粒子的零点能是答案: 1.略。
2。
略. 3。
A 4。
D 5.B 6。
D 7.略 8.略 9。
D 10。
略第二章原子的结构性质1。
用来表示核外某电子的运动状态的下列各组量子数(n, 1, m, m s)中,哪一组是合理的?(A)2,1,—1,—1/2;(B)0,0,0,1/2; (C)3,1,2,1/2; (D)2,1,0,0。
2。
若氢原子中的电子处于主量子数n=100的能级上,其能量是下列的哪一个: (A)13。
6Ev;(B)13。
6/10000eV; (C)-13。
6/100eV;(D)—13.6/10000eV;3.氢原子的p x状态,其磁量子数为下列的哪一个?(A)m=+1;(B)m=—1;(C)|m|=1; (D)m=0;4.若将N原子的基电子组态写成1s22s22p x22p y1违背了下列哪一条?(A)Pauli原理;(B)Hund规则;(C)对称性一致的原则;(D)Bohr理论5。
王顺荣编高教版社结构化学习题答案第6章
(dxy)
(dz2)
(dxz,dyz) LFSE(D4h)=-[2× 0.228+2× (-0.428)+4× (-0.514)] =2.456 所以,LFSE(D4h)>LFSE(Td),即 Ni2+的低自旋配合物通常为正四方形构型。 若 Ni2+的高自旋配合物呈四面体构型,则 d 电子排布如图:
14、为什么羰基配合物中过度金属原子可以是零价(例如 Fe(CO)5) ,甚至是负 价(例如[Co(CO)4]-)? 答:CO 分子的结构为:KK(3σ)2(4σ)2(1π)4(5σ)2(2π)0 可见 CO 分子 中既有低能的 π 占有轨道----1π,又有高能的 π 空轨道----2π,CO 被占用的分子 轨道中,3σ 轨道中电子云大部分密集于 C 和 O 核之间,电子不易给出。4σ 轨道 中电子云主要集中于氧原子一侧, 由于氧的电负性较大, 电子也不易给出。 所以, 能对中心离子给予电子对而形成 σ 键的 CO 的分子轨道只有 1π 和 5σ 轨道。 在 Fe(CO)5 中,中心原子与配位体 σ 轨道,即 CO 的 5σ 轨道可形成 a1g t1u 和 eg 成键 σ 轨道,有 5 个 CO 共 10 个电子填充。这相当于配位体上的电子部分与中
结构化学第六章 配位化合物和簇合物的结构与性质习题解答
组员:林景 070601332 邱丽清 070601327 王华 070601328 林培海 070601349
黄水英 070601329 余建红 070601330 刘梅丽 070601331
1、为什么大多数配合物都有鲜艳的颜色,而四面体 Zn2+的配合物却例外? 答: 配合物中心金属原子或离子的 d 轨道分裂后,在光照下 d 电子可从能级低的 d 轨道跃迁到能级高的 d 轨道,产生 d—d 跃迁和吸收光谱。由于 d—d 跃迁对应 的光子频率在近紫外和可见光区,故过渡金属配合物通常都有颜色。Zn2+的 3d 轨道已充满电子,它通常以 sp3 杂化 轨道形成配建,无 d—d 能级跃迁,电子跃 迁只能发生在 σ—σ*之间,能级差大,在可见光的短波之外。因此,在配位化合 物一般是无色的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第六章配位化合物结构与性质习题答案6150(1) [RhCl6]3-(2) [Ni(H2O)6]2+6001分裂成两组, d22yx 和2zd处于高能级,d xy,d yz,d xz处于低能级。
6002X-为弱场配体,CN-为强场配体, NH3介于两者之间。
6003(A)6004否6005(C)6006-2△06007此结论仅在O h场中,中心离子d 电子数n=4--7 时才成立。
6008-0.4△0×6 =-2.4△06009假设填T d空隙LFSE(Td)=[4×(-0.267△)+4×0.178△] = -0.356△假设填O h空隙LFSE(Oh)=[6×(-0.4△)+2×0.6△] = -1.2△Ni2+倾向填入稳定化能大的空隙中,所以NiAl2O4为反尖晶石。
6010小6011参看《结构化学基础》 (周公度编著) p.275 6012(1) t 2g 4 e g 2(2) - 0.4△ (3) │M s │=6π2h(4) μ= 26μβ6013(D) 6014能级次序: d 22y x -最高, 2d z 次之,d xy 再次之,d yz ,d xz 最低。
理由:①因z 方向拉长,相应xy 平面上的 4 个L 靠近,所以d 22y x -能级升高,d z2能级下降; ②因为 d xy 在xy 平面内,受L 的影响大,所以d xy 能级上升,而d yz , d xz 受xy 平面上的 4 个L 排斥小,所以能级下降。
③但因z 方向上方还有 1 个L,加之2z d 的"小环"在xy 平面上,可受到L 的直接作用,所以2d z 能级高于 d xy 能级。
6015O h 点群,说明Jahn-Teller 效应为 0,按强场排:( t 2g )6(e g )0LFSE =-2.4△0 6016(B), (D) 6017否 6018(B)6019(1) [Fe(CN)6]3-: μ= [n(n+2)]1/2μβ; n1= 1[FeF6]3-: n2= 5(2) 中心离子Fe3+为d5结构,配位场为八面体场。
[Fe(CN)6]3-: t2g 5; [FeF6]3-: t2g 3 e g 2。
(3) [Fe(CN)6]3-: 强场; [FeF6]3-: 弱场。
6020(D)6021CoF63-: 顺磁性-5200 cm-1Co(CN)63-: 反磁性-39600 cm-16022由键价理论可得:络合物未成对电子磁性[Fe(CN)6]4-0 反磁性[Fe(CN)6]3- 1 顺磁性[Mn(CN)6]4- 1 顺磁性[Co(NO2)6]3-0 反磁性[Fe(H2O)6]3+ 5 顺磁性[CoF6]3- 4 顺磁性由晶体场理论络合物未成对电子磁性[Fe(CN)6]4-0 反磁性[Fe(CN)6]3- 1 顺磁性[Mn(CN)6]4- 1 顺磁性[Co(NO2)6]3-0 反磁性[Fe(H2O)6]3+ 5 顺磁性[CoF6]3- 4 顺磁性6023(B)6024(D)6025χA < χB; λA < λB 6026三种:d xz( 或d yz)→d22yx-; 2dz→d22yx-; d xy→d22yx-。
6027(C)6028CoF63-: 13000 cm-1Co(NH3)63+: 23000 cm-1Co(CN)63-: 34000 cm-16029(A)6030(C)6031可见-紫外光谱6032Fe(H2O)62+: HS; Fe(CN)64-: LSFe2+的HS 的半径大于LS 的半径。
6033络合时:(1) C4H4的π轨道电子进入Pt 的空d 轨道;(2) Pt 的d 电子进入C4H4分子的π轨道。
这两个因素均降低π键强度,使 C--C 键增长。
6035当络合物有简并能级,电子未填满,出现简并态时, 络合物会发生变形,消除能级简并态,电子填入低能级,配合物趋向稳定。
6036d 4, d 9 6037(1) D 4h ; (2) 形成 1σ,2π,1δ四重键; (3) 保证δ键和π键形成。
6038(1) Re 3+[Xe]5d 46s 0,dsp 2杂化,尚有d xy ,d xz ,d yz , 2d z 四个d 电子, Re 和 Re 之间形成四重键: σ键: 2d z -2d z π键: d xz -d xz , d yz -d yzδ键: d xy -d xy 电子组态为2π4δ2 (2) [Re 2Cl 8]2-呈四方柱形; C 4, 4C 2, 4σv , σh , i ;D 4h 。
6039(D) 6040(A) 6041(D) 6042CuCl64-6043Fe(CN)64-, Ni(CN)64-: 正八面体Fe(H2O)62+, FeF64-: 八面体变形较小CuCl64-: 八面体变形大6044低自旋: 8 个d 电子集中在4 个d 轨道,空出的一个d 轨道和s,p 轨道形成dsp2杂化轨道,为平面正方形;高自旋: 8 个d 电子分布在5 个d 轨道,取sp3杂化,形成四面体形。
6045Mn3+:d4,高自旋态, Jahn-Teller 效应,发生畸变;Cr3+: d3, 无Jahn-Teller 效应,正八面体。
6046(A), (C) .6047Ni(NH3)42+, 正四面体, sp3杂化;Ni(CN)42-, 平面正方形, dsp2杂化。
6048Co(en)33+: 二种;[Co(NH3)4Cl2]+: 二种。
6049有四种6050ZnCl42-: 四面体形Ni(CN)42-: 平面四方形Mn(H2O)42+: 四面体形TiCl4: 四面体形Ni(CN)53-: 四方锥形6051有二种异构体: 3 个A 同在一个三角形三个顶点上, C3v; 不同在一个三角形上, C2v。
6052(A)6053(C)6054(C)6055(C)6066符合6067(C)6068Re 原子的4d xy6069Jahn-Teller效应指出:当遇到简并态时,配位化合物会发生变形, 使一个轨道能级降低,消除简并态。
Cu(en)32+的逐级稳定常数中,具有反常的最高K1,K2值和最低K3值。
6070螯合效应是指由螯合配位体形成的络合物,一般要比相同配位数和相同配位原子的单啮配位体形成的络合物稳定的效应。
实质是一种熵增效应。
6071(a) 2, (b) 2, (c) 3, (d)0, (e)1 。
6072(a) 0, (b) -2.4, (c) 0, (d) -2.4, (e) -0.4 。
6073每个C5H5都有5 个配位点和同一个Fe 原子结合。
6074每个CO 同时和两个Fe 原子结合成桥式结构。
6075对6076t2g6 e g4607736078三方双锥6079四方锥6080八面体6081见周公度《结构化学基础》p.280 。
6082h ν=∆。
=hc /λ λ=(hc ·N A )/ ∆。
=(6.626×10-34×2.998×108×6.023×1023)/(251.2×103)m=476nm 络合物吸收蓝─绿光,呈现其互补色─紫红色。
6083(E) 6084(D) 6085(1)Fe 2+离子半径,Fe(H 2O)62+>Fe(CN)64-(2)Fe(H 2O)62+: LFSE=-0.4∆。
=-4160cm -1 Fe(CN)64-: LFSE=-2.4∆。
=-79200cm -1(3)Fe(H 2O)62+:μ= μβ,顺磁性Fe(CN)64-:μ=0,反磁性6086金属原子簇化合物 6087单啮配位体:NH 3 非螯合多啮配位体:PO 43- 螯合配位体:EDTA,C 2O 42- 6088D 5d D 5hD 5 6089 ±61(z 1+z 2+z 3+z 4+z 5+z 6)6090±(z 3-z 6)/2 6091±(z 2-z 5)/2 6092±(z 1-z 4)/26093正八面体场的LFSE 比正四面体场的LFSE 大, 只有在d 0, d 10和弱场d 5时二者相等, 这意味着八面体构型比四面体构型稳定。
所以八面体构型比四面体多。
6094在八面体络合物中, 成键和非键分子轨道依能级增加的次序排列为a 1g , t 1u , e g 和t 2g 。
这九个轨道至多可容纳18个电子。
其中,六个配体贡献12个电子, 金属最多只能提供6个电子。
具有7个或7个以上d 电子的金属原子或离子, 其d 电子要占据反键轨道e g *, 因而不稳定。
6095分裂能随金属离子电荷增高而增大, Ni 4+电荷高, 使分裂能大于成对能,而采取低自旋排布t 2g 6e g *0 , 呈反磁性。
6096强场:∆0>P t 2g 6e g 0 未成对电子数为0 弱场: ∆0<P t 2g 4e g 2 未成对电子数为4 6097d xz , d yz 简并, 受到配体的斥力最小。
2d z 直指二个配体, 能量最高。
d 22y x -, d xy 简并, 能量居中。
6098根据羧基的特征振动差值∆=νa(--CO2-)-νs(--CO2-) 的大小可对上述三种配位方式作出区分:单啮配位(结构Ⅰ): ∆值比离子型化合物的∆值大得多(大于200cm-1)双啮配位(结构Ⅱ): ∆值比离子型化合物的∆值小得多桥式配位(结构Ⅲ): ∆值比双啮配位化合物的∆值大, 接近离子型化合物的∆值(约150cm-1)6099符合18电子规则: Fe原子周围价电子数为:8+2×3+1+3×1=186100存在M---M键; [Cl4Re≡ReCl4]2-6101(1)乙二胺四乙酸根EDTA4-中有六个配位点(四个N原子, 二个O原子),可以和Hg2+形成螯合物[HgEDTA]2-而排出体外, 因而得到治疗。
(2)将EDTA的钠盐,钙盐加到饮料等食物中, 使其与食物中痕量金属形成螯合物, 即螯合剂将金属离子隔离起来, 使金属不再对食物分解或氧化起到催化作用。
6102σ-π配键是金属羰基络合物和金属亚硝酰络合物稳定的一个重要因素。
因钛的d电子数很少, 所以很难形成反馈π键。
6103(C)6104(D)6105(C)6106(D)61073σg ; σ; 1πg ; π; σ-π6108(B)6109(D)6110高能级的空π*; π键6111(1)D 4h(2) d 22y x -sp 2杂化, 形成平面正方形配位;52d z -52d z 形成σ键; 5d xz -5d xz , 5d yz -5d yz 重迭形成二个π键;5d xy -5d xy 形成δ键; Re-Re 为四重键, 故较正常单键短。
