化工生产过程的衡算
化工原理物料衡算公式

化工原理物料衡算公式好嘞,以下是为您生成的关于“化工原理物料衡算公式”的文章:咱先来说说化工原理里的物料衡算公式,这玩意儿可重要啦!就像咱们过日子得算计着柴米油盐一样,化工厂里也得把各种物料的进出算得明明白白。
物料衡算公式简单来说,就是“进去的等于出来的”。
这听起来好像挺简单,可实际操作起来,那可得费一番心思。
我还记得有一次去一家化工厂参观,那是个生产化肥的厂子。
我看到工人们在控制台前忙碌着,各种仪表数据不停地跳动。
当时我就好奇,这生产过程中到底怎么保证原料不浪费,产品质量又有保障呢?后来和厂里的技术员交流才知道,物料衡算公式在这里面发挥了大作用。
比如说,他们要生产一定量的化肥,就得先根据物料衡算公式,算出需要投入多少原料。
而且,这个过程可不只是简单的加减乘除。
就拿氮元素来说吧,从原材料里含有的氮,到反应过程中氮的转化,再到最终产品里氮的含量,都得精确计算。
要是哪一步算错了,要么原料浪费了,增加成本;要么产品不合格,影响销售。
在化工生产中,物料衡算公式就像是一个严格的管家。
它能告诉我们每个环节物料的流向和变化,帮助我们优化生产工艺,提高生产效率,降低成本。
比如说,在一个连续的反应装置中,如果我们知道了进料的流量和组成,通过物料衡算公式,就能算出出料的流量和组成。
这就好比我们知道了家里每个月进了多少米、面、油,就能大概算出能做出多少顿饭一样。
而且,物料衡算公式还能帮助我们发现生产中的问题。
如果实际的出料和通过公式计算出来的结果不一样,那就说明可能哪里出了故障,比如有物料泄漏啦,或者反应不完全啦。
再举个例子,假设一个化工厂要生产一种塑料,需要用到两种原材料 A 和 B 。
根据化学反应式和物料衡算公式,我们知道每生产一定量的塑料,需要消耗一定比例的 A 和 B 。
如果在实际生产中,发现 A 消耗得比预期多,而 B 还有剩余,那就要找找原因了,是不是反应条件没控制好,还是某个设备出了问题?总之啊,化工原理中的物料衡算公式虽然看起来只是一些数字和符号的组合,但它背后可是有着大学问。
化工生产过程物料衡算能量衡算介绍课件

化工生产过程的特点
01 连续性:化工生产过程通常为连续生产,以保证生产效 率和产品质量。
02 复杂性:化工生产过程涉及多种化学反应和物理变化, 过程复杂,需要精确控制。
03 安全性:化工生产过程涉及易燃、易爆、有毒等危险物质, 需要严格控制生产条件和操作流程,确保生产安全。
04 环保性:化工生产过程会产生废气、废水、废渣等污染物, 需要采取有效措施进行环保处理,降低对环境的影响。
物料衡算能量衡算在化工生产过程中的作用
物料衡算:计算物料的投入和产出,确保生产过程的物料平衡,提高生产效 率。
能量衡算:计算生产过程中的能量消耗和产出,优化生产工艺,降低能耗, 提高能源利用率。
物料衡算能量衡算相结合:综合考虑物料和能量的平衡,优化生产工艺,降 低生产成本,提高生产效益。
物料衡算能量衡算在化工生产过程中的应用:广泛应用于化工生产过程的设 计、优化和改进,提高生产过程的安全性、环保性和经济性。
物料衡算在质量管理中的应用:物料衡算可以帮助分析产品 质量情况,从而制定质量控制措施和优化质量管理。
能量衡算的概念
能量衡算是化工生产过程中对能量 进行计算和分析的方法
能量衡算的目的是为了优化生产过 程,提高能源利用效率
能量衡算主要包括热能、机械能、 电能等能量的计算和分析
能量衡算可以帮助企业降低生产成 本,减少能源消耗,提高生产效率
视觉效果:运用色彩、图片、动画等元素,提高课 件的视觉效果和吸引力
互动设计:设置提问、讨论、练习等互动环节,提 高学员的参与度和学习效果
课件制作工具:选择合适的课件制作工具,如 PowerPoint、Keynote等,提高制作效率和质量
能量衡算的应用
优化生产工艺:通过能量衡 算,可以优化生产工艺,提 高生产效率
化工过程设计 第三章 物料衡算与热量衡算(1)

各流股组份数一览表
HAC 24%
11 循环流 进料 HAC 30% H2O 69.8% H2SO4 0.2% 萃 取 塔 4
流股号 1 2 3
组份数 3 3 3 4 2 2 2 2
1
2
12
3
混合器1
4
5 6 7 8 9 10 11 12
E 7% HAC H2O H2SO4 混合器2
溶 剂 回 收 塔
7(2) E 99% H2O 1%
附加关系式数
自由度
9(4)
(2)溶剂提馏塔及整体的自由度分析
11(2) 循环流
HAC 24%
进料 HAC 30% 1(3) H2O 69.8% H2SO4 0.2% 混合器1 2(3)
萃 取 塔
3(3) 12(2) 溶 剂 回 收 塔 产品流 HAC 99% H2O 1% 产 品 精 馏 塔
独立MB方程数
已知流股变量数 已知其它关系式数 自由度 2、具体MB计算(略)
在开始下一节讲授之前,大家先考虑一个精馏塔的MB问题。 例题:有人提出了一个无反应的单精馏塔流程的方案,试做其MB计算:
100 C3 i-C4 i-C5 C5 kmol/h 0.20 0.30 0.20 0.30
2 1 精 馏 塔 3
MB与HB计算是化工工艺设计中最基本,也是最主要的计算内容。
一、化工流程(过程)中MB、HB、EB三者之间的关系 1、MB与HB之间的关系 MB有可能能单独(不依赖HB而独立)求解; HB一般不能单独求解; (间壁式换热器除外) 当MB不能独立求解时,它就必须与HB联合起来,求解CB。 2、EB与HB之间的关系 流程压力水平不高,而且压力变化也不大,系统能量只考虑其热 焓,而忽略其动能、势能等机械能,在这种情况下:
化工设计物料衡算和热量衡算

化工设计物料衡算和热量衡算化工设计中的物料衡算和热量衡算是其重要组成部分,对于化工过程的正常运行和优化具有重要意义。
物料衡算主要是指对于化工过程中的原料、中间产物和最终产物的质量和数量进行计算和控制的过程。
而热量衡算则是指对于化工过程中的能量平衡的计算和分析。
化工设计中的物料衡算首先需要确定化工过程的原料组成和性质,包括原料的化学成分、物理性质和纯度等。
根据原料的性质和化学反应方程,可以计算出原料的消耗量和产物的生成量。
同时,还需要考虑到原料的损失和副反应的发生,以及可能的回收和再利用,从而对原料的总需求进行准确的衡算。
此外,物料的运输和储存也需要考虑到,包括原料的装卸和包装,以及仓库的容量和仓储条件等。
在化工过程中,热量的衡算是不可或缺的。
热量衡算主要包括热量输入和输出的计算和分析。
热量输入一般是通过化学反应或物理过程得到的,主要包括燃烧、加热和蒸发等。
热量输出则是指化工过程中热量的损失和传递,包括冷却、换热和放热等。
通过准确的热量衡算,可以确定化工过程中的热能转化效率和能量消耗情况,从而对能源的利用进行优化和改进。
在物料衡算和热量衡算中,还需要考虑到化工过程中可能存在的变化和调整。
化工过程中的原料组成和性质可能会随着时间的推移而发生变化,例如反应的进程或携带物等。
因此,在衡算过程中需要对变化因素进行考虑,并进行相应的调整。
例如,可以通过实验和模拟等手段对原料的性质和反应条件进行测定和预测,从而对衡算结果进行修正和优化。
总之,物料衡算和热量衡算是化工设计中的重要内容,对于化工过程的正常运行和优化具有重要的影响。
通过准确的物料衡算,可以确定化工过程中的原料需求和产物生成量,并进行合理的储存和管理。
通过热量衡算,可以确定化工过程中的能量平衡和热能转化效率,从而对能源的利用进行优化。
这些衡算结果可以为化工过程的生产计划、产品质量控制和能源管理提供重要参考。
热量衡算
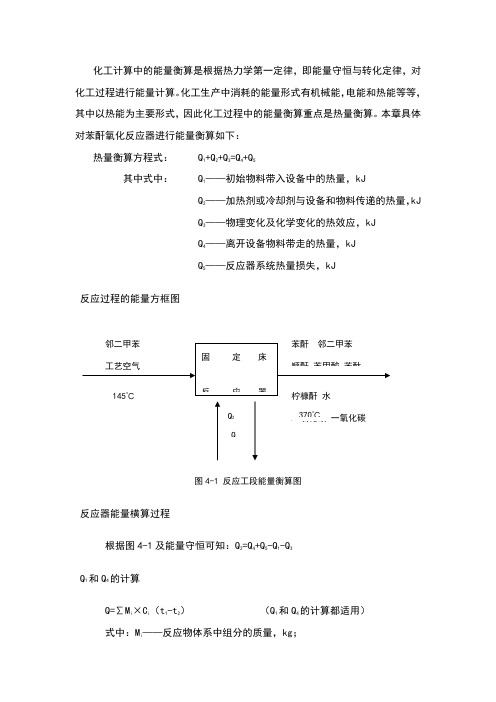
化工计算中的能量衡算是根据热力学第一定律,即能量守恒与转化定律,对化工过程进行能量计算。
化工生产中消耗的能量形式有机械能,电能和热能等等,其中以热能为主要形式,因此化工过程中的能量衡算重点是热量衡算。
本章具体对苯酐氧化反应器进行能量衡算如下:热量衡算方程式: Q1+Q2+Q3=Q4+Q5其中式中: Q1——初始物料带入设备中的热量,kJQ2——加热剂或冷却剂与设备和物料传递的热量,kJQ3——物理变化及化学变化的热效应,kJQ4——离开设备物料带走的热量,kJQ5——反应器系统热量损失,kJ反应过程的能量方框图图4-1 反应工段能量衡算图反应器能量横算过程根据图4-1及能量守恒可知:Q2=Q4+Q5-Q1-Q3Q1和Q4的计算Q=∑Mi×Ci(t1-t2)(Q1和Q4的计算都适用)式中:Mi——反应物体系中组分的质量,kg;C i ——组分i 在0-T℃时的平均比热容,KJ/; t 1,t 2——反应物系在反应前后的温度,℃。
物料进入设备时的温度为145℃,热量衡算的基准为145℃,△T=0,则: Q 1=0查得各物项平均比热容数据: (kJ/kg.℃)表4-1 各物相平均比热容所以: ()21i i 4t C M Q t -=∑=××(370-145)+××225+××225+××225+××225+××225+××225+××225+××225+××225+××225=.4kJ 过程Q 3的计算过程热效率可以分为两类:一类是化学过程的热效率即化学反应速率;另一类是物理过程热效率。
物料化学变化过程,除化学反应外,往往伴随着物料状态变化热效率,但本工艺流程中物理过程热效率较低,可以忽略不计,该过程皆为放热反应,则过程热效率可以由下式计算:主反应:C 8H 10+3O 2→C 8H 4O 3+3H 2O + Q 3-1=×103×=×103kJ/h副反应:CH 3C 6H 4CH 3+→C 4H 2O 3(顺酐)+4CO 2+4H 2O + Q 3-2=×103×=×103kJ/hCH 3C 6H 4CH 3+3O 2→C 6H 5COOH (苯甲酸)+CO 2+2H 2O +Q3-3=×103×=×103kJ/hCH3C6H4CH3+2O2→C8H6O2(苯酞)+2H2O +Q3-4=×103×=×103kJ/hCH3C6H4CH3+→C5H5O3(柠槺酐)+3CO+3H2O +Q3-5=×103×=×103kJ/hCH3C6H4CH3+→8CO+5H2O +Q3-6=×103×=×103kJ/hCH3C6H4CH3+→8CO2+5H2O +Q3-7=×103×=×103kJ/h 继而得到:Q 3 = Q3-1+Q3-2+Q3-3+Q3-4+Q3-5+Q3-6+Q3-7 =×103kJ/hQ5的计算该反应中的热损失按5%计算,即:Q 5=5%×(Q1+Q3)=5%×(0+×103)=×103kJ/hQ2的计算Q2为熔岩移出反应器的热量,由反应器热量守恒可知:Q 2=Q4+Q5-Q1-Q3=.8kJ/h反应器能量衡算表根据以上计算列出氧化反应工段能量衡算表格如下:表4-2 反应工段能量衡算表(吸收热量为“+”,释放热量为“-”)。
化工计算第四章物料衡算及课后习题及答案

第一节 物料衡算式 4—1 化工过程得类型
间歇操作 操作方式 半连续操作
连续操作
间歇操作: 原料一次加入,然后操作,最后一次出 料。
半连续操作: 进料分批,出料连续;或进料连 续,出料分批或一次。
特点: 间歇操作中,无物料进出设备,且设备内各 部分得组成和条件随时间而变。 半连续操作中,设备内各点得参 数(组成、条 件)随时间而变。
N元素平衡
2×0、79A=2N
烟道气总量
M+N+P+Q=100
过剩氧量
0、21A×0、25/1、25
=M 解上述6个方程得要求得结果。(过程略)
由上例可知计算基准选取恰当与否,对计算难 易影响。所以要重视计算基准选取。
基准选取中几点说明:
(1)上面几种基准具体选哪种(有时几种共 用)视具体条件而定,难以硬性规定。
4、 写出化学反应方程式
包括所有主副反应,且为配平后得,将各反应 得选择性、收率注明。
5、选择合适得计算基准,并在流程图上注明基准值 计算中要将基准交代清楚,过程中基准变换时,
要加以说明。 6、列出物料衡算式,然后求解
1)列物料衡算式
无化学反应体系,按:(4—1)、(4—3)(连续稳定过程) 式。
(二)取1mol 空气为计算基准 1mol 空气为计算基准中氧量为0、21mol
燃烧丙烷耗氧量 0、21/1、25=0、168 mol 燃烧丙烷得量 0、168/5=0、 0336mol
衡算结果列于下表:
输
入
输
出
组分 摩尔 克 组分 摩尔 克
C3H8 0、
44 CO2 0、101 132
0336
O2 0、21 200 H2O 0、135 72
化工生产过程物料衡算和能量衡算

化工生产过程物料衡算和能量衡算一、物料衡算物料衡算主要是对物料在生产过程中的流动进行定量分析和计算。
它包括物料的进出口流量、过程中的转化和损失等方面。
物料衡算的目的是确定物料的流动情况,以控制和优化生产过程。
物料衡算通常涉及以下几个方面:1.原料的输入和产物的输出:从化工生产过程的角度来看,物料衡算的第一步是确定原料的输入和产物的输出。
这可以通过物料的质量或体积以及流量来衡量。
2.过程中的转化:化工生产过程中,原料经过一系列的化学反应、物理过程和分离步骤,转化成所需的产物。
物料衡算需要确定过程中每个反应、过程或分离步骤涉及的物料流量和转化率,以及产物的纯度和收率。
3.丢失与损耗:化工生产过程中常常存在物料的丢失和损耗,如挥发、固体颗粒的落地损失等。
物料衡算需要考虑这些损耗,并尽量减少它们的发生。
物料衡算的重要性在于通过对物料流动的定量分析,可以帮助工程师了解和控制生产过程中的物料转化、损耗和产物生成情况,从而优化生产过程。
二、能量衡算能量衡算是对化工生产过程中能量转换的定量分析和计算。
它涉及到能源的输入与输出以及能量的转化。
能量衡算可用于改善能源效率,减少能源消耗和废弃物的排放。
能量衡算主要包括以下几个方面:1.能源输入:能源是化工生产过程中的重要驱动力之一,常见的能源包括电能、燃料、蒸汽等。
能量衡算需要确定能源的类型、质量或热值、消耗量和运用效率。
2.能量转化:化工生产过程中会发生能量的转化,如化学反应产生的热能、电能转化为机械能等。
能量衡算需要考虑这些能量转化过程,并计算能量的转化率和损耗。
3.能源的输出:化工生产过程中也会有能源的输出,如废热、废气、废水等。
能量衡算需要确定这些能源输出的类型、质量或热值、排放量以及处理方式。
能量衡算的目的是优化能源的利用,提高能源效率,减少能源消耗和环境污染。
通过定量分析和计算能量流动,能量衡算可以帮助工程师了解和控制能源输入与输出,寻找能源转化和能耗的瓶颈,提出改进方案,提高生产过程的能量利用率。
化工计算能量衡算

化工计算能量衡算引言化工过程中,能量的衡算是一个重要的步骤。
能量衡算可以帮助工程师了解化工过程中的能量转化和能量损失情况,从而优化工艺和提高能源利用效率。
本文将介绍化工计算能量衡算的基本原理和方法,并以实际案例进行说明。
一、能量的基本概念在进行能量的衡算之前,我们需要先了解能量的基本概念和单位。
能量是物体或系统所具有的做功能力,它是物质存在的一种属性。
能量的单位通常用焦耳(J)表示。
以下是一些常见的能量单位:•千焦(kJ)= 10^3 J•兆焦(MJ)= 10^6 J•吉焦(GJ)= 10^9 J此外,化学工程中经常使用的能量单位还有千卡(kcal)和英尺磅(ft-lbf)等。
二、能量转化和传递能量在化工过程中会发生转化和传递。
常见的能量转化包括热能转化为机械能、化学能转化为热能等。
能量传递则是指能量从一个物体传递到另一个物体。
能量转化和传递的过程可以通过能量平衡方程表示。
能量平衡方程的一般形式为:$$E_{in} - E_{out} = \\Delta E_{sys}$$其中,E in表示系统收入的能量,E out表示系统输出的能量,$\\Delta E_{sys}$表示系统内能的变化。
能量平衡方程是能量衡算的基础,通过对各个能量项进行计算和衡量,可以得到系统能量的全面情况。
三、能量衡算的方法能量衡算的方法包括物料平衡法、焓平衡法和热力学计算法等。
下面分别介绍这些方法的主要原理和应用。
3.1 物料平衡法物料平衡法是一种根据物料的进出量来计算能量收支的方法。
它基于质量守恒定律,假设在化工过程中物料是不可压缩和不可消失的。
使用物料平衡法进行能量衡算的一般步骤如下:1.确定系统边界,包括进出口和反应器等;2.收集进出口的物料信息,包括物料的质量、温度、压力等;3.列出物料平衡方程,根据质量守恒定律得到进出口物质量的关系;4.根据进出口物料的属性,计算出相应的能量。
物料平衡法可以应用于各种化工过程,包括反应器、蒸馏塔、萃取塔等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化工生产技术
案例分析
化工生产技术
【例2】 年产8000 t工业甲醛的物料衡算 (1) 计算范围 全装置。见图16-5。 (2) 主副反应 反应式见计算过程。甲醇发生五个反应的分配 率为主氧化51.2%,脱氢39.2%,加氢0.6%,深度氧化0.8%, 完全氧化8.2%。 (3) 计算任务 甲醇消耗量,干尾气摩尔组成。 (4) 基准 年工作时为7200 h。以1 h为基准。8000×1000 kg÷7200 h = 1111.11 kg/h (5) 选择数据 工业甲醛中甲醛质量含量为37.0%。甲醇转化 率为93.0%。原料甲醇质量组成:甲醇98%,水2%。氧与甲醇 的配比为0.365(mol)。配料水蒸气与甲醇—空气混合气的质 量比为0.3,忽略损失。
化工生产技术
项目三:化工生产过程的分析
任务3-2:化工生产过程的衡算
化工生产技术
上一次任务回顾
1、化工生产中常用的工艺指标有哪些? 2、全程转化率和单程转化率有何区别? 3、转化率和收率有何区别? 4、消耗定额一般分为哪两种?
化工生产技术
任务描述
通过白炭黑的生产技术设计过程,我们已经知道,一 种化工产品的生产过程要经过多个生产工序才能完成,在 化工生产过程中,需要对一系列的参数进行控制,以确保 生产顺利进行。 上一次任务中我们已经了解了化工生产过程中需要的 主要工艺指标。 本次任务是我们能根据生产过程的工艺要求,进行相 应的物料及热量衡算。
案例分析
化工生产技术
案例分析
化工生产技术
案例分析
化工生产技术
案例分析
化工生产技术
案例分析
化工生产技术
案例分析
化工生产技术
案例分析
化工生产技术
案例分析
一、流程简介 1.乙苯脱氢工段 2.精馏工段
化工生产技术
【应用实例】 设计年产1000吨苯乙烯车间的物料衡算
案例分析
8 9 13 11
知识点分析
化工生产技术
6、物料衡算的基本方法 (1)无反应过程的物料衡算:只有物理变化而没有化学反 应的单元操作,例如混合、蒸馏等。化工单元操作 (2)反应过程的物料衡算:必须考虑化学反应中生成和消 耗的物质量。 ①直接求算法:通过化学反应利用转化率、收率等直接 计算。例如课本47页例2.1.3。 ②利用联系物料做衡算 惰性物料:生产过程中不参加反应的物料。例如乙苯脱 氢生产苯乙烯过程中,水蒸气就是一种惰性物料。生产 中氮气是常见的惰性物料,可作为衡算联系物。 ③以结点做衡算:中间产品组成不符合要求时,需要采用 旁路调节才能达到合格,通常以旁路连接点作衡算。
案例分析
一、利用联系物做衡算
化工生产技术
若F和P分别表示输入系统物料量和从系统输出的物料量, 则存在下列关系: F •XT,F= P •xT· P XT,· F__衡算联系物在输入F中的质量 xT· P—衡算联系物在输出P中的质量 例1:甲烷和氢气的混合气用空气完全燃烧来加热锅炉, 生成的水蒸气全部进入烟道气。生成烟道气100mol。烟 道气摩尔组成为:氮72.18%,二氧化碳8.11%,氧2.44%, 水蒸气17.27%,做物料衡算。燃料气中甲烷与氧的比例 如何?空气与燃料气的比例如何?
案例分析
反应过程的物料衡算式
化工生产技术
m 入 m出
整个循环过程的物料衡算式
m反 m产
m新 m粗 m放
m新—新鲜反应物的质量 m粗—粗成品的质量 m放—放空物料的质量
放空物料量占分离剩余物料量的百分率称为放空率α。 循环物料量占分离剩余物料量的百分率称为循环率β。 放空率与循环率之和为100%
案例分析
化工生产技术
循环过程有三个过程限制参数,它们是循环比、混合比和排 放比
循环比 循环物流流量 产品物流流量
R P
混合比
循环物流流量 新鲜原料流量
R FF
排放比
排放物流流量 新鲜原料流量
W FF
案例分析
乙炔法年产3000 t 氯乙烯反应器的 物料衡算
化工生产技术
案例分析
知识点分析
二、热量衡算
化工生产技术
1、定义:利用能量守恒原理,通过计算传入或传出的 热量以确定加热剂(或冷却剂)用量,设备 需要传递的热量多少等,为工程设计、设备 设计提供依据。是化工生产中主要的能量衡 算方式之一。 2、分类: (1)单元设备热量衡算:单元操作过程热量衡算及反应 器的热量衡算。 (2)生产系统热量衡算:一个换热系统、一个车间或全 厂的热量进行衡算。
V2 989.13
V0 2340.78
V3 969.36
V4 2321
案例分析
三、循环过程物料衡算
化工生产技术
假设惰性物质和副产物全部进入循环物流,则
·
·
案例分析
化工生产技术
整个过程可划分为1个总系统和包括三个物理过程(混合、 分离、放空分流)以及一个反应过程的4个子系统。总系统 的物料衡算提供新鲜原料和产品之间的关系。 三个物理过程中,各物料流的质量m守恒,物料流中各 组分的质量mi守恒, 物料流的物质的量n守恒,物料流中各 组分的物质的量ni也守恒。
ห้องสมุดไป่ตู้
尾气 %(质量)其它 乙苯 (0.2) 苯乙烯 (0.3) 水蒸气 (0.03) 二甲苯 (0.5) 苯 (4.5) 甲苯 (1.2) 一氧化碳 (100) 二氧化碳 (100) 氧 (100) 甲烷 (100) 乙烯 (100) ∑ 炉油 %(质量)其它 乙苯 苯乙烯 焦油 (40) 二甲苯 苯 甲苯 ∑
化工生产技术
水 蒸 气 新鲜乙苯 3 4 1 2 7
循 环 乙 苯
5 6 19 去废水处理 12 去精馏段
图16.1.6 乙苯脱氢反应流程图 1-贮罐;2-泵;3-乙苯蒸发器;4-第一预热器;5-第二预热器;6-脱氢反应器;7-换热器; 8-冷水凝器;9-盐水冷凝器;10-油水分离器;11-气液分离器;12-阻凝剂配制槽;13-旋风分离器
知识点分析
化工生产技术
5、物料衡算的基本步骤 (1)确定衡算范围:画流程框图,确定体系边界(虚线)
(2)收集整理计算数据: 设计任务数据:生产规模、生产时间、转化率、收率等 物理性质数据:质量、密度、反应平衡常数等 工艺参数: 温度、压力、流量等。
知识点分析
3、列出化学反应方程式
化工生产技术
4、选择合适的计算基准: 时间基准:一段时间为基准,如一天、一小时等 质量基准:体系为液固相时,以原料或产品的质量 为基准,如1kg 、100kg等 体积基准:气体物料,应以物料在标准状况下的 体积 为基准。 5、列出物料衡算式、求解 6、整理、校核计算结果:物料流程图
知识点分析
化工生产技术
6、物料衡算的基本方法 (3)循环过程的物料衡算: ①循环过程:化工生产中,为了保证原料的充分利用,将 未反应的原料分离出来,重新投入反应器循 环利用的过程。
图1 循环过程的物料流程图(无排放)
知识点分析
化工生产技术
图2 循环过程的物料流程图(有排放) 注意:经过分流器的物料组成不发生变化, 即S、W、R的组成相同。
化工生产技术 做什 么? 进行生产衡算 能力
能进行物料衡算
素 质
能进行热量衡算 物料衡算的依据
如何 做?
知识
物料衡算基本步骤 物料衡算的方法 热量衡算的依据
团 结 协 作 密 切 配 合
化工生产技术
任务实施
师生一起
知识点 分析 1、基本理论 2、基本依据 3、基本步骤 4、………… 5、…………
结点A V0=V1+V2 结点B Vl+V3=V4
V2 不合格产品 V0 A V1 B V3 V4 合格产品
图 16.1.1 以结点做衡算的示意图
案例分析
化工生产技术
【例2】 某工厂用烃类气体制合成气生产甲醇。合成 气体量为2321 m3/h,摩尔比为CO:H2=1:2.4。转化 后的气体摩尔组成为:CO 43.12%,H2 54.2%,不 符合要求。将部分转化气送去CO变换反应器和CO2脱 除装置,置换脱CO2后,气体摩尔组成为: CO 8.76 %,H2 89.75%,气体体积减小2%。用此变换气调节 转化气,以便达到工艺要求。求转化气、变换气各为 多少? 结点A(m3) V1 1351.64 结点B(m3) V1 1351.64
案例分析
物料衡算表
物料名称 分子量 输入 物质的量/mol 质量/g 甲烷 氢 氧 氮 二氧化碳 水 总计 16 2 32 28 44 18 8.11 1.06 19.19 72.18 129.76 2.12 614.08 2021.04
化工生产技术
输出 物质的量/mol 质量/g
2.44 72.18 8.11 17.28
78.08 2021.04 356.84 311.04
100.54
2767
100.01
2767
案例分析
二、利用结点做衡算
化工生产技术
在生产中有些中间产品的组成不符合生产要求,需要采用旁路调节 才能达到合格。在这种情况下,以旁路联结点作物料衡算较方便。 两股物料汇合(混合)称为并流,一股物料成为两股物料(旁路) 称为分流。分流的联结点与并流的联结点均称为结点。 旁路分流和混合并流都是物理过程。由于没有化学变化,因此可以 对总物料及其中某组分进行衡算。如图所示。
循环乙炔 新鲜乙炔 混合乙炔 混合物 驰放乙炔
混合器
反应器
分离塔
粗产物
图 2.1.1 乙炔与醋酸合成醋酸乙烯酯流程
知识点分析
一、物料衡算
化工生产技术
2、分类: (1)衡算范围:单元操作与全流程操作物料衡算。 (2)操作方式:连续操作物料衡算与间歇过程衡算 (3)计算方法:一段工序的衡算及新工段的衡算。 3、物料衡算的依据和范围 (1)依据:质量守恒定律 (2)范围:以物料体系作为主体划分边界。 环境:在物料体系边界之外的空间和物质 封闭体系:与环境没有质量交换的体系 敞开体系:与环境有质量交换的体系
