第12章s区元素课后习题答案
第十二章 s区元素

5、举例说明铍与铝的相似性。 、举例说明铍与铝的相似性。
答:Be 和Al 单质及化合物性质有许多相似之处,可以从以下 几个方面来理解: (1) Be 和Al 都是两性金属,不仅能溶于酸也都溶于强碱,放 出氢气; (2) Be 和Al 的氢氧化物都是两性化合物,易溶于强碱; (3) Be 和Al 都是共价化合物,易升华,聚合,易溶于有机溶 剂; (4) Be 和Al 常温下不与水作用,与冷的浓硝酸接触时都发生 钝化现象; (5) Be 和Al 的盐都易水解。
12、关于s 区元素的性质下列叙述中不正确的是 A、 由于s 区元素的电负性小,所以都形成典型的离子型化 、 由于 区元素的电负性小, 合物 B、 在s 区元素中,Be、 Mg 因表面形成致密的氧化物保护 膜而对水较稳定 C、 s 区元素的单质都有很强的还原性 D、 除Be、 Mg 外,其他s 区元素的硝酸盐或氯酸盐都可做 焰火材料 13、关于Mg , Ca , Sr , Ba 及其化合物的性质下列叙述中不正确 的是 A、 单质都可以在氮气中燃烧生成氮化物M3N2 B、 单质都易与水、水蒸气反应得到氢气 、 单质都易与水、水蒸气反应得到氢气(p378) C、M(HCO3)2 在水中的溶解度大于MCO3 的溶解度 (p392) D、这些元素几乎总是生成+2 价离子
碳酸盐受热分解的难易程度与阳离子的极化作用 有关。阳离子对CO32-离子的极化作用,使CO32-不稳定 离子的极化作用, 有关。阳离子对 以致分解,极化作用越大越易分解。 质子) 以致分解,极化作用越大越易分解。H+(质子)的极 化作用超过一般金属离子,所以有下列热稳定性顺序: 化作用超过一般金属离子,所以有下列热稳定性顺序: M2CO3>MHCO3>H2CO3 p430另外一种解释 另外一种解释
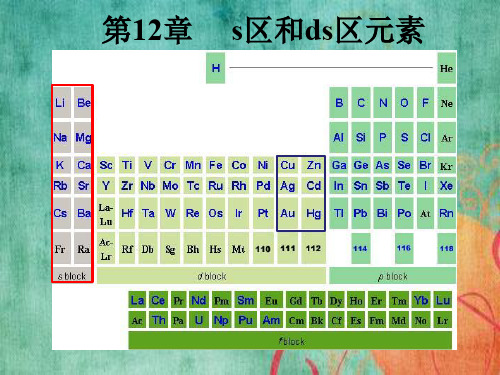
s区和ds区元素吉林大学无机化学
H 2 (g)
HCl
③ Cu,Ag,Au可溶于氧化性酸
Cu 4HNO3 (浓) Cu(NO 3 )2 2NO2 2H 2O Ag 2HNO3 (浓) AgNO 3 NO2 H 2O Cu 2H 2SO4 (浓) CuSO 4 SO2 2H 2O 2Ag 2H 2SO4 (浓) Ag 2SO4 (s) SO2 2H 2O Au 4HCl(浓) HNO3 (浓)
3Hg 8HNO3 (稀,过量) Hg(NO 3 )2 2NO 4H 2O
6Hg(
过量)
8HNO
3
(稀)
冷
3Hg
2
(NO
3
)
2
(4) 锌与OH-,NH3反应
2NO 4H 2O
Zn
2OH
2H 2O
Zn(OH)
24
H2
Zn
4NH3
2H 2O
Zn(NH
4Au 8NaCN 2H2O O2 4Na[Au(CN)2 ] 4NaOH
2
Au(CN
)2
Zn
Zn(CN
)
2 4
2
Au
Solvay制碱法(氨碱法)
海水
饱和吸收氨的海水
NH3
NaCl,H2O
CaCO3 煅烧
CaCO3CaO+CO2
NaCl
CO2
H2O NH3
Na++Cl-+NH3+CO2+H2O NaHCO3(s)+NH4++Cl-
s区元素

第9章 s 区元素【9-1】试说明碱金属和碱土金属在同一族从上到下,同一周期从左到右下列性质递变的情况:(1)离子半径,(2)电离能,(3)离子水和能。
并解释原因。
解:(1)碱金属和碱土金属从上到下离子半径增大,这是因为随着主量子数的增加,外层电子在核外出现概率最大的距离明显增加;在同一周期中,从左到右离子半径减小,这是因为随着核电荷的增加,核对于核外电子的吸引力(即有效核电荷)增强的缘故。
(2)碱金属和碱土金属从上到下电离能减小,是因为随着原子半径的增加,原子核对外层电子的束缚力减小;在同一周期中,从左到右电离能增大,这是因为随着有效核电荷的增加,和对外层电子的束缚力增加的缘故。
(3)碱金属和碱土金属从上到下水合能减小,这是因为随着原子序数增加,离子半径增加,正离子与水分子相互作用力减小的缘故。
在同一周期中,从左到右水合能增加,碱土金属离子在水溶液中,均为正二价离子,所以电荷高于正一价碱金属离子的缘故。
【9-2】锂、钠、钾在氧气中燃烧生成何种氧化物?这些氧化物与水反应情况如何?以化学方程式来说明。
解:分别生成Li 2O 、Na 2O 2、KO 2 ; 【9-3】写出下列反应方程式: (1)Al 溶于NaOH 溶液中 (2)Ba(NO 3)2加热分解 (3)Na 2O 2+CO 2 (4)CaH 2+H 2O(5)Na 2O 2+Cr 2O 3(6)K+KNO 3解:(1) 2Al + 2NaOH + 6H 2O = 2NaAl(OH)4 + 3H 2↑(2)Ba(NO 3)2 = Ba(NO 2)2 + O 2↑(3) 2Na 2O 2 + 2CO 2 =2NaCO 3 + O 2(4) CaH 2 + 2H 2O =Ca(OH)2 + 2H 2↑(5) 3Na 2O 2 + Cr 2O 3 = 2Na 2CrO 4 + Na 2O(6) 10K + 2KNO 3 = 6K 2O + N 2↑【9-4】比较下列性之的大小: (1)溶解度:CsI ,LiI ,CsF ,LiF ,LiClO 4,KClO 4 (2)碱性的强弱:Be(OH)2, Mg(OH)2,Ca(OH)2, NaOH (3)分解温度:Na 2CO 3,NaHCO 3,MgCO 3, K2CO 3 (4)水和能:Na +, K +,Mg 2+,Be 2+ 解:(1)溶解度:CsI<LiI; CsF>LiF; LiClO 4>KClO 4(2)碱性的强弱:Be(OH)2<Mg(OH)2<Ca(OH)2<NaOH (3)分解温度: K 2CO 3>Na 2CO 3> MgCO 3>NaHCO 3 (4)水和能:Na +>K +> Be 2+>Mg 2+【9-5】解释下列事实:(1)卤化锂在非极性溶剂中的溶解度大小顺序为LiI >LiBr >LiCl >LiF 。
12ds区元素

第一节 铜族元素 第二节 锌族元素
ds 区元素
无机化学
第一节
一、铜族元素概述 二、铜的重要化合物 三、银的重要化合物
铜族元素
无机化学
一、铜族元素概述
第 11 族元素包括铜、银、金三种元素,通常 称为铜族元素。
(一) 铜族元素的通性
铜族元素的外层电子组态为 (n-1)d10ns1。由于 18 电子层组态对原子核的屏蔽效应比 8 电子层组态 要小,因此铜族元素原子作用在最外层电子上的有 效核电荷较多,最外层的 s 电子受原子核的吸引比 碱金属元素原子要强得多,所以铜族元素的电离能 比同周期碱金属元素显著增大,原子半径也显著减 小,铜族元素单质的化学性质远不如相应的碱金属 元素的单质活泼。
无机化学
3. 硫酸铜 五水合硫酸铜俗称胆矾或蓝矾。CuSO4 ·5H2O 是蓝色晶体,受热后逐步脱水,最后生成无水硫酸 铜:
CuSO4 5H2 O
无机化学
375 K
CuSO4 3H2 O
386 K
CuSO 4 H 2 O
531 K
CuSO4
在 CuSO4 ·5H2O 中,五个 H2O 的结合力是不 2 SO 同的。其中四个 H2O 和两个 4 位于变形八面体 的六个顶点,四个 H2O 处于平面正方形的四个角 上,两个 SO2 4 位于平面正方形的上方和下方,第 五个 H2O 以氢键与两个配位 H2O 和两个 SO2 4 结 合。加热时,先失去两个非氢键水分子,再失去 另外两个氢键水分子,最后失去以氢键与 SO2 4 结 合的水分子。
-582 -2121
2083
-485 ─ 285 1.9
1987
-644 ─ 约 385 2.4
第十二章 s区元素

§12.3 s区元素的化合物
12.3.1 氢化物 12.3.2 氧化物 12.3.3 氢氧化物 12.3.4 重要盐类及其性质 12.3.5 配合物
12.3.1 氢化物
s区元素的单质(除Be、Mg外)均能与氢 形成离子型氢化物。 1.均为白色晶体, 热稳定性差 LiH NaH KH RbH CsH NaCl
第三篇 元素化学
第十二章 s区元素
§12.1 s区元素概述 §12.2 s区元素的单质 §12.3 s区元素的化合物 §12.4 锂与铍的特殊性
对角线规则
§12.1 s区元素概述
碱金属(IA ):ns1 Li, Na, K, Rb, Cs, Fr
碱土金属(IIA ):ns2 Be, Mg, Ca, Sr, Ba, Ra 都是活泼金属。
3.形成配位氢化物
4LiH AlCl 3 (无水)乙醚Li[AlH 4 ] 3LiCl 铝氢化锂
Li[AlH 4 ] 受潮时强烈水解 LiAlH 4 4H 2O LiOH Al(OH) 3 4H 2
12.3.2 氧化物
1.形成四类氧化物
正常氧化物(O2-):1s2 2s2 2p6
过氧化物(O22-):
RbO2 CsO2
BeO MgO CaO SrO BaO2
Na2O2
镁
Li2O
带
的
燃
烧
KO2
•与水作用 2M + 2H2O → 2MOH + H2(g)
Li
Na
K
Ca
•与液氨的作用
2M(s) + 2NH3 (l) →2M+ + 2NH-2 + H2 (g)
M(s) 液氨溶剂 M (am) e- (am)
化学一轮复习文档:第12章 物质结构与性质(选修)第37讲 含答案

第37讲原子结构与元素周期表、元素性质考纲要求1.了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~36号元素原子核外电子、价电子的排布式和轨道表达式。
2.了解电离能的含义,并能用以说明元素的某些性质。
3.了解电子在原子轨道之间的跃迁及其简单应用。
4.了解电负性的概念,并能用以说明元素的某些性质。
考点一原子核外电子排布原理1.电子层、能级与原子轨道(1)电子层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同电子层。
通常用K、L、M、N……表示,能量依次升高。
(2)能级:同一电子层里电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f 等表示,同一电子层里,各能级的能量按s、p、d、f的顺序依次升高,即:E(s)<E(p)<E(d)<E(f)。
(3)原子轨道:电子云轮廓图给出了电子在核外经常出现的区域。
这种电子云轮廓图称为原子轨道。
特别提醒第一电子层(K),只有s能级;第二电子层(L),有s、p两种能级,p能级上有三个原子轨道p x、p y、p z,它们具有相同的能量;第三电子层(M),有s、p、d三种能级。
2.基态原子的核外电子排布(1)能量最低原则:即电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
如图为构造原理示意图,即基态原子核外电子在原子轨道上的排布顺序图:注意所有电子排布规则都需要满足能量最低原则。
(2)泡利不相容原理每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
如2s轨道上的电子排布为,不能表示为。
(3)洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
如2p3的电子排布为,不能表示为或。
洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1。
2011第二学期复习题1

第十一章配合物1、填空(1)、根据配合物的价键理论,配合物的形成体与配体之间以( )键结合,它是由配体提供的( )投入到形成体的( )形成的。
由于配合物具有一定的空间构型,形成体参与成键的轨道采取( )方式。
(2)、根据配合物的价键理论,填充下表中的空白处。
(3)、根据晶体场理论,在电子构型为d1~d10的过渡金属离子中,当形成六配位的八面体配合物时,其高自旋和低自旋配合物的电子排布不相同的中心离子的电子构型为( );过渡金属配离子往往具有一定颜色,这是由于中心离子能产生( )跃迁所致。
(4)、当△0>P时,过渡金属离子能形成( )自旋八面体配合物;当△0<P时,则形成( )自旋八面体配合物;(5)、在光谱化学序中,F-是( )场配体,CN-是( )场配体;[FeF6]3-是( )自旋配合物,在八面体场中,中心离子Fe 3+的电于排布为( );[Fe (CN)6]3-是( )自旋配合物,中心离子Fe 3+的电于排布为( )。
二.选择题(1)、下列配合物中,空间构型为直线形的是( )。
(A) [Cu (en)2]2+(B) [Cu (P2O7)2] 6-(C)[Cu(EDT A)] 2+(D)[ CuCl2](2)下列配离子中,未成对电子数最多的是( )。
(A) [Ni (NH3)6]3+(B) [Mn (H2O)6]2+(C) [Fe (CN)6]4-(D) Ni (CO)4(3)、下列关于配合物的叙述中错误的是( )。
(A)在螯合物中,中心离子的配位数一定不等于配体的数目;(B)同种元素的内轨型配合物比外轨型配合物稳定;(C)中心离子的未成对电子愈多,配合物的磁矩愈大;(D)价键理论的内轨型配合物对应着晶体场理论的高自旋配合物。
(4)、某金属离子与弱场配体形成的八面体配合物的磁矩为4.98 B·M,而与强场配体形成反磁性的八面体配合物,则该金属离子为( )。
(A)Cr3+(B)Ti3+((:)Mn3+(D)Au3+(5)已知[Co (NH3)6]3+的μ=0,则下列叙述中错误的是( )。
第12-16章 p区元素习题

第12-16章P区元素习题目录一判断题;二选择题;三填空题;四完成方程式;五计算并回答问题一判断题 (返回目录)1 硼在自然界主要以含氧化合物的形式存在。
()2 在硼与氢形成的一系列共价型氢化物中,最简单的是BH3。
()3 硼酸是三元酸。
()4 硼是非金属元素,但它的电负性比氢小。
()5 由于B-O键键能大,所以硼的含氧化合物很稳定。
()6 硼砂的化学式为Na2B2O7。
()7 B2H6为平面形分子。
()8 硼是缺电子原子,在乙硼烷中含有配位键。
()9 三卤化硼熔点的高低次序为BF3<BCl3<BBr3<BI3。
()10 三卤化硼沸点的高低次序为BF3>BCl3>BBr3>BI3。
()11 地壳中丰度最大的金属元素是铝。
()12 Al2O3是两性氧化物,因而各种晶型的Al2O3既可溶于酸,又可溶于碱。
()13 只有在强酸性溶液中才有Al(H2O)63+存在。
()14 在气相中三氯化铝以双聚分子Al2Cl6的形式存在。
()15 AlX3都是共价型化合物。
()16 KAl(SO4)2·12H2O与KCr(SO4)2·12H2O属于同分异构体。
()17 在氯化氢气流中加热金属铝可制得无水AlCl3。
()19 因AlCl3分子中Al为缺电子原子,所以AlCl3中有多中心键。
()20 碳酸盐的溶解度均比酸式碳酸盐的溶解度小。
()21 Na2CO3比NaHCO3的溶解度大,同理,CaCO3比Ca(HCO3)2的溶解度也大。
()22 硅在地壳中的含量仅次于氧。
()23 分子筛是人工合成的硅铝酸盐,具有吸附和催化作用。
()24 活性炭具有吸附作用,它是颗粒状的石墨。
()25 金刚石比石墨更稳定,即使在纯氧气中,金刚石也不能燃烧。
()26 一般情况下,CO2不能助燃,但是镁在二氧化碳气体中能燃烧。
()27 高纯度的硅和锗是良好的半导体。
()28 金刚石与石墨是同素异形体,由金刚石转变为石墨的△r H>0。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1) 金属钠分别与水、液氨、甲醇反应
(2)钠汞齐与水反应
(3)过氧化钠分别与水和稀硫酸反应
解答
(1)2Na(s)+2H2O(l)===2Na+(aq)+2OH-(aq)+H2(g)↑
NH3(l)
Na(s) ====== Na+(NH3)n+e-(NH3)m
2Na(s)+2CH3OH(l,无水)===2CH3ONa(l)+H2(g)↑
MgCO3+2H3O+===Mg2++CO↑+3H2O
沉淀溶解但无气体逸出者为Mg(OH)2:
Mg(OH)2+2H3O+===Mg2++4H2O
剩余有沉淀并有气体逸出者为BaCO3:
BaCO3+2H3O++2SO ===BaSO4+CO2+3H2O
8.商品NaOH中为什么常含有杂质,Na2CO3滴定分析中如何配制不含这种杂质的NaOH?
解答
判断碱金属和碱土金属碳酸盐热分解的规律时可有两条规律可循:①大阳离子能稳定大阴离子;②碳酸盐的分解式为:
M2CO3(s)===M2O(s)+CO2(g)
MCO3(s)===MO(s)+CO2(g)
这时M+或M2+离子的极化力对分解反应的影响很大,因此可以看出,由表12.4的热力学数据得出碱土金属酸盐热稳定性由Mg-Ba增加。它们的热分解温度总是低于同周期碱金属硫酸盐的分解温度,是由于其M2+离子正电荷离子极化力大,对大阴离子CO 的一个O原子的作用特大易结合成MO,而使MCO3分解。
(2)2NaHg(s)+2H2O(l)===2Na+(aq)+2OH-(aq)+H2(g)↑+2Hg(s)
(3)Na2O2(s)+2H2O(l)===H2O2(l)+2Na+(aq)+SO
6.含有Ca2+、Mg2+、SO 离子和不溶性杂质的粗溶于水后首先滤除法溶性杂质,然后加入BaCl2溶液以除去SO 离子:
解答
可先配制成很浓的NaOH溶液,此时碳酸钠不溶解,静置后即沉淀,上层清液即为NaOH溶液,滴定分析前取之用纯水稀释并标定之即为NaOH标准溶液。
9.用下面提供的数据通过玻恩-哈伯循环计算KCl(s)的晶格焓
△LH /kJ·mol-1
K(s)的升华+89
K(g)的电离+425
Cl2(g)的离解+244
第12章s区元素课后习题答案:
1.写出周期表s区元素的化学符号并回答下列各种性质的变化规律
(1)金属的熔点;
(2)族氧化态阳离子的半径;
(3)过氧化物热分解生成氧化物的趋势;
解答
(1)参见表12.1,总的规律是各族由上至下熔点降低,因为价电子数相同,半径递增,金属键逐渐减弱。碱土金属比对应碱金属熔点高,是因为:①每个碱土金属原子中有两个价电子,而碱金属只有一个价子;②碱土金属的晶格结构多是属于配位数为12的最密堆积(六方密堆积或立方面心密堆积),而碱金属的结构是属于体心立方晶格,配位数为8,是次密堆积。因而金属键强弱不同。碱土金属中不完全是由大到小,是由于其晶格类型不同所致。
OH-+H3O+===2H2O
将清液蒸发、浓缩、结晶或通入HCl气体(同离子效应)均可得纯氯化钠。
7.在6个未贴标签的试剂瓶中分别装有白色固体试剂Na2CO3,BaCO3,Na2SO4,MgCO3,CaCl2和Mg(OH)2,试设法鉴别并以化学反应式表示。
解答
取少量各固体试剂分别置试管中,加一定量水,易溶者为Na2CO3,Na2SO4,和CaCl2,
(3)电极电势属热力学范畴,而反应的剧烈程度属动力学范畴,两者之间并无直接联系。锂与水反应缓和的原因有二:①锂的熔点较高(180℃),与水反应产生的热量不足以使其熔化,是固一液反应,不象钠、钾熔点低(分别为98℃和63.5℃)是液-液反应;②锂与水反应的产物LiOH溶解度小,一旦产生,就覆盖在锂的表面上,阻碍反应继续进行。
难溶者为剩余3种。
在易溶盐中,以pH试纸检验之,溶液呈碱性者为Na2CO3:
CO +H2O HCO +OH-
显中性者为Na2SO4和CaCl2,此两者中加入BaCl2溶液有白色沉淀者为Na2SO4:
SO +Ba2+===BaSO4↓
否则者为CaCl2。
在难溶者中,除去清液后分别加入H2SO4溶液,沉淀溶解且有气体逸出者为MgCO3:
(7)例如
熔融
2(FeO·Cr2O3)+7Na2O2====Fe2O3+4Na2CrO4+3Na2O
熔融
Fe2O3+Na2O2====2Na2FeO4+Na2O
熔融
MnO2+Na2O2====Na2MnO4
4.用课文给出的热力学数据解释碱土金属碳酸盐的热稳定性变化趋势,它们的热分解温度为什么总是低于同周期碱金属碳酸盐的分解温度。
(7) Na2O2在化学分析中用于分解某些矿物使相关元素转化为较高氧化态的可溶性化合物。
解答
(1)同位素 Li (在开然锂中约占7.5%)受中子轰击产生热核武器的主要原料氚:
(2)前者是铯在光照条件下会逸出电子(光电效应),后者是因为133Cs厘米波的振动频率(9 192 631 770s-1)在长时间内会保持稳定。
(5)钠的钴亚硝酸盐、四苯硼酸盐和氯铂酸盐易溶于水而相应的钾盐则难溶。
(6) Be(OH)2既可溶于酸又可溶于碱,而同族其他元素的氢氧化物只能溶于酸。
(7)冠醚和穴醚配体对不同大小碱金属离子的选择性配位。
解答
(1)Be、Li的半径太小。
(2)由于OH-是个体积小的阳离子,而SO 体积大,根据相差溶解规律而知之。
(7)参见节12.2.4。
3.回答下列用途所依据的性质,可能情况下并写出相关的反应式
(1)锂用做生产热核武器的一种原料。
(2)铯用于制造光电池和原子钟。
(3)钠用于干燥醚类溶剂时,能显示出溶剂的干燥状态。
(4)钠用于钛和其他一些难熔金属的高温冶炼。
(5)钠钾合金用做核反应堆的冷却剂。
(6) Na2O2用做高空飞行、潜水作业和地下采掘人员的供氧剂。
(4)锂和铍的离子半径特别小,离子势大,极化力强和半径较大的X-(变形性大)结合有较多的共价性,因而易溶于某些有机溶剂,而其它同族元素则为离子性化合物。
(5)三个酸根均为大阴离子,K+比Na+半径大,自然前者形成的盐比后者形成的盐稳定而在水中的溶解度小,仍是相差溶解规律的典型例子。
(6)根据ROH规则,Be(OH)2为两性化合物,故既可溶于酸又可溶于碱,而同族其他元素的氢氧化物碱性都很强,故只能溶于酸。
(3)钠溶于干燥的纯醚类会产生溶剂合电子,呈深蓝色。但若有水时,则首先与水反应,有H2跑出而无蓝色,因此颜色的出现可看作溶剂处于干燥状态的标志。
(4) Na为强还原剂:
TiCl4+4Na===Ti+4NaCl
(5)钠钾合金通常为液体,比热容较高,中子吸收能力较低。
(6)2Na2O2+2CO2===O2+2Na2CO3
SO +Ba2+===BaSO4↓
再加入NaOH和Na2CO3的混合液以除去Mg2+、Ca2+和上面所加过量的Ba2+离子:
Mg2++2OH-=== Mg(OH)2↓
Ca2++CO === CaCO3↓
Ba2++CO === BaCO3↓
过滤,加盐酸以除去上述加过量的CO ,并中和到微酸性或中性:
CO +2H3O+===CO2↑+3H2O
(2)表2.2,半径自上而下增大。
(3)随阳离子半径的增大热分热温度增高。
2.解释
(1)钡能形成过氧化物而铍则不能,钠能形成过氧化物而锂则不能。
(2)第2族元素自上而下氢氧化物在水中的溶解性增大,而硫酸盐则有相反的变化趋势。
(3)碱金属元素中以锂的标准还原电势最低,而锂与水之间的反应却最缓和。
(4)锂和铍的卤化物较之各自同族元素的卤化物易溶于某些有机溶剂。
Cl(g)结合电子-355
由单质生成KCl(s) -438
解答
△fH =1/2D + S + I + E + (-U)
∴U = (1/2D + S + I +E)-△fH
=[1/2 (244) + 89 + 425 + (-355) - (-438)] kJ·mol-1
=719kJ·mol-1
