高一化学元素周期表1
高一化学《元素周期表》
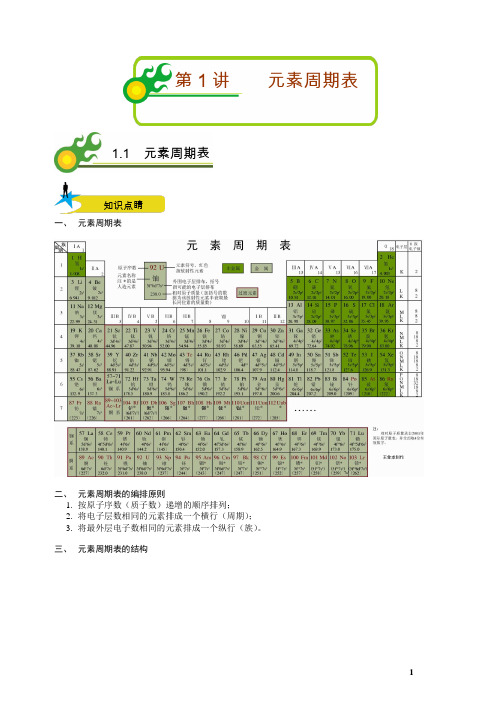
第1讲元素周期表1.1 元素周期表知识点睛一、元素周期表二、元素周期表的编排原则1.按原子序数(质子数)递增的顺序排列;2.将电子层数相同的元素排成一个横行(周期);3.将最外层电子数相同的元素排成一个纵行(族)。
三、元素周期表的结构⎧⎧⎧⎪⎪⎪⎨⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎪⎪⎪⎪⎪⎪⎪⎨⎪⎨⎪⎪⎪⎪⎪⎩⎩⎧⎪⎪⎨⎪⎪⎩⎩:2:8:8:18:18:32::IA ~VIIA 7:IIIB ~VIIB IB ~IIB 7VIII VIIB IB 第一周期种元素短周期第二周期种元素第三周期种元素周期第四周期种元素第五周期种元素长周期第六周期种元素第七周期未填满(又称不完全周期)主族共个主族副族、共个副族族第族:三个纵行,位于第族和第族之间零族:稀有气体⎪⎪⎪⎪⎪⎪⎪ 【总结】1.周期表中的相等关系 周期序数=电子层数主族族序数=最外层电子数=价电子数=最高正价数元素的原子序数=核电荷数=质子数=原子的核外电子数 2.元素周期表(记忆口诀):3.周期和族的表示方法(1)周期用大写数字直接表示即可,如:第四周期。
(2)主族:用罗马数字加A 表示,如:第IIA 族; 副族:用罗马数字加B 表示,如:第IVB 族。
4.由原子序数确定元素位置的规律记住每周期的元素的种数(2、8、8、18、18、32)以及稀有气体元素的原子序数(He 2、Ne 10、Ar 18、Kr 36、Xe 54、Rn 86),便于确定元素在元素周期表中的位置。
具体如下:①若比相应的稀有气体元素的原子序数多1或2,则应处在下周期的第IA 族或第IIA 族,如88号元素88862-=,则应在第七周期第IIA 族。
②若比相应的稀有气体元素少1~5时,则应处在同周期的第VIIA ~IIIA 族,如:84号元素84862-=-,则应在第六周期第VIA 族。
③若预测新元素,可与未发现的第七周期的稀有气体元素(118号元素)相比较,去推知它的位置; 如:114号元素1141184-=-,应在第七周期第IV A 族。
化学必修元素周期表ppt课件

ppt课件.
41
总结:
碱金属的原子结构
Li Na K Rb Cs
1.相似性:
最外层上都只 有一个电子
化学性质相似
1) 都易失电子表现强还 原性
2) 化合物中均为+1价
核电荷数
2.递变性: 电子层数
原子半径
核对最 外层电 子的引 力
失电 子能 力
还原 性
金 属 性
(电子层数的影响大于核电荷数的影响)
很好 逐渐增大(K特殊) 单质的熔沸点逐渐降低
ppt课件.
40
通过比较碱金属单质与氧气、水的反应, 我们可以看出,元素性质与原子结构有密 切关系,主要与原子核外电子的排布,特 别是 最外层电子数 有关。原子结构相 似的一族元素,它们在化学性质上表现出
相似性 和递变性 。
在元素周期表中,同主族元素从上到下原 子核外电子层数依次 增多 ,原子半径逐 渐 增大 ,失电子能力逐渐 增强 ,金 属性逐渐 增强 。
通过大量实验和研究,人们得出了如下结论:
碱金属元素原子的最外层都有1个电子,它们的化学性
质彼此相似 ,它们都能与 水 等非金属单质以及氧气 反应,表现出金属性(还原性).
4Li+O2=2Li2O
2Na+O2=Na2O2 2Na+2H2O=2NaOH +H2↑
2K+2H2O=2KOH +H2↑
上述反应的产物中,碱金属元素的化合价都是 +1 。
49
卤族元素: 氟(F)
F +9 2 7
氯(Cl)
Cl + 1 7 2 8 7
溴(Br)
Br +35 2 8 18 7
碘(I)
I +53 2 8 1818 7
化学元素周期表读音-规律-口诀

化学元素周期表读音1氢(qīng)2氦(hài)3锂(lǐ)4铍(pí)5硼(péng)6碳(tàn)7氮(dàn)8氧(yǎng)9氟(fú)10氖(nǎi)11钠(nà)12镁(měi)13铝(lǚ)14硅(guī)15磷(lín)16硫(liú)17氯(lǜ)18氩(yà)19钾(jiǎ)20钙(gài)21钪(kàng)22钛(tài) 23钒(fán)24铬(gè)25锰(měng)26铁(tiě)27钴(gǔ)28镍(niè)29铜(tóng)30锌(xīn)31镓(jiā)32锗(zhě)33砷(shēn)34硒(xī)35溴(xiù)36氪(kè)37铷(rú)38锶(sī)39钇(yǐ)40锆(gào)41铌(ní)42钼(mù)43锝(dé)44钌(liǎo)45铑(lǎo) 46钯(bǎ)47银(yín)48镉(gé)49铟(yīn)50锡(xī)51锑(tī)52碲(dì)53碘(diǎn)54氙(xiān)55铯(sè)56钡(bèi)57镧(lán) 58铈(shì)59镨(pǔ)60钕(nǚ)61钷(pǒ)62钐(shān)63铕(yǒu)64钆(gá)65铽(tè)66镝(dī)67钬(huǒ)68铒(ěr)69铥(diū) 70镱(yì)71镥(lǔ)72铪(hā)73钽(tǎn)74钨(wū)75铼(lái)76锇(é)77铱(yī)78铂(bó)79金(jīn)80汞(gǒng)81铊(tā) 82铅(qiān)83铋(bì)84钋(pō)85砹(ài)86氡(dōng)87钫(fāng)88镭(léi)89锕(ā)90钍(tǔ)91镤(pú)92铀(yóu)93镎(ná) 94钚(bù)95镅(méi)96锔(jú)97锫(péi)98锎(kāi)99锿(āi)100镄(fèi)101钔(mén)102锘(nuò)103铹(láo)104钅卢(lú) 105钅杜(dù)106钅喜(xǐ)107钅波(bō)108钅黑(hēi)109钅麦(mài)110钅达(dá)111钅仑(lún)在背诵之前先用2分钟时间看一个不伦不类的小故事:侵害从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。
高一化学元素周期表

同一元素的
1个126C原子的质量
原子中,质 子数和中子
12 = 1.6726×10-27kg
1.993×10-26kg
数是否一定
12
相等呢?
≈1.007
1个中子的质量=1.6749×10-27kg
中子的相对质量=1.008
质子的相对质量取整数与中子的相对
质量取整数相加起来所得的数值叫做原子
质量数。用A表示。
第一节 元素周期表
复习: 1、元素: 具有相同核电荷数(即核内质子
数)的一类原子的总称。
2、原子的构成:
质子 每个质子带1个单位正
原子核
电荷相对质量为1
原子
中子 不带电,相对质量为1
核外电子 每个电子带1个单位负电荷 相对质量为1/1836
核电荷数=质子数=核外电子数,
因此,原子 呈电中性
质子的相对质量= 1个质子的质量
⑤ 天然存在的同位素,相互间保持一定的比率。元素的相对 原子质量,是按照该元素的各种核素原子所占的一定百分比 算出的平均值。
1、作核燃料:作制造核武器的动力性材料(235U) 2、金属探伤:利用γ射线的贯穿本领,可以检查金属内 部有没有沙眼和裂纹。 3、辐射育种:利用放射性同位素的射线对遗传物质产生 影响,提高基因突变频率,从而选育出优良品种。 4、临床治癌:利用放射性同位素的射线杀伤癌细胞或阻 止癌细胞分裂。 5、环保治污:利用放射性同位素的射线可消毒灭菌,杀 死各种病原体从而能保护环境是其少受污染。
2、核素:具有一定数目的质子和一定 数目的中子的一种原子。
3、同位素:质子数相同而中子数不同的 同一种元素的不同原子互称为同位素。 即:同一元素的不同核素之间互称为同位素
(1) Z同,N不同 (2)不同的原子
高一化学 23元素周期表

③最外层电子数是次外层电子数的 3倍的元素: O ④电子层数与最外层电子数相等的 元素:H、Be、Al
⑤次外层电子数是最外层电子数 2倍的元素: Li、Si ⑥原子核内无中子的原子: H ⑦最外层电子数是1的原子: Li Na H ⑧最外层电子数是2的原子: He Be Mg
元素金属性强弱判断的依据 元素金属性是指元素的原子失去电子的 能力. 判断元素金属性强弱, 从参加反应的元素 的原子失电子的难易程度加以分析判断: 1、利用原子结构和元素在周期表中的 位置判断: 在周期表中,同一周期里从左到右, 元素的金属性逐渐减弱,同一主族里 从上到下,元素的金属性逐渐增强。
2、 从元素单质与水或酸反应置换出氢 的难易判断: 与水反应越易、越剧烈的金属单质,其 原子越易失电子,该金属活泼性越强。
钠与水在常温下剧烈反应,置换出水中的氢
镁与冷水反应很微弱,镁与沸水迅 铝与热水不反应 地反应并产生气泡, 金属性由强到弱:Na>Mg>Al Na、Fe、Cu分别加入盐酸中,钠反 应剧烈, Fe反应迅速,Cu不反应。 金属性由强到弱:Na>Fe> Cu
1
2
3
4
5
6
7
8
1
2
3
4
5
6
7
8
原子半径的周期性变化
原子半径由大变小
主要化合价的周期性变化 IA IIA IIIA VIA VA VIA VIIA 0
最高正价从+1递增到+7, 负价从-4递增到-1
+1 +2 +3 +4 +5 --- ----4 -3 -2 -1 +1 +2 +3 +4 +5 +6 +7 -4 -3 -2 -1
化学元素周期表(有拼音)[1]
![化学元素周期表(有拼音)[1]](https://img.taocdn.com/s3/m/9bd65725aaea998fcc220e14.png)
元素周期表(注音版)氢qīng氦hài---- 侵害锂lǐ铍pí硼péng 碳tàn 氮dàn 氧yǎng氟fú氖nǎi ---- 鲤皮捧碳蛋养福奶钠nà镁měi铝lǚ硅guī磷lín 硫liú氯lǜ氩yà---- 那美女桂林留绿牙(那美女鬼流露绿牙)钾jiǎ 钙gài 钪kàng 钛tài 钒fán 铬gè锰měng ---- 嫁改康太反革命铁tiě 钴gǔ镍niè铜tóng 锌xīn镓jiā锗zhě---- 铁姑捏痛新嫁者砷shēn硒xī溴xiù氪kè---- 生气休克铷rú锶sī 钇yǐ锆gào 铌ní---- 如此一告你钼mù锝dé钌liǎo---- 不得了铑lǎo钯pá银yín 镉gé铟yīn锡xī 锑tī---- 老把银哥印西堤碲dì碘diǎn氙xiān---- 地点仙铯sè钡bèi 镧lán 铪ke----(彩)色贝(壳)蓝(色)河钽tǎn钨wū铼lái 锇é---- 但(见)乌(鸦)(引)来鹅铱yī铂bó金jīn汞gǒng铊tā铅qiān---- 一白巾供它牵铋bì钋po 砹ài 氡dōng---- 必不爱冬(天)钫fāng镭léi 锕ā----防雷啊!镧系镧lán 铈shì镨pǔ钕nǚ钷pǒ钐shān铕yǒu钆gá铽tè镝dí钬huǒ铒ěr铥diū镱yì镥lǔ锕系铪hā钍tǔ镤pú铀yóu 镎ná钚bù镅méi 锔jū锫péi 锎kāi锿āi镄fèi 钔mén 锘nuò铹láo。
高中化学必修一第一节元素周期表
第一节元素周期表第1课时元素周期表多选A.B. X的氧化物XO有毒C. Y能与氢氧化钠溶液反应生成氢气D. Z的氧化物只能与酸反应10. 下列叙述不正确的是()。
A. 除0族元素外, 短周期元素的最高正化合价在数值上都等于该元素所属族的族序数B.除短周期外, 其他周期均为18种元素C. 副族元素没有非金属元素D. 第ⅢB族中所含元素种类最多12. 下列各表为周期表的一部分(表中数字为原子序数), 其中正确的是()。
ABCD13. A.B.C.D.E五种元素在元素周期表中的位置如图1-1-1所示, 已知E的原子序数为x, 则五种元素的原子序数之和不可能为()。
图1-1-1A. 5xB. 5x+10C. 5x+14D. 5x+2514.已知115号元素原子有七个电子层, 且最外层有5个电子, 试判断115号元素在元素周期表中的位置是()。
A. 第七周期第ⅢA族B. 第七周期第ⅤA族C. 第五周期第ⅦA族D. 第五周期第ⅢA族15.目前人类已发现的非金属元素除稀有气体元素外, 共有16种。
下列对这16种非金属元素的相关判断()。
①都是主族元素, 最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态, 所以又都叫气态氢化物;④氧化物常温下都可以与水反应生成酸。
A. 只有①②正确B. 只有①③正确C. 只有③④正确D. ①②③④均不正确16. 已知X、Y、Z、W是短周期中的四种非金属元素, 它们的原子序数依次增大。
X元素形成的离子就是一个质子, Z、W在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体, Y形成的一种单质是自然界中硬度最大的物质。
(1)请写出元素符号: X______、Y______、Z______、W________。
(2)X单质与Z单质在一定条件下反应生成化合物E, 该反应的化学方程式为(注明反应条件)__________________________________;E在催化剂存在的条件下, 可用于还原汽车尾气中的__________, 以减少大气污染。
人教版高一化学必修一第一章第一节元素周期表 课件(共20张ppt)
3.现行元素周期表中已经列出了112种元素,其中元素种类最多的周
期是?
C
A.第4周期
B.第5周期
C.第6周期
D.第7周期
2024/1/20
16
判断下列说法是否正确
1、短周期元素全是主族元素 错,还有0族元素
2、短周期元素共有20种元素 错,短周期包括1、2、3周期,共18种元素
——32 种
主族 共 7 个主族,包括短周期和长周期元素
副族 共 7 个副族,只包括在长周期中
族
(16个) 第VIII族 包括第8、9、10 纵行
0族
稀有气体元素
2024/1/20
18
练习
推算原子序数为6,13,34,53,88,82的元素在周期表中的位置。
第6号元素: 6-2=4
第二周期第ⅣA 族。
2023最新整理收集 do something
第一节 元素周期表
化学 必修2
第一课时
元素周期表
2
1
2019年被联合国批准为“国际化学元素周 期表年”。2019年是国际纯粹与应用化学联合 会IUPAC成立100周年,同时也是化学元素周期 表发明150周年。
俄国科学家门捷列夫
2024/1/20
2
一、元素周期表的发展史
3、过渡元素全是长周期元素 正确,过渡元素还全是金属元素
4、过渡元素全是副族元素
错,还有第VIII族元素
2024/1/20
17
课堂小结:
短周期
周期
(7个) 长周期
第 1周期 第 2周期
第 3周期 第 4周期
第 5周期 第 6周期 第 7周期
1化学元素周期表读音
1氢(qīng) 2氦(hài) 3锂(lǐ) 4铍(pí) 5硼(p?ng) 6碳(tàn) 7氮(dàn) 8氧(yǎng) 9氟(fú) 10氖(nǎi) 11钠(nà) 12镁(měi) 13铝(lǚ) 14硅(guī) 15磷(lín) 16硫(liú) 17氯(lǜ) 18氩(yà) 19钾(jiǎ) 20钙(gài) 21钪(kàng) 22钛(tài) 23钒(fán) 24铬(ga) 25锰(měng) 26铁(tiě) 27钴(gǔ) 28镍(nia) 29铜(tóng) 30锌(xīn) 31镓(jiā) 32锗(zhě) 33砷(shēn) 34硒(xī) 35溴(xiù) 36氪(ka)37铷(rú) 38锶(sī) 39钇(yǐ) 40锆(gào) 41铌(ní) 42钼(mù) 43锝(d?) 44钌(liǎo) 45铑(lǎo) 46钯(bǎ) 47银(yín) 48镉(g?)49铟(yīn) 50锡(xī) 51锑(tī) 52碲(dì) 53碘(diǎn) 54氙(xiān) 55铯(sa) 56钡(bai) 57镧(lán) 58铈(shì) 59镨(pǔ) 60钕(nǚ)61钷(pǒ) 62钐(shān) 63铕(yǒu) 64钆(gá) 65铽(ta) 66镝(dī) 67钬(huǒ) 68铒(ěr) 69铥(diū) 70镱(yì) 71镥(lǔ) 72铪(hā)73钽(tǎn) 74钨(wū) 75铼(lái) 76锇(?) 77铱(yī) 78铂(bó) 79金(j īn) 80汞(gǒng) 81铊(tā) 82铅(qiān) 83铋(bì) 84钋(pō)86氡(dōng) 87钫(fāng) 88镭(l?i) 89锕(ā) 90钍(tǔ) 91镤(pú) 92铀(yóu) 93镎(ná) 94钚(bù) 95镅(m?i) 96锔(jú) 、97 号元素: 锫 [化学符号]Bk, 读“陪”、 98 号元素: 锎 [化学符号]Cf, 读“开”第 99 号元素: 锿 [化学符号]Es, 读“哀”,第 100 号元素: 镄 [化学符号]Fm, 读“费”第101 号元素: 钔 [化学符号]Md, 读“门”第 102 号元素: 锘 [化学符号]No, 读“诺”,第 103 号元素: 铹 [化学符号]Lw, 读“劳”第 104 号元素: 鐪 [化学符号]Rf, 读“卢”第 105 号元素: [化学符号]Db, 读“杜”第 106 号元素: 钅喜 [化学符号]Sg , 读”喜“,第 107 号元素: 钅波 [化学符号]Bh, 读"波“第 108 号元素: 钅黑 [化学符号]Hs, 读”黑“,第 109 号元素: 钅麦 [化学符号]Mt, 读"麦",第 110 号元素: 鐽 [化学符号]Ds, 读”达“, 第 111 号元素: 钅仑 [化学符号]Rg, , 读”伦“,第 112 号元素: uub 113 号元素: uut114 号元素: uuq115 号元素: uup116 号元素: uuh117 号元素: uus尚未发现、。
化学元素周期表1
48 Cd 镉
4d105s2 112.4
49 In 铟
5s25p1 114.8
50 Sn 锡
5s25p2 118.7
79 Au 金
5d106s1 197.0
80 Hg 汞
5d106s2 200.6
81 Tl 铊
6s26p1 204.4
82 Pb 铅
6s26p2 207.2
111 Rg 112 Uub
87.62
55 Cs 铯 6s1
132.9
56 Ba 钡
6s2 137.3
87 Fr 钫
7s1 〔223 〕
88 Rr 镭 7s2
〔226〕
原子序数——92 U——元素符号
红色表示放射性元素
铀 元素名称—— 5f36d17s2
注*的表示人造元素 238.0—相对原子质量 (加括号的数据为该放射性
元素半衰期最长同位素的质量数)
72 Hf 73 Ta 74 W
铪
钽
钨
75 Re 76 Os 77 Ir 78 Pt
铼
锇
铱
铂
La~
5d26s2 5d36s2 5d46s2 5d56s2 5d66s2 5d76s2 5d96s1
Lu
178.5 180.9 183.8 186.2 190.2 192.2 195.1
镧系
89~ 104
105
錀*
* …………
〔272〕 〔285〕
ⅤA
7N 氮 2s22p3 1145.01P 磷 3s23p3 30.97 33 As 砷 4s24p3 74.92
51 Sb 锑 5s25p3 121.8
83 Po 铋 6s26p3 209.0
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
●备课资料1.地球上元素的分布跟它们在元素周期表中的位置关系科学家的多次实验发现如下规律:相对原子质量较小的元素在地壳中含量较多,相对原子质量较大的元素在地壳中含量较少;偶数原子序数的元素较多,奇数原子序数的元素较少。
处于地球表面的元素多数呈现高价,处于岩石深处的元素多数呈现低价;碱金属一般是强烈的亲石元素,主要富集于岩石圈的最上部;熔点、离子半径相近的元素往往共生在一起,同处于一种矿石中。
有的科学家把元素周期表中性质相似的元素分为10个区域,并认为同一区域的元素往往是伴生矿。
这对探矿具有指导作用。
2.门捷列夫门捷列夫,1834年2月7日生于西伯利亚西部的托波尔斯克,是俄罗斯和蒙古人的后裔,是一个大家庭中最小的孩子,从小就聪明伶俐,深受母亲的喜爱。
门捷列夫的父亲是一位中学校长,因患病而不能工作,这样,全家生活的重担就压在了他母亲身上。
他的母亲是一位富有科学精神的顽强而又伟大的女性。
她开了一个玻璃厂,由于经营有方,收益足以维持全家美满的生活。
在门捷列夫的生活中,有一个对其影响很大的人叫巴萨尔金,是门捷列夫的姐夫。
他是“十二月党人”,因反沙皇被流放到西伯利亚。
他很有学问,经常给门捷列夫上课,教他数学、物理学、化学和历史。
门捷列夫从巴萨尔金那里学习了很多知识。
门捷列夫17岁那年,他母亲的玻璃厂被一场大火烧成平地,紧接着父亲去世。
他57岁的母亲带着两个最小的孩子奔波千里,到了莫斯科。
为了培养门捷列夫成才,她四处求人,希望把儿子送进大学读书。
最后,在门捷列夫父亲的好友——中央师范学院院长普列特诺夫的帮助下,门捷列夫进入师范学院物理系学习,并且获得了公费的资格。
在门捷列夫进入大学学习后第三个月,他的母亲因一生的劳苦和千里奔波积劳成疾,离开了人间。
她在尚存一息时说:“唯一的安慰是门捷列夫终于获得了一个受教育的机会。
”她在将去世的弥留之际,曾嘱咐她的孩子说,不要有不现实的妄想,要努力工作,不要说空话,要专心耐心地去探索科学真理。
门捷列夫对慈母的去世,十分悲痛。
他在大学里很少说话,总是苦读到深夜,希望用优异的成绩告慰他母亲的在天之灵。
一直到门捷列夫成名之后,仍念念不忘他慈母的一片深情,他把母亲的临终遗言视为神圣。
门捷列夫师范学院毕业时,因成绩优异,获得了金质奖章。
此后,他又去巴黎学习了三年,还到德国本生那里研究过一段时间。
1861年他返回彼得堡,获博士学位,并先后在工业学院及彼得堡大学担任教授。
1869年3月,门捷列夫向俄国化学会提交一篇论文,题目是《元素特性与原子量的关系》,提出了化学元素周期律,并给出了化学元素周期表。
门捷列夫把当时的化学元素排列成6个周期,他在按原子量大小排列各种元素时,注意到元素系列并不完整,还有许多化学元素应当存在,但当时却没有被发现,于是他在周期表中留下了4个“空位”。
他认为,这些空位应当由新发现的元素去充填。
门捷列夫以大智大勇预言了尚未发现的元素,特别是对镓、钪、锗的预言,十分准确,使后来的发现者感到非常惊奇。
门捷列夫的周期表,比前人的更加完备,更加有实验基础。
门捷列夫在化学上的贡献是巨大的。
他曾著《化学原理》一书,此书使他荣获英国捷米多夫奖金。
这本书写得很奇特,注释比正文要多,这种写作风格对俄国化学著作的影响十分深远。
门捷列夫对历史上的科学巨人十分尊敬,他的房间里挂着哥白尼、伽利略、牛顿、拉瓦锡、笛卡儿、法拉第等人的画像,他总是以这些巨人为楷模。
门捷列夫的晚年比较寂寞。
但对科学的热爱使他一直工作到他人生的最后一天。
1907年1月20日,他平静地告别了人世。
门捷列夫的学生为他举行了葬礼。
送葬的人抬着一个很大的横幅,上面画着元素周期表和门捷列夫的像。
这是葬礼,也是对门捷列夫的评价。
3.周期律的发现和周期表的编排,为后人从事科学研究和工农业生产起着重要的指导作用(1)在非金属区寻找制造农药的元素,如Cl、P、S、N、As等。
(2)在B、Si、As、Te、At阶梯线两旁寻找半导体材料,如Si、Ge、Se等。
(3)在过渡元素区寻找化学反应的催化剂(如Fe、Ni、Cu、Mn、Pt等)及耐高温材料(如W)。
(4)在周期律指导下,自然界中存在的92种元素迅速地被发现、“归位”。
人造元素及同位素一种接一种被制造出来,不完全周期不久可排满。
截至目前为止,在自然界找到了约300种同位素,人工合成了约1200多种元素及同位素。
超重元素(110号以上的元素,有的从92号铀算起)的研究更有诱人的前景,主要是开发新能源。
有人想利用超重元素制造袖珍核武器——暗藏在手提包里的小型核弹。
此外在治疗癌症方面,疗效好,无副作用。
(5)周期系在指导原子核的研究方面有深刻的影响。
门捷列夫曾指出,周期系中具有“最大”相对原子质量的钍和铀的重要性。
放射性的发现证实了这一预见。
这一发现是原子核研究的序幕。
放射性的位移定律也是以周期系为依据。
总之,原子核的种种人工蜕变,都是按元素在周期表中的位置来实现的。
4.张青莲张青莲于1908年7月31日生于江苏常熟的一个小康家庭。
1922年,他考入苏州桃坞中学。
他学习刻苦勤奋,曾获全校中、英文竞赛冠军,高中毕业后考入上海光华大学化学系,1931年考入清华大学研究生院,1934年入柏林大学物理化学系学习,并确立了以当时新发现的重水物理、化学性质为主的研究课题。
在两年博士生学习期间,他共发表了10篇有关重水研究的论文,成为当时世界上首批从事稳定同位素研究的年轻学者之一。
其中一些论文成为同位素化学领域的经典文献,其内容涉及重水、半重水、重氧水的蒸汽压测定,以及不同地区雪水样品中半重水和重水含量的测定。
1936年6月,他以优异成绩获柏林大学哲学博士学位。
回国后,他先后在昆明西南联大及北京大学任教,同时从事化学研究工作。
1983年张青莲教授赴丹麦哥本哈根参加了国际纯粹与应用化学联合会第三十二届工作会议。
在原子量和同位素丰度委员会的讨论会上,他以渊博的知识和精湛的学术见解,赢得与会者的好评,被评为衔称委员,是第一位获得此项荣誉的中国科学家。
嗣后,他出席了在法国里昂和美国波士顿分别召开的两次国际性学术会议,并对原子量质谱法测定产生兴趣,成为他近年来的研究领域。
张青莲教授从1934年起就开始进行重水和稳定同位素的科学研究。
60多年来,他对同位素化合物的各种物理化学性质、同位素分离原理和方法、同位素动力学效应、同位素标准样品的研制、同位素天然丰度的测定和元素的原子量等,进行了深入系统的研究,取得了丰硕的成果,成为我国稳定性同位素学科的奠基人和开拓者。
张青莲教授首次用高富集同位素校准质谱法测定了碳的原子量,被国际纯粹与应用化学联合会(IUPAC)的原子量和同位素丰度委员会于1991年评为NBS—19参考物质的13C 标准同位素丰度。
此后,又多次使用高富集同位素校准质谱法,精确地测定了铟、铱、锑、铕、铈、铒、锗的相对原子质量,得到新值,均经上述委员会采用为国际新标准。
使我国在此科技领域达到了国际先进水平。
5.相对原子质量的测定方法现代测定相对原子质量的方法主要有化学方法和物理方法(质谱法)。
化学方法是先制备该元素的纯卤化物,采用银作二级基准分析卤化物纯度,再向一定量的卤化物样品溶液中加入等量的硝酸银,用重量法测定卤化银的重量,然后通过当量求出相对原子质量。
质谱法是通过测定同位素的相对原子质量,然后根据其在自然界的丰度(即原子百分数)计算得到的。
它所使用的仪器叫质谱仪。
这种方法的最大优点是精度高,现代相对原子质量几乎都是由质谱法测定的。
在质谱仪中,被测样品(气体和固体的蒸汽)中的元素经阴极射线的作用产生带正电荷的离子,正离子先后通过电场和磁场后,发生偏转。
无论正离子速度的大小,只要其电荷与质量之比(e/m,简称荷质比)相同的离子就会收敛在一处,在照相板上留下痕迹;不同e/m 的正离子将收敛在不同位置,从而形成相应的线条。
将这些线条的位置与12C原子质谱上的谱线和相应的质量标度比较可求得这些离子即元素的相对质量。
同时,用电流检示计通过测定离子流的强度求出这些元素的相对丰度,进而便可算出该元素的相对原子质量。
由于用质谱法测定原子量时,必须同时测定同位素丰度,而有些元素同位素的组成因来源不同而有涨落,以导致实际测得这些元素的相对原子质量并非固定不变。
因此,在进行同位素丰度测定时,为了保证精确性,还要用人工合成的核素混合物来校正质谱仪的偏差,以消除质谱仪的质量歧视现象。
6.重水重水的一个分子是由两个重氢原子和一个氧原子组成,其分子式为D2O,相对分子质量是20,重水在自然界中分布较少,在普通水中约含重水0.015%。
由于含量少,制备难,它比黄金还贵重。
重水外观上和普通水相似,是无色、无臭无味的液体。
密度比普通水大,熔点、沸点比普通水高。
由于重水分子量大,运动速度慢,所以在高山上的冰雪中,特别是在南极的冰雪中重水含量微乎其微,水的密度最小,是地球上最轻的水。
重水在尖端科技中有十分重要的用途。
原子能发电站的心脏是原子反应堆,为了控制原子反应堆中核裂变反应的正常进行,需要用重水做中子的减速剂。
电解重水可以得到重氢,重氢是制氢弹的原料,我国已于1967年6月17日成功地爆炸了第一颗氢弹,大长了中国人民的志气。
更重要的是重氢进行核聚变反应时,可放出巨大的能量,而且不会污染环境。
有人计算推测,如果将海水中的重氢都用于热核反应发电,其总能量相当于全部海洋都变成了石油。
重水虽然在尖端技术上是宝贵的资源,但对人却是有害的。
人是不能饮用重水的,微生物、鱼类在纯重水或含重水较多的水中,只要数小时就会死亡。
相反,含重水特别少的轻水,如雪水,却能刺激生物生长。
7.放射性同位素同位素,特别是放射性同位素的发现,在人们生活、生产、高科技领域,发挥着巨大作用。
放射性元素铀发生原子核裂变时放出巨大能量,1 kg铀释放出来的热量相当于2000 t 优质煤燃烧时放出的热量。
海水中铀的贮量在4.5×1010t左右,和平利用原子能,前景多么诱人!放射性同位素碳-14在地底下默默地记载着地质年龄,让地质和考古工作者较准确地知道出土文物的年代,人们把碳-14喻为考古钟与地质钟。
农业上农民利用放射性同位素作为示踪原子、标记农药残留的多少和残留在植物的什么部位;指导合理施肥;运用放射的射线进行辐射育种。
医药上,利用同位素作为与癌症作斗争的武器,诊断肿瘤,控制肿瘤,并作为筛选药物的工具。
此外还在工业部门有更多用途。
●综合能力训练题1.若短周期中的两种元素可以形成原子个数比为2∶3的化合物,则这两种元素的原子序数之差不可能是A.1B.3C.5D.6解析:(1)列举法:1~18号常见元素能形成X2Y3或X3Y2的化合物有:B2O3、B2S3、Al2O3、Al2S3、N2O3、Mg3N2、Mg3O2,可能设想还有Be3N2、Be3P2。
