化学反应工程-3-第一章-均相反应动力学
化学反应工程知识点梳理(精华版)
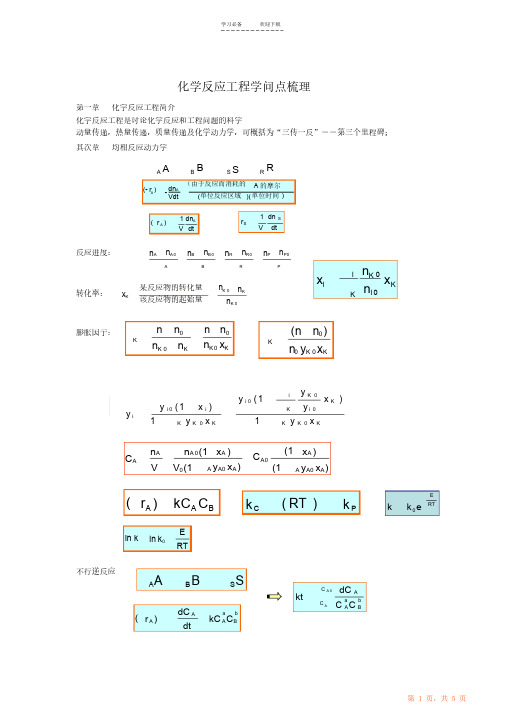
化学反应工程学问点梳理第一章化学反应工程简介化学反应工程是讨论化学反应和工程问题的科学动量传递,热量传递,质量传递及化学动力学,可概括为“三传一反”--第三个里程碑; 其次章均相反应动力学AA- dn A VdtBSSRBR(由于反应而消耗的 A 的摩尔数) (- r ) A (单位反应区域 )( 单位时间) dn dt1 V 1 dn S r SA ( r )A V dt反应进度:n A n A 0An Bn B 0Bn Rn R 0Rn P n P0Pn K i 0x ix K 某反应物的转化量 该反应物的起始量n i 0n K 0 n K 0n K转化率:x KKn n K 0 n 0 n Kn n 0 (n n 0 )膨胀因子:KKn K 0 x Kn y x 0 K 0 Ky i K 0 y ( 1x )i 0 K y ( 1 x i )y i i 0 Ky i1y x 1y x KK 0 K KK 0 Kn A Vn A 0 (1 x A ) (1 x A ) A y A0 x A)C AC A0V 0 (1A y A0 x A)(1ERT( r A ) kC A C Bk C( RT )k Pkk e0 E RTln kln k 0不行逆反应AABBSSdC C A 0 A kta b BC CC AAdC A dtab ( r A )kC ACB均相催化反应 CC 为催化剂浓度dC Adt( r )(kC )C A C A自催化反应 → A + C 2C + RdC A dt( r A )kC A C CR+S串联反应 PA + B总收率n P n A0 n P 0n AP单位时间内生成 单位时间内消耗 P 的摩尔数A 的摩尔r p ( r A )瞬时收率dC P / dt dC A / dtdC P dC A得率 yieldX ( n Pn P 0 ) / n A 0P总挑选性 目的产物 P 所生成的摩尔数与副产物S 生成的摩尔数之比,用 S0 表示:n P n S n P 0n S 0S 0αA2 αA1 AαS S 平行反应( 副 )αP P A(主)dC A dt( r A ,1) k 1C A( r A,2) k 2 C A( r A )( r A,1) ( r A,2 )(k 1k 2 )C AdC dtdC P dtp P S S r P( r A ,1 )k 1C Ar Sk 2 C AA,1A ,1A ,2( k 1 k 2 ) tC AC A 0ek 1k 2AP串联反应S (均为一级反应)dC PdtdC S dtr Pk 1 C A k 2 C P r Sk 2 C P第三章 抱负均相反应器间歇反应器 (BSTR) 反应时间dx r dC x A C A A A t C 等容过程,液相反应A 0( )C A 0( r )A A 实际操作时间 (operating time)= 反应时间 (t) + 帮助时间 auxiliary time(t')反应体积 V 是指反应物料在反应器中所占的体积V = v0 (t + t')VV 实际的反应器体积为:实际为装料系数 (the volume charge coefficient) ,通常在 ~ 平推流反应器 PFR 空时反应器的容积进料的体积流量V v 0反应期的容积dV vV Rt反应器中物料 的体积流量V v 0C A0 ( C A r A )C A0 x A 全混流反应器 (CSTR)( r A )50000 V F A 0dx Ar A )V v 0 C A 0x A VF A0x A r A )F v C R 0 0 R24 M 0( C A 0( Rdx dx dx x A x A x A A A At C A 0C A 0C A0绝热操作恒容间歇反应器的设计式为:nE x A 0( r A )x A 0kCAx A 0n nRTk 0 e C A0(1 x A )1 x A tI ( x A )dx An 1x A 0k C 0A02dx A dlD ( r A ) 4F A02变温平推流反应器F A 0dx A ( r A )dV P( r A ) D dl4化学反应工程讨论的目的是实现工业化学反应过程的优化全混流V mF A 0 x A 0 r AV B F A 0 t BC A 0d x A r Ax A mC A 0BR :CST R:V PF A 0 d A x r Ax A 平推流PF R:PC A 0多级 CSTR 串联的优化 对于一级不行逆反应应有x A1 kC A0 (1 0 x A1 ) x A2 x A1x Am kC A 0 (1 x Am 1x Am )V v C ...R 0 A 0kC A 0 (1 x A 2 )x Ai 1 x Ai Aix Ai 1 x Ai Ai 111 V R x Aiv 0 k 1 (1 x Ai 11x Ai 10 (i 1,2,.....m 1)x x 2x Ai )1 ln( k / k )k 2( k 1 )k2 k 1k 2C P max C A01 2 k 2PFR : X 同间歇釜optP maxk 1 C P max C A 01X 1P max12CSTR:2[( k 2 / k 1 )1]optk k 1 2全混流反应器的热衡算方程V ( r A )(v 0 c PH r )UAT m UA UAT m UA T (1) (T 0)Q rT (1) (T 0)v 0 c Pv 0 c Pv 0 c Pv 0 c P第四章非抱负流淌停留时间分布E(t) = P{t < residencetime< t + t}停留时间分布函数F ( t ) = P { residence time < t }t F (t)E(t )dt2(t t ) E (t )dt2 t22 2(t t ) E (t )dtt E (t ) d t t方差E (t) dtPFR0 t t tt 0 1t t t tE(t )t tF (t)2 t22(t t ) E(t)dt ( t t )CSTRttF(t) 1 et2t2 21et最大tE(t) tr2( ) [2 Rr( R 层流流淌)2]F (t) 22t 2轴向扩散模型tE z E z 2 uL / E 2( ) uL 2( ) (1 uLe Z) 2 Pe 1 2 ) (1 Pe 2( e ) Pe。
化学反应工程-4-第一章-均相反应动力学

P平均选择率: 平均选择率:
CP − CP0 α P k1 SP = = C A 0 − C A α A1k1 + α A 2 k 2
结论一: P 和浓度没有关系,仅仅是温 结论一 S 度的函数。 结论二:提高温度对活化能大的反应有利。 结论二
CP最大值的计算: 最大值的计算: 看
dC P rP = = k1C A − k 2 C P dt dC P =0 在最大点处: dt
k1C A = k 2 C P
rP :
t OPT
C P ,max C A0
k2 ln k1 = k 2 − k1
( A)
k1 k2 k 2 − k1 k 2 − k1 k1 k1 k1 = − k k 2 − k1 k 2 2
1.3.2平行反应
一、平行反应动力学特征
α A1 A k1 α P P(主反应 ) → k2 α A2 A → α S S (副反应 )
主、副反应都是一级不可逆反应:
r1 r2
(− rA1 ) = k C = (− rA 2 ) = k =
α A2 α A1
1 2
A
CA
反应动力学特征: 反应动力学特征:
H 2O + (CH 2 )2 O 1 CH 2OHCH 2OH →
同样具有平行反应和连串反应的特征,为简明起见,各组分分别用 下列符号代替:
(CH 2 )2 O → A , 2 O → B, 2 OHCH 2 OH → P H CH
CH 2 OHCH 2 OCH 2 CH 2 OH → Q
化学反应工程知识点回顾

化学反应⼯程知识点回顾第⼀章知识点1.化学反应⼯程学的范畴和任务2.化学反应⼯程学的基本⽅法3.化学反应⼯程学的学科系统和编排第⼆章均相反应动⼒学基础知识点 1、概念:①化学计量⽅程:反应物 - ,产物 + ②化学反应速率等温定容反应dtdc r AA -=-反应速率之⽐等于各计量系数的⽐值。
③反应转化率反应程度膨胀因⼦δA 关键组分A 的膨胀因⼦物理意义:每反应掉⼀个摩尔A 所引起反应体系总摩尔数的变化量。
④反应速率⽅程:反应级数 a 、b 由实验确定 k 遵循Arrhenius ⽅程i α1A A dn r V dt-=-00-=K KK K n n x n 0kk k n nξα-=1sii A A αδα==∑a bA AB r kC C -=2、单⼀反应的速率⽅程重点:求取动⼒学参数 1)不可逆反应微分⽅程: 积分⽅程: 2)可逆反应微分⽅程: 反应平衡时: 3)均相催化反应微分⽅程积分⽅程4)⾃催化反应当C A = C M0/2 时,反应速率最⼤ 3、复合反应:平⾏反应串联反应总收率选择性exp[]a E k k RT=-a bA A A BdC r kC C dt-==-0A A C Aa b C ABdC kt C C =?'A A A SdC r kC k C dt-=-=-0A Ae Se r kC k C '-=-=()AA C A dC r kC C dt-=-=A A A C dC r kC C dt-=-=0max 0001ln[]A M M A C t C kC C =-0121()ln ln1A C A A C k k C t C x +==-A B P R +→+A B S +→A B P R S+→→+0000()/()///--Φ==P P P P P A A n n p C C pn a C a 0000()/()/;;()/()/--==--p p p p p p A A A A n n P C C PS S n n a C C a第三章理想反应器1返混的基本定义2⼏个时间的定义反应持续时间t r--在间歇反应器中反应达到⼀定转化率所需时间(不包括辅助时间)。
化学反应工程的分类

Chemical Reaction Engineering
第
§1-2 化学反应工程的分类
一 一、按反应系统涉及的相态分类 章
1.均相反应,包括气相均相反应和液相均相反应。
均
相绪 反
2.非均相反应,包括气—固相,气—液相,气— 液—固相反应等。
应论
动 力
例如: so2 o2 钒 so3 为一气固催化反应
学 二、按反应器形式来分类
Chemical Reaction Engineering
第 一 章 均相绪 反 应论 动 力 学
Chemical Reaction Engineering
第 一 章 均相绪 反 应论 动 力 学
Chemical Reaction Engineering
第 一
三、按反应器操作方式分类
章 1.间歇操作,是指一批物料投入反应器后,经过一定时间的反应
均相绪
再取出的操作方法(一次性投料,卸料。反应物系参数如浓度 或组成等随时间变化)。
反 2.连续操作,指反应物料连续地通过反应器的操作方式(原料不
应论
断加入,产物不断引出,反应器内物系参数均不随时间变化)。
动 3.半连续操作,指反应器中的物料,有一些是分批地加入或取出,
力 3.非等温、非绝热反应
学
器,与外界有热量交 换,但不等温。
Chemical Reaction Engineering
第 一 章 均相绪 反 应论 动 力 学
Chemical Reaction Engineering
第 一 章 均相绪 反 应论 动 力 学
Chemical Reaction Engineering
化学反应工程 第一章

第一章气-固相催化反应本征动力学 概论化工生产中大多数反应是过程,气-固相催化反应是重要反应之一。
本章讨论: 1, 连续过程中化学反应速率的有关问题;2,气-固相催化反应的化学动力学,即本征动力学。
第一节 化学计量学 1-1化学计量式化学计量学是研究化学反应系统中反应物和产物组成相互关系变化的数学表达式。
化学计量式是化学计量的基础。
化学计量式表示参加反应的各组分的娄量关系,等式左边的组分为反应物,等式右边的组分为产物,化学计量式的通式为: 或 或一般将反应物的化学计量取负值,产物的化学计量取正值。
如果反应系统中有m 个反应,则第j 个反应的化学计量式的通式为或112211.........n n n nA A A A υυυυ--++=++112211 0n n n n A A A A υυυυ-----++=10(1,2,...)ni ii A i n υ===∑10(1,2,...)niji i A i n υ===∑112211.........j j n j n nj nA A A A υυυυ--++=++也可用矩阵表示为1-2 反应程度、转化率及化学膨胀因子 一.反应程度对于间歇反应中的单反应 0A B RA B R υυυ++=进行物料衡算按化学计量关系有0000i i A A B B R R i A B Rn n n n n n n n ----ξ====υυυυ 上式中的ξ称为化学反应程度。
注意上述表达式中各项的正负号。
(1-7)式也可表达为: 0i i i i n n n υξ-=∆=0i i i n n n ∆=- 为i 组分已反应的量,所以,知道反应程度即可计算出所有反应物及产物已经反应(或生成)的量。
二、转化率反应物A 的反应量与其初如量之比称为A 的转化率:0000A A A A A A A A n n n x n n n -∆υξ==-=-工业反应过程中的原料中各组分之间往往不符合化学计量关系,通常选择不过量的反应物计算转化率,这样的组分称为关键组分。
化学反应工程第一章

4 反应器的类型
釜式反应器
管式反应器
固定床反应器
流化床反应器
Agitating tank reactor
气液相反应器
Plug flow reactor
Packed bed reactor
Packed bed reactor
Packed bed reactor
Fluidized bed reactor
反应前后物料组成
组分 反应前 % 反应后 % 组分 反应前 % 反应后 %
正丁烷
正丁烯 丁二烯 异丁烷 异丁烯
0.63
7.05 0.06 0.50 0.13
0.61
1.70 4.45 0.48 0
氧气
氮气 水蒸气
7.17
27.0 57.44 -
0.64
26.10 62.07 1.20 1.80
CO2
ISCRE 1
ISCRE 2 ISCRE 3 ISCRE 4 ISCRE 5
Washington
Amsterdam Evanston Heidelberg Houston
USA
Netherlands USA Germany USA
1970
1972 1974 1976 1978
ACS/AIChE
EFChE ACS/AIChE EFChE ACS/AIChE
各因素(T, P, c)的变化规律 最佳工况
化学反应速率:r=f(T,P,C…)
1.2.2 反应工程的研究方法
科学研究的两种主要方法: 1.经验归纳法
2.数学模型法(演绎法)
林语堂在“论东西思想法之不同”:总而
言之,中国重实践,西方重推理。中国重近
情,西人重逻辑。中国哲学重立身安命,西 人重客观的了解与剖析。西人重分析,中国 重直感。西洋人重求知,求客观的真理。中 国人重求道,求可行之道。这些都是基于思
化学反应工程知识点复习

三传一反
动量传递 热量传递 质量传递 反应工程
2·1 概 述
• 均相反应--在均一液相或气相中进行的反应 • 均相反应动力学是解决均相反应器的选型、操
作与设计计算所需的重要理论基础 • 公式:P15
1、化学反应速率及其表示
对于均相反应aA+bB=rR+sS反应速率定义为:
rA
1 V
dpA dt
k1 pA
k2 pP
k1 pA
2.5k2 pA0
pA
积分,得
(k1 2.5k2 )t
ln
pAe pA0 pA pAe
以(-ln(pA-pAe))对t作图
y 0.1633t 2.5035
k1 2.5k2 0.1633
K
k1 k2
2.5( pA0 pAe
pAe )
2.5(1 0.2) 0.2
10
k1 0.131 k2 0.0131
rA 0.131pA 0.0327 pA0 pA
2.2.2 复合反应
复合反应是指同时存在两个以上独立进行反应的反应过 程。
从相同的反应物按各自的计量关系同时地发生的过程称为 平行反应。
如果这些反应是依次发生的,这样的复合反应称为串联反 应。
反应的反应级数或总反应级数:指浓度函数中各组分 浓度的幂数之和。
对可逆反应,有正反应的反应级数和逆反应的反应级数 。
分子数:
对于基元反应:aA+bB=rR+sS
(rA ) k AcA cB
• 分子数:基元反应中反应物分子或离子的个数。 对于基元反应来讲α,β必须是正整数,α+β是基
元反应的分子数,不能大于3(根据碰撞理论, α+β的取值不能大于3,必须是一个小于等于3 的正整数)。
化学反应工程 教案(1-3章)

第一章绪论1.1 化学反应工程学的范畴和任务1.1.1化学反应工程发展简述自然界的物质的运动或变化过程由物理或化学的两类,物理过程不牵涉化学反应,但化学过程却总是与物理因素有着紧密联系。
所以化学反应过程是物理与化学两类因素综合体。
远溯古代,陶瓷制作、酿酒等工艺,但直到本世纪五十年代一直还未形成一门专门研究的独立学科,到1957年举行的第一次欧洲反应工程会议上确立了这一学科的名称。
1.1.2 化学反应工程的范畴和任务化学反应工程学:是一门研究化学反应的工程问题的科学,既以化学反应作为研究对象,又以工程问题为研究对象,把二者结合起来的学科体系。
一、研究的范畴1.化工热力学:确定物系的各种物性常数(热容、研所引资、反应热等),看化学反应是否能进行及其反应程度。
2.反应动力学:专门阐明学反应速率与各项物理因素(如温度、压力、催化剂等)之间的定量关系。
为实现某一反应,要选定合易的条件及反应器的结构型式、尺寸和处理能力等,这些都依赖于对反应动力学特性的认识。
3.催化剂4.设备型式、操作方法和流程有小试到扩是出现放大效应,因此工业装置的反映条件必须结合工程上的考虑才能合理的确定。
反应器型式:管式、釜式、塔式、固定床或流化床等。
操作方式:分批式、连续式或半连续式。
反应器的型式与特性表型式适用反应优缺点搅拌槽液相、液—液、液—固相适用性大,操作弹性大,温度、浓度易控制,产品质量均一管式气相、液相返混小,反应器容积小,比传热面大空塔或搅拌塔液相、液—液相结构简单,返混程度与高/径比及搅拌有关,轴向温差大鼓泡塔或挡板鼓泡塔气—液相,气—液—固相气相返混小,液相返混大,温度较易调节,气体压降大,流速有限制填料塔液相、气—液相结构简单,返混小,压降小,有温差,填料装卸麻烦板式塔气—液相逆流接触,气液返混均小,流速有限制,如需传热,常另加传热面喷雾塔气—液相快速反应结构简单,液体表面积大,停留时间受塔高限制,气流速度有限制固定床气—固相返混小,催化剂用量少,不易磨损,装卸麻烦,传热控温不易流化床气—固相,特别是催化剂失活很快的反应传热好,温度均匀,易控制,催化剂有效系数大,磨损大,返混大,对转化率不利,操作条件限制大移动床同上固体返混小,固气比可变性大,床内温差大,调节困难滴流床气—液—固相催化剂带出少,分离易,气液分不要均匀,温度调节困难蓄热床气相,以固相为热载体结构简单,调节范围较广,切换频繁,温度波动大,收率低喷嘴式气相,高速反应的液相传热、传质速度快,流体混合好,反应物急冷易分批式(或间歇)操作:是指一批反应物料投入反应器内后,让它经过一定的反应,然后再取出的操作方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
n n0 2 2 n A0 n A 1
2xA PB P 1 2xA dP 2P dxA B dt (1 2 x A ) 2 dt
求
dx A dt
n nA0 (1 2 xA )
PA P
nA 1 xA P n 1 2xA
dPA 1 dxA 3P dt 1 2 xA 2 dt
1.2.3均相催化反应
k AC R C
是C为催化剂,Cc为常数。
dC A rA kC A C C k C A 反应速率: dt
1.2.4自催化反应
k AC 2C R ……(1) • 自催化反应:
速率方程:
dn A rA kC A C C Vdt
• k0、E、a1、b1、c1、d1为模型参数,通常应用线性或非线性最小二乘法进行参数估 值。 •
A 2.5 P, 例1:在0℃时纯气体组分A在一恒容间歇反应器中依以下计量方程进行反应: 实验测得如下数据:
组分A分压随时间变化关系
时间/min
0
2
4
6
8
10
12
14
∞
PA/105Pa
1
n
CR R CS S C A A CB B
技 巧:
• 为使速率方程能够同时满足动力学和热力学平衡,可将反应速率方程表示成以下形式:
S R C C R S r kC C C C 1 K C A C B C A B
a1 A b1 B c1 R d1 S
CM 0 2
∴在中间某时刻,-rA必将达到最大,有最大值存在。
结论: 当 CA
时,-rA达到最大。
例2:在700℃和3atm的恒压下进行下列反应:
C4 H10 2C2 H 4 H 2
反应开始时,系统中C4H10的含量为116kg,当反应完成50%,丁烷的分压以 2.4atm/s的速率发生变化,试求下列各项的变化速率:(a)乙烯的分压;(b) H2的摩尔数;(c)丁烷的摩尔分率。
dyA 3 dnA 1 1 0 . 8 ( s ) 2 dt 2 3 n A dt
当r=0时,称之为达到动力学平衡,此时:
k1C C
nA A
nB B
k1 C RR C S S nS nR k 2 C R C S , 则: n n k 2 C AA C BB
n
n
• 热力学平衡
•当时间为无限长,反应过程达到热力学平衡时,此时:
R S
KC
k1 KC k2
•
CR CS
2、转化率对反应速率的影响
结论:
理由:
r x 0 A T
r1 r2 x x 0 A T A T
r1 r2 (负) x x (正) A T A T
A
C A CB
B
显然:即动力学平衡与热力学平衡不一致。
nA nB
1
若要同时满足两个平衡,则下式必须成立:
n
ABnRnR
S
nS S nB B
nS
KC
k1 k 2
1
n
因为:
k1 k 2
C C C C
nR R nA A
Topt Te Te RTe RT E 1 ln 2 1 e E2 E1 E1 Em
Em
E 1 ln 2 E2 E1 E1
二、可逆反应动力学方程的建立——初始速率法
A • 动力学方程: k k' R + S ……(3)
r s rA kCa k C C A R S
1.2.2可逆反应
平衡常数K值 >>1 不可逆反应 之间 可逆反应 <<1 反应不发生
一、可逆反应的动力学特征
对可逆反应: A A B B S S R R
速率方程式为:r r1 r2
k1 f x A k 2 g x A
n A nB k1C A C B nR nS k 2C R C S
dx A 则: 1.0667 ( 1 / S) dt
dPB 1.6( atm / s ) dt
(b)H2的摩尔数
dnC dn A 2.133km ol/ s dt dt
(c) 丁烷的摩尔分率
yA nA nA n 1 A n 6 2n A 2 3 n A
s k k C S 0
dC dC A R dt t 0 dt t 0
根据该式,按照“a的求法”方法,即可求出r。 s的求取: 和r的求取完全一样,略。
动力学平衡和热力学平衡
• 动力学平衡
可逆反应: A A B B S S R R n A nB nR nS 反应速率: r r1 r2 k1C A C B k 2 C R C S
a的求取(初始速率法):
看CA~t的曲线:
方法的关键在于“初始”两字
• 当t→0时,CR=CR0=0,CS=CS0=0
rA t0
CA0 (-rA)0
kC
a A0
rA t0
(CA0)2 (-rA)0,2
dC A dt t0
…… …… (CA0)1 (-rA)0,n
•t=∞ CAe
CPe
PA CA RT
C A0
PA0 44.034m ol/ m 3 RT
达到平衡时:
k 2 C Ae 0.1 k1 C Pe
将速率方程由微分式化为积分式:
dC A k1C A 2.5k 2 C A0 C A k1 2.5k 2 C A 2.5k 2C A0 dt
3、温度对反应速率的影响
dk1 dk 2 r g x A f x A dT dT T x A
dk E k dT RT 2
E1 E2 r f x k g x k A 1 A 2 T xA RT 2 RT 2
解:
C4 H10 2C2 H 4 H 2
A 2B C
t=0 nA0=2 t=t nA=1 0 nB 0 nC
(a)乙烯的分压 (
B
dPB ) dt P V nRT, PV nRT
PB nB P n
n A0 n A 1 nB 2
nB 2(nA0 nA )
2n A 0 x A PB P n
t
C A0
CA
dCA k1 2.5k 2 C A 2.5k 2C A0
1 k2 k1 ln C A0 k2 k2 1 2 . 5 C 2 . 5 C A0 A k1 k1
1 t k1
1 2.5
1 44.034 t 0.8 ln k1 1.25C A 11
(CA0)1 (-rA)0,1
应用试差法即可求出a和k。
• r的求取:
•当t→0时,令CA0=0,CS0大大过量。
r s rA k CR CS
rA t0 k C
'
s S0
C
r R0
k C
''
r R0
dC A dt t0
dC A r k C R 0 dt t 0
……(2)
特点:(1)C为催化剂(表明它是个催化反应); (2)C又是个产物(所以称为自催化反应)。
由(1)式得:
k A C R
t=0 t=t CA0 CA CC0 CC
即:
CC C A0 CC 0 C A CM 0 C A
CM 0 C A0 CC0
1 r r1 E1 r2 E 2 r 0, 故r1 r2 2 T x A RT
• 当反应为吸热反应时:
H E1 E2 0
r 0 T x A
E1 E2
见图1、图2。
结论:可逆吸热反应速率是随温度的升高而增加。
E 1 E1k10 exp RTopt g x A f x A E 2 E 2 k 20 exp RTopt
注 意: • 最优温度为转化率xA的函数,图4虚 线所示,又称最佳温度曲线,是过 程的自身特性,和设备类型及操作 条件无关,在数学上又名无约束最 优。
1、过程的极限
• 达到平衡时:
r 0,即k10e
Te k 20 R ln k 10
E 1 RTe
f xA k20e
E 2 RTe
g x A
平衡温度Te与xA:
E2 E1
E2 E1 g ( x A ) R ln k 20 g ln k10 f f (xA )
• 当反应为放热反应时:
H E1 E2 0 E1 E2
r 则: T x A可能大于0,也可能等于0,
也可能小于0。见图3:
•
r 0(最佳温度) 考察: T x A
f x A k1E1 g x A k 2 E2
Topt
E 2 E1 k 20 E 2 g R ln k10 E1 f
Te与Topt关系如下
E E1 E1 k10 exp 1 k exp 10 RTopt RTe k exp E 2 E 2 k 20 exp E 2 20 RTe RT opt
