《有机化学芳香烃》PPT课件
合集下载
有机化学精品课件第七章 芳香烃.ppt

谢谢阅读
20
3.磺化反应
80℃ + 浓 H2SO4
H2SO4, SO3 30~50℃
SO3H
SO3H
+
H2O
反应可逆,生成的水
使 H2SO4 变稀,磺化速度
变慢,水解速度加快,故
常用发烟硫酸进行磺化,
以减少可逆反应的发生。
烷基苯比苯易磺化
CH 3
+ H2SO4
CH 3
SO3H +
CH 3
反应温度不同
磺化反应历程:
2 H2SO4
SO3 + H3O+ + HSO4
O
+δS
δ
O
H
H+
SO3
SO3H
2020-6-17
O
谢谢阅读
22
4.付瑞德—克拉夫茨(C.Friede — J.M.Crafts)反应
1877年法国化学家付瑞德和美国化学家克拉夫茨发现了制 备烷基苯和芳酮的反应,简称为付—克反应。前者叫付— 克烷基化反应,后者叫付—克酰基化反应。 (1) 烷基化反应 苯与烷基化剂在路易斯酸的催化下生成烷基苯的反应称为 付—克烷基化反应。
2.卤代反应
+ Cl2 + Br2
Fe 或 FeCl3 55~60℃
Fe 或 FeBr3 55~60℃
+ 2Cl2 Fe 或 FeCl3
反应历程:
Cl
+ HCl
Br
+ HBr
Cl
+
Cl Cl
50%
Cl
+ 2HCl
45%
Br 2
Br-Br FeBr3
芳香烃PPT课件

-COOH
苯甲酸
-COOH
R- -R 酸性KMnO4溶液 HOOC- -COOH
总结:苯的同系物中侧链和苯环的相互影响
(1)侧链影响苯环,使苯环上的氢原子比苯更易 被取代(一般在邻位和对位上的H)
(2)苯环影响侧链,使侧链能被强氧化剂氧化 (与苯环直接相连的第一个碳被氧化为羧基。)
稠环芳香 烃——由两个或两个以上的苯环共用相
2、下列物质中所有原子都可能在同一平面上
的是 ( B C )
Cl
CH=CH2
CH3
(A)
(B)
(C)
(D)
(三)、苯的化学性质 1、氧化反应
①空气里燃烧:
2C6H6 +15O2 → 12CO2 + 6H2O 现象:明亮的火焰、伴有黑烟
②不能使酸性KMnO4溶液褪色
2.苯的取代反应:
•Br2 为液溴
5.如何将粗溴苯提纯?
水洗、NaOH溶液、水洗、干燥、蒸馏
(2)苯的硝化反应:
无色、具有苦杏仁味的油状液体,其密 度大于水
注意:
①浓硝酸和浓硫酸的混合酸要冷却到50~60℃以 下,再慢慢滴入苯,边加边振荡,因为反应放热, 温度过高,苯易挥发,且硝酸也会分解,同时苯 和浓硫酸在70~80℃时会产生反应。
①具有可燃性 ②都能产生苯环上取代反应
③能产生加成反应
注意
其它不饱和键优先产生加成
CH=CH-CH=CH2 H2/催
CH=CH-CH2CH3
(2)、苯的同系物含有侧链,性质与苯又有不同 ①侧链影响苯环,使苯环上的氢原子更易被取代
例如:甲苯能产生硝化反应
CH3
浓硫酸
2
+2 HNO3 300C
有机化学第7章,ppt课件

7.4.1 反应类型及反应机理
1. 亲电取代反应概述
+
+ E
HEsp3杂E化sp2杂化
+
E
+
+ -H
+H+
亲电试剂 π络合物 σ络合物 取代苯
+H E H E+
讨论:1.当过渡态 + 比 + 稳定时,中间体 σ
络合物较难形成,一旦形成后很快转化成产物。
+H E
H E+
2.当过渡态 + 比 + 能量相近时,
ψ3
无节面
ψ1 苯的π 电子分子轨道重叠情况
7.3 单环芳香烃的物理性质
物理性质 苯和其同系物的芳烃一般都溶剂,如 乙醚、CCl4 、石油醚等非极性溶剂。具有一定 的毒性,吸入过量苯蒸气,急性中毒引起神经性 头昏,并可发生再生障碍性贫血,急性白血病; 慢性中毒造成肝损伤。
4. 6电子体系有中性分子、碳正离子和碳负离子。 —
苯
环 戊 二 烯 负 离 子
3. 10 π电子体系( n=2)
环辛四烯双负离子
126°46 ' 0.1334nm2K, THF
K
=
= 2K+
0.1462nm
K
成环C不在同一平面 无
π 电子=8
芳
不能形成环状共轭体系 性
成环C在同一平面 有芳 π 电子=10 n=2 性
三苯甲烷
萘
7.1.2 按4n+2规则的n分类
1. 2 π电子体系( n=0)
2.
具两个电子的环状结构是稳定的,有芳香
Ph性。
Ph
Ph Ph
+
化学课件《芳香烃》优秀ppt优秀ppt19 人教课标版

加成反应而使溴水褪色,这是苯与烯烃的明显不同之处。
(1)苯的化学性质可概括为:易取代,能加成,难氧化。 (2)苯的卤代、硝化反应都属于取代反应。
2.能说明苯分子中的碳碳键不是单双键交替的事实是( )
A.苯的一元取代物没有同分异构体
B.苯的邻位二元取代物只有一种
B
C.苯的间位二元取代物只有一种
解析:D.若苯苯的分对子位中二的元碳取碳代键物为只单有双一键种交替连接,则苯的邻位二
入沸水中,将沸腾挥发; (苯有毒!!是常用的有机溶剂。)
4.苯的化学性质
火焰明亮,带有浓烟
2C6H6+15O2―点―燃→12CO2+6H2O
4.苯的化学性质3-1苯取代溴.mp4
反应
化学方程式
燃烧
与液溴
反应条件 点燃
FeBr3作催 化剂
苯的硝化反应 苯的硝化反应.flv 苯的加成反应.swf
C.苯和甲苯都不能使KMnO4酸性溶液褪色
D.苯和甲苯都能与卤素单质、硝酸等发生取代 [解析]反应芳香烃是分子中含一个或多个苯环的烃类化合物,而苯 的同系物仅指分子中含有一个苯环,苯环的侧链全部为烷基的
元取代物有两种,若不是单双键交替,则苯的邻位二元取代物
只有一种;而不论是或不是单双键交替,苯的一元取代物、间
位二元取代物和对位二元取代物都只有一种,B项正确。
3.下列说法中,正确的是
()
D A.芳香烃的分子通式是CnH2n-6(n≥6,n∈N)
B.苯的同系物是分子中仅含有一个苯环的所有
烃类化合物
选修5有机化学基础 章烃和卤代烃 节芳香烃
第 二第 章二
节 烃 和芳 卤香 代烃 烃
晨背关键语句 理解教材新知
把握热点考向 应用创新演练
化学课件《芳香烃》优秀ppt优秀ppt9 人教课标版

5/19/2019
③温度计的位置,必须悬挂在水浴中。 ④不纯的硝基苯(显因黄为色溶有NO2)而纯净硝 基苯是无色,有苦杏仁味,比水重,油 状液体。 ⑤为提纯硝基苯,一般将粗产品依次用
蒸馏水和NaOH溶液洗涤。
5/19/2019
(3)磺化(苯分子中的H原子被磺 酸基取代的反应)
+ HO-SO3H 70℃~80℃
5/19/2019
(1)卤代反应---苯跟溴的反应
问题1:导管口为什么在液面上? 溴化氢易溶于水,防止倒吸。
问题2:什么现象说明发生了取代反应?
导管口有白雾。锥形瓶里滴入硝酸银溶液后 生成浅黄色沉淀,说明苯跟溴反应时苯环上 的一个氢原子被溴原子取代,生成溴化氢。
问题3:怎样除去无色溴苯中所溶解的溴?
联苯或多联苯:苯环之间通过碳碳单键直接相连
—
联苯(C12H10)
稠环芳烃:苯环之间通过共用苯环的若干环边
而形成
萘(C10H8)
蒽(C14H10)
5/19/2019
三、芳香烃的来源及其应用
芳香烃对健康的危害
是黏合剂、油性涂料、油墨等的常用有机溶剂
操作车间空气中苯的浓度≤40mg·m-3
苯 居室内空气中苯含量平均每小时≤0.09mg·m-3
未褪色
2mL甲苯 3滴高锰酸钾酸性溶液
用力振荡
褪色
实验 结论:
苯不能被KMnO4酸性溶液氧化, 甲苯能被KMnO4酸性溶液氧化
5/19/2019
二、苯的同系物
甲苯被氧化的是侧链,即甲基被氧化,该
反应可简单表示为:
CH3
KMnO4、H+
COOH
(苯甲酸)
这样的氧化反应,都是苯环上的烷烃基被 氧化,说明了苯环上的烷烃基比烷烃性质活泼。 这活泼性是苯环对烷烃基影响的结果。
③温度计的位置,必须悬挂在水浴中。 ④不纯的硝基苯(显因黄为色溶有NO2)而纯净硝 基苯是无色,有苦杏仁味,比水重,油 状液体。 ⑤为提纯硝基苯,一般将粗产品依次用
蒸馏水和NaOH溶液洗涤。
5/19/2019
(3)磺化(苯分子中的H原子被磺 酸基取代的反应)
+ HO-SO3H 70℃~80℃
5/19/2019
(1)卤代反应---苯跟溴的反应
问题1:导管口为什么在液面上? 溴化氢易溶于水,防止倒吸。
问题2:什么现象说明发生了取代反应?
导管口有白雾。锥形瓶里滴入硝酸银溶液后 生成浅黄色沉淀,说明苯跟溴反应时苯环上 的一个氢原子被溴原子取代,生成溴化氢。
问题3:怎样除去无色溴苯中所溶解的溴?
联苯或多联苯:苯环之间通过碳碳单键直接相连
—
联苯(C12H10)
稠环芳烃:苯环之间通过共用苯环的若干环边
而形成
萘(C10H8)
蒽(C14H10)
5/19/2019
三、芳香烃的来源及其应用
芳香烃对健康的危害
是黏合剂、油性涂料、油墨等的常用有机溶剂
操作车间空气中苯的浓度≤40mg·m-3
苯 居室内空气中苯含量平均每小时≤0.09mg·m-3
未褪色
2mL甲苯 3滴高锰酸钾酸性溶液
用力振荡
褪色
实验 结论:
苯不能被KMnO4酸性溶液氧化, 甲苯能被KMnO4酸性溶液氧化
5/19/2019
二、苯的同系物
甲苯被氧化的是侧链,即甲基被氧化,该
反应可简单表示为:
CH3
KMnO4、H+
COOH
(苯甲酸)
这样的氧化反应,都是苯环上的烷烃基被 氧化,说明了苯环上的烷烃基比烷烃性质活泼。 这活泼性是苯环对烷烃基影响的结果。
大学有机化学芳香烃PPT课件

HE HE
+或
+
HE
+
HE
+
.
20
σ络合物的能量比苯高,不稳定,很容易从 sp3
杂化碳原子上失去一个质子,使该碳原子恢复成
sp2 杂化状态,再形成六个 π 电子离域的闭合共轭
体系——苯环,生成取代苯。其反应机理可表示如 下:
+
+E
亲电试剂
HEsp3杂E化sp2杂化
+
E
+
+ -H
+H+
π络合物 σ络合物 取代苯
O
R C
δ
δ
R o rR X A lC l3
.
31
5.2加成反应
苯环易起取代反应而难起加成反应,但并不是绝对的,在特 定条件下,也能发生某些加成反应。
1.加氢
NP i, + 3H 2
180~250℃
2.加氯 + 3Cl2
光 50℃
H Cl
CH l
H Cl
Cl 六 六 六 H 对 人 畜 有 害 , 世 界 禁 用 ,
.
18
第五节 单环芳烃的化学性质
亲电取代反应及机理
亲电取代反应 苯环上氢的亲电取代反应:苯环上电子云密
度高,易被亲电试剂进攻,引起 C—H 键的氢被 取代,称为亲电取代反应。
.
19
5.1 亲电取代反应机理
苯与亲电试剂 E+ 作用时,生成 π 络合物,接 着亲电试剂从苯环的 π 体系中得到两个电子,生成 σ 络合物。此时,这个碳原子由 sp2 杂化变成 sp3 杂 化状态,苯环中六个碳原子形成的闭合共轭体系被 破坏,变成四个 π 电子离域在五个碳原子上。从共 振论的观点来看,σ 络合物是三个碳正离子的共振 杂化体:
大学有机化学芳香烃课件

大学有机化学芳香烃课件
让我们一起探索大学有机化学芳香烃的奇妙世界!从烷基苯的合成反应到芳 香烃的应用与生产工艺,这里将为你展示一个全方位的课件。
烷基苯的合成反应
1 苯甲烷与烃的反应
通过烷基化反应,将苯甲烷与烃反应,可以合成烷基苯化合物。
2 重氢化反应
利用重氢化反应,可以将苯甲烷中的苯环氢原子替换为重氢原子,得到重氢化烷基苯。
芳香核磁共振(NMR)谱图解释
谱图读法
NMR谱图通过观察能级跃迁的 信号峰来解释芳香烃分子的结 构和化学环境。
芳香性指数
芳香性指数是评估分子芳香性 的重要参数,可以通过芳香核 磁共振谱图中的信号峰位置来 确定。
化学位移
化学位移是芳香烃谱图中的关 键特征,可用于确定分子中芳 香性环的相对位置。
一元芳香烃的取代反应
芳基芳基偶联反应
芳基芳基偶联反应是合成对称二 元芳香烃的重要手段,可以连接 两个芳香环。
杂环芳香烃的合成
通过循环合成反应,可以合成包 含杂原子的二元芳香烃化合物。
苯的氢化反应与重氢化反应
1 苯的氢化反应
通过催化剂的作用,苯环中的双键被还原为单键,实现苯环的氢化。
2 重氢化反应
利用含重氢(氘)的试剂与苯发生反应,替换苯环的氢原子为氘原子,得到重氢化苯。
3 催化烷基化反应
通过催化剂的作用,将苯环中的氢原子替换为烷基,实现烷基苯的合成。
芳香烃的可见光催化氧化反应
可见光激发
通过可见光照射,芳香烃可 以被激发产生高能态,参与 氧化反应。
活性氧物种
在可见光催化氧化反应中形 成的活性氧物种可以与芳香 烃发生反应,产生氧化产物。
催化剂的选择
不同类型的催化剂可以加速 可见光催化氧化反应的速率, 提高反应效率。
让我们一起探索大学有机化学芳香烃的奇妙世界!从烷基苯的合成反应到芳 香烃的应用与生产工艺,这里将为你展示一个全方位的课件。
烷基苯的合成反应
1 苯甲烷与烃的反应
通过烷基化反应,将苯甲烷与烃反应,可以合成烷基苯化合物。
2 重氢化反应
利用重氢化反应,可以将苯甲烷中的苯环氢原子替换为重氢原子,得到重氢化烷基苯。
芳香核磁共振(NMR)谱图解释
谱图读法
NMR谱图通过观察能级跃迁的 信号峰来解释芳香烃分子的结 构和化学环境。
芳香性指数
芳香性指数是评估分子芳香性 的重要参数,可以通过芳香核 磁共振谱图中的信号峰位置来 确定。
化学位移
化学位移是芳香烃谱图中的关 键特征,可用于确定分子中芳 香性环的相对位置。
一元芳香烃的取代反应
芳基芳基偶联反应
芳基芳基偶联反应是合成对称二 元芳香烃的重要手段,可以连接 两个芳香环。
杂环芳香烃的合成
通过循环合成反应,可以合成包 含杂原子的二元芳香烃化合物。
苯的氢化反应与重氢化反应
1 苯的氢化反应
通过催化剂的作用,苯环中的双键被还原为单键,实现苯环的氢化。
2 重氢化反应
利用含重氢(氘)的试剂与苯发生反应,替换苯环的氢原子为氘原子,得到重氢化苯。
3 催化烷基化反应
通过催化剂的作用,将苯环中的氢原子替换为烷基,实现烷基苯的合成。
芳香烃的可见光催化氧化反应
可见光激发
通过可见光照射,芳香烃可 以被激发产生高能态,参与 氧化反应。
活性氧物种
在可见光催化氧化反应中形 成的活性氧物种可以与芳香 烃发生反应,产生氧化产物。
催化剂的选择
不同类型的催化剂可以加速 可见光催化氧化反应的速率, 提高反应效率。
有机化学芳香烃PPT课件
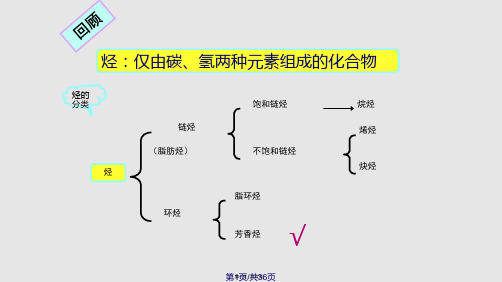
2. 间位定位基
第二类定位基,间位定位基能使苯环钝化
第第3三1十页一页/,共共337页6。页
取代基的定位效应
第第3三2十页二页/,共共337页6。页
NR
+ 3
小结
• 芳香烃的分类 • 芳香烃的结构 • 芳香烃的命名 • 单环芳烃的取代反应加、成反应 • 烷基苯侧链的反应 课后练习P64选择题、命名题
CH3
CH3 CH3
H3C
CH3
CH3
1,3,5-三甲苯 均-三甲苯
1,2,4-三甲苯
偏-三甲苯
第第1十3三页页,/共共373页6。页
当苯环连接较复杂的烃基或不饱和烃基时,常以苯环为取代基进行命名。
6 5 43 21
CH3CH2CHCH2CHCH3 CH3
CH CH2
2-甲基-4-苯基己烷
苯乙烯
第第1十4四页页,/共共373页6。页
α
CH2CH3
KMnO4
COOH
注意:叔丁基苯由于无,在一般情况下不
氧化
第第二2十9九页页/,共共3376页页。
CH3
均有,直接氧化成苯甲酸
CH2CH2CH3
MnO4-/H2O
COOH
第第3三0十页页,/共共373页6。页
六、苯环上取代反应的定位规律
(一) 两类定位基 1. 邻对位定位基
第一类定位基,使苯环活化 (卤素除外)。
第第8八页页,/共共373页6。页
(3) 稠环芳香烃:分子中含有两个或多个苯 环共用两个相邻碳原子的芳香烃,称为稠环芳香烃。
萘37页6。页
三、芳香烃的命名 1.芳基的概念
芳烃分子中,去掉一个氢原子后,剩下的基团称为芳基,用--Ar表示。重要的芳基有:
第二类定位基,间位定位基能使苯环钝化
第第3三1十页一页/,共共337页6。页
取代基的定位效应
第第3三2十页二页/,共共337页6。页
NR
+ 3
小结
• 芳香烃的分类 • 芳香烃的结构 • 芳香烃的命名 • 单环芳烃的取代反应加、成反应 • 烷基苯侧链的反应 课后练习P64选择题、命名题
CH3
CH3 CH3
H3C
CH3
CH3
1,3,5-三甲苯 均-三甲苯
1,2,4-三甲苯
偏-三甲苯
第第1十3三页页,/共共373页6。页
当苯环连接较复杂的烃基或不饱和烃基时,常以苯环为取代基进行命名。
6 5 43 21
CH3CH2CHCH2CHCH3 CH3
CH CH2
2-甲基-4-苯基己烷
苯乙烯
第第1十4四页页,/共共373页6。页
α
CH2CH3
KMnO4
COOH
注意:叔丁基苯由于无,在一般情况下不
氧化
第第二2十9九页页/,共共3376页页。
CH3
均有,直接氧化成苯甲酸
CH2CH2CH3
MnO4-/H2O
COOH
第第3三0十页页,/共共373页6。页
六、苯环上取代反应的定位规律
(一) 两类定位基 1. 邻对位定位基
第一类定位基,使苯环活化 (卤素除外)。
第第8八页页,/共共373页6。页
(3) 稠环芳香烃:分子中含有两个或多个苯 环共用两个相邻碳原子的芳香烃,称为稠环芳香烃。
萘37页6。页
三、芳香烃的命名 1.芳基的概念
芳烃分子中,去掉一个氢原子后,剩下的基团称为芳基,用--Ar表示。重要的芳基有:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
X
X
X
X
X
不符合实验事实: X
X
① 难与Br2加成; X ② 一种邻二取代物。
编辑ppt
X X
2
凯库勒提出:
苯环上的双键没有固定位置,两种邻二 取代物不能分离(解释②)
X
X
X
X
无法解释①
编辑ppt
3
二、苯分子结构的解释
H σ H
σ
H H
0.1397nm
苯:
H
碳碳键长:0.1397nm
120°
普通C-C 普通C=C
催化剂作用:加促产生亲电试剂NO2+
编辑ppt
23
(2)反应机理—
O快
+N +
O
亲电加成-消除反应历程
+
N O 2
H N O 2
慢
快
+ -H+
N O 2
π络合物
σ络合物
亲电加成
实验: C6H6 C6D6 同等条件下硝化
V1
V2
V1=V2
证明H的离去不是决速步骤
编辑ppt
消除
24
O快
+N +
H N O 2
磺化:
+S O3 或 浓 H2 S O4
NO2 X S O3 H
编辑ppt
18
烷基化:
+RX
AlX3
R
酰基化:
+R C OFeX3
X
O C
R
注意:
① 每类反应的特点; ② 比较苯、甲苯和硝基苯的反应活性; ③ 反应机理。
编辑ppt
19
1. 硝化反应
+H N O3
浓 H2 S O4 55~ 60℃
胺
-COR 羰基
酮
-OH 羟基
酚
-SO3H 磺酸基 磺酸
-CHO 醛基
醛 -COOH
编辑ppt
羧基
酸
15
取代基 -X(F Cl Br I)
-NO2、-NO -R -OR
取代基名称 卤素
硝基、亚硝基 烃基
烃氧基
编辑ppt
16
2.苯环上有多取代基,选择母体,定位为1位。
其它取代基按“顺序规则”,优先基团后列出。
N O2
N O2
N O2
N O2
发 烟 H N O3
继 续 反 应
浓 H2 S O4 95℃
CH3
CH3
浓HNO3 浓H2SO4 30℃
110℃
N O2
O2 N
CH3
N O2
+
NO2 发烟HNO3
浓H2SO4 80℃
NO2
编辑ppt
20
CH3 NO2O2N
+
CH3 NO2 发 烟 HNO3
O2N
浓 H2SO4 110℃
轨道:
反键轨道
E
原子轨道
成键轨道
编辑ppt
8
23
1 6
4 ψ6
5
23
三 个节 面
23
1
4
1
4
E
6
5
ψ4
ψ5
6
5
两 个节 面
两 个节 面
23
1
4
6
5 ψ2
1
ψ3
23
4
6
5
一 个节 面
23
一 个节 面
1
4 ψ1 无 节面
6
5
编辑ppt
9
三个ψ成键轨道的迭加结果,六个碳上 的电子云密度相等,C-C键键长完全平均 化。
NO2 C H3
NO2
NO2 NO2
编辑ppt
22
(1)浓硫酸的作用
亲电试剂: NO2+ +快
H2SO4 HONO2
+
慢
H2O NO2
H2O + H2SO4
+ +
H2O NO2
HSO4-
NO+2 + H2O
H3O++HSO4-
+ H S 2 O 4H O N O 2
N O 2 + + H 2 S O 4 -+ H 3 O
第四章 芳烃 Arene
脂肪烃
(aliphatics)
烃
单环芳烃
CH3
CH=CH2 C H
芳香烃 (arenes)
多环芳烃
联苯 对苯脂肪烃 (C6H5)3CH
稠环芳烃
编辑ppt
1
第一节 苯的结构
一、苯的凯库勒式
H
H
H
H
H
H
简写:
符合实验事实:
① 满足C的四价性; ② 一种一元取代物; ③ 三种二元取代物。
CH3
邻二甲苯 O-二甲苯
CH3
间二甲苯 对二C甲H3苯 m-二甲苯 p-对二甲苯
ortho 邻 meta 间 para 对
对保留俗名的芳烃,如甲苯、异丙苯等可作为母
体命名 C2 H5
C H3 H3 C
C(C H3)3
对乙基甲苯
对叔丁基甲苯
编辑ppt
13
3. 三烃基苯
H3C
CH3 CH3
CH3 CH3
CH3
连三甲苯
H3C
CH3
CH3
偏三甲苯 均三甲苯
当烃基不同时,按顺序规则,以小基团为1位 (为母体)满足取代基位码尽可能小。
C2H5 CH3
2-乙基-4-异丙基甲苯
(CH3)2CH
编辑ppt
14
二、苯的衍生物
1.取代基和专有名称
取代基
取代基 名称
母体 名称
取代基
取代基 名称
母体 名称
-NH2 氨基
1. 一烃基苯、
以苯环为母体,称“× ×苯”
以苯基为取代基,称“苯基× ×”
CH3
CH(CH3)2 CH=CH2 C CH
(C6H5)3CH
甲苯 异丙苯 CH3 CH3
CH3CH2CHCH2C CH
苯乙烯
编辑ppt
苯乙炔 三苯甲烷
2,4-二甲基-1-苯基-1-己烯
12
2.二烃基苯
CH3 CH3
CH3
NH2
OH Cl
CHO NH2
NH2 SO3H
NO2 A
CH3 B
HO C
NO2 D
A. 间硝基苯胺
C. 2-氨基-5-羟基苯甲醛
3-硝基苯胺
B.4-甲基-2-氯苯酚 D. 2-氨基-6-硝基苯磺酸
编辑ppt
17
第三节 单环芳烃的性质
一、亲电取代反应
硝化:
+HNO3 浓H2SO4
卤代:
+X2
FeX3
编辑ppt
10
三、氢化热和苯分子的稳定性
烃 氢化热 (KJ/mol) 离域能(KJ/mol)
119.5
< 239 (2× 119.5)
7.2
208
< 3 5 8 .5(? 3 × 1 1 9 .5 )
152
离域能(共轭能)越大,共轭体系越稳定。
编辑ppt
11
第二节 芳烃的异构现象及命名
一、单环烃基苯
编辑ppt
25
如何解释思考题②和③
CH3 NO2
TNT
NO2
NO2
思考: ① 浓硫酸起什么作用? ② 从反应条件看几种单环芳烃的硝化活性 ③ 当苯环上有取代基后,继续硝化时的取代位置
原有取代基
-NO2 -CH3 - CH3, -NO2
后进入位置 间位
邻位、对位 甲基的邻位、对位
编辑ppt
21
C H3 NO2
NO2
C H3
NO2
NO2
N O 2
N O 2 + 慢
快
+ -H+
π络O 合物: 没有生成共价键
σ络合物: 碳原子杂化态从SP2转化为SP3,大
π键被破坏,四个π电子离域于环上
五个碳原子上,使苯环呈正电荷。
H N O 2
+
H N O 2
H N O 2
+
H N O 2
+
+
极限式
离域式
当σ络合物脱去H+,碳从SP3转化为SP2 ,又形成大π键。
H
0.154nm 0.134nm
键角:120°
构型:平面正六边形
编辑ppt
4
1. 价键理论解释
(1)苯的骨架: 6个C sp2 C sp2键 6个C—H键
C sp2杂化
编辑ppt
5
(2)6个P 轨道平行交盖形成大π键。
编辑ppt
6
编辑ppt
7
2. 分子轨道理论解释
(1)苯的骨架结构(同上)
(2)6个P 原子轨道线性组合成6个分子
