高中化学 阿伏加德罗定律及5个推论
阿伏伽德罗定律及其推论ppt课件.ppt
1.下列说法中正确的是 [
]
A.相同状况下,
气体的摩尔体积约等于22.4L/mol
B.标准状况下,22.4L的任何气体中都
约含有6.02×1023个分子
C.0℃,101kPa条件下,5.6LNH3中约 含有6.02×1023个原子
D.100℃、101kPa条件下,
22.4L水蒸气的质量等于18g
2.同温同压下,物质的量为0.2mol的 N2O(气)和NO2(气),它们的 [ CD ] A.质量相同,体积不同 B.体积相同,分子数不同 C.分子数相同,质量不同 D.体积相同,原子数相同
m
M
n X NA
N
XM
NA
ρ Vm X
ρX
Vm
V
1.利用气体摩尔体积,进行质量与体积 间的相互计算
【例题1】8.5g氨在标准状况时体积是多少升? 解:氨的式量是17,氨的摩尔质量是17g/mol
n(NH3)=
m(NH3) M(NH3) =
8.5g 17g/mol = 0.5mol
V(NH3)=22.4L/mol×0.5mol=11.2L
等于摩尔质量比。
练习:
ρ1∶ρ2=M 1∶M 2
在标准状况下,空气的平均式量为29,
相同条件下的下列气体密度比空气密度大的是(①③④ )
①CO2②H2③Cl2④HCl⑤N2
推论5
恒温恒容下,
气体的压强比等于它们的物质的量之比。
即:p1∶p2=n1∶n2
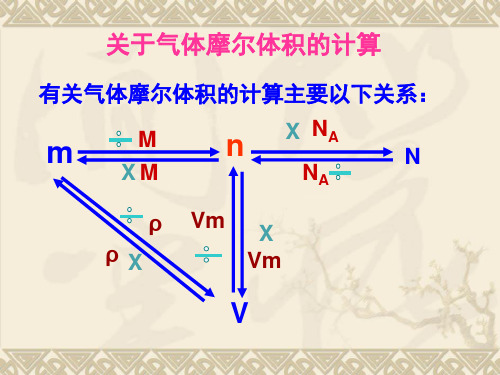
三、关于气体摩尔体积的计算
有关气体摩尔体积的计算主要以下关系:
解得:x=8g m(CO2)=30g-8g=22g
V(CO2)=17.6L-6.4L=11.2L
答:CO的质量为8g,CO2的质量为22g; CO的体积为6.4L,CO2的体积为11.2L。
阿伏加德罗定律及其推论(修改版)2015修改版

第十讲 阿伏加德罗定律及其推论一、阿伏加德罗定律及其推论同温、同压下相同体积的任何气体都含有相同的分子数。
推论:1 同温同压下:111222V n N ==V n N 推论:2 同温同体积下:1122P n =P n 推论:3 同温同压下:1122M ==D M ρρ(相对密度) 二、混合气体平均摩尔质量的求算方法①已知混合物的总质量[m (混)]和总物质的量[n (混)],则:(混)=)()(混混n m 。
②已知标准状况下混合气体的密度[ρ(混)],则:(混)=(22.4L/mol)×ρ(混)。
③已知同温、同压下混合气体的密度[ρ(混)]是一种简单气体A 的密度[ρ(A)]的d 倍(也常叫相对密度),则:d=)A ()()A ()(M M 混混=ρρ,即M (混)=d ×M(A)。
④已知混合物各成分的摩尔质量和在混合体系内的物质的量的分数或体积分数(对气体),则:(混)=M(A)×a%+M(B)×b%+M(C)×c%例题精析【例题1】标准状况下,m g 气体P 和n g 气体R 所含分子数目相同,下列说法中不正确的( )A.气体P 和气体R 的相对分子质量之比为n ∶mB.同温同压下,气体P 和R 的密度之比为 m ∶nC.同质量的气体P 和R 的分子个数之比为 n ∶mD.同温同压同体积的气体P 和R 的质量之比为 m ∶n【例题2】有一真空瓶的质量为m 1,该瓶充入空气后总质量为m 2,在相同状况下,若充入某气体A 后,总质量是m 3,求A 的式量。
【例题3】已知空气中氮气和氧气的体积之比大约为4:1;估算空气的平均相对分子质量。
【变式1】某混合气体由H2、O2按物质的量之比比1:8构成,计算该混合气体的平均相对分子量。
该气体对H2的相对密度是多少?【变式2】某混合气体由H2、O2按质量比1:8构成,计算该混合气体的平均相对分子量。
该气体对H2的相对密度是多少?【例题4】标准状况下CO和CO2的混和气体5g 所占体积为 3. 36L。
阿伏伽德罗定律及其推论

A.3∶2
B.1∶3
C.2∶3
D.1∶2
【规范解答】选A。1 mol H2含氢原子2 mol,1 mol NH3含 氢原子3 mol,若H2和NH3所含氢原子数相等,则H2和NH3 的物质的量之比为3∶2,同温同压下气体的体积比等于
其物质的量之比,两个容器的体积比是3∶2。
精品课件
【互动探究】(1)若改为A容器中H2与B容器中 NH3所含原子数相等,则两个容器的体积之比为 ________。
气体摩尔体积(二)
阿伏加德罗定律及其推论
精品课件
气体摩尔体积 定义:单位物质的量的 气体所占的体积 Vm=V/n 单位:L/mol
精品课件
[注意]
★ 气体摩尔体积的数值不是固定不变的,它与 温度和压强有关
★ 气体摩尔体积只适用于气态物质,对于固态 物质和液态物质来讲,都是不适用的。
★ 标准状况下气体摩尔体积约为22.4L/mol (标准状况:T=0 ℃,P=101KPa)
物质的量分数)
精品课件
例题讲析
已知氮气和氨气的混合气体在标准状况 下的密度为1g/L,求混合气体的平均相 对分子质量。
解析:混合气体的平均摩尔质量为: 1g/L×22.4L/mol=22.4g/mol
故混合气体的平均相对分子质量为22.
精品课件
【练习4】
标准状况下
CO和CO2的混和气体 5g 所占体积为 3. 36L。 求CO的质量、CO2的体积及混和气体的平均式量。
精品课件
5. 气体的相对分子质量(M)的计算
(1)已知标准状M=况ρ下标气体. 2密2度.4ρ标
(2)已知两种气体的相对密度D
M(A)=D . M(B)
(3)混合气体的平均相对分子质量(M)
阿伏伽德罗定律及其推论

N
n
×NA
V(气体)
×ρ ÷ρ
m
分子数目
〖阅读材料〗
阿伏加德罗定律
1805年盖·吕萨克在定量研究气体反应体积间的关系时,发 现了气体定律:当温度和压强不变时,参加反应的气体与生成 的气体体积间成简单的整数比。
这一定律的发现,引起了当时许多科学家的注意。贝采利
乌斯首先提出了一个假设:在同温同压时,同体积的任何气体 都含有相同数目的原子。
思考:该假设能否解释如下事实——1体积的氢气和1体积的 氯气反应生成2体积的氯化氢?
为解决矛盾,1811年阿伏加德罗在化学中引入了分子的概念, 提出了阿伏加德罗假说:在同温同压下,同体积的任何气体都 含有相同数目的分子。
一、阿伏加德罗定律
1、含义 同温、同压下,相同体积的任何气体都含有相同
数目的分子数。
2、适用范围:
适用于气态物质(既适用于单一气体,又适用 于混合气体)
二、阿伏加德罗定律推论
推论1:同温同压下,
,M=22.4 ρ气 ( 单位:g/L)
推论3:同温同体积,
阿伏伽德罗定律推论及应用

阿伏伽德罗定律应用
• • 1. 下列叙述正确的是 ( ) A.同温同压下,相同体积的物质,其物质的量必 然相等 • B.任何条件下,等物质的量的乙烯 (C2H4) 和一氧 化碳所含的分子数必然相等 • C.1 L一氧化碳气体一定比1 L氧气的质量小 • D.同温同压下,等体积的物质所含的分子数一定 相等
结论 语言表达 同温、同压下,气体的密度与其 相对分子质量成正比 同温、同压、相同体积的气体, 其质量与相对分子质量成正比
相同条件 公式
结论 语言表达
T、p、m V1 M2 同温、同压下,等质量的气体,其 = V M1 体积与相对分子质量成反比 2 相同 T、V、m p1 M2 同温、同体积下,等质量的气体, = p M1 其压强与相对分子质量成反比 2 相同
阿伏伽德罗定律及其推论
学习目标
• • • • • 【知识目标】 1. 进一步巩固物质的量的概念及其与质量、摩 尔质量、物质的量、物质的粒子数之间的相互 关系 2.知道阿伏伽德罗定律及其推论的概念,学 会有关阿伏伽德罗定律及其推论的应用的简单 计算 【能力目标】 初步学会分析处理数据、推. 相同条件下,同质量的X、Y两种气体, 相对分子质量分别为A、B;则: • (1)X与Y的体积比为________,分子个 数比为________,密度比为________; • (2)相同条件下的X、Y两种气体体积相 同,则X与Y的质量比为________,物质的 量比为________。
阿伏加德罗定律:
同温同压下,相同体积的任何气体都 具有相同的分子数
阿伏加德罗定律:
同温同压下,相同体积的任何气体都 具有相同的分子数
• 例:同温、同压下,CO2与CO的体积分别 为12 mL 、6 mL ,则CO2与CO 物质的量之 比为 2:1
8阿伏伽德罗定律以及推论

阿伏伽德罗定律以及推论【知识整合】一、阿伏加德罗定律在相同温度和压强下,相同体积.............的任何气体都含有相同数目的分子数。
注意:在该定律中有“四同”:同温、同压、同体积、同分子数目,有“三同”就可定“一同”。
二、阿伏加德罗定律的推论根据阿伏加德罗定律及气态方程(pV =nRT )限定不同的条件,便可得到阿伏加德罗定律的多种形式, ○1T 、p 相同21N N =21V V 同温同压下,气体的分子数与其体积成正比○2T 、V 相同21p p =21N N 温度、体积相同的气体,压强与其分子数成正比○3n 、p 相同21V V =21T T 分子数相等、压强相同的气体,体积与其温度成正比○4n 、T 相同21p p =12V V 分子数相等、温度相同的气体,压强与其体积成反比○5○6○7T 、p 、m 相同21MM =12V V 同温同压下,等质量的气体相对分子质量与其体积成反比【典例分析】例1、 同温同压下,质量相等的O 2与CO 2,密度比为_______,体积比为_______;同温同压下,体积相等的O 2与CO 2,密度之比为_______,质量之比为_________。
例2、 同温同压下,某瓶充满O 2,质量为116g ,充满CO 2质量为122g ,充满气体X ,质量为114g ,则X 的相对分子质量为( )A .28B .60C .32D .44例3、体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气,在同温同压下两容器内的气体一定具有相同的( ) A. 原子总数 B. 质子总数 C. 分子总数 D. 质量例4、某非金属单质A 和氧气发生化合反应生成B 。
B 为气体,其体积是反应掉氧气体积的两倍(同温同压)。
以下对B 分子组成的推测一定正确的是()A. 有1个氧原子B. 有2个氧原子C. 有1个A 原子D. 有2个A 原子例5、在150℃时,(NH 4)2CO 3分解的方程式为:(NH 4)2CO 3=====△2NH 3↑+H 2O↑+CO 2↑,若完全分解,产生的气态混合物的密度是相同条件下氢气密度的( ) A .96倍 B .48倍 C .12倍 D .10倍【测评反馈】1.同温、同压下,下列有关比较等质量的二氧化硫气体和二氧化碳气体的叙述中正确的是( )A .密度比为16:11B .密度比为11:16C .体积比为1:1D .体积比为11:162.下列各组中,两种气体的分子数一定相等是( )A .温度相同、体积相同的O 2和2NB .质量相等、密度不等的2N 和42HC C .体积相等、密度相等的CO 和42H CD .压强相同、体积相同的2N 和2O3.在一定条件下,气体A 可发生如下反应:,若知所得混合气体对氢气的相对密度为4.25,则A 的相对分子质量可能为( ) A .34 B .8.5C .17 D .16 4.在一定温度和压强下,1体积2X (气)和3体积2Y (气)化合生成2体积Z (气),则Z 的分子式是( )A .3XYB .XYC .Y X 3D .32Y X5.在标准状况下,如果25.0LO 含有m 个2O 分子,则阿伏加德罗常数可表示为( ) A .m/22.4 B .44.8mC .22.4m D .m/326.在同温、同压下,有同质量的气体X 和Y 。
阿伏伽德罗定律的推论

阿伏伽德罗定律的推论
阿伏伽德罗定律,也被称为物质守恒定律,是化学领域中一个重
要的基本原则。
它表明,在任何化学反应中,所有参与反应的物质的
总质量保持不变。
换句话说,化学反应发生时,物质的总质量既不会
减少也不会增加。
根据阿伏伽德罗定律,可以得出以下推论:
1. 反应物质的质量与生成物质的质量的关系:在一个化学反应中,反应物质的总质量等于生成物质的总质量。
无论是化学反应中发
生的任何变化,总质量都必须保持恒定。
2. 化学计量关系的确定:通过阿伏伽德罗定律,可以确定化学
反应中不同物质的质量之间的化学计量关系。
化学计量关系是化学方
程式中反应物质与生成物质之间的质量比。
通过实验测量出反应物质
和生成物质的质量,可以确定它们之间的化学计量关系,并进一步研
究反应机理和反应速率。
3. 原子守恒定律的推论:阿伏伽德罗定律是原子守恒定律的基础。
原子守恒定律表明,在化学反应中,每种元素的原子数目保持不变。
由于原子不会被创建或消灭,所以反应前后每个元素的原子数目
必须保持一致。
阿伏伽德罗定律的推论为化学研究提供了重要的理论指导。
通过
理解和应用这些推论,化学家能够更好地探索和解释化学反应的本质,并在实际应用中进行合成化学、分析化学、物理化学等领域的研究。
在工业生产中,也可以基于阿伏伽德罗定律来设计和控制化学反应过程,以实现高效、安全和可持续的化学生产。
阿伏加德罗定律及其推论

状态1:P1M1=ρ1RT1 状态2:P2M2=ρ2RT2
① ②
① PM RT T —: 1 1 1 1 1 1 ② P2 M 2 2 RT2 2T2
3
第二部分 经典例题赏析 第二部分:经典例题 德 律 其推 考查 1.(1999年上海)由CO2、H2和CO组成的混合气在同温 同压下与氮气的密度相同 则该混合气体中CO2、 同压下与氮气的密度相同。则该混合气体中 H2和CO的体积比为( ) A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.26∶16∶57
知识点回顾 阿伏加德罗定律及其推论的内容 4.阿伏伽德罗定律的推论3: 同温、同压、同体积时: 气体质量之比等于构成气体物质分子的摩尔质量之比。 5.阿伏伽德罗定律的推论4: 同温、同体积、同质量时: 气体的压强之比等于构成气体物质分子的摩尔质量的反比。 气体的压强之比等于构成气体物质分子的摩尔质量的反比 6.阿伏伽德罗定律的推论5: 同温、同压时: 气体的密度之比等于构成气体物质分子的摩尔质量之比。
4
m1 M 1 m2 M 2
知识点精讲 ① P1V1 m1M2RT1 m1M2T1 —— : —— = ———— = ———— ② P2V2 m2M1RT2 m2M1T2 5.阿伏伽德罗定律的推论4: 同温、同体积、同质量时: 体 质量时 (T1 = T2,V1 = V2,m1 = m2 )
P1 M 2 P2 M 1
知识点精讲 克拉伯龙方程的变形形式 m PV RT M m1 状态1:PV RT 1 1 M1 1 状态2: P2V2
m2 RT2 M2
知识点精讲 ① P1V1 m1M2RT1 m1M2T1 —— : —— = ———— = ———— ② P2V2 m2M1RT2 m2M1T2 3.阿伏伽德罗定律的推论2: 同温 同压 同质量时:(T1 = T2,P1 = P2,m1 = m2 ) 同温、同压、同质量时:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阿伏加德罗定律
•阿伏伽德罗定律:
同温同压下,相同体积的任何气体含有相同的分子数。
•
•阿伏伽德罗定律的使用范围:
阿伏伽德罗定律只对气体起作用,使用于任何气体,包括混合气体。
•方法与技巧:
1.“三同”定“一同”(温度、压强、气体体积、气体分子数);“两同”
定“比例”。
2.阿伏伽德罗定律及其推论的数学表达式可由理想气体状态方程(PV=nRT)
或其变形形式(PM=ρRT)推出,不用死记硬背。
•理想气体状态方程:
理想气体状态方程的表达式:PV= nRT
P表示压强,V 表示体积,T表示温度,R是常数,n是气体的物质的量。
可根据此方程来推断阿伏伽德罗定律的相关推论:
一、阿伏伽德罗定律及推论
1、定律内容:同温同压下,相同体积的任何气体含有相同数目的分子。
注意:
(1)适应范围:任何气体。
(2)拓展:在定律中,可以“四同”中的任意“三同”为条件,均可导出“第四同”。
(3)与气体摩尔体积的关系:标准状况下的气体摩尔体积实际上是阿伏加德罗定律的一个特例。
2、重要推论:
根据理想气体状态方程推导:
(1)、同温同压下,任何气体的体积之比等于物质的量(或分子数)之比。
V1:V2=n1:n2=N1:N2。
(2)、同温同体积的任何气体的压强之比等于物质的量之比。
p1:p2=n1:n2。
(3)、同温同压下,气体密度之比等于相对分子质量之比。
ρ1:ρ2=M1:M2
(4)、同温同压下,同体积的气体的质量之比等于密度之比。
m1:m2=ρ1:ρ2
(5)、同温同压下,同质量的气体的体积之比等于相对分子质量的反比。
V1:V2=M2:M1
(6)、同温同体积同质量的任何气体的压强之比等于相对分子质量的反比。
p1:p2=M2:M1
【练习】
1.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内气体的温度和密度相等时,下列说法正确的是( )
A.两种气体的压强相等
B.O2比O3质量小
C.两种气体的分子数目相等
D.两种气体的氧原子数目相等
参考答案:D
二、气体密度和气体相对分子质量的计算方法
1、气体密度的计算:
(1)密度定义法:任意情况下,ρ=m÷v
(2)摩尔质量法:在标准状况下,ρ=m÷v=M•n÷Vm•n=M÷22.4L.mol-1
(3)相对密度法:同温同压下,A气体对B气体的相对密度等于A气体的密度比B气体的密度,也等于A气体的相对分子质量比B 气体的相对分子质量。
D=ρA÷ρB=MA÷MB
2、气体相对分子质量的计算:
(1)标况密度法:M=22.4L•mol-1×ρ(g/l)
(2)相对密度法:MA=MB•D
(3)混合气体的平均式量(M):
A、摩尔质量定义法:
M=m总÷n总=(M1n1+M2n2+…+Mini) ÷n总=(M1V1+M2V2+…+MiVi) ÷n总
B、物质的量或体积分数法:M=M1a1+M2a2+…+Miai
其中:M1、M2、…+Mi为各气体组分的摩尔质量,a1、a2、…、ai各气体组分的物质的量分数或体积分数。
【练习】
1.由CH4和O2组成的混合气体,标准状况下的密度为1g•L﹣1,则该混合气体中CH4和O2的体积比为( )
A. 2:1
B.3:2
C. 2:3
D.1:2
参考答案:B。
