配合物结构-晶体分子
无机化学 第十一章配合物结构

② 先阴离子配体,后阳离子和中性配体;
K[PtCl3NH3] 三氯· 氨合铂(Ⅱ)酸钾 配体数目(一、二、三等) →配体名称→合→中心 离子名称(氧化态Ⅰ、Ⅱ、Ⅲ等)
③ 同类配体,按配位原子元素符号的字母顺序排列:
[Co(NH3)5H2O]Cl3
三氯化五氨· 水合钴(Ⅲ)
④ 同类配体而且配位原子相同时,则将含较少原子数
(2)[ 内界 ] 命名顺序:
配体数目(一、二、三等) →配体名称→合→中心 离子名称(氧化态Ⅰ、Ⅱ、Ⅲ等)
[Co(NH3)6]Cl3 [Cu(en)2]SO4 H2[SiF6] [Cu(H2O)4]2+
三氯化六氨合钴(Ⅲ) 硫酸二乙二胺合铜(Ⅱ) 六氟合硅(Ⅵ) 酸 四水合铜(Ⅱ)配离子
(3) 多种配体共存时排列顺序 ① 先无机配体,后有机配体; [PtCl2(Ph3P)2] 二氯· 二(三苯基膦)合铂(Ⅱ)
一般若分子无“对称面”或“反演中心”,则 有对映异构体。 ①Mabcd四面体分子有对映体; ②平面正方形配合物某配体中含有手性C、N、P,As 则有对映体; ③八面体没有σ或i,则有对映体。
m C A A B CC AA AA MM BB CB BC A A M B C M C M B C A A
轨道,可以和CN-离子充满电子的pz轨道重叠,而形
成离域∏98键,增强了[Ni(CN)4]2-配离子的稳定性。
Ni 2 +
CN
N C Ni C N C C
N
2Ni(CN)4
N
价键理论的应用和局限性 价键理论可用来: 1、解释许多配合物的配位数和几何构型。 2、可以说明含有离城键的配合物特别稳定。 3、可以解释配离子的某些性质,如[Fe(CN)6]4-(低 自旋型配离子)配离子为什么比[FeF6]3-(高自旋型配离 子)配离子稳定。 价键理论的局限性: 1、价键理论在目前的阶段还是一个定性的理论, 不能定量地或半定量地说明配合物的性质。 2、不能解释每个配合物为何都具有自己的特征光 谱,也无法解释过渡金属配离子为何有不同的颜色。 3、不能解释过渡金属离子的配合物的稳定性随中 心离子的d电子数的变化而变化。
物质结构与性质高考热点归纳 配合物和晶胞配位数的确定

物质结构与性质高考热点归纳配位数的确定一、各种典型配合物中配位数的判断1.配位数可以等同于中心离子(或原子)与配位原子形成的配位键键数,也可以等同于配位体的数目。
如[Ag(NH3)2]NO3、[Ag(CN)2]-、[Cu(NH3)4]SO4、[Cu(H2O)4]2+、[Zn(NH3)4]2+、[Zn(CN)4]2-、K3[Fe(SCN)6]、[Fe(CN)6]3-、[FeF6]3-等配合物或配离子中的中心离子与配位体的数目以及配位原子形成的配位键键数均相等,其中Ag+离子的配位数为2,Cu2+离子与Zn2+离子的配位数均为4,Fe3+离子的配位数为6。
一般规律:一般配合物的配位数可以按中心离子电荷数的二倍来计算。
又如Ni(CO)4、Fe(CO)5、Cr(CO)6等羰基化合物中Ni、Fe、Cr原子的配位数分别为4、5、6。
[Co(NH3)4(H2O)2]Cl2、[CrCl(H2O)5]Cl2中Co2+离子与Cr3+离子的配位数均为6。
说明:羰基化合物中的中心原子呈电中性,此类配合物的配位数由化学式直接判断。
Co2+离子与Cr3+离子的电荷数分别为2、3,但配位数都是6。
所以,配合物的配位数不一定按中心离子(或原子)的电荷数判断。
2.当中心离子(或原子)与多基配体配合时,配位数可以等同于配位原子的数目,但不是配位体的数目。
如[Cu(EN)2]中的EN是乙二胺(NH2CH2CH2NH2)的简写,属于双基配体,每个乙二胺分子有2个N原子与Cu2+离子配位,故Cu2+离子的配位数是4而不是2。
3.当中心离子(或原子)同时以共价键与配位键结合时,配位数不等于配位键的键数。
如[BF4]-、[B(OH)4]-、[AlCl4]-、[Al(OH)4]-等配离子中,B、Al原子均缺电子,它们形成的化学键,既有共价键,又有配位键,配位数与配位键的键数不相等,配位数均为4。
又如Al2Cl6(如下左图所示)中Al原子的配位数为4。
配合物分子结构和性质(PPT34)

02
03
有机合成
配合物可作为催化剂或反 应中间体,用于有机化合 物的合成。
无机合成
配合物可用于合成金属簇 、金属氧化物和复合物等 无机材料。
材料科学
配合物可用于制备光电材 料、磁性材料和传感器等 先进材料。
04
配合物在生活和工业中的应用
配合物在医药领域的应用
药物研发
配合物可用于药物设计和 合成,提高药物的疗效和 降低副作用。
总结
01
配合物的定义和分类
配合物是由金属离子或原子与配体通过配位键结合形成的化合物。根据
配体的性质和数目,配合物可分为单核、双核和多核配合物。
02
配合物的结构和性质关系
配合物的结构和性质密切相关。金属离子的电子构型、配体的性质和配
位数等都会影响配合物的稳定性、磁性和光学性质。
03
配合物在化学和工业领域的应用
• 配合物理论计算和实验技术的创新:随着计算化学和实验技术的发展,人们可 以更加深入地研究配合物的结构和性质。未来研究将致力于发展新的理论计算 方法和实验技术,以揭示配合物的微观结构和动态行为,为新型配合物的设计 和合成提供理论指导。
谢谢您的聆听
THANKS
配合物在化学合成、催化反应、药物设计和材料科学等领域有广泛应用
。例如,过渡金属配合物可用于催化有机合成反应,某些配合物具有抗
癌活性,可用于药物开发。
研究展望
• 新型配合物的设计和合成:随着理论计算和实验技术的发展,人们可以更加精 确地预测和设计具有特定结构和性质的配合物。未来研究将致力于设计和合成 新型配合物,以满足不同领域的需求。
配合物的几何构型
直线型
当配位数为2时,中心原子与两 个配位体形成直线型结构,如 Co(H2O)2+2。
配合物的结构和研究方法

( 3 )配体内的电子跃迁带
常出现于有机配体中,吸收处于紫外区。强度 比较大,所以该类配合物的光谱和自由配体的 光谱非常类似
有机化合物中分子轨道能级的能量次序 成键 σ < 成键 π < 非键 n < 反键 π * < 反键 σ * 配体的电子吸收光谱主要由三种跃迁形式产生
n → σ 跃迁 n → π * 跃迁 π → π * 跃迁
第九章 配合物的结构研究方法
结构研究法的一般特点:利用各种能 量的电磁波(或微粒)作为能源投照在被 研究物质样品上,利用特定的检测器测量 这种相互作用过程中某一物理量的变化, 并将所测试的结果在记录器上进行显示。
第九章 配合物的结构研究方法
9.1 紫外 - 可见吸收光谱 9.2 振动光谱 9.3 光电子能谱 9.4 核磁共振波谱 9.5 X- 射线衍射
9.1 紫外 - 可见吸收光谱
1. 电子跃迁和光谱
电子光谱是由于分子中的 价电子 吸收了光源 能量后从低能级的分子轨道跃迁到高能级的 分子轨道而引起的
2. 跃迁选律
谱线的强度理论上与电子的跃迁几率有关
(1) 宇称选律 :对于具有对称中心的分子,允许的 跃迁是 g → u 或 u → g 。即 Δ l = ± 1 的跃迁才是允 许的。
键合能 (BE) : 把电子移到
能量守恒要求: E(A)+ h ν =E(A + ) + E(e真- )需空能能量级所
E(e - ) = h ν - [E(A + ) -E(A)]
每一种元素的原子都有与内部原子轨道相关 的特征键合能,所以每一元素在光电子能谱中 都将产生一组特征峰。
(2) 应用
在特定能量处峰的存在表明所研究样 品中含有某一特定元素,并且,峰的强度 与样品的浓度成正比。
晶体结构,配合物结构知识点与习题1-1
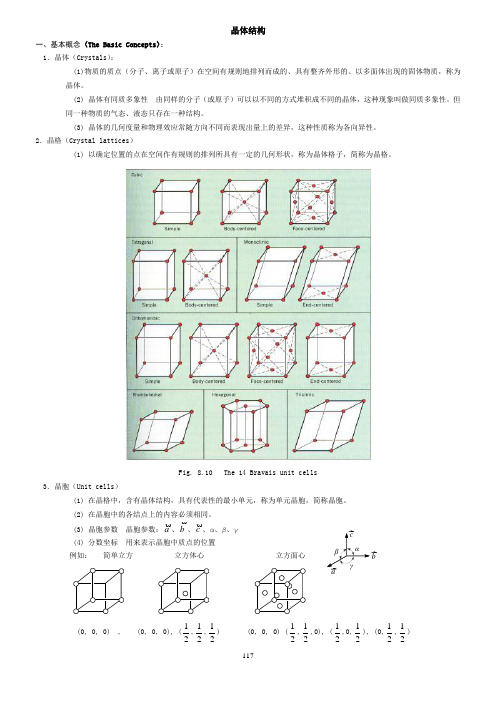
117晶体结构一、基本概念(The Basic Concepts ): 1.晶体(Crystals ):(1)物质的质点(分子、离子或原子)在空间有规则地排列而成的、具有整齐外形的、以多面体出现的固体物质,称为晶体。
(2) 晶体有同质多象性 由同样的分子(或原子)可以以不同的方式堆积成不同的晶体,这种现象叫做同质多象性。
但同一种物质的气态、液态只存在一种结构。
(3) 晶体的几何度量和物理效应常随方向不同而表现出量上的差异,这种性质称为各向异性。
2.晶格(Crystal lattices )(1) 以确定位置的点在空间作有规则的排列所具有一定的几何形状,称为晶体格子,简称为晶格。
Fig. 8.10 The 14 Bravais unit cells3.晶胞(Unit cells )(1) 在晶格中,含有晶体结构,具有代表性的最小单元,称为单元晶胞,简称晶胞。
(2) 在晶胞中的各结点上的内容必须相同。
(3) 晶胞参数 晶胞参数:a、b、c、α、β、γ (4) 分数坐标 用来表示晶胞中质点的位置例如: 简单立方 立方体心 立方面心(0, 0, 0) , (0, 0, 0), (21,21,21) (0, 0, 0) (21,21,0), (21,0,21), (0,21,21) αβγbc a118在分数坐标中,绝对不能出现1,因为1即0。
这说明晶胞是可以前后、左右、上下平移的。
等价点只需要一个坐标来表示即可,上述三个晶胞中所含的质点分别为1、2、4,所以分数坐标分别为1组、2组和4组。
(5) 晶面指数 晶面在三维空间坐标上的截距的倒数(h 、k 、l )来表示晶体中的晶面,称为晶面指数,如立方晶系中(100),(110),(111)面分别为(100) (110)(111)lFig. 8.12 Selected planes and their Miller indices for cubic system用X-ray 的衍射可以测量晶体中的面间距,2d ·sin θ = n ·λ。
晶体结构配合物结构知识点与习题

配合物结构一、配位化合物的定义由提供孤电子对(NH3、H2O、X「)或n电子(H2C= CH2、| 、)的物种与提供适当空轨道的物种(金属原子或金属离子)组成的化合物称为配位化合物,简称为配合物。
二、配位化合物的组成1 .配合物由内界(inner)和外界(outer)组成。
外界为简单离子,配合物可以无外界,但不可以无内界。
例如:Fe(CO)5 Pt(NH3)2Cl22 .内界由中心体(center)和配位体(ligand)组成。
(1) 中心体:提供适当的空轨道的原子或离子,绝大部分是d区或ds区元素。
用M表示。
(2) 配位体(L)(简称配体):提供孤对电子对或n电子的离子,离子团或中性分子。
三、配位化合物的分类 (Classification )1. Classical complexes :配体提供孤电子对,占有中心体的空轨道而形成的配合物。
例如:Ag(NH 3)2 , Cu(CN) 42. n -complexes :配体提供n电子,占有中心体的空轨道而形成的配合物。
例如:Fe(C5H5)2, K[PtCl 3(C2H4)](第一个n配合物,Zeise's salt)出匚CH2 IMM配体提供:2个n电子4个n电子6个n电子四、配位体(L) Ligand1.根据配体中配位原子的不同,配体可分类成:(1) 单基(齿)配体(unidentate ligand ):配体中只含有一个配位原子;例如:NH3、H2。
、X「、(py)N(2) 多基(齿)配体(multidentate ligand ):配体中含有两个或两个以上的配位原子。
由单齿配体组成的配合物,称为简单配合物;由多齿配体组成的配合物,称为螯合物(chelate)。
2 .一些常见的配体:(1) 单基配体:X : F (fluoro)、Cl (chloro)、Br (bromo)、I (iodo)、H2O (aquo)、CO (carbonyl)、NO (nitrosyl)、C5H5N (py)、OH (hydroxo)(2) 双基配体:en (乙二胺)H2NCH2CH2NH2 (ethylenediamine)(oxalate ion^N Ci giy C (氨基乙酸根)O(2,2 -d ipyridyl )(3) 多基配体:EDTA (乙二胺四乙酸)(六齿) (H4Y)HOOCH2C CH2COOHNCH 2CH2N、(ethyle nediami netetracetato)HOOCH2C CH2COOH五、配位数(Coordination Number1.中心原子(或离子)所接受的配位原子的数目,称为配位数2 .若单基配体,则配位数=配体数;若多基配体,则配位数=配体数配位原子数/每个配体3 .确定配位数的经验规则一EAN规则(Effective atomic number rule )或十八电子(九轨道)规则(1) 含义:a. EAN规则:中心体的电子数加上配体提供给中心体的电子数等于某一稀有气体的电子构型( 36, 54,86)+配体提供的电子数=18, (n 1)d10nEnp6b.十八电子规则:中心体的价电子数c .九轨道规则:五个 (n 1)d 轨道(或者五个nd 轨道),1个ns 轨道和3个np 轨道(9个价轨道)都充满电子。
高考化学全国卷专题———结构化学

高考化学全国卷专题———结构化学高考化学全国卷专题———结构化学一、结构化学在高考化学中的重要性结构化学是高考化学考试中的重要专题之一,主要考察学生对原子结构、分子结构、晶体结构等基础知识的掌握程度,以及运用这些知识解决化学问题的能力。
在历年高考化学试卷中,结构化学的考题数量居高不下,分值占比逐渐增大,难度也有逐年提高的趋势。
因此,学生需要充分了解结构化学的知识点,掌握解题方法,才能在考试中取得好成绩。
二、结构化学的知识点解析1.原子结构:主要考察原子核外电子排布规律、能级、轨道、量子数等基础知识,以及原子结构与元素性质的关系。
2.分子结构:重点考察分子轨道、共价键、分子间作用力、氢键等知识点,涉及配合物、有机分子的结构与性质。
3.晶体结构:主要考察晶体结构的基本概念、晶胞、晶格、晶体对称性等知识,涉及不同类型的晶体(离子晶体、分子晶体、原子晶体等)的结构与性质。
三、结构化学的解题方法1.掌握基本概念:对于原子结构、分子结构、晶体结构等基础知识,要熟记概念并理解其含义。
2.善于运用图像:通过绘制原子结构示意图、分子球棍模型、晶胞图等图像,有助于理解和解决结构化学问题。
3.灵活运用公式:掌握并能运用原子结构中相关的计算公式,如波尔理论、轨道数与电子数的关系等公式,能够快速解决相关问题。
4.对比记忆:对于相近或相反的的概念和知识点,可以通过对比记忆,加深理解,避免混淆。
5.实践操作:通过实验验证理论,实践操作有助于巩固和加深对知识点的理解和记忆。
四、总结结构化学是高考化学考试的重要专题,需要学生充分了解和掌握相关知识点。
在备考过程中,学生应注重基本概念的掌握,善于运用图像和公式,对比记忆和实践操作等方法,提高解题能力和效率。
要结合历年高考真题进行训练,加深对知识点的理解和记忆,为在高考化学考试中取得好成绩打下坚实的基础。
高二化学晶体结构与性质(配合物与超分子)

[解析] (1)[Zn(NH3)4]Cl2 中[Zn(NH3)4]2+与 Cl-形成离子键,而 1 个 [Zn(NH3)4]2+中含有 4 个 N→Zn 键(配位键)和 12 个 N—H 键,共 16 个 σ 键, 故 1 mol 该配合物中含有 16 mol σ 键,即 16NA。
(2)Zn2+的配位原子个数是 4,所以其配位数是 4,故 A 错误;该配合物 中氮原子提供孤电子对,所以 NH3 是配体,故 B 错误;[Zn(NH3)4]Cl2 中外 界是 Cl-,内界是[Zn(NH3)4]2+,故 C 正确;该配合物中,锌离子提供空轨道, 氮原子提供孤电子对,所以 Zn2+和 NH3 以配位键结合,属于特殊共价键, 不属于离子键,故 D 错误。
(2)配合物的形成
实验操作
实验现象
有关离子方程式
滴加氨水后,试管中首
先出现蓝色沉淀,氨水 过量后沉淀逐渐溶解, Cu2++2NH3·H2O===Cu(OH)2↓
+2NH+ 4 、Cu(OH)2+4NH3===
滴加乙醇后析出深蓝 [Cu(NH3)4]2++2OH-
色晶体
[Cu(NH3)4]SO4·H2O
A.Ag+、NH3
B.H2O、H+
C.Co3+、CO
D.Ag+、H+
D [配位键的形成条件必须是一方能提供孤电子对,另一方能 提供空轨道,A、B、C 三项中,Ag+、H+、Co3+能提供空轨道,NH3、 H2O、CO 能提供孤电子对,所以能形成配位键,而 D 项 Ag+与 H+ 都只能提供空轨道,而无法提供孤电子对,所以不能形成配位键。]
第三章 晶体结构与性质 第四节 配合物与超分子
一、配合物 1.配位键 (1)概念:成键原子一方提供 孤电子对,另一方提供空轨道 形成 的共价键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
14000
13600
[MoCl6]319200
● 配位体的影响:光谱化学序列 (ectrochemical series)
o /cm-1
[CoF6]313000
[Co(H2O)6]3+ [Co(NH3)6]3+ [Co(CN)6]3-
18600
22900
34000
各种配பைடு நூலகம்对同一M产生的晶体场分裂能的值由小到大的顺序:
Et2=1.78Dq,
Ee=-2.67Dq
E = 12.28 Dq
d x 2 y2
d E = 6 Dq
能
E = 1.78 Dq
量
d
E = 0 Dq
= 4.45 Dq
= 10 Dq
d
E = -2.67 Dq
E = -4 Dq
四面体场
d
八面体场
E = 2.28 Dq d xy s = 17.42Dq
dx2-y2 极大值指向面心
dxy
c
极大值指向棱的中点
x y
d 轨道在四面体场中的能级分裂
能级计算:
Es
1.78Dq 2.67Dq
t2 (dxy, dyz, dxz)
t=
4
9
10Dq
e(dx2-y2, dz2)
自由离子 球形场 四面体场
配体相同,中心离子与配体距离相同时,分裂 能Δt=4/9Δo
μ 0
4d
Ag
4d
[Ag(NH 3 ) 2 ]
5s
5p
sp 5p
[
]
NH3 NH3
四 配
1s Be 2
位 的
1s [BeX 4 ]2
配
合
物
Ni2 [Ni(CN) 4 ]2
[NiCl 4 ]2
2s
2p
2s
2p
F-
(H 2O)
F- F- F-
(H 2O)(H 2O)(H 2O)
sp3杂化
3d
4s
5p
3d
4s
[
4p
]
CN- CNdsp2杂化
CN- CN-
3d
4s
4p
[
]
Cl-
Cl- Cl- Cl-
sp3杂化
六配位的配合物
[FeF6]3- 外外轨轨配配合合物物 配位原子的电负性很大,如卤素、氧等, 不易给出孤电子对,使中心离子的结构不发生变化,仅用外层的空 轨道ns,np,nd进行杂化生成能量相同,数目相等的杂化轨道与配 体结合
[Fe(CN)6]3- 外内轨轨配配合合物物 配位原子的电负性较小,如氰基(CN-,以C配 位),氮(-NO2,以N配位),较易给出孤电子对,对中心离子的影响较大,使电 子层结构发生变化,(n-1)d 轨道上的成单电子被强行配对,腾出内层能 量较低的 d 轨道接受配位体的孤电子对,形- 成配合物.
内轨配合物比外轨配合物稳定
(2) 配合物的磁性
配合物磁性的测定是判断配合物结构的一个重要手段.
磁 矩: µ=[n(n+2)]1/2 (B.M.)玻尔磁子.
外轨型配合物
3d
4s
4p
4d
内轨型配合物
3d
sp3d2
4s
4p
d2sp3
价键理论的成功与不足
1)成功
① 杂化轨道
配位数、构型
② 内、外轨型配合物 磁性
I-<Br-<Cl-,SCN-<F-<OH-<C2O42<H2O<NCS-<edta<NH3<en<bipy
<phen<SO32-<NO2<CO, CN-
初步看作是配位原子电负性的排列: 卤素 < 氧 < 氮 < 碳
电负性 4.0 3.5 3.0 2.5
● 晶体场类型的影响
四面体场 4.45 Dq CoCl4 2-的 = 23100cm-1 八面体场 10 Dq Fe(CN)64- 的 = 33800cm-1 正方形场 17.42 Dq Ni(CN)4 2-的 = 35500cm-1
构); ② 配体与中心离子间的作用是纯静电相互作
用,不形成任何共价键。
贝蒂(Hans Albrecht Bethe,美国物理学家,曾 获1967诺贝尔物理学奖) 约翰·哈斯布鲁克·范弗累克,著名的美国理论物理学家,1977年 诺贝尔物理学奖的获得者
d轨道能级分裂(单电子能级的分裂)
由于d轨道空间取向不同,与配体所形 成的非球形对称静电场的作用则不相同, 引起d轨道能级发生分裂。
4. 配合物的化学键理论
配合物的化学键理论
• 目标:解释性质,如配位数、几何结构、 磁学性质、光谱、热力学稳定性、动力学 反应性等。
• 三种理论: • ①价键理论 • ②晶体场理论 • ③分子轨道理论
4.2.1 价键理论 (valence bond theory) 同一原子内,轨道的杂化和不同原子间轨道的重叠构成了
根若解据取得能Es为量能重量心零原EE点理te2g,:g==则6-D42EDqeg+q32EEte2gg+=35EEts2g=0 (2)
(2) 配体对中心离子的影响(d轨道的分裂)
d 轨道在八面体场中的能级分裂
正四面体场中d轨道能级的分裂
d轨道与电场的作用z
z
z
b
b
b
a
a
y
y
a y
x
yc
d
d
c
d
E = -4..28 Dq d
z2
E = -5.14 Dq
d xz d yz
正方形场
不同晶体场中的相对大小示意图
(3) 影响的因素(中心离子, 配位体, 晶体场)
● 中心M离子:电荷Z增大, o增大;主量子数n增大, o增大
[Cr (H2O)6]3+
o /cm-1 17600
[Cr (H2O)6]2+ [CrCl6]3-
d轨道中电子的排布及对配合物磁性的解释
③ 继承了传统的价键概念(配位共价键),简明易 于理解。
2)不足 ① 定量程度差,无法解释配合物的吸收光谱 ② 无法说明Cu2+平面正方形内轨型配合物的稳定
性
4.2 晶体场理论(Crystal field theory)
由Bethe和Van Vleck提出
• 要点: ① 把配体视为点电荷或偶极子(不考虑其结
共价键理论的核心论点之一.这里把第二章的s-p杂化轨道扩大
到d轨道上,形成s-p-d杂化轨道.
(1) 价键理论的要点 ● 形成体(M)有空轨道,配位体(L)有孤对电子,形成配位键 ML
● 形成体(中心离子)采用杂化轨道成键
● 杂化方式与空间构型有关
二配位的配合物
[Ag(NH 3 ) 2 ]
直线形
分裂样式与配体所形成的非球形对称 静电场有关。
正八面体场中d轨道的分裂
d轨道与电 场的作用
x
z
y
y x
y x
z
y
z
x
正八面体场中d轨道的分裂
能级计算:
eg(dx2_y2, d z2)
6Dq 4Dq
o=10Dq
Es
t2g(dxy,dyz,dxz)
自由离子
球形场
八面体场
d轨道
分裂能Δo=Eeg-Et2g =10Dq (1)
