药物开发和生物制品表征:质谱流式实验数据分析-百泰派克生物科技BTP
基于质谱的肽和蛋白质从头测序

基于质谱的肽和蛋白质从头测序基于质谱的肽和蛋白质从头测序方法从头测序是一种分析和鉴定肽序列和一些翻译后修饰的蛋白质的方法。
与其他一些依赖于已知的蛋白质序列数据库或已知的质谱数据库的分析方法不同,从头测序利用串联质谱根据肽段的裂解特性直接进行分析。
因此,未包括在蛋白质数据库中的肽序列、新物种的蛋白质序列和基因组未被测序的蛋白质序列都可以进行从头测序。
采用该方法开发的软件有PepNovo、PEAKS、pNovo。
基于质谱的肽和蛋白质从头测序基本原理在质谱分析中,待分析物质的粒子在通过电磁场之前首先被电离。
由于不同质荷比的离子在电磁场中受到的作用力不同,其运动轨迹和飞行时间等分离检测离子的特征也不同。
找到特定的裂解模式后,根据质谱峰之间的质量差和氨基酸的翻译后修饰情况,可以计算出相应的氨基酸信息。
基于质谱的肽和蛋白质从头测序工作流程蛋白质/肽从头测序的工作流程如下:首先利用生化分离或亲和选择过程从样品组织中提取待分析的蛋白质。
然后将该蛋白质用相关的酶(如胰蛋白酶)酶解成肽段;使用高效液相色谱分离和纯化肽消化产物;在进入离子源之前,再利用高压液相色谱分离和洗涤肽;肽通过离子源并转化为带高电荷的液滴。
脱水后进入质谱仪生成一级质谱;计算机生成肽的优先级列表;该多肽被选择用于下一轮的碎裂。
通过串联质谱检测离子在电磁场中的运动可得到离子的质荷比;在质谱仪分析过程中,具有特定质量电荷比的多肽离子代表一定的质量;这种能量轰击裂解可以根据这些碎裂离子的质量电荷比信息来推断,通过排列组合可以推导出对应的多肽氨基酸残基,从而解析出与质谱图相对应的多肽序列;用软件来分析每个肽的二级质谱峰。
拼接肽序列可获得蛋白质的全长序列。
基于质谱的肽和蛋白质从头测序方法应用该技术可用于生物样品中未知多肽序列的分析和检测、末端残基缺失的多肽的检测、赖氨酸和亮氨酸的鉴定、N端封闭和环状蛋白质的鉴定、未知蛋白质或多肽序列信息的准确测定、商业修饰的蛋白质和酶序列的准确测定、稳定细胞系表达的蛋白质序列的准确测定以及抗体一级结构序列的克隆分析等。
灭活疫苗病毒颗粒纯度及大小分析

灭活疫苗病毒颗粒纯度及大小分析灭活疫苗是指将病原微生物培养后灭活而制成的疫苗,是一种较为常见的疫苗类型。
对于病毒灭活疫苗而言,病毒的结构蛋白是疫苗最重要的组成成分之一,它包括表面蛋白和核壳蛋白。
病毒的结构蛋白是病毒生命周期和病毒感染宿主的关键因素,也是疫苗引发免疫反应的主要靶点。
病毒颗粒纯度指的是疫苗中活性成分与其他成分(如蛋白质、核酸、细胞残留物和灭活剂等)的比例。
高纯度的病毒颗粒能够提供更强的免疫反应,并降低不良反应的风险。
因而评估和控制病毒颗粒的纯度是疫苗生产过程中的重要环节,电泳法和高效液相色谱技术是目前常用的纯度分析技术。
病毒颗粒的大小可以影响病毒颗粒的免疫原性,进而影响疫苗的效力。
病毒颗粒的大小直接关系到病毒与宿主细胞的相互作用,包括细胞摄取病毒的效率和病毒诱导的免疫反应类型。
对病毒颗粒大小的精确测量可以帮助我们更好地理解病毒的生物学性质,优化疫苗设计,并评估疫苗的质量。
动态光散射(Dynamic light scattering, DLS)是用于确定溶液样品中悬浮体或聚合物中颗粒尺寸和半径分布最常用的分析方法之一,也被广泛应用于病毒颗粒大小的测定。
DLS通过光子自相关函数(ACF)测量颗粒在被测介质中的扩散系数,还可以计算出球体的尺寸分布并详细描述颗粒在被测介质中的运动。
生物制品表征病毒颗粒纯度及大小分析示意图。
百泰派克生物科技(BTP)采用ISO9001认证质量控制体系管理实验室,获国家CNAS实验室认可,为客户提供符合全球药政法规的药物质量研究服务。
我们为您提供一站式的灭活疫苗病毒颗粒纯度及大小分析服务,只需要将您的实验目的告诉我们并寄送样品,百泰派克生物科技负责所有项目后续,包括样品处理、上机分析、数据分析和项目报告。
欢迎免费咨询。
百泰派克生物科技传统疫苗表征内容。
LC-MS高分辨质谱分子量检测

LC-MS高分辨质谱分子量检测液相色谱-质谱联用 (LC-MS) 是一种结合液相色谱 (LC)和质谱 (MS) 的强大分析技术,其允许分离、检测和量化混合物中的各种化合物。
LC-MS中的高分辨质谱是一种能够更高精准度测量分子量的质谱技术,这使得该技术尤其适用于复杂的、分子量相近的大分子化合物检测。
LC-MS高分辨质谱分子量检测在生物医学研究、药物发现及开发等研究都发挥着重要作用,分子量是必不可少的一项质量检测指标,通过准确、快速、灵敏的分子质量测量,可以很大程度上确定生物制品的是与非问题。
百泰派克生物科技(BTP)通过CNAS/ISO9001双重质量体系认证体系;,根据分子量测定(质谱法)原理,建立了针对于不同类别生物制品的分子量鉴定服务,可实现对蛋白、抗体、疫苗、多肽、重组胶原蛋白等生物制品高分辨分子量测定。
LC-MS高分辨质谱分子量检测的基本流程如下所示:LC-MS高分辨质谱分子量检测基本流程。
实验仪器高效液相色谱仪:Ultimate 3000(Thermo Fisher Scientific)。
电喷雾-四极杆飞行时间质谱仪质谱仪:AB SCIEX TripleTOF 5600(AB SCIEX)。
技术优势高分辨率质谱可以对蛋白质样品进行精确分子量测定(10-250 kDa),精度达到1Da;可分析蛋白质的修饰状态(比如磷酸化、小分子药物结合等),并对这些修饰情况进行相对定量分析;可高灵敏度、高分辨率、高准确度实现抗体的原始、还原、切糖分子量检测,以及抗体药物偶联的检测。
案例示意样品溶液在电场的作用下形成带高度电荷的雾状小液滴,在向质量分析器移动的过程中,经过电离,最后得到带单电荷或多电荷的离子。
得到的不同电荷离子经过去卷积计算得到最终的蛋白质分子量。
如图为样品不同电荷离子质谱图及去卷积后的分子量,横坐标为分子量,纵坐标为信号强度。
中/英文项目报告在技术报告中,百泰派克会为您提供详细的中英文双语版技术报告,报告包括:1. 实验步骤(中英文)。
肽图分析--检测技术

肽图分析随着现代医药工业的进展,肽图分析已成为生物制品表征过程中的关键步骤和质量控制的重要手段。
肽图检测法利用特定的化学试剂或酶将蛋白质特异性地降解为肽段,然后通过可靠的方法进行分离和鉴定,并与经同一方法处理的对照品进行比较和结果判定。
根据所选用的检测仪器不同,肽图分析可分为基于高效液相色谱法的HPLC肽图分析和基于质谱法的HPLC质量肽图分析。
北京百泰派克生物科技有限公司BTP基于高效液相色谱仪和液质联用仪,建立了HPLC肽图和HPLC质量肽图分析平台,百泰派克生物科技通过CNAS/ISO9001双重质量体系认证;为您提供HPLC肽图和HPLC质量肽图分析服务,并提供包括方法学建立、验证和转让的完整服务。
百泰派克生物科技肽图分析方法学验证内容。
实验仪器• 液相色谱仪: UltiMate3000。
• 高效液相色谱(紫外检测器)(2695/2996)。
• 高分辨率质谱仪: AB SCIEX 5600+。
技术应用• 评估产品放行检验的鉴别试验中生产工艺的批间一致性和生产用细胞基质表达的稳定性;• 检测和监测单个氨基酸的改变,如氧化、去酰胺化以及其他降解形式;• 直接检测常见的生物制品修饰变异,如N端环化、C端赖氨酸处理、N-糖基化等。
常见问题问题1:哪些样品适合进行肽图分析?。
回答:适合进行肽图分析的样品通常具有已知的理论参考氨基酸序列,或者存在可用作参考的样品。
对于前者,我们通常使用质谱法进行HPLC质量肽图分析;对于后者,我们采用反相高效液相色谱法进行HPLC肽图分析。
中/英文项目报告在技术报告中,百泰派克会为您提供详细的中英文双语版技术报告,报告包括:1. 实验步骤(中英文)。
2. 相关的质谱参数(中英文)。
3. 肽图分析详细信息。
4. 质谱图片。
5. 原始数据。
肽图分析一站式服务您只需下单-寄送样品。
百泰派克一站式服务完成:样品处理-上机分析-数据分析-项目报告。
抗体药物纯度分析(CE-SDS、SDS-PAGE、SEC、RP等)
抗体药物纯度分析(CE-SDS、SDS-PAGE、SEC、RP等)抗体药物是一类通过人工合成的抗体来治疗疾病的药物,通过与目标分子特异性结合从而达到治疗的目的。
常见的抗体类药物类型包括单克隆抗体、人工合成的抗体片段、免疫毒素、抗体药物共轭物等。
抗体类药物在治疗多种疾病方面表现出显著的疗效,如癌症、自身免疫性疾病、炎症性疾病、免疫调节及眼科疾病等。
抗体药物研究中,剖析高级结构对于理解其药效活性、稳定性、传递途径和毒性等方面非常重要。
抗体药物纯度是蛋白质结晶以及严谨的结构和功能研究的关键。
不纯净的样品会导致整个实验的结果不准确。
另外,蛋白质纯度是进一步蛋白质研究和生物制药应用的非常重要的特征。
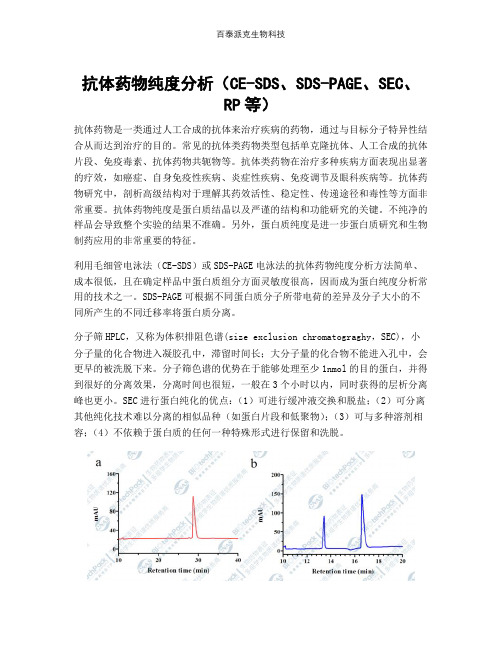
利用毛细管电泳法(CE-SDS)或SDS-PAGE电泳法的抗体药物纯度分析方法简单、成本很低,且在确定样品中蛋白质组分方面灵敏度很高,因而成为蛋白纯度分析常用的技术之一。
SDS-PAGE可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离。
分子筛HPLC,又称为体积排阻色谱(size exclusion chromatograghy,SEC),小分子量的化合物进入凝胶孔中,滞留时间长;大分子量的化合物不能进入孔中,会更早的被洗脱下来。
分子筛色谱的优势在于能够处理至少1nmol的目的蛋白,并得到很好的分离效果,分离时间也很短,一般在3个小时以内,同时获得的层析分离峰也更小。
SEC进行蛋白纯化的优点:(1)可进行缓冲液交换和脱盐;(2)可分离其他纯化技术难以分离的相似品种(如蛋白片段和低聚物);(3)可与多种溶剂相容;(4)不依赖于蛋白质的任何一种特殊形式进行保留和洗脱。
生物制品表征纯度分析(CE-SDS、SDS-PAGE、SEC、RP等)示意图。
百泰派克生物科技(BTP)采用ISO9001认证质量控制体系管理实验室,获国家CNAS实验室认可,为客户提供符合全球药政法规的药物质量研究服务。
多肽药物质谱法全序列分析

多肽药物质谱法全序列分析
多肽药物是一种生物大分子药物,由数个到几十个氨基酸通过肽键连接而成,具有广泛的生物活性,可以通过精确地和机体中的特定受体结合来发挥药效。
这种特异性的结合方式使得多肽药物在治疗各种疾病(如癌症、糖尿病和自身免疫病)时,具有良好的疗效和较低的副作用。
然而,多肽药物的质量控制是一大挑战。
由于它们的结构复杂、容易降解,并且常常含有一种或多种的修饰形式,因此,对多肽药物进行全序列分析以确保药物的质量和安全性是非常必要的。
质谱法全序列分析可以用于分析多肽药物的整个氨基酸序列以及任何可能的修饰。
这种方法通过将多肽分解为更小的片段,然后分析这些片段的质量,以确定多肽的氨基酸序列。
质谱法的敏感性高,分辨率好,可以检测到微量的样品,并能在复杂样品中精确地识别目标物质。
此外,质谱法可以定性和定量分析,对于研究药物的构效关系、药物代谢和药物的稳定性等方面都有非常重要的应用。
特别是在多肽药物的开发和生产过程中,质谱法全序列分析被广泛用于药物的质量控制,以确保药物的安全性和疗效。
生物制品表征质谱法全序列分析示意图。
百泰派克生物科技(BTP),采用ISO9001认证质量控制体系管理实验室,获国家CNAS实验室认可,为客户提供符合全球药政法规的药物质量研究服务。
我们利用现有的高分辨率质谱技术平台,开发出以质谱为基础的多肽药物质谱法全序列分析技术,实现对所测定靶蛋白多肽序列100%的覆盖。
此分析可以用于确认多肽是否得到完整表达,检测多肽表达过程是否发生断裂。
百泰派克生物科技多肽药物表征内容。
单细胞分析

单细胞分析随着现代生物学的发展,“平均值”这个词已经不能满足我们的研究需要了,我们需要更进一步了解细胞之间的差异性,于是针对单细胞的各类研究技术应运而生。
单细胞质谱流式(Mass Cytometry)技术是利用质谱技术对单细胞进行多参数检测的流式技术,它既有传统流式细胞术能够高速分析的特点,又兼并了质谱检测的高分辨能力。
单细胞测序和质谱流式都是目前非常强大的技术,越来越多的高分文献都是将两者结合使用,两者不能说有优劣之分。
区别在于质谱流式针对蛋白进行检测,能够指定检测蛋白,避免漏掉丰度很低但又很重要的蛋白,且质谱流式技术因为其通量相当的高,可以实现大量细胞的检测,都是对单细胞测序一个很好的补充。
百泰派克生物科技单细胞质谱流式技术采用金属元素标记物(通常是金属元素标记的特异抗体)标记细胞表面和内部的分子,然后用流式细胞原理分离单个细胞,再用电感耦合等离子体质谱(ICP-MS)分析单个细胞的原子质量谱,最后将原子质量谱数据转换为细胞表面和内部的信号分子表达量。
单细胞质谱流式技术。
单细胞质谱流式技术优势:1,技术先进,填补技术空白。
单细胞质谱流式采用金属标记抗体技术,避免了传统流式荧光通道少且易相互影响的问题。
可在单细胞层面上对多种指标同时进行表征,百泰派克生物科技可做到同时检测51个目标蛋白。
2,分析数量大,成本较低。
单细胞RNAseq受成本等因素限制,所有样本细胞汇总的分析数目一般在2x10^4个左右,而流式质谱技术一次(单样本)就可分析至少10^5的细胞,实现了数量级的提高,且成本不高于单细胞RNAseq。
3,应用前景大。
a)流式质谱结果可以给出细胞亚群的变化,在临床诊断、疾病机制研究等方面具有极大的研究前景;b)将金属标签技术与其他技术结合会有新应用方向。
除常规蛋白外,质谱流式细胞技术还可用于蛋白翻译后修饰;c)可检测细胞存活率、细胞大小、mRNA转录子表达量、DNA合成速率以及蛋白酶活性等。
重组蛋白质药物单糖谱分析

重组蛋白质药物单糖谱分析
重组蛋白质药物是利用重组DNA技术在微生物或哺乳动物细胞中制备的,其结构和功能与人体内自然产生的蛋白质相似或相同。
重组蛋白质药物具有很高的治疗效果,主要应用于各类疾病的治疗,例如肿瘤、免疫性疾病、遗传性疾病等。
这些药物在生产过程中通常会发生糖基化反应,形成糖蛋白。
糖蛋白中的糖链(由单糖分子连接形成)对药物的稳定性、活性和免疫原性有着重要影响,因此,对糖链结构的精确分析和鉴定是重组蛋白质药物质量控制的关键步骤。
单糖谱分析是一种专门用来测量和鉴定蛋白质中糖链结构的单糖组成的技术。
首先,需要将蛋白质中的糖链通过酶或酸水解分解成单糖。
然后,通过色谱技术和质谱技术等高效的检测方法对这些单糖进行定量和定性分析。
单糖谱分析不仅可以提供蛋白质中糖链的单糖类型和数量信息,还可以用于推断糖链的连接方式和结构。
此外,由于不同的生产过程和条件可能会导致药物的糖链结构产生微小的差异,单糖谱分析也是评价药物一致性的重要工具。
因此,单糖谱分析在保障重组蛋白质药物的安全性和有效性方面起着重要作用。
生物制品表征单糖谱分析示意图。
百泰派克生物科技(BTP),采用ISO9001认证质量控制体系管理实验室,获国家CNAS实验室认可,为客户提供符合全球药政法规的药物质量研究服务。
我们基于
高分辨率质谱仪Obitrap Fusion Lumos,利用包含了几乎所有糖型的Byonic软件,
为您提供重组蛋白质药物单糖谱分析服务,可以确定重组蛋白样品的糖基化位点、N糖/O糖类型、糖基化位点糖组成等。
百泰派克生物科技重组蛋白质药物表征内容。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药物开发和生物制品表征:质谱流式实验数据分
析-百泰派克生物科技BTP
质谱流式技术(Mass Cytometry)在药物开发和生物制品表征中的潜力巨大。
质谱流式细胞术将质谱技术与流式细胞仪相结合,能够实现对单个细胞的生化成分进行深入研究,帮助我们理解疾病机制,验证药物的效果,发现新的药物靶点以及增强生物制药质量控制。
这在生物制品表征中非常有用,它可以帮助解决以下一些问题:
单细胞层次的分子表征:传统的质谱技术通常需要大量的样本以获取可靠的结果,而质谱流式技术则可以分析单个细胞的生化成分,这可以帮助我们更深入地理解
细胞的生物学特性。
生物分子的定量分析:质谱流式技术可以对细胞内的生物分子进行定量分析,包
括蛋白质、代谢物和其他生物分子。
细胞异质性的研究:细胞群体中的细胞并非完全相同,它们之间的差异可能影响
疾病的发展和治疗的效果。
质谱流式技术可以帮助我们研究这种细胞异质性。
百泰派克生物科技BTP采用基于Fluidigm Helios流式细胞仪(Mass Cytometry System for Single Cell Analysis)用于单细胞质谱分析,该平台能够完成包括
单细胞捕获、cDNA合成、实时定量PCR分析、目标区域扩增以及质谱流式细胞分析。
相较于传统流式,质谱流式的特点在于包含巨大的信息量。
质谱流式提供的高维数据能够检查单个样本中大量细胞亚群的特征、研究已知细胞群内的异质性、识别与临床状态相关的细胞群变化、评估靶细胞群与已知参考群体的相似性、确定细胞群生理状态的变化、识别发育途径中的中间状态或分支点。
图1. 质谱流式细胞术与传统流式数据分析比较。
1、质谱流式数据导出
使用质谱流式仪器检测的数据,需要进行数据合并、校正、归一化等数据转换操作后方可导出,导出的文件格式为FCS(图2)。
图2. 质谱流式细胞术数据导出。
质谱流式原始数据通常以具有不同表达范围的偏态分布为特征。
由于可视化和聚类性能取决于规模和分布,使表达峰尽可能接近正态分布非常重要。
因此,表达值通
常使用反双曲正弦(arcsinh)变换进行变换,辅因子分别通常5。
arcsinh 转换的行为类似于高值时的对数变换,但在接近零时近似线性,并且辅助因子控制线性区域的宽度。
由于背景噪声、自发荧光和补偿的校正,传统流式数据包含更多的负值;相反,当未检测到离子时,质谱流式数据包含零值,并且由于背景减法和随机化而引入的负值很少。
对于不同时间检测数据的可比性,质谱流式引入了基于beads的归一化。
该算法使用市售校准微球(EQ beads),加入并与样品一起采集。
因此,可以通过采集时间跟踪信号的变化。
在数据处理过程中,识别beads并在所有文件中以定义的时间间隔计算beads的中值强度。
根据获得的值,计算每个beads的全局平均值并将其用作目标值。
为了获得变换因子,使用全局均值和区间特定强度计算线性模型。
然后将该因子应用于所有细胞事件,并插值到相应间隔和文件中的所有标记。
2、质谱流式数据预处理
在传统流式中,通常使用FSC参数高度(H)和面积(A)消除双峰,超出对角线的事件被定义为双峰,因为它们的特征是信号曲线的高度相同但面积不同。
在质谱流式数据中,通常使用cytobank或FlowJo对细胞数据进行过滤,其中顺铂用于区分活细胞,Cell-ID intercalator Ir同于区分单个细胞。
圈出单个活细胞群进行后续分析(图3)。
图3. 质谱流式细胞术单个活细胞细胞圈门策略。
也可以使用例如flowWorkspace包将数据导入R环境中进行自动门控。
如果已有某
些文件提供了门控策略,则可以使用像flowLearn这样的半监督门控方法来重现其余数据的门控策略,该算法使用提供的门控阈值作为输入,并使用基于导数的密度对齐将它们传输到其余样本。
像flowStats,flowDensity或OpenCyto(用于构建
自动门控层次结构的框架)这样的软件包对于构建用户定义的门控策略很有用。
自动门控的方法更适用于大样本的处理过程。
除了导出单个活细胞数据,也可以对感兴趣的某类细胞亚群进行圈门导出(图4)。
图4. 质谱流式细胞术T细胞圈门策略示例。
在圈门前需要确认在数据转换导出过程中是否把EQ beads的数据去除,如果未去除,则在圈单个活细胞前加一步去除beads的操作(图5)。
图5. 质谱流式细胞术去除beads圈门策略示例。
导出细胞亚群后,可以对数据进行进一步的降维聚类等分析(表1)。
表1. 质谱流式数据常用的数据分析方法举例。
降维方法的目标是将高维数据的结构保留在较低的、更易于解释的二维或三维地图中。
这些方法可分为线性工具和非线性工具。
由PCA(主成分分析),表示的线性方法侧重于将点的最大方差保持在较低空间中,从而使不同的点彼此远离。
另一方
面,非线性算法如t-SNE(t-随机邻居嵌入)及其衍生算法,使相似的细胞彼此靠近,专注于保持局部关系。
一些工具,如t-SNE和UMAP将众所周知的群体分开,
可以很好地概述了现有细胞。
其他方法,如Isomap(等距特征映射)或扩散图可视化分化轨迹,因为它们能够保留细胞之间的局部和全局距离。
基于聚类的算法对相似的细胞进行分组,并使用可视化工具在低维空间中表示它们。
在选择最佳聚类方法时,应考虑几个要求,例如需要缩减采样、可重复性、稀有细胞检测和运行时间。
不同的分析方法具有不同的特点,可根据实验需求自行选择分析方法。
2019发表的一篇文章在六个质谱流式细胞术数据集上测试了七种无监督
方法(Accense、Xshift、PhenoGraph、FlowSOM、flowMeans、DEPECHE和kmeans)和两种半监督方法(自动细胞类型发现和分类(ADCC)以及线性判别分析(LDA)),计算所有定义的性能度量,并将其与随机子抽样、不同的样本大小以及每种方法的聚类数进行比较(图5)。
图5. 文章测试的7种质谱流式细胞术数据分析方法。
在准确性(precision)上,研究人员将“manual gating”的细胞分群结果看作“ground truth”,利用四种外部评价指标(Accuracy,F-measure, NMI和ARI),对不同方法的分群准确性和效率进行了讨论。
讨论发现,LDA是准确性比较高的半
监督分群方法,无监督方法中FlowSOM和flowMeans的准确性较高,其次是PhenoGraph和DEPECHE方法。
在一致性(coherence)上,不再考虑“manual gating”的细胞分群结果,而是直接利用三种内部评价指标(DB,CH和XB),对每个方法揭示细胞数据内部本质结构的能力进行了探讨。
经过探讨发现,DEPECHE,FlowSOM和PhenoGraph方法能更好
地捕捉到CyTOF数据的内部本质结构。
在稳定性(stability)上,根据细胞采样数量的变化,研究人员对不同方法在分
群准确性上的鲁棒性和不同方法识别出的细胞亚群数量的鲁棒性进行了深入研究。
综合来说,PhenoGraph,DEPECHE和LDA具有相对较高的稳定性,而FlowSOM在分
析较大的CyTOF数据时更加鲁棒。
此外,这篇文章还研究了分群方法的分群分辨率,发现PhenoGraph和Xshifit能够对特定的细胞亚型细化分类(识别出更细粒度的
亚群),而DEPECHE更倾向于忽略细胞亚型之间的差异,将不同的T细胞或B细胞
合并到一个细胞亚群(识别粗粒度的亚群)。
总的来说,文章结果表明,LDA最精确地再现了手动标签,但在评估中排名不高。
PhenoGraph和FlowSOM在精度,连贯性和稳定性方面优于其他无监督工具。
PhenoGraph和Xshift在检测精细的子集群时具有优势,而DEPECHE和FlowSOM倾
向于将相似的集群分组到元集群中。
PhenoGraph、Xshift和flowMeans的性能受
到样本量增加的影响,但随着样本量的增加,FlowSOM相对稳定(图6)。
图6. 7种质谱流式细胞术数据分析方法优缺点汇总。
2023年在Nature Communications上发表的一篇文章在对425种质谱流式数据降
维方法的性能进行了基准测试。
结果表明像SAUCIE,SQuaD-MDS和scvis这样鲜为人知的方法总体上表现最佳。
特别是SAUCIE和SCVIS平衡良好,SQuaD-MDS在结
构保持方面表现出色,而UMAP具有出色的下游分析性能。
t-SNE(以及SQuad-
MDS/t-SNE杂交种)具有最佳的局部结构保存。
该研究的结果反驳了该领域的普遍
想法,即tSNE和UMAP是scRNA-seq数据的最佳表现者,也是CyTOF数据的最佳选择。
并且数据降维工具之间存在显着的互补性,方法的选择应取决于底层数据结构和分析需求(图7)。
图7. 质谱流式细胞术降维方法测试基本流程。
