电解原理应用及金属腐蚀
电化学腐蚀的原理及应用

电化学腐蚀的原理及应用1. 什么是电化学腐蚀电化学腐蚀是指金属在电解质溶液中发生氧化反应和还原反应,导致金属表面发生物理和化学变化的过程。
在电化学腐蚀过程中,金属表面被腐蚀掉,在金属内部生成电化学腐蚀产物,从而导致金属的退化和破坏。
2. 电化学腐蚀的原理电化学腐蚀是由以下三个基本要素组成的:- 金属:作为电极参与电化学反应。
- 电解质溶液:提供导电性和溶解氧的介质。
- 环境:包括温度、压力、湿度等因素,会对腐蚀过程产生影响。
电化学腐蚀的过程可以分为两种基本反应: 1. 氧化反应(阳极反应):金属表面发生氧化反应,将金属原子转化为正离子并释放电子。
2. 还原反应(阴极反应):导电的电解质溶液中的阳离子被还原为金属或者其他物质。
通过以上两种反应,金属表面发生物理和化学变化,导致腐蚀和金属破坏。
3. 电化学腐蚀的应用电化学腐蚀的原理和机制在工业和科学研究中有广泛的应用。
以下是一些主要的应用领域。
3.1 金属腐蚀研究电化学腐蚀的研究对于理解金属的腐蚀行为和机制至关重要。
通过研究不同金属在不同环境下的电化学腐蚀行为,可以评估金属的腐蚀性能,选择合适的材料用于特定的应用,以延长金属的使用寿命。
3.2 防腐蚀技术电化学腐蚀的原理为防腐蚀技术的研发和应用提供了理论基础。
通过使用合适的涂层、阻隔层或者中和剂等物质,可以降低金属的腐蚀速率,延长金属的使用寿命。
例如,在航空航天工业中,通过电镀技术给金属表面添加一层保护性的金属镀层,可以防止金属在高温和高湿环境下的腐蚀。
3.3 腐蚀监测和控制电化学腐蚀的研究还为腐蚀监测和控制提供了方法和工具。
通过使用电化学腐蚀监测技术,可以实时监测金属的腐蚀速率和腐蚀产物的生成情况。
这对于设备的维护、预测设备的寿命和做出合理的维修计划非常重要。
3.4 腐蚀改良和治理电化学腐蚀的原理还可应用于腐蚀改良和治理。
通过了解腐蚀的原因和机制,可以研发出适用的腐蚀治理方法,以减少或避免金属材料的腐蚀。
2024届高考一轮复习化学课件:电解池 金属的腐蚀与防护
答案 D 解析 氯碱工业中阳极是Cl-放电生成Cl2,A错误;电解精炼铜时阳极上粗铜 溶解,阴极上Cu2+放电析出Cu,由于粗铜中含有锌、铁等比铜活动性强的杂 质金属,活动性强的金属先放电,因此电解质溶液中Cu2+浓度变小,B错误;铁 片上镀铜时,阴极应该是铁片,阳极是纯铜,C错误。
考向2 利用电解原Байду номын сангаас制备有机化合物
考向3 利用电解原理治理污染问题 例3.某些无公害免农药果园利用如图所示电解装置进行果品的安全生产, 解决了农药残留所造成的生态及健康危害问题。下列说法正确的是( ) A.a为直流电源的负极,与其相连的电极为阴极 B.离子交换膜为阴离子交换膜 C.“酸性水”具有强氧化性,能够杀菌 D.阴极反应式为H2O+2e-===H2↑+O2-
答案 C 解析 右侧Cl-放电得到ClO-,ClO-再氧化CN-生成N2,则右侧电极为阳极,b为 电源的正极,A错误;b为电源的正极,则a为电源的负极,左侧电极为阴极,发 生反应2H2O+2e-===H2↑+2OH-,阴离子增加,污水中的Na+会通过隔膜Ⅰ进 入左侧,形成NaOH溶液,则隔膜Ⅰ为阳离子交换膜,B错误;由A、B可知左 侧电极反应为2H2O+2e-===H2↑+2OH-,则X为H2,C正确;生成的2.24 L N2未 标明条件,无法求得电路中通过电子的量,D错误。
例2.(2023山东潍坊模拟)科技工作者开发以乙醇为原料制备
DDE(
)的电解装置如图所示。下列说法错误的是( )
A.电源的电极电势:a>b B.阳极电极反应式为C2H5OH+Cl-2e-===C2H5OCl+H+ C.乙醛为该转化过程的催化剂 D.每产生1 mol DDE,电路中通过2
第六章第三节电解池金属的腐蚀与防护考点电解原理的应用-课件新高考化学一轮复习

B.电解过程中废水的 pH 不发生变化
C.电解过程中有 Fe(OH)3 沉淀生成 D.电路中每转移 12 mol 电子,最多有 1 mol Cr2O27-被还原
解析:铁作阳极,反应为 Fe-2e-===Fe2+,Fe2+还原 Cr2O27-,反应过程 中阴极为 H+放电同时 Fe2+还原 Cr2O27-也消耗 H+,c(H+)变小,pH 变大, B 项错误。 答案:B
金属 Na、Ca、Mg、Al 等。
总方程式
阳极、阴极反应式
冶炼 钠
2NaCl(熔融)=电==解==2Na+Cl2↑
阳极:2Cl--2e-===Cl2↑ 阴极:2Na++2e-===2Na
冶炼 镁
MgCl2(熔融)=电==解==Mg+Cl2↑
阳极:2Cl--2e-===Cl2↑ 阴极:Mg2++2e-===Mg
6.[双选]实验室以某燃料电池为电源模拟工业上用电解法治理亚硝酸盐对水体的
污染的装置如图所示,电解过程中 Fe 电极附近有 N2 产生。下列说法不正确的
是
()
A.电解过程中,装置甲中 Fe 电极附近溶液颜色变化为无色→黄色→浅绿色 B.b 电极的电极反应式:2NO3-+10e-+12H+===N2↑+6H2O C.装置乙的中间室中的 Na+移向右室,Cl-移向左室 D.1 mol 甲醇参加反应时,整个装置能产生 0.6 mol N2
题点(二) 电解原理在治理废水方面的应用
4.用电解法处理酸性含铬废水(主要含有 Cr2O27-)时,以铁板作阴、阳极,处
理过程中发生反应:Cr2O27-+6Fe2++14H+===2Cr3++6Fe3++7H2O,最后
Cr3+以 Cr(OH)3 形式除去。下列说法中错误的是
第17练 电解原理及其应用 金属腐蚀与防护(解析版)
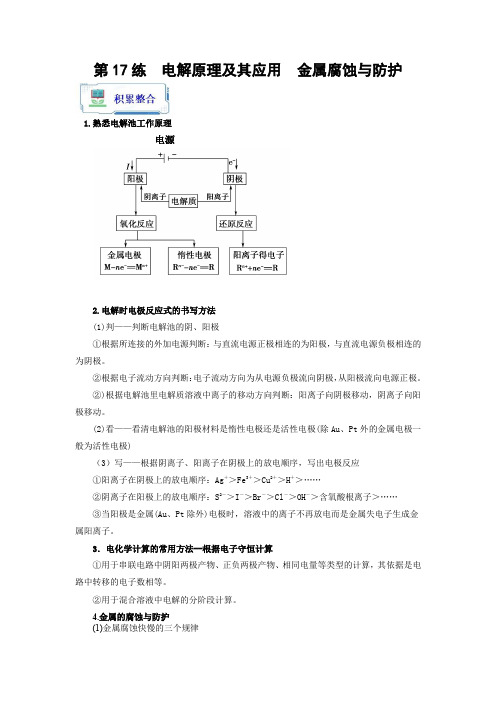
第17练电解原理及其应用金属腐蚀与防护1.熟悉电解池工作原理电源2.电解时电极反应式的书写方法(1)判——判断电解池的阴、阳极①根据所连接的外加电源判断:与直流电源正极相连的为阳极,与直流电源负极相连的为阴极。
②根据电子流动方向判断:电子流动方向为从电源负极流向阴极,从阳极流向电源正极。
②)根据电解池里电解质溶液中离子的移动方向判断:阳离子向阴极移动,阴离子向阳极移动。
(2)看——看清电解池的阳极材料是惰性电极还是活性电极(除Au、Pt外的金属电极一般为活性电极)(3)写——根据阴离子、阳离子在阴极上的放电顺序,写出电极反应①阳离子在阴极上的放电顺序:Ag+>Fe3+>Cu2+>H+>……②阴离子在阳极上的放电顺序:S2->I->Br->Cl->OH->含氧酸根离子>……③当阳极是金属(Au、Pt除外)电极时,溶液中的离子不再放电而是金属失电子生成金属阳离子。
3.电化学计算的常用方法--根据电子守恒计算①用于串联电路中阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
②用于混合溶液中电解的分阶段计算。
4.金属的腐蚀与防护(1)金属腐蚀快慢的三个规律①金属腐蚀类型的差异电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀。
①电解质溶液的影响a.对同一金属来说,腐蚀的快慢(浓度相同):强电解质溶液>弱电解质溶液>非电解质溶液。
b.对同一种电解质溶液来说,电解质浓度越大,腐蚀越快。
①活泼性不同的两金属,活泼性差别越大,腐蚀越快。
(2)两种腐蚀与三种保护①两种腐蚀:析氢腐蚀、吸氧腐蚀(关键在于电解液的pH)。
①三种保护:电镀保护、牺牲阳极的阴极保护法、外加电流的阴极保护法。
1.(2023·湖北·校联考模拟预测)科研团队开创了海水原位直接电解制氢的全新技术(如图所KOH侧的水蒸气压力差使海水自发蒸发,并示)。
电化学金属腐蚀与防护原理及应用

电化学金属腐蚀与防护原理及应用电化学金属腐蚀是指金属在电解质溶液中发生的一种化学反应,会导致金属表面产生氧化、溶解或析出等不可逆过程。
金属腐蚀会导致金属失去原有的性能,降低材料的强度、硬度和可靠性,造成经济损失。
因此,为了保护金属材料免受腐蚀的损害,人们研究了多种防护技术。
电化学金属腐蚀的原理是基于金属表面的电化学反应。
金属在电解质溶液中处于一种平衡状态,既有金属的氧化(腐蚀)反应,也有金属的还原反应。
这个平衡状态被称为电池电位或者腐蚀电位。
当金属表面存在助腐蚀因素(如氧、酸、碱、盐)时,金属表面的氧化反应将被加速,导致金属腐蚀的加剧。
如果能够降低或改变金属表面的电位,就可以减缓金属腐蚀的发生。
为了实现金属腐蚀的防护,我们可以采用以下几种方法:1.阻止金属与电解质接触:通过物理屏障(如油漆、涂层、涂料等)将金属表面与电解质隔开,阻止金属被电解液侵蚀,起到保护金属的作用。
2.加强阳极的保护:在金属表面形成一层更活泼、更易氧化的金属层,作为阳极,吸引电流,减缓金属的腐蚀。
常见的做法是采用镀层、热浸镀、电镀等方法,在金属表面形成一层保护膜。
3.采用阻止电流流动的方法:通过在金属表面施加外加电流或者电磁场,阻止电流在金属间流动,减缓金属的腐蚀。
常见的做法是采用阴极保护或者磁场保护方法。
4.控制电解质环境:通过改变电解质的成分、浓度、温度等参数,使其不利于金属的氧化反应,减缓金属的腐蚀。
例如,对于钢铁材料,可以通过控制水中的溶解氧、酸碱度等因素,来减少金属腐蚀的发生。
电化学金属腐蚀防护的应用非常广泛。
在船舶、桥梁、海洋工程、化工设备等领域,金属材料容易受到海水、氧气、酸碱等环境的腐蚀,因此需要采取有效的防护措施。
例如,对于船舶,在船体表面施加阴极保护,将船体作为阴极,以减缓钢铁的腐蚀。
在化工设备中,常常采用高温涂层、耐酸碱材料等措施,延长设备的使用寿命。
总之,电化学金属腐蚀防护技术的目标是保护金属材料免受腐蚀的侵害,延长材料的使用寿命。
电解加工的原理及应用范围

电解加工的原理及应用范围1. 电解加工的原理电解加工是一种利用电化学原理进行金属加工的方法。
它基于电解液中的离子导电性和金属表面的化学反应来实现加工过程。
电解加工利用电流通过工作电极和工件之间的电解液,通过电极的阳极氧化或阴极解除来去除金属材料。
该过程在金属零件表面形成微小的坑洞或凹陷,从而实现加工效果。
电解加工的原理基于两个关键因素:电解液和电流。
1.1 电解液电解液是电解加工过程中一个重要的组成部分。
它通常由溶剂和电解质组成。
溶剂是一种导电的液体,如水或有机溶剂。
电解质是在溶剂中溶解的化学物质,如盐或酸。
电解质通过提供离子来使电流在电解液中传导。
1.2 电流电流是电解加工的推动力。
通过施加电压,电解液中的离子会导致金属表面的氧化或还原反应。
阳极氧化是一种将阳极材料转化为氧化物的反应,而阴极解除是一种将阴极表面的氧化物还原为金属的反应。
2. 电解加工的应用范围电解加工具有广泛的应用范围,特别是在微细加工和特殊材料加工方面。
以下列举了电解加工的主要应用领域:2.1 微加工电解加工在微加工领域有着广泛的应用。
由于其高精度和低表面粗糙度的特点,电解加工被广泛用于制造微细结构和微型零件。
微细加工领域的应用包括:•微机械系统(MEMS)制造•显微加工•微切削加工•精密钻孔2.2 金属腐蚀电解加工可以用于金属腐蚀过程中的精确控制。
通过调整电解液的成分和电流密度,可以实现对金属表面的特定区域进行腐蚀。
金属腐蚀的应用包括:•金属模具制造•电路板制造•金属艺术品制作2.3 超合金加工电解加工在超合金加工中发挥着重要作用。
超合金通常是高强度和高温材料,难以通过传统的切削或加热加工方法进行加工。
电解加工提供了一种有效的方式来加工超合金,同时提供良好的表面质量。
超合金加工的应用领域包括:•航空航天工业•汽车制造业•能源领域2.4 生物医学应用电解加工在生物医学领域也有一定的应用。
它用于制作生物医学器械和植入物,如人工关节、心脏支架和人工骨骼。
金属的腐蚀原理防腐技术措施和应用场景

金属的腐蚀原理防腐技术措施和应用场景金属的腐蚀问题一直是工程领域中需要解决的重要难题之一。
腐蚀会导致金属材料的损耗、性能下降甚至结构破坏,给工业生产和生活带来很大的影响。
为了延长金属材料的使用寿命,科学家和工程师们提出了各种各样的防腐技术和措施。
本文将介绍金属的腐蚀原理、常见的防腐技术措施以及应用场景。
一、金属的腐蚀原理金属的腐蚀是指金属在特定环境下与周围介质发生氧化还原反应,造成金属表面的金属离子溶解掉或形成新的化合物。
常见的腐蚀形式有电化学腐蚀、化学腐蚀和微生物腐蚀等。
1. 电化学腐蚀电化学腐蚀是金属在电解质溶液中发生的一种腐蚀形式。
当金属表面存在不均匀的电位差时,形成电化学腐蚀电池,金属作为阳极处于电化学腐蚀的位置。
阳极反应导致金属的离子溶解,而阴极反应则是还原过程。
电化学腐蚀通常在潮湿环境中发生,如海水、土壤和大气中。
2. 化学腐蚀化学腐蚀是指金属与非电解质介质(如酸、碱等)发生的一种腐蚀形式。
在化学腐蚀中,金属表面与介质中的活性物质直接发生化学反应,形成稳定的化合物。
不同的金属对不同的化学物质有不同的腐蚀敏感性,一些金属可以在特定的酸或碱溶液中很容易发生化学腐蚀。
3. 微生物腐蚀微生物腐蚀是由微生物所引起的金属材料腐蚀。
微生物可以通过产生酸、产生腐蚀性代谢产物、吸附在金属表面等方式导致腐蚀。
微生物腐蚀广泛存在于土壤、水体、沉积物等环境中,对金属设备和管道的腐蚀破坏较为严重。
二、防腐技术措施为了减缓金属材料的腐蚀速度,延长其使用寿命,人们开发了多种防腐技术措施,常见的包括涂层保护、金属表面处理、合金改性以及阳极保护等。
1. 涂层保护涂层保护是通过在金属表面形成一层保护膜来防止金属与环境接触,减少腐蚀的发生。
常见的涂层材料包括涂漆、涂料、电镀等。
这些材料可以形成一层致密的膜,防止氧气、水分等腐蚀性物质渗入金属表面,起到防融化、隔绝和隔离的作用。
2. 金属表面处理金属表面处理是通过改变金属表面的物理或化学性质来提高其抗腐蚀性能。
高考化学复习高中总复习:专题6第3讲电解池的工作原理及应用 金属的腐蚀与防护

第3讲 电解池的工作原理及应用 金属的腐蚀与防护[考纲要求] 1.了解电解池的工作原理,能写出电极反应和电池反应方程式。
2.理解金属发生电化学腐蚀的原因、金属腐蚀的危害、防止金属腐蚀的措施。
考点一 电解的原理 1.电解定义在________作用下,电解质在两个电极上分别发生______和__________的过程。
2.能量转化形式________转化为________。
3.电解池 (1)构成条件①有与________相连的两个电极。
②__________(或__________)。
③形成____________。
(2)电极名称及电极反应(如图)(3)电子和离子移动方向①电子:从电源________流向电解池的________;从电解池的________流向电源的________。
②离子:阳离子移向电解池的________; 阴离子移向电解池的________。
4.分析电解过程的思维程序(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H +和OH -)。
(3)然后排出阴、阳两极的放电顺序阴极:阳离子放电顺序:Ag +>Fe 3+>Cu 2+>H +(酸)>Fe 2+>Zn 2+>H +(水)>Al 3+>Mg 2+>Na +>Ca 2+>K +。
阳极:活泼电极>S 2->I ->Br ->Cl ->OH ->含氧酸根离子。
(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
(5)最后合并两个电极反应式得出电解反应的总化学方程式或离子方程式。
5.用分析电解过程的思维程序分析电解下列物质的过程,并总结电解规律(用惰性电极电解)电解质(水溶液) 电极方程式 被电解 的物质 电极产物 溶液pH 变化的原因、结果 电解质溶液复原 阳极阴极含氧酸(如H 2SO 4)阳极:_________水减少,酸溶液的浓加_______阴极:_________ ___ 度____,pH____强碱(如NaOH) 阳极:____________阴极:____________水减少,碱溶液的浓度____,pH____加____活泼金属的含氧酸盐(如KNO3、Na2SO4) 阳极:____________阴极:____________水减少,盐溶液的浓度____,pH__________(若为水解的盐)加____无氧酸(如HCl),除HF外阳极:____________阴极:____________________(如Cl2)H+放电,c(H+)减小,pH____不活泼金属的无氧酸盐(如CuCl2),除氟化物外阳极:____________阴极:____________________(如Cl2)________(如Cu)pH基本不变加______活泼金属的无氧酸盐(如NaCl) 阳极:__________阴极:__________________(如Cl2)H+放电,c(H+)减小,c(OH-)增大,pH____不活泼金属的含氧酸盐(如CuSO4) 阳极:____________阴极:_________________(如Cu)OH-放电,c(OH-)减小,c(H+)增大,pH____加____或_______1.分别写出用惰性电极电解上述5中各物质的化学方程式或离子方程式:(1)________________________________________________________________________; (2)________________________________________________________________________; (3)________________________________________________________________________; (4)________________________________________________________________________; (5)________________________________________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氯碱工业等
a
1
电解原理的应用——电镀
• 目的:增强抗腐蚀能力;增加 美观;改善机械性能;
• 概念:应用电解原理在某些物 体表面镀上一层其他金属或合 金的方法
• 组成:
• 直流电源
• 阳极——镀层金属 M-ne-= Mn+
• 阴极——镀件 =M
Mn++ne-
• 电解液:含镀层金属离子的a 盐
• 电池阳反极应::2MClg--C2el2-=C熔电l解2融 Mg+Cl2↑
a
5
电解原理的应用---电冶金
由于电解池中的反应是在外力强制下发生的,推动 力与所施加的电压成比例。因此电解方法对于推进 氧化还原反应而言,已经不存在任何禁区,广泛用 于制备或生产活泼金属、非金属单质等。对于像钠、 钙、镁、铝等活波金属,电解法几乎是唯一可行的 实用方法。
– 阳极(粗铜):Zn-2e-=Zn2+
–
Fe-2e-=Fe2+
–
Ni-2e-=Ni2+
–
Cu-2e-=Cu2+
– Ag、Au掉入阳极附近形a 成阳极泥
3
电冶炼——铝的冶炼
• 原料:Al2O3 • 电极材料:石墨
• 电极反应:
遇到的主要问题:
如何得到含有Al3+的熔融 的电解质?
• 阴极:4Al3++12e- →4Al
高考对电解的要求
【08天津卷】下列叙述正确的是( ) A.在原电池的负极和电解池的阴极上都是发生失电 子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物 质的量之比为1:2 C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转 移,则生成1 molNaOH D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
2
溶液
电冶炼——铜的电精炼
• 目的:火法冶炼得到的铜纯度不够高不能满足电气工业 对铜的要求(含Cu量≥99.95%)。为了得到高纯度的铜常采 用电解法精炼。
• 粗铜中的主要杂质:Zn、Fe、Ni、Pb、Au、Ag 、Cu2O 、 CuS等
• 原理:阳极粗铜、阴极纯铜、CuSO4溶液为电解液
– 阴极(纯铜):Cu2++2e-=Cu
a
8
高考对电解的要求
【08上海卷】取一张用饱和的NaCl溶液浸湿的pH试纸,两根 铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试 纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。 则下列说法错误的是
A. b电极是阴极
B.a电极与电源的正极相连 阳极
阴极
C.电解过程中水是氧化剂
D.b电极附近溶液的pH变小
据反应现象判断电极及电极反应等
a
9
高考对电解的要求
【08全国Ⅱ卷】右图为直流电源电解稀Na2SO4水溶液的装置, 通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象
正确的是
A.逸出气体的体积:a电极的小于b电极的
B.电极逸出无味气体,另一电极
逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
固体复合氧化物
该电解池采用了能传导某种离子( H+、教L师i+、要F-、努O力2- )通的过固体
复钯合多氧孔化多物晶为薄电膜解为质电(极简。称SCY),吸附在自SC己Y内的外教侧表学面将的金学属
阳极:3H2 - 6e- =6H+ 阴极:N2+6H++6e- =2NH3 a
生思维引向自由 地创新! 7
D.a电极附近呈蓝色,b电极附近呈红色
阴 H2 O2 阳
据反应现象判断电极及电极反应等
极
-+ OH H
极
a
10
高考对电解的要求
【09年安徽理综·12】Cu2O是一种半导体材料,基于绿色化学 理念设计的制取.Cu2O的电解池示意图如下,电解总反应: 2Cu+H2O==Cu2O+H2↑。下列说法正确的是 A.石墨电极上产生氢气
a
6
拓展:电解的应用
德国人哈伯发明了合成氨技术而获 得1918年诺贝尔化学奖,但该方法 须在高温高压催化剂条件下,否则 难以自发进行。2000年希腊化学家 斯佳在《科学》杂志上公布了他的 新发明在常压下把氢气与氮气通入 一加热到570℃的电解池(如图) 氢氮在电极上合成氨,而且转化率 高于哈伯法的五倍,达到80%。
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
金属的电冶炼考查
a
13
•近年来,加“碘反”食思盐K较多IO的3使的用制了碘备酸钾(KIO3) ,碘酸
钾在工业上可用电解法制取。以石墨和不锈钢为电极,以
KI溶液为电解液,在一定条件下电解,反应方程式为:
•
KI+3H2O 电解 KIO3+3H2↑。
•判断电极材料和电极反应
石墨作阳极
不锈钢作阴极
阳极反应:I--6e-+3H2O=IO3- +6H+ 阴极反应:6H2O+6e-=6OH-+3H2↑
深入思考是否合理?
做一名有理性的化学教师!a
14
水的电解——1
•用电解水的实验来证明,水是由H、O元素组成的,通过
比较产生的氢气和氧气的体积还可以定量证明水中氢元
B.铜电极发生还原反应 C.铜电极接直流电源的负极 D.当有0.1mol电子转移时,
-
+
阴
阳
极
极
有0.1molCu2O生成
新情境下,根据电解总反应,
判断电极材料、电极反应及计算。
a
11
高考对电解的要求
【2009北京卷6】 下列叙述不正确的是 A.铁表面镀锌,铁作阳极 B.船底镶嵌锌块,锌作负极,以防船体被腐蚀 C.钢铁吸氧腐蚀的正极反应:O2 + 2H2O + 4e- = 4OHD.工业上电解饱和食盐水的阳极反应: 2Cl--2e- = C12↑ 电解原理与原电池原理的简单综合
值得思考的是放电顺序!
a
12
高考对电解的要求
【05天津-12】金属镍有广泛的用途。粗镍中含有少量Fe、Zn、 Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确 的是(已知:氧化性Fe2+<Ni2+<Cu2+) A.阳极发生还原反应,其电极反应式:Ni2+ + 2e- == Ni B.电解过程中,阳极质量的减少与阴极质量的增加相等 C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
• 电池阳反极应::62OA2-l-21O23e- 电→解 34OA2l+3O2↑ 熔融
Al2O3的熔点2045℃ 冰晶石Na3AlF6 将Al2O3的熔点降低到大约1000 ℃
a
4
电冶炼——镁的冶炼
• 原料:MgCl2 • 电极材料:
遇到的主要问题:如何得 到无水的MgCl2?
• 电极反应:
• 阴极:Mg2++2e-=Mg
